复方氨基比林注射液说明书(兽用)【兽药名称】通用名:复方氨基比林注射液 英文名:Compound Aminophenzone Injection 汉语拼音:Fufang Anjibilin Zhusheye【主要成分】为氨基比林与巴比妥混合制成的灭菌水溶液。含氨基比林7.15%和巴比妥2.85%。【性 状】本品为无色或淡黄色的澄明液体。【药理作用】本品给药后即时产生镇痛作用,其解热镇痛作用强而持久,氨基比林与巴比妥合用能增强其镇痛作用,有利于缓解疼痛症状。本品还有抗风湿和消炎作用。半衰期为1~4小时。【适 应 症】用于发热性疾患、关节炎、肌肉痛和风湿症等。【用法用量】 肌内、皮下注射:一次量,马、牛20~50mg;羊、猪5~10mg。【注意事项】连续长期应用可引起粒性白细胞减少症,应定期检查血象。【停 药 期】28日,弃奶期7日。【有 效 期】二年【规 格】10ml【包 装】10ml /支×5支/盒【贮 藏】遮光、密闭保存。
[center]脑蛋白水解物注射液药品标准不完善[/center] 据国家药监局网站消息,为确保公众用药安全,国家药监局日前通知要求各地进一步加强对脑蛋白水解物注射液的监督检查。 通知称,在全国开展注射剂类药品生产工艺和处方核查工作中,发现脑蛋白水解物注射液品种在药品标准和执行工艺处方等方面存在着较为突出的问题,主要是企业选用猪脑原料的质量标准不完善;企业之间现行生产工艺差别较大;猪脑水解所用的蛋白酶种类、酶量及水解温度、时间等不一致,甚至有补加氨基酸的行为。针对上述突出问题,部分地区已采取了控制措施。 通知指出,一、要充分认识到脑蛋白水解物注射液在产品质量方面存在的安全风险,各地应在注射剂类药品生产工艺和处方核查工作的基础上,积极组织力量认真做好监督检查工作。要建议辖区内脑蛋白水解物注射液生产企业主动停止该品种的生产,并要求脑蛋白水解物注射液生产企业按相关技术要求,组织开展改进工艺和质量控制方法的研究工作,在相关工艺改进和质量标准未经批准前,暂不宜恢复生产。 二、对于生产企业认为其脑蛋白水解物注射液生产工艺合理、质量可控,继续进行生产的,所在地省级食品药品监督管理局应对其生产全过程予以跟踪检查,并对监督生产的产品进行现场抽样,由省级药品检验所检验。 凡生产企业存在未按批准变更生产处方工艺生产,或在制成品中补加氨基酸等违法违规行为,以及现场抽样检验不合格的,应依法予以严厉查处。 三、国家局将组织有关专家开展脑蛋白水解物注射液有效性、安全性评价工作,组织对脑蛋白水解物注射液生产工艺的改进、质量控制标准的提高工作,并在此基础上提出监管措施和改进意见。信息来源:中国新闻网
5-单硝异山梨醇酯检查时HPLC的问题5-单硝异山梨醇酯注射液检查有关物质时,色谱图在溶剂峰处有时会出现一个很大很尖的峰,有时又没有,有做过的来讨论一下。有时含量测定时也会出现。是5-单硝异山梨醇酯分解产物吗?困惑。
RT、硫酸鱼精蛋白注射液告急什么原因造成的???有知道的吗?
中药注射液,确切的说我要做香丹注射液的重金属及有害元素检查,可以制剂取10ml加5ml置赶酸仪中130°,加热至近干,就稀释等上机做可以吗?
土霉素注射液用高效液相怎么检测?谢谢!
近日有群友求助,群里尚未有人应答,现在版面上贴出,希望有人予以回应: 依据依######注射液处方,配制#####注射液作为制剂空白。精密量取B、Mg、Al、K、Ca、Cr、Fe、Zn、Ba、As、Cd、Pb、Co、Ti、Mn、Sb标准液适量于10ml量瓶中,用1%硝酸稀释至刻度,得对照储备液精密量取对照储备液适量于50ml量瓶中,加入制剂空白溶液10ml, 1%硝酸稀释至刻度,得系列浓度溶液。以含20%制剂空白的1%硝酸溶液为标准空白溶液。测定标准空白溶液和标准溶液系列,仪器自动绘制标准曲线。然后根据此线性进行样品测定,及方法学考察。不知这样的做法是否有不妥的地方?
【中国药典】从1985年版至1995年版均采用显微镜法检查注射液中的不溶性微粒。检查≥10μm与≥25μm两档,与美国药典标准基本相同。在2000年版【中国药典】显微镜法检查注射液中不溶性微粒的基础上增加了第二法----光阻法。在2005年版【中国药典】中增加了对小剂量注射液的检测。【中国药典】2005年版初稿对注射液中不溶性微粒污染的监控作了修订,将光阻法修订为第一法,显微镜法为第二法。修订后的结果判定也与美、英、欧共体、日本基本一致。原文来自:http://pssnicomp.cn/zhuanti.html
我测的是注射液里的钠,钾,铯,可是注射液里有葡萄糖和枸橼酸,是不是必须硝化啊,硝化的方法在那里着找啊,我是新手,忘各位前辈指点指点。我在一些专利网上没有查到。
多多药业有限公司生产的双黄连注射液被叫停。今天,国家食品药品监督管理局在其网站上发出通知,要求各地暂停销售使用标示为多多药业有限公司生产的双黄连注射液。 16日,国家药品不良反应监测中心报告称,标示为黑龙江多多药业有限公司生产的双黄连注射液在使用中出现严重不良事件。为确保公众用药安全,决定暂停销售和使用标示为多多药业有限公司生产的双黄连注射液。 目前,国家食品药品监督管理局和卫生部正在对该事件发生的原因进行调查。 大家对此事件如何看待的,有什么想法、看法、观点,说说,晒晒![em09502]
注射液是常用的药品之一,而且因其药效迅速、作用可靠,正越来越广泛地应用于临床。因注射液直接进入血液,对其无菌性的要求非常高,《中国药典》规定,注射液中不应含有任何活的微生物,这就需要抗氧剂来帮忙。那么在注射液中常用的抗氧剂 有哪些?
喜炎平脉络宁注射液引起严重过敏2012年06月27日08:47新华网国家食品药品监督管理局26日发布通报,提示生产企业和医患人员关注喜炎平注射液和脉络宁注射液引起严重过敏反应的问题。据了解,喜炎平注射液的成分是穿心莲内酯磺化物,主要用于解热消炎。2011年,国家药品不良反应监测中心病例报告数据库有关喜炎平注射液的病例报告数共计1476例,其中涉及14岁以下儿童报告达1048例。主要不良反应表现为过敏样反应、过敏性休克、紫绀、呼吸困难等。脉络宁注射液是2009版国家基本药目录品种,其功能与主治为清热养阴、活血化瘀。用于血栓闭塞性脉管炎、动脉硬化性闭塞症、脑血栓形成及后遗症、静脉血栓形成等。2011年,国家药品不良反应监测中心病例报告数据库共收到有关脉络宁注射液药品不良反应病例报告1500例,其中严重病例报告189例。严重不良反应主要为呼吸系统损害、全身性损害和心血管系统损害等。国家食品药品监管局建议,由于这两种注射液易发生过敏反应,建议医护人员在用药前详细询问患者的过敏史,特殊人群和过敏体质者应慎重使用。使用时应严格按照说明书规定的用法用量给药,不得超剂量使用;谨慎联合用药。如确需联合使用其他药品时,应谨慎考虑与此两种药品的间隔时间以及药物相互作用等问题。对于药品生产企业,国家食品药品监管局建议,加强临床合理用药的宣传,确保产品的安全性信息及时传达给患者和医生;完善生产工艺、提高产品质量标准,开展相应安全性研究。(新华网)
注射液粘度不算小,稀释了5倍检测其中的铝,含量约为0.009,但加标回收很低。想着应该再加大稀释倍数,但是样品中的铝浓度会更低,担心检测误差会更大。记得对于很微量的检测,可以通过加标来测定,但具体怎么操作,或者测完后怎么计算样品中的铝呢?请知道的老师详细指导一下。
USP的各论中,有些注射液没有提到是检查内毒素还是热原,这些注射液不检查内毒素或热原吗?注射液中,只提到了无菌,也没有提到热原和内毒素的要求。
求下面依达拉奉注射液中苯肼检测的专利和文献。??????谁可以下载的帮我下载一下吧,求求了[img]https://ng1.17img.cn/bbsfiles/images/2023/08/202308141926478314_1702_5341064_3.png[/img][img]https://ng1.17img.cn/bbsfiles/images/2023/08/202308141926479682_8480_5341064_3.png[/img][img]https://ng1.17img.cn/bbsfiles/images/2023/08/202308141926480553_6273_5341064_3.png[/img]
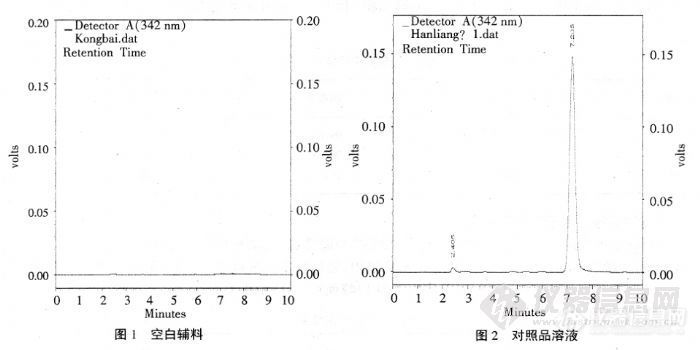
标题:5.1 甲钴胺注射液含量的方法学研究作者:常 明 1, 李 晶 1, 武玉洁 2, 张文双 2( 1.石家庄学院 化工学院, 河北 石家庄 050035; 2.石家庄栢奇制药有限公司, 河北 石家庄 050035)摘要: 摘 要: 以乙腈- 甲醇- 0.05 mol /L磷酸二氢钾溶液( 10∶ 20∶ 70) (用磷酸调节 pH 值为 4.0)为流动相, 采用迪马钻石 C18( 250 mm× 4.6 mm, 5 μ m)色谱柱及紫外检测器, 建立了甲钴胺注射液中甲钴胺含量的反相高效液相色谱检测方法. 柱温: 40℃; 检测波长为 264 nm; 流速: 1.0 mL /min. 本方法测定的日内精密度为 0.59%, 日间精密度为 0.67%, 回收率为 99.7%~ 100.5%, 在 160~ 240 μ g /mL范围内线性关系满足要求( r=0.999 9) ; 结果表明方法准确、 操作简单、 专属性强, 可用于定量测定甲钴胺注射液含量.http://ng1.17img.cn/bbsfiles/images/2012/07/201207161648_377914_2379123_3.jpg
利用[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]法建立复方苦参注射液中7个成分(甲基氧化偶氮甲醇樱草糖苷、苦参碱、槐果碱、槐定碱、氧化槐果碱、氧化苦参碱、番石榴酸)的含量测定方法。采用Waters Xselect CSHTM C18色谱柱(250 mm×4.6 mm, 5μm),以甲醇-0.2%磷酸二氢钾为流动相,梯度洗脱,流速0.6 mLmin-1,柱温30℃,检测波长211 nm。测定的甲基氧化偶氮甲醇樱草糖苷、苦参碱、槐果碱、槐定碱、氧化槐果碱、氧化苦参碱、番石榴酸7个成分的平均加样回收率分别为95.7%、101.3%、100.8%、101.7%、102.6%、102.5%、99.5%,RSD分别为2.0%、0.72%、0.90%、0.74%、1.4%、0.96%、1.8% 10批次样品中7个成分的含量分别为0.53~0.73、2.66~4.22、0.75~1.11、0.70~0.89、2.20~2.84、7.62~9.95、1.63~2.20 mgmL-1。该方法稳定可靠,可为复方苦参注射液的质量控制与评价提供参考。详见王鹏飞等,药物分析杂志. 2022,42(07)
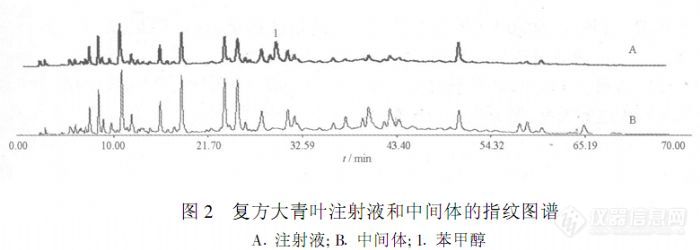
【作者中文名】刘瑞; 刘志刚; 李磊; 任冲; 袁波; 李发美;【作者英文名】LIU Rui; LIU Zhi-gang; LI Lei; REN Chong; YUAN Bo; LI Fa-mei(School of Pharmacy; Shenyang Pharmaceutical University; Shenyang 110016; China);【作者单位】沈阳药科大学药学院; 沈阳药科大学药学院 辽宁沈阳; 辽宁沈阳;【摘要】目的:采用HPLC建立复方大青叶注射液的指纹图谱测定方法。方法:采用Diamonsil C18色谱柱,甲醇-水-磷酸为流动相进行梯度洗脱,流速1.0 mL.min-1,检测波长254 nm。结果:建立了复方大青叶注射液的HPLC对照指纹图谱,标示了注射液中的20个共有峰,并初步确定注射液的相似度阈值为0.85。结论:该方法准确、重复性好,为复方大青叶注射液的质量控制提供了依据。http://ng1.17img.cn/bbsfiles/images/2012/08/201208131758_383604_2379123_3.jpg
哪 位朋友有氨基酸注射液含量的液相检测方法,传过来学习一下。谢谢!

【作者】 王小平; 刘峰; 杨东华; 屠鹏飞; 马存德;【Author】 WANG Xiao-ping1,2,LIU Feng2,YANG Dong-hua1,TU Peng-fei3,MA Cun-de2(1.Shaanxi University of Traditional Chinese Medicine,Xianyang 712046,China;2.Shaanxi BuchangPharmaceuyical Co.Ltd,Xianyang 712000,China;3.Beijing University,Beijing100191,China)【机构】 陕西中医学院; 陕西步长制药有限公司; 北京大学;【摘要】 目的:建立丹红注射液中迷迭香酸在大鼠血浆中浓度的测定方法。方法:雄性SD大鼠6只,静脉注射丹红注射液(10 mL.kg-1)后,分别于不同时间取血,以肉桂酸为内标,液液萃取处理后,HPLC测定浓度。Diamonsil(钻石)C18色谱柱(4.6 mm×250 mm,5μm),乙腈-0.4%的磷酸水为流动相,梯度洗脱,流速1.0 min.mL-1,检测波长286 nm。结果:迷迭香酸在4.0~100.0 mg.L-1呈良好线性关系(R2=0.996 5);回收率在85.0%~101.4%,方法的日内、日间精密度(RSD)分别为4.00%~6.76%,4.50%~7.81%。不同时间点血浆中迷迭香酸的质量浓度分别为85.44,75.09,61.13,54.73,43.02,20.92,10.12,7.18,4.28 mg.L-1。结论:建立的方法灵敏度好、准确率高,可用于丹红注射液中迷迭香酸的药代动力学研究。 http://ng1.17img.cn/bbsfiles/images/2012/07/201207231612_379232_2379123_3.jpg
想配制一个不含主药成分的注射液空白,看了下某注射液的辅料,为丙二醇,但没写浓度。有人告诉我大概就按照1%~10%的浓度配制这个辅料溶液就可以了,但我一估算,主药成分是10ml:0.1g,相当于1%的浓度。想不到名为辅料,这个浓度居然跟主药浓度相当甚至还超过啊,所以有点吃不准,特来请教各位老师,还望赐教。
作者:偶志红,徐丹丹,郭薇 来源:中国论文下载中心【摘要】 目的 建立薄层层析-紫外分光光度法测定香丹注射液中原儿茶醛的含量。方法 以原儿茶醛为对照品,展开剂为二氯甲烷-乙酸乙酯-甲酸(8∶5∶0.8)分离得到原儿茶醛,采用紫外分光光度法,检测波长281nm,测定原儿茶醛的含量。结果 原儿茶醛在0.55~4.95μg/ml 范围内线性关系良好,r=0.9998。平均含量为0.174mg/ml,加样回收率为97.3%~102.3%,RSD为1.6%。结论 实验结果表明,薄层层析-紫外分光光度法测定香丹注射液中原儿茶醛的含量,方法操作简便,准确度高,精密度好,可作为样品的检测方法。 【关键词】 香丹注射液;原儿茶醛;薄层层析-紫外分光光度法;含量测定
小弟最近忙AAS,火焰测了4个,石墨炉要测至少4个。现在忙铅,不知道国标对于注射液的含铅量有没有要求,这样我测得时候就有数了,有知道的就发个话吧,我这边附上不错的资料以示表达[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=58278]多种微量元素注射液中铁锌锰铜硒铬钼的测定[/url]
复方氨基酸注射液 含量测定 是用液相色谱吗?哪位大侠知道怎么弄的,指导我呀。谢啦! 我13914681818 wcj.yc@163.com
看到氢化可的松注射液的辅料里有乙醇和注射用水,想扣除辅料干扰就得配制相应浓度的辅料,谁能透露下,这处方里头的乙醇大概浓度多少啊? 叩谢各位大大。
[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=63620]注射液微粒检测仪的校正与检定[/url]
药典制剂通则中注射剂项下没有色泽均匀或一致的规定,如发现同批注射液色泽深浅不一、经检验均符合标准规定,如何下结论?
摘要: 目的 通过处方筛选试验确定利巴韦林葡萄糖注射液的制备工艺。 方法 通过一系列处方筛选优化试验和药物稳定性研究试验,初步确定质量表现稳定的利巴韦林葡萄糖注射液的完整处方。并通过灭菌工艺选择和验证研究,使生产工艺符合国家化学药品注射剂的技术要求。 结果 确定了质量表现稳定的利巴韦林葡萄糖注射液的完整处方,并针对在试验中发现的活性炭对利巴韦林吸附较大的问题,通过试验确定了主药后加的工艺流程,避免了活性炭的吸附影响。结论 本品经由试验确定的制剂工艺具有路线短,污染小,成本较低的优点,有利于转化为产业化大生产,将具有较好的经济效益和社会效益。关键词:利巴韦林;葡萄糖;注射液;制剂;利巴韦林(Ribavirin)是一种广谱抗病毒核苷类药物,在体内、体外对多种病毒的脱氧核糖核酸(DNA)或核糖核酸(RNA)的合成有显著抑制作用。data:image/png;base64,R0lGODlhxQDNAHcAMSH+GlNvZnR3YXJlOiBNaWNyb3NvZnQgT2ZmaWNlACH5BAEAAAAALAIABQC/AL8AhQAAAAAAAB0AAAAAHQAAMwAdPQAdMgAcSAAzWh0zWh1GbDMAAD0dADQdNDMeRzNbgEgcAEgdHUceM1ozAEg0AFszM11/f0huf1l/bmxGHW5dXX9/XX9uSG6AbmaIiIBbM4iIZgECAwECAwECAwECAwECAwECAwECAwECAwECAwECAwECAwECAwECAwECAwECAwECAwECAwECAwECAwECAwECAwECAwECAwECAwECAwECAwECAwECAwECAwECAwECAwb/QIBwSCwaj8ikcslsOo2BKOFJrVqv2Kx22/wEigEFd0wum89ar5iYCTzQ8Lh8joVMjYsDfc/vzwVJA36DhIVWAQhHE1+GjY6PAIxHkpCVlnICekYQgpeen2ScF3iaoKanVZRDqqitrpNgr7KzRQtRAaW0uru8vb6/wMHCw2esxMd9xsjLcsrMz2bO0NNPxtLU2ErW2dxU293gS6zXV17WUQAMt52Rt2vhyarkWLhGEUQC70ITd/CE8nBsLVlwJJc/PwDPOIhURAIRgkUmGDyYLBYcZxCLTKTIJyGZhQAWsHM4xNatW7miJOJIx2MZDgL6PSw4JAEAmPpYXgRzsqdP/59FQALwMoWkkAU5JRrJsFFnnHlX2hioRdNIU6fFzAgV0kYm0ogTM2DdA1ULP3xHZI7taGYRuoZCIKxbdWttxVZv7KIpayin3jF8C51U+5de4XCBDwNLrNgX48a9HkPWJXmyt3o8Me+1jPDIvaec/dhaSTa0n4WqjEYzfRqAXCKqyVRmXQWkyCGxucymjSXmTt59hBIFoPrnSSa7gT/ZKrVBNeN1lQcv0lW2dEdnrV+X4zYMXO3bF4cXlnx8o/LmoWxelf53Vvbty7jUQgl9/PlZ6seXTwS9/v26WQQeQwDSJyBg/RVoIHz8MahgKgcimOCDEE64moMUNvHfe0LYt/8dfhJimGESIAZo4YjaRNggik6UiGAUBrUBI4sEiohGG1fR6KIZo323i1xRsHMcEUAGQJghO2pFgXe4/QKIEWolyZYhC8mVF3G/fEWEUjZ6eAgktwmTERGl2HFEHo54udwQvmHpi5ZDcAlAJkdwkqYjWxnpZi8m9VSKM2o+RyUYBjj3ZlJ/krZloN5YouebVc0ZiKOEbDXEkbPAuU+Z7DyU4yBvkRVqk5BaNYQXigLQxpWU8pZPRDK1QdoirF7CKDRFCunOQ9GhMuqIv0Li363IBHuniaYZi2RlxFLTbDVCmDPJqMqGVu0jmg3xWYfmXWuIQCTe9wlqPgLorWA0tlP/iW0joXguHzBhSuGzSORZlI6XSJUuvUdYWh2L/DaRnbuGdJdTbg9WVqS86VZ4hZQNI2eYeg9HXCMVZpJSccSM0blJp9ByvDEsX4pcBaqKuFFywx1vZOfK+2IB8lETs0xPqm3UHHNUiMSp8sg7Y9Hnp+JYHHC4JoeMXFlH28V0YFA1vVbUOiNtszjMXiP1WFoPSPHV00ajzNZYjQ3a10HTNcc4Rqt40YZBv7si2U4xIrXdRsv9Nt068c1t0thafDGSgg+OruB67+V332Qnbu6xhTsu2+J130153YQXrjaol1f+T+eM89ur5urGQ3p/ooNe+bOjny75w6qXzXrsq7f0/3qGtwt6OhS5L0277Iy2vns7wfc+r/FICD888Xsvz7uayi8ffX7I41496r87Dd323A/pfGbdh//T99OKb/711p9vPvnJc8i+2wu+D39+8qMdYv1/r4i/4VtkX5iH/vsLAPdno/jtb4AE5J8B8YdAAjbwgO5jYATr90AJXsiBE5RfBRPIwTEsjEhz6dD0PjiEXNEFfayZz5OKIC8VpgVwDhrTPqx2Ik0BQE4sylgtSiFDIbjsSGiimanS5bEivCwkiDpCEYnEDhvikGDtO8pPNgKokkyRZanahyR6+MQOZfGGP3Mi0fazQiM0MVJoQcIZh0ijI3qqJEn82Jl4GEcaoTSMDT8LCRpP1TM8XqmHABjjfmTlM1aVcR8tnJUqXrUlhlGoT0YMIfGYhIfWmVCEUfALNIIAADs=图1-1 利巴韦林的分子结构目前利巴韦林已在全球44个国家上市,相关制剂从口服、注射到外用,可谓应有尽有。本课题通过一系列处方筛选优化试验和药物稳定性研究试验,初步确定利巴韦林葡萄糖注射液的完整处方。通过灭菌工艺选择和验证研究,使生产工艺符合国家化学药品注射剂的技术要求。并针对在试验中发现的活性炭对利巴韦林吸附较大的问题,在查找、研究文献的基础上,通过试验确定了主药后加的工艺流程,避免了活性炭的吸附影响。1材料1.1 试剂利巴韦林(湖北潜江制药股份有限公司,国药准字H19999139);针用活性炭(上海活性炭厂);氢氧化钠、盐酸均为分析纯。1.2 仪器梅特勒pH计PE20K(梅特勒);Agilent 1100型HPLC(安捷伦);岛津UV2450紫外分光光度(岛津);电热鼓风干燥箱DHG-9123A(上海精宏实验设备有限公司);美的冰箱 BCD-183CM(美的集团冰箱制造合肥有限公司);YB-2照度仪(天津天光光学仪器有限公司)。2方法2.1 处方与依据利巴韦林葡萄糖注射液为利巴韦林和葡萄糖的灭菌水溶液。目前,利巴韦林葡萄糖注射液在国内上市的规格有100 ml : 0.1 g、100 ml : 0.2 g、100 ml : 0.5 g、250 ml : 0.25 g、250 ml : 0.5 g、500 ml : 0.5 g,在临床上用于治疗由呼吸道合胞病毒感染而引起的病毒性肺炎及支气管炎。在不改变原使用方法的情况下,我们拟开发规格为100 m l: 0.1 g、100 m l: 0.2 g、100 ml : 0.5 g的利巴韦林葡萄糖注射液。2.2 处方筛选按照注射液研究的一般要求,设计以下处方,逐步开展试验。2.2.1 处方1首先,对规格为100 ml: 0.5 g的注射液,进行处方筛选试验。处方1的设计方案如下: 利巴韦林 5 g 葡萄糖 50 g 注射用水 加至1000 ml 称取上述处方量的主药和葡萄糖,加入80%注射用水,搅拌使完全溶解,然后再加入注射用水至全量,检查外观,并测定pH值。2.2.2 处方2 处方2的设计方案如下: [td=1,
甘露醇注射液含量检测测出倒峰,水为流动相,如何解决出倒峰问题[img=,690,920]https://ng1.17img.cn/bbsfiles/images/2021/07/202107271704099598_9643_3978275_3.png[/img]
大家好,我不是做[url=https://insevent.instrument.com.cn/t/Wp][color=#3333ff]原子吸收光谱[/color][/url]的,但我现在在做一个注射液的砷盐限量检查,其中用到了湿法消解,由于是第一次接触,很多地方不明白,也不知道如何掌握尺度,需要向大家请教,在这里多谢了。我的检测方法是这样的:处方组成:黄芩,熊胆粉,山羊角,金银花,连翘。颜色为红棕色的澄明液体。取本品5ml,加数粒玻璃珠后加硝酸高氯酸混合液(4:1)15ml,放置5分钟后,小火缓慢加热,待作用缓和后取下放冷,沿瓶壁加硫酸5ml,升高温度至产生白烟,溶液应为无色澄明液体(必要时放冷后再加入硝酸高氯酸溶液,至有机质破坏完全,溶液澄明),放冷,加水煮沸至产生白烟为止,放冷,转移至50ml量瓶中,定容至刻度,摇匀,取4ml,加盐酸5ml和蒸馏水19ml,自“再加入碘化钾试液”起依法测定(中国药典2005年版附录IX J第一法),含砷盐不得过百万分之二。问题:1、 小火缓慢加热,待作用缓和后,小火如何控制,什么叫作用缓和,我看到论坛中的大部分方法都是这么描述的,但是我的注射液加热后就是冒红棕色的烟,反应并不剧烈,所以应该烧到什么程度,是到冒完红烟后冒白烟然后溶液变无色算消解好了么,还是烟的红色中夹杂白色但溶液仍为红色就可以了呢。2、加硫酸的目的是什么,至产生白烟,是开始产烟就取下,还是没白烟才取下,产烟是在瓶口还是在瓶内。3、加水的目的是什么,产烟的问题同上。4、我曾经这样做过:加硝酸和高氯酸后用电炉加热至溶液无色,加硫酸烧了约5分钟,加水至产生白烟,结果我的样品和标准砷斑均无颜色,也就是砷没了,这是怎么回事呢,砷在哪一步跑掉的呢。5、请大家帮我算一下限度是否是百万分之二,我不会算。请经验丰富的同仁们多多帮忙了。