多金属矿中I的测定,有啥好办法?
用ICP测试多金属矿石中多金属元素,有没有同仁知道样品怎么消解.测试条件是什么呢?我是刚接触ICP希望多指点.有标准规程吗?
在紧张的讨论,学术委员会的审核下,项目终于批下来了,目前确定的方向是,粉末压片做地质样品中多金属矿石含量包括Cu,Pb,Zn,W,Mo,Co,Ni。单位要求,用该方法做多金属含量,能计算矿石储量为了达到这个条件,我们需要做哪些工作,大家讨论一下吧。提供一下思路。
含氧酸盐,比如铬酸钾,钨酸铵,都易溶于水,可以溶解了直接由ICP测定吗?
压片法做矿石中多金属元素,大家有这方面的经验的吗。
文章:喷流沉积型多金属矿床中镍钼的赋存特征来源:《岩矿测试》2013年第1期免费下载地址:http://www.ykcs.ac.cn 首页或“过刊浏览”
我们在矿山上采集了一批原矿样品,但矿山上化验又喜欢采用传统化学分析方法,来分析矿石中各元素的百分含量。关键是老板不舍的出钱,所以请教下各位,如何才能更好的测定该多金属原矿中铜。铅。锌的百分含量?

求助大虾们 谁手头有没有关于(ICP-OES)等离子体发射光谱法测多金属元素的国家标准方法,若有,麻烦能不能提供一下国家标准号、行标号、或者电子版附件 在此谢过!!
各有关单位及行业专家:根据《成都市环境科学学会团体标准管理办法(试行)》的相关规定,由四川大学、四川省生态环境科学研究院等单位申报的《四川高山河谷区多金属矿区采选场地及周边影响区土壤污染风险管控与修复技术规范》团体标准已完成征求意见稿,为保证团体标准的科学性、实用性、可操作性,现公开征求意见。请各有关单位及专家对标准的征求意见稿提出宝贵的意见和建议,并将意见反馈表通过邮箱于2023年6月18日前反馈至学会秘书处。联系人:袁敏联系电话:17709039867电子邮箱:2215795430@qq.com[url=http://file2.foodmate.net/wenku2023/wfx202305231022.zip]附件:[/url]1、成都市环境科学学会团体标准意见反馈表2、《四川高山河谷区多金属矿区采选场地及周边影响区土壤污染风险管控与修复技术规范》征求意见稿3、《四川高山河谷区多金属矿区采选场地及周边影响区土壤污染风险管控与修复技术规范》编制说明[align=right]成都市环境科学学会[/align][align=right]2023年5月19日[/align]附件1 成都市环境科学学会团体标准征求意见反馈表.doc附件2 征求意见稿-四川高山河谷区多金属矿区及周边影响区土壤污染风险管控与修复技术规范.pdf附件3 标准编制说明.doc

ICP-OES用于测定多金属矿石中的元素分析摘要:样品经硝酸和氢溴酸处理后,用75%王水消解,盐酸介质中用耦合等离子体原子发射光谱仪分析其中的金属元素含量。1.仪器设备耦合等离子体原子发射光谱仪 Varian735ES (带自动进样器,冷却循环水机);电子天平,感量0.001mg石墨消解炉;PP试管,试管架瓶顶移液器,计时器;2.试剂2.1 浓盐酸、浓硝酸、氢溴酸(均为优级纯);2.2 消泡剂;Aerosol OT-B消泡剂(粉未)2.3 50 g/L Aerosol OT-B消泡剂:称取50g Aerosol OT-B消泡剂(粉未)于烧杯中,然后用纯水溶解,转入1L的容量瓶中,定容并充分摇匀,再转入1L的玻璃容器中静置,去掉底部约1cm深的溶液。(注:使用前必须充分摇匀)2.4 去离子水;2.5 75%的王水:向容量瓶中加入约200mL纯水及20mL50g/L Aerosol OT-B消泡剂,摇匀后加入187.5mL硝酸和562.5mL盐酸,并充分摇匀,然后加纯水至刻度,塞上瓶塞并摇匀。(注:此溶液的有效期为8小时,其瓶塞不可太紧,且应放置于通风柜中);2.6 50%盐酸(V/V):向1000mL容量瓶中加入约300mL纯水,再加入500mL的浓盐酸,加纯水至刻度,塞上瓶塞并摇匀3. 样品消解:3.1 准确称取0.4000g(精确至0.001g)样品于PP试管中,并将试管置于试管架上;3.2 向每根试管中加入2mL浓硝酸和0.5mL的氢溴酸,轻摇试管架使样品充分润湿,于室温下至少放置30分钟;3.3 将试管放入已恒温至115±5℃的石墨消解炉上,加热消解样品10分钟;3.4 将试管取下并放在试管架上,分4次加入20mL75%王水(2.5),待其稳定10~30分钟;3.5 转移试管至150±10℃的石墨消解炉上消解60分钟;3.6 取下试管并立即加入10mL浓盐酸,待其冷却至室温;3.7 将溶液转移至已加有20mL50%盐酸(2.6)的100 mL容量瓶中,反复冲洗试管3~4次,并将冲洗液转入容量瓶中,最后加纯水至刻度线,塞上瓶塞并反复摇晃容量瓶使溶液充分均匀;3.8 将溶液倒入PP试管中,送仪器分析。4.仪器分析 4.1使用Varian735ES耦合等离子体原子发射光谱仪(附带自动进样器)来进行样品溶液中元素的检测,相关元素如下:http://ng1.17img.cn/bbsfiles/images/2017/01/201701191656_648750_1657564_3.pnghttp://ng1.17img.cn/bbsfiles/images/2013/12/201312252122_484631_1657564_3.png4.2 将仪器各相关参数设置好,然后点火并预热约20分钟直至稳定;http://ng1.17img.cn/bbsfiles/images/2013/12/201312252111_484629_1657564_3.png4.3 用校正标准溶液(混合标液Cal-6对仪器进行校准,绘制校准曲线,曲线相关系数应≥0.995;http://ng1.17img.cn/bbsfiles/images/2013/12/201312252220_484644_1657564_3.png4.4 输入样品的相关信息,如样品标识号、重量、溶液体积等;4.5 将装有样品溶液的试管架放在自动进样器的相应位置,选择手动或自动进样方式,对样品溶液进行分析检测;4.6 样品中各元素浓度计算式为:http://ng1.17img.cn/bbsfiles/images/2017/10/2013091909234054_01_1657564_3.pngC : 样品中元素的浓度(ug/g)W : 样品溶液中元素的浓度(ug/mL)
[font=宋体, SimSun][size=18px]各有关单位及行业专家:[/size][/font][font=宋体, SimSun][size=18px]根据《成都市环境科学学会团体标准管理办法(试行)》的相关规定,由四川大学、四川省生态环境科学研究院等单位申报的《四川高山河谷区多金属矿区采选场地及周边影响区土壤污染风险管控与修复技术规范》团体标准已完成征求意见稿,为保证团体标准的科学性、实用性、可操作性,现公开征求意见。[/size][/font][font=宋体, SimSun][size=18px]请各有关单位及专家对标准的征求意见稿提出宝贵的意见和建议,并将意见反馈表通过邮箱于2023年6月18日前反馈至学会秘书处。[/size][/font][font=宋体, SimSun][size=18px]联系人:袁敏 [/size][/font][font=宋体, SimSun][size=18px]联系电话:17709039867[/size][/font][font=宋体, SimSun][size=18px]电子邮箱:2215795430@qq.com [/size][/font][font=宋体, SimSun][size=18px] [/size][/font][font=宋体, SimSun][size=18px]附件:[/size][/font][font=宋体, SimSun][size=18px]1、成都市环境科学学会团体标准意见反馈表[/size][/font][font=宋体, SimSun][size=18px]2、《四川高山河谷区多金属矿区采选场地及周边影响区土壤污染风险管控与修复技术规范》征求意见稿[/size][/font][font=宋体, SimSun][size=18px]3、《四川高山河谷区多金属矿区采选场地及周边影响区土壤污染风险管控与修复技术规范》编制说明[/size][/font][font=宋体, SimSun][size=18px] [/size][/font][font=宋体, SimSun][size=18px] [/size][/font][align=right][font=宋体, SimSun][size=18px]成都市环境科学学会[/size][/font][/align][align=right][font=宋体, SimSun][size=18px]2023年5月19日[/size][/font][/align][img]http://www.ttbz.org.cn/ueditor/dialogs/attachment/fileTypeImages/icon_doc.gif[/img][url=http://www.ttbz.org.cn/upload/file/20230519/6382011460080522105997403.doc]附件1 成都市环境科学学会团体标准征求意见反馈表.doc[/url][img]http://www.ttbz.org.cn/ueditor/dialogs/attachment/fileTypeImages/icon_pdf.gif[/img][url=http://www.ttbz.org.cn/upload/file/20230519/6382011460586351039035244.pdf]附件2 征求意见稿-四川高山河谷区多金属矿区及周边影响区土壤污染风险管控与修复技术规范.pdf[/url][img]http://www.ttbz.org.cn/ueditor/dialogs/attachment/fileTypeImages/icon_doc.gif[/img][url=http://www.ttbz.org.cn/upload/file/20230519/6382011463236702637981818.doc]附件3 标准编制说明.doc[/url]
最近做了一种多金属复合氧化物,但用XRD进行分析时发现,样品与现有的PDF卡片都对不上,所以怀疑是否产生了新的晶相,如果想要分析未知晶相的结构,应该怎么做,或者什么仪器可以做到?谢谢大家!原始数据文件已上传至附件。基本元素是 Te、V、Mo、Nb、O
一,金属键理论及其对金属通性的解释一切金属元素的单质,或多或少具有下述通性:有金属光泽,不透明,有良好的导热性与导电性,有延性和展性,熔点较高(除汞外在常温下都是晶体),等等.这些性质是金属晶体内部结构的外在表现.金属元素一般比较容易失去其价电子变为正离子,在金属单质中不可能有一部分原子变成负离子而形成离子键.由于X射线衍射法测定金属晶体结构的结果可知,其中每个金属原子与周围8到12个同等(或接近同等)距离的其它金属原子相紧邻,只有少数价电子的金属原子不可能形成8到12个共价键.金属晶体中的化学键应该属于别的键型.1916年 ,荷兰理论物理学家洛伦兹(Lorentz,H.A.1853-1928)提出金属"自由电子理论",可定性地阐明金属的一些特征性质.这个理论认为,在金属晶体中金属原子失去其价电子成为正离子,正离子如刚性球体排列在晶体中,电离下来的电子可在整个晶体范围内在正离子堆积的空隙中"自由"地运行,称为自由电子.正离子之间固然相互排斥,但可在晶体中自由运行的电子能吸引晶体中所有的正离子,把它们紧紧地"结合"在一起.这就是金属键的自由电子理论模型.根据上述模型可以看出金属键没有方向性和饱和性.这个模型可定性地解释金属的机械性能和其它通性.金属键是在一块晶体的整个范围内起作用的,因此要断开金属比较困难.但由于金属键没有方向性,原子排列方式简单,重复周期短(这是由于正离子堆积得很紧密),因此在两层正离子之间比较容易产生滑动,在滑动过程中自由电子的流动性能帮助克服势能障碍.滑动过程中,各层之间始终保持着金属键的作用,金属虽然发生了形变,但不至断裂.因此,金属一般有较好的延性,展性和可塑性. 由于自由电子几乎可以吸收所有波长的可见光,随即又发射出来,因而使金属具有通常所说的金属光泽.自由电子的这种吸光性能,使光线无法穿透金属.因此,金属一般是不透明的,除非是经特殊加工制成的极薄的箔片.关于金属的良好导电和导热性能,高中化学课本中已用自由电子模型作了解释.上面介绍的是最早提出的经典自由电子理论.1930年前后,由于将量子力学方法应用于研究金属的结构,这一理论已获得了广泛的发展.在金属的物理性质中有一种最有趣的性质是,包括碱金属在内的许多金属呈现出小量的顺磁性,这种顺磁性的大小近似地与温度无关.泡利曾在1927年对这一现象进行探讨,正是这一探讨开辟了现代金属电子理论的发展.它的基本概念是:在金属中存在着一组连续或部分连续的"自由"电子能级.在绝对零度时,电子(其数目为N个)通常成对地占据N/2个最稳定的能级.按照泡利不相容原理的要求,每一对电子的自旋方向是相反的 这样,在外加磁场中,这些电子的自旋磁矩就不能有效地取向.当温度比较高时,其中有一些配对的电子对被破坏了,电子对中的一个电子被提升到比较高的能级.未配对的电子的自旋磁矩能有效地取向,所以使金属具有顺磁性.(前一节中介绍价键理论的局限性时已指出,顺磁性物质一般是具有自旋未配对电子的物质.)未配对电子的数目随着温度的升高而增多 然而,每个未配对电子的自旋对顺磁磁化率的贡献是随着温度的升高而减小的.对这二种相反的效应进行定量讨论,解释了所观察到的顺磁性近似地与温度无关.索末菲与其他许多研究工作者,从1928年到30年代广泛地发展了金属的量子力学理论,建立起现代金属键和固体理论——能带理论,可以应用分子轨道理论去加以理解.(可参看大学《结构化学》教材有关部分)
本人是研一新生,使用氧化饵陶瓷靶射频溅射氧化饵薄膜,但是溅射之后靶的表面有很多金属颗粒状物体于靶材表面,原因无从而知,希望大佬们能给些意见,谢谢你们![img]https://ng1.17img.cn/bbsfiles/images/2020/06/202006151317575201_8602_4204633_3.png[/img][img]https://ng1.17img.cn/bbsfiles/images/2020/06/202006151317576246_7946_4204633_3.png[/img]
有害金属对食品的污染(一)有害金属污染食品的途径、毒作用特点和控制措施环境中80余种金属元素可以通过食物和饮水摄入,以及呼吸道吸入和皮肤接触等途径进入人体,其中一些金属元素在较低摄入量的情况下对人体即可产生明显的毒性作用。如铅、镉、汞等,常称之为有毒金属;另外许多金属元素,甚至包括某些必需元素,如铬、锰、锌、铜等,如摄入过量也可对人体产生较大的毒性作用或潜在危害。1.有害金属污染食品的途径 食品中的有害金属主要来源于①某些地区特殊自然环境中的高本底含量;②由于人为的环境污染而造成有毒有害金属元素对食品的污染;③食品加工、储存、运输和销售过程中使用和接触的机械、管道、容器以及添加剂中含有的有毒有害金属元素导致食品的污染。2.食品中有害金属污染的毒作用特点 摄入被有害元素污染的食品对人体可产生多方面的危害,其危害通常有以下共同特点:①强蓄积性:进入人体后排出缓慢,生物半衰期多较长;②可通过食物链的生物富集作用而在生物体及人体内达到很高的浓度,如鱼虾等水产品只能感汞和镉等金属毒物的含量可能高达环境浓度的数百倍甚至数千倍;③有毒有害金属污染食品对人体造成的危害常以慢性中毒和远期效应为主。3.影响金属毒物毒作用强度的因素 主要有以下几个方面:①金属元素的存在形式;②机体的健康和营养状况以及食物中某些营养素的含量和平衡情况;③金属元素间或金属与非金属元素间的相互作用;④另一方面,某些有些金属元素间也可产生协同作用。4.预防金属毒物污染食品及其对人体危害的一般措施 ①消除污染源;②制定各类食品中有毒有害金属的最高允许限量标准,并加强经常性的监督检测工作;③妥善保管有毒有害金属及其化合物,防止误食误用以及以外或人为污染食品;④对已污染的食品应根据污染物种类、来源、毒性大小、污染方式、程度和范围、受污染食品的种类和数量等不同情况作不同处理。处理原则是在确保使用安全性的基础上尽可能减少损失。三、N-亚硝基化合物污染及其预防N-亚硝基化合物(NOC)是对动物具有较强致癌作用的一类化学物质,已研究的有300多种亚硝基化合物,其中90%具有致癌性。(一)N-亚硝基化合物的分类和结构特点及理化性质根据分子结构不同N-亚硝基化合物可分为N-亚硝胺和N-亚硝酰胺。1. 亚硝胺: 亚硝胺是研究最多的一类N-亚硝基化合物,低分子量的亚硝胺(如二甲基亚硝胺)在常温下为黄色油状液体,高分子量的亚硝胺多为固体;溶于有机溶剂,特别是三氯甲烷。亚硝胺在中性和碱性环境中较稳定,在酸性环境中易破坏,盐酸有较强的去亚硝基作用。加热到70℃~110℃,N-N之间可发生断裂。此键最弱。形成氢键和加成反应:亚硝基上的O原子和与烷基相连的N原子能和甲酸、乙酸、三氯乙酸2.亚硝酰胺:亚硝酰胺的化学性质活泼,在酸性和碱性条件中均不稳定。在酸性条件下,分解为相应的酰胺和亚硝酸,在弱酸性条件下主要经重氮甲酸酯重排,放出N2和羟酯酸。在弱碱性条件下亚硝酰胺分解为重氮烷。(二)N-亚硝基化合物的前体物1.硝酸盐和亚硝酸盐(1)硝酸盐和亚硝酸盐广泛的存在于人类环境中,是自然界中最普遍含氮化合物。一般蔬菜中的硝酸盐含量较高,而亚硝酸盐含量较低。但腌制不充分的蔬菜、不新鲜的蔬菜中、泡菜中含有较多的亚硝酸盐(其中的硝酸盐在细菌作用下,转变成亚硝酸盐)。(2)作为食品添加剂加入量过多。2.胺类物质含氮的有机胺类化合物,是N-亚硝基化合物的前体物,也广泛的存在于环境中,尤其是食物中,因为蛋白质、氨基酸、磷脂等胺类的前体物,是各种天然食品的成分。另外,胺类也是药物、化学农药和一些化工产品的原材料(如大量的二级胺用于药物和工业原料)。(三)天然食品中的N-亚硝基化合物及亚硝胺在体内的合成在自然界中含量比较高的有以下几种: 海产品,肉制品,啤酒,及不新鲜的蔬菜等。此外亚硝基化合物可在机体内合成。胃[font=T
[url=https://insevent.instrument.com.cn/t/Wp][color=#3333ff]原子吸收[/color][/url]前处理常用酸和混合酸的重要特性1、HNO3HNO3是一种氧化性酸,它可以溶解绝大多数金属形成可溶性金属硝酸盐。浓度在2mol/L以下时,它的氧化能力很弱,但是在最高浓度时它是强氧化性酸。它的氧化能力可以通过加入氯酸盐、高锰酸盐、过氧化氢或溴,或者是通过提高温度和压力而得到提高。硝酸可以氧化绝大多数金属和合金,但是不能氧化金和铂,高浓度的硝酸可使一些金属钝化。溶解这些金属可以使用混酸或稀硝酸来实现。HNO3最常用的破坏有机物的酸。HNO3与其它的酸混合时是一种较强的酸,例如与HF混合。2、HClHCl是非氧化性酸,在溶解过程中它表现出弱的还原性。盐酸可以很容易地溶解许多金属碳酸盐、氧化物和碱金属氢氧化物,另外,它还可以溶解许多金属,包括Au、Cd、Fe和Sn,并且通过加入其它的酸可以加快溶解的速度。绝大多数金属生成可溶性金属氯化物,除了AgCl、HgCl和TiCl不溶和PbCl微溶几个特例外。HCl的络合性使许多金属可以完全溶解,例如和Fe(II)和Fe(III)络合生成(FeCl4)2-和(FeCl4)-。HCl经常和其它的酸混合使用,最常混合的为HNO3,王水就是HCl和HNO3(HCl+ HNO3=3+1)的混合物。3、HFHF是非氧化性酸,它的反应是基于它的强络合性。HF是无机分析中最常用的酸,因为它是为数不多能溶解硅酸盐的酸其中的一种。溶于HF的物质生成可溶性氟化物,除了碱土、镧系元素锕系元素生成不溶或微溶的氟化物。为了提高溶解能力,HF经常与其它酸混合使用,如HNO3。通过在消解后除去HF的方法,可以增加不溶氟化物的溶解性。 HF是一种溶解硅基物料的有效试剂。硅酸盐被转变成可挥发的物质而留下待测的元素。4、H2SO4稀硫酸没有任何氧化性,但浓硫酸能氧化许多物质。硫酸常与其它酸和溶剂混合使用,最常使用的是高氯酸和双氧水。硫酸作为脱水剂大大提高了高氯酸的氧化性。硫酸是许多有机组织、无机氧化物、氢氧化物、合金、金属及矿石等的在效溶剂。浓硫酸可完全破坏几乎所有的有机化合物。5、HClO4稀高氯酸不论是加热还是冷却,都是非氧化性酸。高浓度的高氯酸(60-72%)在低温时是非氧化性酸,但当处于高温时,它成为强氧化性酸。因此,高氯酸的氧化能力与它的和温度有关,高温高氯酸能容易地分解有机物质,有时是剧烈的。因为它能迅速与有机基体反应(有时爆炸),高氯酸通常与硝酸混合使用,这种混合酸可实现有机物的可控消解,在低温时,混酸中的硝酸首先氧化易被氧化的物质,随着温度的升高,高氯酸将完全消化未被消化的物质。因为高氯酸可以分解几乎所有的有机基体,所以可以选择它来破坏有机物,并且几乎所有的高氯酸盐都可溶。但是,许多干燥的高氯酸盐都可爆炸。6、H2O2消解中用到的双氧水典型的浓度大约为30%,但是浓度接近50%的也可以用。双氧水和许多有机物能发生爆炸反应,特别是在较高浓度的情况下。随着浓度的增加,双氧水和氧化性也在增加。双氧水通常与酸混合使用,双氧水和硫酸混合是一咱非常强的溶剂。鉴于它的氧化能力,通常在基体预消化后再加入双氧水,双氧水能够完全消化样品(如硝酸消解食物可类似样品后仍有残余有机物存在时,可以加入双氧水,双氧水就逐滴加入)。双氧水的用法与高氯酸相似,在有机物预消解后再加入双氧水是避免激烈反应的一个方法。7、H3PO4热磷酸已成功地用于消解那些用盐酸消解时会使某些特定痕量组分挥发损失掉的铁基合金。磷酸还可以溶解许多铝炉渣,铁矿石,铬及碱金属。资料共享!
RESTEK有很多金属柱,比如MXT金属色谱柱,那么这种金属柱是否可以切割,比如截柱头,如果可截,是否有专用工具?此外,看RESTEK家有很多柱链接器,有使用过的小伙伴吗?
大气多金属分析仪 型号 AMMS-100 厂商 聚光科技 Abient metal monitor (AMM) 型号Xact 620 厂商 CES
今天领导发现我测的仪器燃烧头下面好多金属地方生锈了,晕开始还以为这些东西不会生锈了,才用二年时间,是不是单火焰原吸经常吸取稀酸液从燃烧头喷出来腐蚀了金属还是这本是自然现象久了就会生锈。
酸浓度%(mol/L)特性用途硝酸(HNO3)69 (16)强氧化剂,不能将硫完全转化为硫酸盐可将样品中许多痕量元素转化为溶解度高的硝酸盐,通常加入盐酸及氢氟酸以增加溶解能力。多用于分解有机物。盐酸(HCl)36 (12)弱还原剂分解许多金属氧化物以及其氧化还原电位低于氢的金属,一般不用于分解有机物质。其中可能与AsSbSnSeTeGeHg等形成易挥发金属氯化物。高氯酸(HClO4)70 (12)热的时候是强氧化剂,与有机物结合可能产生爆炸。经常用来驱赶HCl、HNO3、HF,高氯酸盐绝大多数易溶,用它分解样品时其中Cr有10%以CrOCl3的形式挥发掉, V以VOCL3的形式挥发掉。氢氟酸(HF)48 (29)唯一能分解以硅为基体的无机酸常与HCl HClO4 HNO3混合使用主要用于分析硅酸盐类的样品(地质矿石土壤等),BAsSbGe也会根据其价态挥发。另外对玻璃器皿有强腐蚀作用,因此常采用柏或者塑料器皿在分解样品时我们常常采用硝酸、盐酸、氢氟酸、高氯酸中的一种或者多种混合,比如(VHCl:VHNO3=3:1王水※, VHNO3: VHCl =3:1逆王水※)等。必须使用HF溶解样品时,在处理完后要冒烟除去HF,用稀盐酸或者稀硝酸稀释定容。必须用硫酸和磷酸处理样品时,必须控制其酸度在8%以内。高氯酸慎用!
根据分解试样时所用的试剂不同,分解方法可分别为湿法和干法。湿法是用酸、碱或盐的溶液来分解试样,干法则用固体的盐、碱来熔融或烧结分解试样。 一、 酸法分解 由于酸较易提纯,过量的酸,除磷酸外,也较易除去,分解时,不引进除氢离子以外的阳离子,操作简单,使用温度低,对容器腐蚀性小等优点,应用较广。酸分解法的缺点是对某些矿物的分解能力较差,某些元素可能挥发损失。1、盐酸浓盐酸的沸点为108℃,故溶解温度最好低于80℃,否则,因盐酸蒸发太快,试样分解不完全。① 易溶于盐酸的元素或化合物是:Fe,Co,Ni,Cr,Zn;普通钢铁、高铬铁,多数金属氧化物(如MnO2、2PbOPbO2、Fe2O3等),过氧化物,氢氧化物,硫化物、碳酸盐、磷酸盐、硼酸盐等。②不溶于盐酸的物质包括灼烧过的Al,Be,Cr,Fe,Ti,Zr和Th的氧化物SnO2,Sb2O5,Nb2O5,Ta2O5,磷酸锆,独居石,磷钇矿,锶、钡和铅的硫酸盐,尖晶石,黄铁矿;汞和某些金属的硫化物,铬铁矿,铌和钽矿石和各种钍和铀的矿石。③ As (Ⅲ),Sb (Ⅲ),Ge (Ⅳ) 和Se (Ⅳ),Hg (Ⅱ),Sn (Ⅳ),Re (Ⅷ) 容易从盐酸溶液中(特别是加热时)挥发失去。在加热溶液时,试样中的其他挥发性酸,诸如HBr,HI,HNO3,H3BO3和SO3当然也会失去。2、硝酸① 易溶于硝酸的元素和化合物是除金和铂系金属及易被硝酸钝化以外的金属、晶质铀矿(UO2)和钍石(ThO2)、铅矿,几乎所有铀的原生矿物及其碳酸盐、磷酸盐、钒酸盐、硫酸盐。②硝酸不宜分解氧化物以及元素Se,Te,As。很多金属浸入硝酸时形成不溶的氧化物保护层,因而不被溶解,这些金属包括Al,Be,Cr,Ga,In,Nb,Ta,Th,Ti,Zr和Hf。Ca,Mg,Fe能溶于较稀的硝酸。3、硫酸①浓硫酸可分解硫化物、砷化物、氟化物、磷酸盐、锑矿物、铀矿物、独居石、萤石等。还广泛用于氧化金属Sb,As,Sn和Pb的合金及各种冶金产品,但铅沉淀为PbSO4。溶解完全后,能方便地借加热至冒烟的方法除去部分剩余的酸,但这样做将失去部分砷。硫酸还经常用于溶解氧化物、氢氧化物、碳酸盐。由于硫酸钙的溶解度低,所以硫酸不适于溶解钙为主要组分的那些物质。②硫酸的一个重要应用是除去挥发性酸,但Hg (Ⅱ),Se (Ⅳ)和Re (Ⅶ)在某种程度上可能失去。磷酸、硼酸也能失去。4、磷酸磷酸可用来分解许多硅酸盐矿物、多数硫化物矿物、天然的稀土元素磷酸盐、四价铀和六价铀的混合氧化物。磷酸最重要的分析应用是测定铬铁矿,铁氧体和各种不溶于氢氟酸的硅酸盐中的二价铁。尽管磷酸有很强的分解能力,但通常仅用于一些单项测定,而不用于系统分析。磷酸与许多金属,甚至在较强的酸性溶液中,亦能形成难溶的盐,给分析带来许多不便。5、高氯酸温热或冷的稀高氯酸水溶液不具有氧化性。较浓的酸(60%~72%)虽然冷时没有氧化能力,热时却是强氧化剂。纯高氯酸是极其危险的氧化剂,放置时它将爆炸,因而决不能使用。操作高氯酸、水和诸如乙酸酐或浓硫酸等脱水剂的混合物应格外小心,每当高氯酸与性质不明的化合物混合时,也应极为小心,这是严格的规则。热的浓高氯酸几乎与所有的金属(除金和一些铂系金属外)起反应,并将金属氧化为最高价态,只有铅和锰呈较低氧化态,即Pb (Ⅱ)和Mn (Ⅱ)。但在此条件下,Cr不被完全氧化为Cr (Ⅵ)。若在溶液中加入氯化物可保证所有的铱都呈四价。高氯酸还可溶解硫化物矿、铬铁矿、磷灰石、三氧化二铬以及钢中夹杂碳化物。6、氢氟酸氢氟酸分解极其广泛地应用于分析天然或工业生产的硅酸盐,同时也适用于许多其他物质,如Nb,Ta,Ti和Zr的氧化物、Nb和Ta的矿石或含硅量低的矿石。另外,含钨铌钢、硅钢、稀土、铀等矿物也均易用氢氟酸分解。许多矿物,包括石英、绿柱石、锆石、铬铁矿、黄玉、锡石、刚玉、黄铁矿、蓝晶石、十字石、黄铜矿、磁黄铁矿、红柱石、尖晶石、石墨、金红石、硅线石和某些电气石,用氢氟酸分解将遇到困难。7、混合酸混合酸常能起到取长补短的作用,有时还会得到新的,更强的溶解能力。王水(HNO3∶HCl = 1∶3):可分解贵金属和辰砂、镉、汞、钙等多种硫化矿物,亦可分解铀的天然氧化物、沥青铀矿及许多其他的含稀土元素、钍、锆的衍生物,某些硅酸盐、矾矿物、彩钼铅矿、钼钙矿、大多数天然硫酸盐类矿物。磷酸 — 硝酸:可分解铜和锌的硫化物和氧化物。磷酸 — 硫酸:可分解许多氧化矿物,如铁矿石和一些对其他无机酸稳定的硅酸盐。高氯酸 — 硫酸:适于分解铬尖石等很稳定的矿物。高氯酸 — 盐酸 — 硫酸:可分解铁矿、镍矿、锰矿石。氢氟酸 — 硝酸:可分解硅铁、硅酸盐及含钨、铌、钛等试样。
根据分解试样时所用的试剂不同,分解方法可分别为湿法和干法。湿法是用酸、碱或盐的溶液来分解试样,干法则用固体的盐、碱来熔融或烧结分解试样。 1. 酸法分解 由于酸较易提纯,过量的酸,除磷酸外,也较易除去,分解时,不引进除氢离子以外的阳离子,操作简单,使用温度低,对容器腐蚀性小等优点,应用较广。酸分解法的缺点是对某些矿物的分解能力较差,某些元素可能挥发损失。⒈盐酸浓盐酸的沸点为108℃,故溶解温度最好低于80℃,否则,因盐酸蒸发太快,试样分解不完全。⑴ 易溶于盐酸的元素或化合物是:Fe,Co,Ni,Cr,Zn;普通钢铁、高铬铁,多数金属氧化物(如MnO2、2PbOPbO2、Fe2O3等),过氧化物,氢氧化物,硫化物、碳酸盐、磷酸盐、硼酸盐等。⑵ 不溶于盐酸的物质包括灼烧过的Al,Be,Cr,Fe,Ti,Zr和Th的氧化物SnO2,Sb2O5,Nb2O5,Ta2O5,磷酸锆,独居石,磷钇矿,锶、钡和铅的硫酸盐,尖晶石,黄铁矿;汞和某些金属的硫化物,铬铁矿,铌和钽矿石和各种钍和铀的矿石。⑶ As (III),Sb (III),Ge (IV) 和Se (IV),Hg (II),Sn (IV),Re (VIII) 容易从盐酸溶液中(特别是加热时)挥发失去。在加热溶液时,试样中的其他挥发性酸,诸如HBr,HI,HNO3,H3BO3和SO3当然也会失去。⒉硝酸⑴ 易溶于硝酸的元素和化合物是除金和铂系金属及易被硝酸钝化以外的金属、晶质铀矿(UO2)和钍石(ThO2)、铅矿,几乎所有铀的原生矿物及其碳酸盐、磷酸盐、钒酸盐、硫酸盐。⑵ 硝酸不宜分解氧化物以及元素Se,Te,As。很多金属浸入硝酸时形成不溶的氧化物保护层,因而不被溶解,这些金属包括Al,Be,Cr,Ga,In,Nb,Ta,Th,Ti,Zr和Hf。Ca,Mg,Fe能溶于较稀的硝酸。⒊硫酸⑴ 浓硫酸可分解硫化物、砷化物、氟化物、磷酸盐、锑矿物、铀矿物、独居石、萤石等。还广泛用于氧化金属Sb,As,Sn和Pb的合金及各种冶金产品,但铅沉淀为PbSO4。溶解完全后,能方便地借加热至冒烟的方法除去部分剩余的酸,但这样做将失去部分砷。硫酸还经常用于溶解氧化物、氢氧化物、碳酸盐。由于硫酸钙的溶解度低,所以硫酸不适于溶解钙为主要组分的那些物质。⑵ 硫酸的一个重要应用是除去挥发性酸,但Hg (II),Se (IV)和Re (VII)在某种程度上可能失去。磷酸、硼酸也能失去。⒋磷酸磷酸可用来分解许多硅酸盐矿物、多数硫化物矿物、天然的稀土元素磷酸盐、四价铀和六价铀的混合氧化物。磷酸最重要的分析应用是测定铬铁矿,铁氧体和各种不溶于氢氟酸的硅酸盐中的二价铁。尽管磷酸有很强的分解能力,但通常仅用于一些单项测定,而不用于系统分析。磷酸与许多金属,甚至在较强的酸性溶液中,亦能形成难溶的盐,给分析带来许多不便。⒌高氯酸温热或冷的稀高氯酸水溶液不具有氧化性。较浓的酸(60%~72%)虽然冷时没有氧化能力,热时却是强氧化剂。纯高氯酸是极其危险的氧化剂,放置时它将爆炸,因而决不能使用。操作高氯酸、水和诸如乙酸酐或浓硫酸等脱水剂的混合物应格外小心,每当高氯酸与性质不明的化合物混合时,也应极为小心,这是严格的规则。热的浓高氯酸几乎与所有的金属(除金和一些铂系金属外)起反应,并将金属氧化为最高价态,只有铅和锰呈较低氧化态,即Pb (II)和Mn (II)。但在此条件下,Cr不被完全氧化为Cr (VI)。若在溶液中加入氯化物可保证所有的铱都呈四价。高氯酸还可溶解硫化物矿、铬铁矿、磷灰石、三氧化二铬以及钢中夹杂碳化物。⒍氢氟酸氢氟酸分解极其广泛地应用于分析天然或工业生产的硅酸盐,同时也适用于许多其他物质,如Nb,Ta,Ti和Zr的氧化物、Nb和Ta的矿石或含硅量低的矿石。另外,含钨铌钢、硅钢、稀土、铀等矿物也均易用氢氟酸分解。许多矿物,包括石英、绿柱石、锆石、铬铁矿、黄玉、锡石、刚玉、黄铁矿、蓝晶石、十字石、黄铜矿、磁黄铁矿、红柱石、尖晶石、石墨、金红石、硅线石和某些电气石,用氢氟酸分解将遇到困难。⒎混合酸混合酸常能起到取长补短的作用,有时还会得到新的,更强的溶解能力。王水(HNO3︰HCl = 1︰3):可分解贵金属和辰砂、镉、汞、钙等多种硫化矿物,亦可分解铀的天然氧化物、沥青铀矿及许多其他的含稀土元素、钍、锆的衍生物,某些硅酸盐、矾矿物、彩钼铅矿、钼钙矿、大多数天然硫酸盐类矿物。磷酸 — 硝酸:可分解铜和锌的硫化物和氧化物。磷酸 — 硫酸:可分解许多氧化矿物,如铁矿石和一些对其他无机酸稳定的硅酸盐。高氯酸 — 硫酸:适于分解铬尖石等很稳定的矿物。高氯酸 — 盐酸 — 硫酸:可分解铁矿、镍矿、锰矿石。氢氟酸 — 硝酸:可分解硅铁、硅酸盐及含钨、铌、钛等试样。
华北地区中生代岩浆岩成因系列与内生金属矿床组合[J].地质与勘探,1985,21(4 ):1-5.湘东南燕山早期钨锡与铅锌多金属矿床组合形成的构造-岩浆动力学机制广西融水蛇绿岩及其矿床组合特征河北下营房金矿床的复合成矿作用及矿床组合研究湘东南燕山早期钨锡与铅锌多金属矿床组合形成的构造-岩浆动力学机制
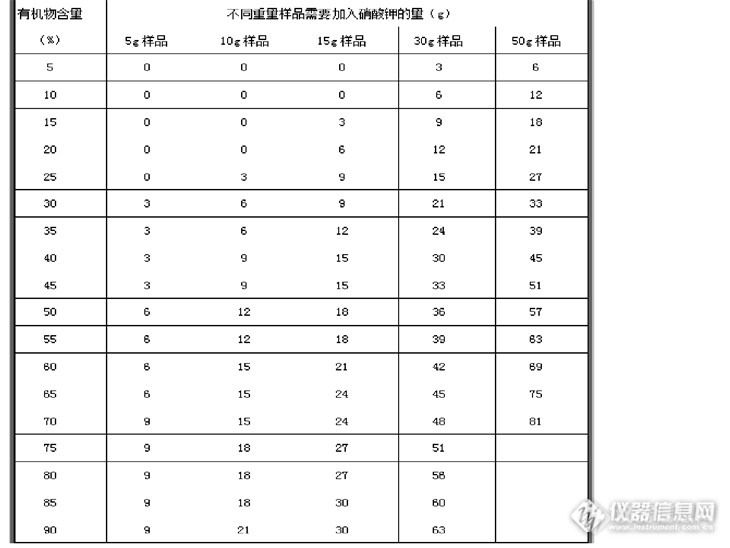
99%,对低至0.2~0.3g/t的Au仍有很高的回收率,铅试金对常量及微量贵金属的分析准确度都很高。但是实际操作中,我们会碰到很多不同类型的样品,由于成矿的不同,矿石或者矿体的成分相差很大,有的含有机物C,S很高,有的含Fe,Cu,Mn,Cr等金属元素很高,在样品熔炼前如何平衡这些组分之间的影响,才能更好的造渣,得到很好的熔炼效果。这就需要在实际操作中摸索和总结一些经验了。下面就以我们做过的常见的一些有代表性的样品为例总结出的一些经验和大家分享。为了便于大家理解,先来说一下火试金熔炼中用到的5种试剂的作用:硝酸钾(KNO3)又名硝石,是一种很强的氧化剂。在高温时分解释放出氧,将硫化物及砷化物等氧化成氧化物,控制硫化物对氧化铅的还原能力,以便获得质量合适的铅扣。使用硝酸钾时,必须将试样先进行氧化力试验,然后再计算硝酸钾的需要量,一般以每克硝酸钾能氧化4g金属铅来计算。氧化铅(PbO) 与重金属的硫化物共热时,它很容易放出氧气,将硫化物氧化成氧化物(贵金属和铅的硫化物除外),氧化铅自身被还原成金属。面粉(C6H10O5)是试金分析中常用的还原剂,它受热后失去水分,生成颗粒细微的无定形碳,能均匀地分布在坩埚物料中,在低于500℃开始起还原反应,当600℃时其反应速度最快。面粉的还原力理论值是15 .3,即1g面粉能还原15. 3g铅,但实际上只能还原出10~12g铅。二氧化硅(SiO2) 即石英粉,是一种很强的酸性熔剂。硼砂(Na2B4O7·10H2O)是一种活泼而易熔的酸性熔剂,它在熔炼中在350℃时开始失去其中的结晶水,并迅速膨胀。因此在配料中使用过量的硼砂容易引起熔炼时物料溢出,造成坩埚内试样的损失。硼砂能和许多金属氧化物形成硼酸盐,它们的熔点要比相应的硅酸盐低。例如CaSiO2的熔点是1540℃,Ca2SiO4的熔点是2130[/font
根据分解试样时所用的试剂不同,分解方法可分别为湿法和干法。湿法是用酸、碱或盐的溶液来分解试样,干法则用固体的盐、碱来熔融或烧结分解试样。 6.2.1 酸法分解 由于酸较易提纯,过量的酸,除磷酸外,也较易除去,分解时,不引进除氢离子以外的阳离子,操作简单,使用温度低,对容器腐蚀性小等优点,应用较广。酸分解法的缺点是对某些矿物的分解能力较差,某些元素可能挥发损失。⒈盐酸浓盐酸的沸点为108℃,故溶解温度最好低于80℃,否则,因盐酸蒸发太快,试样分解不完全。⑴ 易溶于盐酸的元素或化合物是:Fe,Co,Ni,Cr,Zn;普通钢铁、高铬铁,多数金属氧化物(如MnO2、2PbOPbO2、Fe2O3等),过氧化物,氢氧化物,硫化物、碳酸盐、磷酸盐、硼酸盐等。⑵ 不溶于盐酸的物质包括灼烧过的Al,Be,Cr,Fe,Ti,Zr和Th的氧化物SnO2,Sb2O5,Nb2O5,Ta2O5,磷酸锆,独居石,磷钇矿,锶、钡和铅的硫酸盐,尖晶石,黄铁矿;汞和某些金属的硫化物,铬铁矿,铌和钽矿石和各种钍和铀的矿石。⑶ As (III),Sb (III),Ge (IV) 和Se (IV),Hg (II),Sn (IV),Re (VIII) 容易从盐酸溶液中(特别是加热时)挥发失去。在加热溶液时,试样中的其他挥发性酸,诸如HBr,HI,HNO3,H3BO3和SO3当然也会失去。⒉硝酸⑴ 易溶于硝酸的元素和化合物是除金和铂系金属及易被硝酸钝化以外的金属、晶质铀矿(UO2)和钍石(ThO2)、铅矿,几乎所有铀的原生矿物及其碳酸盐、磷酸盐、钒酸盐、硫酸盐。⑵ 硝酸不宜分解氧化物以及元素Se,Te,As。很多金属浸入硝酸时形成不溶的氧化物保护层,因而不被溶解,这些金属包括Al,Be,Cr,Ga,In,Nb,Ta,Th,Ti,Zr和Hf。Ca,Mg,Fe能溶于较稀的硝酸。⒊硫酸⑴ 浓硫酸可分解硫化物、砷化物、氟化物、磷酸盐、锑矿物、铀矿物、独居石、萤石等。还广泛用于氧化金属Sb,As,Sn和Pb的合金及各种冶金产品,但铅沉淀为PbSO4。溶解完全后,能方便地借加热至冒烟的方法除去部分剩余的酸,但这样做将失去部分砷。硫酸还经常用于溶解氧化物、氢氧化物、碳酸盐。由于硫酸钙的溶解度低,所以硫酸不适于溶解钙为主要组分的那些物质。⑵ 硫酸的一个重要应用是除去挥发性酸,但Hg (II),Se (IV)和Re (VII)在某种程度上可能失去。磷酸、硼酸也能失去。⒋磷酸磷酸可用来分解许多硅酸盐矿物、多数硫化物矿物、天然的稀土元素磷酸盐、四价铀和六价铀的混合氧化物。磷酸最重要的分析应用是测定铬铁矿,铁氧体和各种不溶于氢氟酸的硅酸盐中的二价铁。尽管磷酸有很强的分解能力,但通常仅用于一些单项测定,而不用于系统分析。磷酸与许多金属,甚至在较强的酸性溶液中,亦能形成难溶的盐,给分析带来许多不便。⒌高氯酸温热或冷的稀高氯酸水溶液不具有氧化性。较浓的酸(60%~72%)虽然冷时没有氧化能力,热时却是强氧化剂。纯高氯酸是极其危险的氧化剂,放置时它将爆炸,因而决不能使用。操作高氯酸、水和诸如乙酸酐或浓硫酸等脱水剂的混合物应格外小心,每当高氯酸与性质不明的化合物混合时,也应极为小心,这是严格的规则。热的浓高氯酸几乎与所有的金属(除金和一些铂系金属外)起反应,并将金属氧化为最高价态,只有铅和锰呈较低氧化态,即Pb (II)和Mn (II)。但在此条件下,Cr不被完全氧化为Cr (VI)。若在溶液中加入氯化物可保证所有的铱都呈四价。高氯酸还可溶解硫化物矿、铬铁矿、磷灰石、三氧化二铬以及钢中夹杂碳化物。⒍氢氟酸氢氟酸分解极其广泛地应用于分析天然或工业生产的硅酸盐,同时也适用于许多其他物质,如Nb,Ta,Ti和Zr的氧化物、Nb和Ta的矿石或含硅量低的矿石。另外,含钨铌钢、硅钢、稀土、铀等矿物也均易用氢氟酸分解。许多矿物,包括石英、绿柱石、锆石、铬铁矿、黄玉、锡石、刚玉、黄铁矿、蓝晶石、十字石、黄铜矿、磁黄铁矿、红柱石、尖晶石、石墨、金红石、硅线石和某些电气石,用氢氟酸分解将遇到困难。⒎混合酸混合酸常能起到取长补短的作用,有时还会得到新的,更强的溶解能力。王水(HNO3︰HCl = 1︰3):可分解贵金属和辰砂、镉、汞、钙等多种硫化矿物,亦可分解铀的天然氧化物、沥青铀矿及许多其他的含稀土元素、钍、锆的衍生物,某些硅酸盐、矾矿物、彩钼铅矿、钼钙矿、大多数天然硫酸盐类矿物。磷酸 — 硝酸:可分解铜和锌的硫化物和氧化物。磷酸 — 硫酸:可分解许多氧化矿物,如铁矿石和一些对其他无机酸稳定的硅酸盐。

摘要:采用碱熔融酸化方法处理样品,电感耦合等离子体原子发射光谱法同时测定锰精矿中的钨、锡、钼、铌、钽、钒。方法相对标准偏差(RSD,n=11)低于5.0%;回收率为99.5~105%,经国家有证标准物质分析验证,测定结果与标准值吻合很好。关键词:电感耦合等离子体原子发射光谱法,锰精矿,熔融,同时测定Simultaneous Determination of high grade tungsten, stannum, molybdenum,niobium, tantalum and vanadium in manganic concerntrate Samples by Inductively Coupled Plasma –OpticalEmission SpectrometryAbstract: The quantitative analysis of W, Sn,Mo,Nb, Ta, V in manganic concerntrate samples were tested using ICP-OES with Na2O2 fusion. The reliability of the methodhas been tested by determination of these elements in rock and mineral NationalStandard Reference samples and the results are in agreement with certifiedvalues with the precision of less than 5.0% RSD(n=11).Recoveries for differentelements are between 99.5% and 105%.Key words:InductivelyCoupled Plasma –Optical Emission Spectrometry,manganic concerntrate,fusion, Simultaneous Determination自然界中的锰呈化合物存在,具有工业意义的大部分是锰的氧化物和碳酸盐矿物(见表)。锰矿石的工业类型有碳酸锰矿石、氧化锰矿石、混合锰矿石及多金属锰矿石等。中国的锰矿以碳酸锰矿石为主,铁锰矿石次之,还有氧化锰矿石、混合锰矿石及多金属锰矿石。其中含有大量的有价值的多金属矿。准确了解这些主要元素的含量,具有重要的意义。在矿石样品的分析中,国家标准方法主要采用原子吸收光谱法测定各元素的含量。原子吸收法具有一定的缺陷,不能同时测定多种元素。而电感耦合等离子体原子发射光谱法(ICP-OES)具有线性范围宽、灵敏度高、多元素同时测定等优点。在样品分析测试中,电感耦合等离子体原子发射光谱法已得到广泛应用;但是利用ICP-OES法同时测定岩矿中高含量的砷、锑、锡、钨、钼、铌、钽、钒,文献报道较少。固体地球化学样品的溶解一般有混合酸消解法、碱熔消解法两类。虽然HCl-HNO3-HF-HClO4混合酸能溶解大多数金属元素,如铜、铅、锌、镍等元素,但对于高含量的难溶金属元素,过氧化钠碱熔是个不错的选择。本文采用锆坩锅为容器,过氧化钠为熔剂,高温熔融,盐酸提取,以Eu为内标元素,采用内标校正法,用ICP-OES测定岩矿中高含量的砷、锑、锡、钨、钼、铌、钽、钒。研究了试样熔融时间、熔剂量、盐酸量对试样溶解结果的影响,选择了仪器的最佳工作条件,消除了对被测元素和被测元素之间的干扰,用有证标准物质验证,测定值与标准值一致,本法简便易行、快速准确。1 实验部分1.1 仪器及工作参数Varian735ES ICP-OES电感耦合等离子体原子发射光谱仪(美国瓦里安公司),功率[/fon
1)王水,HCl:HNO3=3:1(v/v)王水需现配现用。王水可用来溶解许多金属和合金,其中包括钢、高温合金钢、铝合金、锑、铬和铂族金属等。植物体与废水也常使用它来进行消化。2)HNO3:H2SO4,常用比例为1:1(v/v)这种混酸的最高温度仅比单纯HNO3时的最高温度高10℃左右。用它消解的样品有:聚合物、脂肪及有机物质。3)HNO3:HF,常用比例为5:1(v/v)这种混合酸对于溶解金属钛、铌、钽、锆、铪、钨及其合金特别有效,也可用来溶解铼、锡及锡合金、各种碳化物及氮化物、铀及钨矿石、硫化物矿石及各种硅酸盐。4)H2SO4:H3PO4,常用比例为1:1(v/v)此种混合酸用于消解陶瓷,尤其是一些含铝高的陶瓷和耐火材料等。5)HNO3、HCl、HF混酸先配制王水(HCl:HNO3=3:1,v/v),再将王水:HF=7:3(v/v)配制。或者以HNO3:HCl:HF=5:15:3(v/v/v)配制。这种混酸适用于消解合金、矽酸盐、岩石、熔渣、 沸石、玻璃、陶瓷等。

http://ng1.17img.cn/bbsfiles/images/2016/12/201612301503_01_3167027_3.jpg产品介绍: LBT-GDYN-301M农产品安全快速检测仪(农残、硝酸盐、重金属)应用 适用于农副产品、日常食品、海产品及其制品等食品中农残、硝酸盐、重金属等的快速定量测定 LBT-GDYN-301M农产品安全快速检测仪(农残、硝酸盐、重金属)特点 1、样品培养生化、反应、显色和测定一体化,样品无需转移。 2、仪器能多通道(6通道)检测(农残),全自动测量提高检测效率。 3、同时显示出被测样品的抑制率和吸光度。 4、试剂为进口酶,液体小包装,使用方便。 5、仪器全固态、模块化设计,使用可靠,寿命长达10万小时。 6、 色环保型设计,使用安全无污染。 7、可现场分别定量检测农残、硝酸盐、重金属。 LBT-GDYN-301M农产品安全快速检测仪(农残、硝酸盐、重金属)技术指标 测定下限: 农 残:0.01-3.0mg/kg 硝酸盐:100.0mg/kg 重金属:0.20mg/kg(以Cr计) 测定范围: 农 残:0-100% 硝酸盐:0.0-15000mg/kg 重金属:0.0-20.0mg/kg(以Cr计) 测量精度: 农 残:±5% 硝酸盐:±5% 重金属:±2%
想跟各位前辈请教一下:最近用[url=https://insevent.instrument.com.cn/t/yp][color=#3333ff]ICP-MS[/color][/url]测试尿样中锰、镍、铜等多金属含量,其他金属的RSD能控制在8左右,但是锰元素的RSD好的情况五点多,差的时候能到二三十。造成锰元素RSD差的原因有哪些?能用哪些方法改善?
海水中很多金属元素的浓度实在太低,急需一种可以用于高盐度基体的分离富集技术,请各位专家同仁指点...[em61]