席夫碱铜(II)配合物用dmso做溶剂,为什么不出峰?
配合物组成用电脑处理可减少误差 如何测
各位,请帮帮我这个新手。我是做配合物的,我的TG用氦气保护,加热到700度,失重至0mg.配合物中含有金属离子,芳香羧酸,胺。仪器是PE公司的。为什么会一点东西都没有了。谢谢。
想请问配合物如果测电导率的几个问题:1. 什么样的配合物一般测电导率有意义?也就是说那些特性的配合物一般用来测电导率?2. 测试的时候,样品要用量多少?纯度要求多高?用的是固体样品还是溶液样品?3. 测试的仪器叫什么名字?
今天在文献中见到,有人在含有Ni-C键和膦配体的Ni络合物的核磁鉴定中,观测到膦配体中的31P和Ni-C键中的13C之间的偶合,从而证明配合物的结构.请问配合物中配体的杂核与配合物其他与金属成键原子之间的偶合是否是通常的现象?能否作为结构的可靠证据?
我最近做了一个配合物,配离子是Tb3+,氢的化学位移跑到了40ppm去了,不知道做过类似的配合物没有?tb3+的吸引电子的能力有这么强吗?
是不是所有的稀土配合物都不能做核磁?有没有其他可以替代的检测方法呢?谢谢!
金属有机配合物 测定,手性配合物如何确定。
核磁新手问:一般金属离子配合物做核磁需要什么特殊制样过程吗?如果金属离子有磁性,能做核磁吗?
哪位大侠,可以告诉我稀土元素和哪些有机物形成配合物,其形成配合物的机理是什么?尤其是药物方面,哪些药物可以和稀土元素形成配合物。
如果又一个配合物,在溶液状态会慢慢氧化,氧化前金属是抗磁性的,而氧化后是顺磁性的,该怎么做核磁比较好
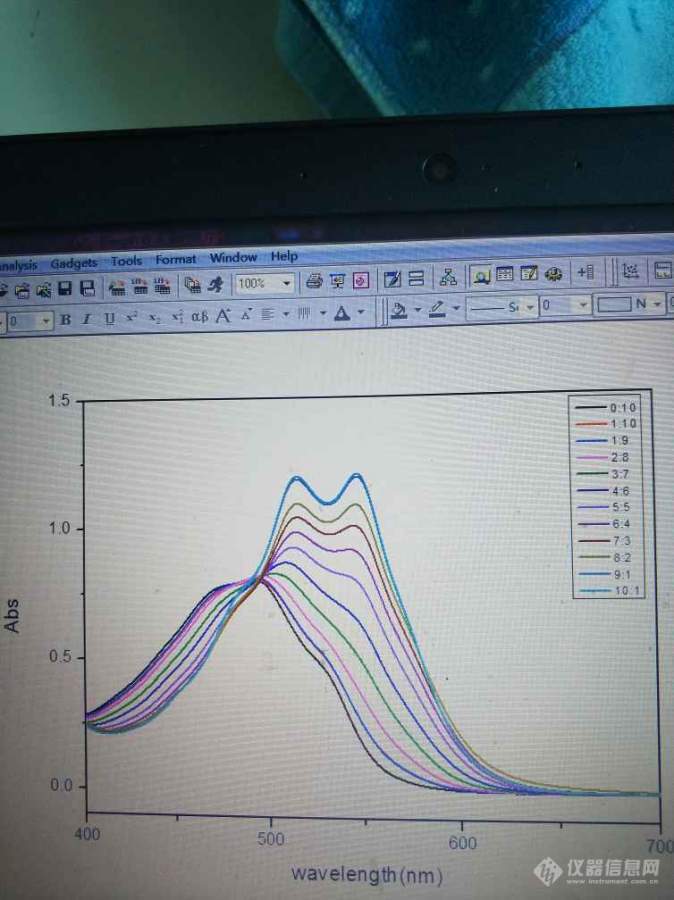
[color=#444444]紫外吸收光谱图中逐渐出现的双峰是代表生成了两种不同配比的配合物吗,如何测定配位比呢[/color][color=#444444][img=,674,900]https://ng1.17img.cn/bbsfiles/images/2019/07/201907251121543654_6682_1752342_3.jpg!w674x900.jpg[/img][/color]
方法一:挥发用金属配合物的良溶剂将其溶解在小烧杯中,小烧杯的内表面越光滑单晶性越好,否则晶体形状不好缺陷多就会给后面的收单晶衍射数据带来麻烦,甚至会造成无法解晶体结构,那将是非常可惜的;烧杯用滤纸或塑料薄膜封口防止灰尘落入,同时减慢挥发速度,长出较好晶形的单晶,一般挥发性稍差的溶剂用滤纸,如,水等。静置至发现满意的晶体出现。方法二:扩散用金属配合物的良溶剂将其溶解在小烧杯或广口瓶中,塑料薄膜封口(用针戳3-5个小孔),放于盛有该金属配合物的挥发性不良溶剂(一般用乙醚)的大瓶子中。静置至发现满意的晶体出现。方法三:分层将金属的水溶液放于试管下层,配体的有机溶剂溶液放于试管上层,中间是水和有机溶剂的混合溶剂,封口。操作要小心,最好是用滴管伸进试管靠近液面缓慢滴加。静置至发现满意的晶体出现。以上是我在培养配合物单晶常用的方法,一般是几种方法同时做,不是每种方法都能或总能培养出单晶,更多的是取决于配合物的结晶性好坏。总之就是多试:不同的温度、溶剂、混合溶剂的比例……1.制备结晶,要注意选择合宜的溶剂和应用适量的溶剂。合宜的溶剂,最好是在冷时对所需要的成分溶解度较小,而热时溶解度较大。溶剂的沸点亦不宜太高。一般常用甲醇、丙酮、氯仿、乙醇、乙酸乙醋等。但有些化合物在一般溶剂中不易形成结晶,而在某些溶剂中则易于形成结晶。2.制备结晶的溶液,需要成为过饱和的溶液。一般是应用适量的溶剂在加温的情况下,将化合物溶解再放置冷处。如果在室温中可以析出结晶,就不一定放置于冰箱中,以免伴随结晶析出更多的杂质。“新生态”的物质即新游离的物质或无定形的粉未状物质,远较晶体物质的溶解度大,易于形成过饱和溶液。一般经过精制的化合物,在蒸去溶剂抽松为无定形粉未时就是如此,有时只要加入少量溶剂,往往立即可以溶解,稍稍放置即能析出结晶。3.制备结晶溶液,除选用单一溶剂外,也常采用混合溶剂。一般是先将化合物溶于易溶的溶剂中,再在室温下滴加适量的难溶的溶剂,直至溶液微呈浑浊,并将此溶液微微加温,使溶液完全澄清后放置。4.结晶过程中,一般是溶液浓度高,降温诀,析出结晶的速度也快些。但是其结晶的颗粒较小,杂质也可能多些。有时自溶液中析出的速度太快,超过化合物晶核的形成劝分子定向排列的速度,往往只能得到无定形粉未。有时溶液太浓,粘度大反而不易结晶化。如果溶液浓度适当,温度慢慢降低,有可能析出结晶较大而纯度较高的结晶。有的化合物其结晶的形成需要较长的时间。5.制备结晶除应注意以上各点外,在放置过程中,最好先塞紧瓶塞,避免液面先出现结晶,而致结晶纯度较低。如果放置一段时间后没有结晶析出,可以加入极微量的种晶,即同种化合物结晶的微小颗粒。加种晶是诱导晶核形成常用而有效的手段。一般地说,结晶化过程是有高度选择性的,当加入同种分子或离子,结晶多会立即长大。而且溶液中如果是光学异构体的混合物,还可依种晶性质优先析出其同种光学异构体。没有种晶时,可用玻璃棒蘸过饱和溶液一滴,在空气中任溶剂挥散,再用以磨擦容器内壁溶液边缘处,以诱导结晶的形成。如仍无结晶析出,可打开瓶塞任溶液逐步挥散,慢慢析晶。或另选适当溶剂处理,或再精制一次,尽可能除尽杂质后进行结晶操作。6.在制备结晶时,最好在形成一批结晶后,立即倾出上层溶液,然后再放置以得到第二批结晶。晶态物质可以用溶剂溶解再次结晶精制。这种方法称为重结晶法。结晶经重结晶后所得各部分母液,再经处理又可分别得到第二批、第三批结晶。这种方法则称为分步结晶法或分级结晶法。晶态物质在一再结晶过程中,结晶的析出总是越来越快,纯度也越来越高。分步结晶法各部分所得结晶,其纯度往往有较大的差异,但常可获得一种以上的结晶成分,在未加检查前不要贸然混在一起。7.化合物的结晶都有一定的结晶形状、色泽、熔点和熔距,一可以作为鉴定的初步依据。这是非结晶物质所没有的物理性质。化合物结晶的形状和熔点往往因所用溶剂不同而有差异。原托品碱在氯仿中形成棱往状结晶,熔点207℃;在丙酮中则形成半球状结晶,熔点203℃;在氯仿和丙酮混合溶剂中则形成以上两种晶形的结晶。所以文献中常在化合物的晶形、熔点之后注明所用溶剂。一般单体纯化合物结晶的熔距较窄,有时要求在0.5℃左右,如果熔距较长则表示化合物不纯。不知这些可否对各位朋友有些许帮助?单晶培养的具体操作方法:四条注意事项:1、结晶容器的选择(敞口烧杯,既不能用从未使用过的新烧杯,也不能用很旧的烧杯。可能原因为,烧杯太新,不利于晶核的形成,而太旧则形成晶核的部位太多,不利于单晶的生长。) 2、溶剂的选择(合适的溶剂将物质溶解,溶解性不能太好也不能太差且具有一定的挥发性,不能挥发太快也不能太慢)3、结晶速度(尽量慢的让溶剂挥发,一旦析出结晶,过滤,可能得到单晶也可能是混晶,千万别用母液洗晶体)4、环境的选择(放在一个平稳的地方,千万不能有一丝一毫的震动,否则即使得到单晶也全完了)。
二价钴离子溶于乙醇溶液的配合物是什么
[color=#444444]我要对所做的配合物进行表征做质谱,(貌似只能做电喷雾质谱)。一般都是水,甲醇,乙腈作为溶剂,但是我做的物质不溶于水,甲醇,乙腈。[/color][color=#444444]想问下,这种情况,如果要做质谱该怎么办?[/color][color=#444444]做质谱是不是非得完全溶解才行?[/color]
[font=宋体]对农作物来讲,叶片是植物光合作用的器官。当太阳光照射到叶子表面时,就会被植物体内的色素所吸收,而能将吸收的光能用于光合作用的叶绿素体中的色素有叶绿素α和叶绿素β,α-胡萝卜素、叶黄素等。植物进行光合作用主要靠叶绿素来完成。从叶绿素α,β的吸收光谱来看,有两个峰区:(1)蓝光区(400-480nm),其中425nm为叶绿素α吸收峰,440-460nm为叶绿素β,叶黄素和α-胡萝卜素吸收峰;(2)红橙区(600-680nm),其中643nm为叶绿素β的吸收峰,660nm为叶绿素α的吸收峰。光生态学表明,400-480nm的蓝光区和600-680的红橙区对植物的光合作用有利。但太阳光经大气层到达地面的光线中,波长为290-400nm的紫外光部分对植物成长不利,而且对高聚物有较强的光氧化破坏作用。若能将其调节为对植物成长有利的蓝光和红光,不仅可以提高光能利用率,而且有助于延长高聚物(如塑料)的使用寿命。目前,正在研制的稀土光转换剂可以说已经起到了这样的作用。稀土无机发光材料和稀土有机配合物之所以能作转换剂,主要是由于稀土离子(尤以Eu[sup]3+[/sup],Tb[sup]3+ [/sup],Sm[sup]3+[/sup]和Dy[sup]3+[/sup])的最低激发态和基态间的f-f跃迁能量频率落在可见区,呈现尖锐的线状谱带,且激发态具有相对长的寿命。如镨,铽和铕三种稀土化合物在紫外光照射下,分别发射出435-480nm的蓝光,波长为500-560nm的绿光和波长为600-680nm的红光。各色荧光对农作物的成长影响不同,有选择地利用,可以实现充分利用光能的目的。[/font][font=宋体]早在20世纪80年代中期,前苏联地Golodkova LN等人已经研制出了保温大棚膜的稀土光转换剂。它能吸收97% 的200-450nm的紫外光,并能将其转换为500-750nm的红橙光。近年来,稀土有机配合物由于具有发光强度高和稳定性较好的优点,越来越引起人们的广泛关注,其应用研究非常活跃。稀土配合物发光机理在于有机配位体将所吸收的能量传递给稀土离子,使其4f电子被激发产生f-f电子跃迁并发光,例如铕β-二酮配合物是发红光的荧光材料,主要产生[sup]5[/sup]D[sub]0[/sub]-[sup]7[/sup]F[sub]2[/sub]的跃迁。这种发光材料能吸收太阳光中的紫外光并转换为可见光,将其添加到塑料膜中能改善光质,更好地利用太阳能。这种铕的配合物在365nm高压汞灯下观察有明亮的红色发光。从荧光的激发与发射光谱结果来看,配合物激发态处于长波紫外范围,这是配体的吸收,由于配合物是个大的共轭体系,所以π-π[b][sup]*[/sup][/b]吸收强度特别高,吸收的能量通过分子内能量传递,使中心离子Eu[sup]3+[/sup]发出强的红光。我国专利CN1122814A选用Eu, Tb制成稀土螯合物型光转换剂,其发光原理仍为吸收紫外光发出红橙光。但目前所研制的稀土光转换剂仍存在一些问题,如光稳定性差、转光衰减快、随时间的延长透光率降低等问题。而且,还存在可转紫外光源少和转成的红光锐峰对光合作用的延长透光率降低等问题。另外,还存在可转紫外光源少和转成的红光锐峰对光合作用所需的光谱成分不太吻合的问题。最突出的问题就是成本较高,这给稀土光转换剂和光转换膜在农业上的广泛推广带来不利。如何解决上述问题,已成为产品应用的关键。此外,荧光稀土配合物还能用于防伪制品如防伪油墨、防伪涂料等。为此我们选用在研究实验中常用的体系和常见的方法作为实验内容,为进一步开发应用提供思路和实验依据。[/font]
我前一段时间做了一些含二茂铁化合物及含铬的配合物的核磁实验,图谱很清晰,只是二茂铁化学位移值及含铬的配合物的苯环化学位移值往低场移动。请问各位,是否可以作这样的实验?做这些实验对机器有何不利影响?
近日遇到几个样品,都是含金属的配合物,有Zn,Cu,Ag等,请问这些都可以测吗?有什么特殊的地方?测出来会和配体的不一样吗?我用的是bruker AV-400
[em0804]文献铱配合物(铱有一价和三价)在铂盘电极上电位差是80MV,而我合成的类似的铱配合物,工作电极用的玻碳电极,而电位差却是160多MV,重复了七八遍,数据一直是这样。问题1、为什么会差这么多?同一物质会由于基体电极不同电位差也会跟着发生变化吗?2、是不是两电子转移过程啊,是的话,理论值应该在29mv啊,怎么文献是在80mv? 有做过配合物电化学的朋友吗,急盼高手指教!
请问稀土离子配合物能做核磁吗?3价的Eu能做吗?其他离子配合物呢?另外,这个怎么判断啊?
配合物的制备及其组成分析目的原理 实验目的 1. 制备铜氨、钴氨配合物。2. 掌握电导法测定配离子电荷的原理和方法。3. 测定钴氨配合的组成。实验原理 配合物中的配合盐是含有配离子的盐,而配离子是中心离子和若干配体(阴离子或中性分子)以配位键相结合形成的复杂离子。本实验中合成二个配合物:1.[Cu(NH3)4]SO4H2O2.[Co(NH3)6]Cl3方括号内表示配离子,它是中心离子和配位体组成的整体,即配位体直接与中心离子键合,称为配合物的内界,而方括号以外的部分称为配合物外界。本实验通过配体取代反应即一个配体取代中心离子上的另一个配体制备配合物,反应通常在水溶液中进行,金属离子的任何反应都是从水合离子出发,任何配件与金属形成配合物都是该配体取代金属离子上的水分子。如Cu(H2O) 42+ (aq) + 4 NH3(aq) = Cu(NH3) 42+ (aq) + 4 H2O 在许多配离子形成的反应中,反应速度是很快的,这些反应服从化学平衡规律。因此通过改变反应条件,可以控制反应方向,上述反应在氨存在下可以向右移动,而降低氨浓度如加入酸,将重新生成铜的水合阳离子,取代反应进行得很快的配合物称为活性配合物。但并不是所有配合物都是活性的,某些配合物包括本试验合成的配合物,以比较慢的速度交换配体,称为惰性或非活性配合物,取代反应中产生的配离子可能动力学上是稳定的,而不是热力学上有利。不同的反应条件,加入催化剂等可能改变形成配离子的相对速度,从而改变反应中产生的配离子。许多配合物无论是在溶液中,还是固体都有颜色,测定配合物是否活性的一个简单方法是,当加入一个强的配位体,观察该溶液的颜色改变,从而确定取代反应的相对速度。应用红外交谱可以鉴定化合物或测定化合物的结构。电磁辐射作用于物质的分子,如果其能量hv与电子振动或转动能量差相当时,将引起能级跃迁,此能量的辐射即被吸收,记录强度对波关系,即得吸收光谱。分子的能量可以近似地分为三部分,分子中的电子运动、组成分子的原子振动和转动。振动和转动能级跃迁出现在红外区,纯转动能级跃迁出现在远红外及微波区。红外区可分三个亚区,近红外区(波长0.78~2.5μm);加红外区(波区2.5~25μm);远红外区(25~1000μm)。近红外区波长较短,能量较大,绝大多数有机化合物和许多无机化合物化学键振动的基频都在中红外区,在此区内,几乎所有化合物都有自己特征的红外光谱,因此正像利用熔点、沸点或其它物理性质那样,可以用红外光谱来鉴定化合物。仪器药品 托盘天平、分析天平、锥形瓶、吸滤瓶、布氏漏斗、量筒、滴定管、普通漏斗、烧杯、玻璃管、pH计、DDS-11A型电导仪。HCl 6moldm-3、标准HCl溶液 0.5moldm-3、NaOH(10%)、标准NaOH溶液0.5moldm-3 、NH3H2O(浓)、H2O2 10% 、Na2S2O3 0.1moldm-3标准溶液、HgNO3 0.1moldm-3-3标准溶液、K2Cr2O7 5%、NH4Cl(s)、KI(s)、CuSO45H2O(s)、CoCl26H2O(s)、活性炭、甲基红(0.1%)、淀粉溶液(0.2%)、C2H5OH(无水)。过程步骤 一、配合物的制备(1)[Cu(NH3)4]SO42H2O的制备Cu(H2O) 42+ (aq) + SO42-(aq) + 4 NH3(aq) = [Cu(NH3)4]SO4H2O(s) + 3 H2O称取7.0gCuSO45H2O,放入100cm3烧杯中,加入15cm3H2O,加热溶液,冷却至室温,分次加入浓NH3H2O,每次数立方厘米,摇动锥形瓶,使溶液混合均匀,直至产生的沉淀完全溶解为止。加入10cm3 C2H5OH,产生深蓝色沉淀Cu(NH3)4SO4H2O,不溶于C2H5OH溶液,减压过滤,用少量C2H5OH洗涤数次,用滤纸吸干晶体,然后在空气中干燥,称量。(2)[Co(NH3)6]Cl3的制备2Co (H2O)2+(aq)+6Cl-(aq)+12NH3(aq) + H2O2(aq) = 2[Co(NH3)6]Cl3(s)+12H2O+2OH-(aq)在100cm3锥形瓶内加入3g研细的CoCl26H2O、2gNH4Cl和50cm3H2O。加热,溶解后,加入0.2g活性炭。冷却,加7cm3浓NH3H2O,进一步冷至10℃以下,缓慢加入4.5cm310%的H2O2。在水浴上加热到60℃左右,并维持此温度约20min(适当摇动锥形瓶),冷却,减压过滤。将沉淀溶于含有1cm3浓HCl的25cm3沸水中,趁热过滤,慢慢加入3.5cm3浓HCl于滤液中,以冰水冷却,即有晶体析出,过滤,用少量C2H5OH洗涤抽干。将固体置于真空干燥器中干燥或在105℃以下烘干,称量。(3)配离子的相对活性将少量配合物[Co(NH3)6]Cl和[Cu(NH3)4]SO4H2O溶于数立方厘米水中,注意溶液颜色以及加入几滴浓盐酸后的影响。二、配离子配位数的测定在100cm3烧杯中,加入约0.6g铜氨配合物,用少量水溶解,倒入250cm3容量瓶中,加入25cm30.5moldm-3HCl,再加入水稀释到刻度。取试样溶液10cm3放入烧杯中,再加入约50cm3 0.5moldm-3NaOH标准溶液进行滴定,每次滴定都要充分地搅拌,然后用pH计测定溶液的pH值。三、配合物组成的测定化学分析测定各种组分的百分含量,从而确定分子式。(1)氨的测定[Co(NH3)6]Cl3在煮沸时可被强碱所分解放出氨来,逸出的氨用过量的标准HCl溶液吸收,剩余的酸用标准NaOH溶液回滴,便可测出氨的含量,为此,准确称取0.2g左右的[Co(NH3)6]Cl3晶体,放入250cm3锥形瓶中,加80cm3水溶解,然后再加入10cm310%NaOH。在另一锥形瓶中准确加入30~35cm30.5moldm-3标准HCl溶液,锥形瓶浸在冰水中。将安全漏斗下端固定于一小试管中,试管内注入3-5cm3 10%NaOH溶液。使漏斗柄插入小试管内液面下约2~3cm,整个操作过程中漏斗下端的出口不能露在液面上,小试管口的胶塞要切去一个缺口,使试管内与锥形瓶相通。加热样品溶液,开始时大火加热,溶液开始沸腾时改用小火始终保持微沸状态。蒸出的氨通过导管为标准HCl所吸收,约60min左右可将氨全部蒸出。取出并拔掉插入HCl溶液中的导管,用少量蒸馏水将导管内外可能沾附的溶液洗入锥形瓶内,以酚酞为指示剂,用0.5moldm-3标准NaOH溶液滴定剩余的盐酸,计算被蒸出的氨量,从而计算出样品的百分含量。(2)钴的测定待蒸出氨后的样品溶液冷却后,取下漏斗(连胶塞)及小试管,用少量蒸馏水将试管沾附的溶液冲洗回锥形瓶内,加入1g Kl固体,振荡使其溶解,再加入12cm3左右的6moldm-3HCl酸化,于暗处放置约10min,此时发生如下反应2Co3++2I- = 2Co2+ + I2用0.1moldm-3的标准硫代酸钠溶液滴定至浅黄,加入2cm3新配的0.2%淀粉溶液后,再滴到蓝色消失,计算钴的百分含量。(3)氯的测定准确称取样品0.2g于锥形瓶中,用少量水溶解,加入1cm35%K2CrO4溶液,然后以0.1moldm-3AgNO3标准溶液滴定至溶液呈现砖红色即为终点,计算氯的百分含量。四、配离子电荷的测定配制100dcm31.0×10-3moldm-3[Co(NH3)6]Cl3,用DDS-11A型电导率仪测定溶液的电导率κ。五、红外光谱测定用研钵将少许样品研细,滴两滴石腊油,再继续研磨,用不锈钢刮刀刮到NaCl盐片上,压上另一块盐片,放在可拆液体池的池架上,然后在光谱仪上进行测定(或KBr压片测定红外光谱)。
Pt的L-proline配合物反应两天后在135Pt谱中出现了六个峰,请问是参数设置的问题还是因为生成了六种配合物?
请教各位 怎样用等摩尔连续变化法和摩尔比法求三元配合物配比 希望有详细方案 谢谢啦!!
对于有机金属配合物的核磁表征比较感兴趣,但是在实际过程中常遇到问题如:金属配合物较难溶解,有时只有用DMSO,DMF等强极性溶剂才能溶解,想问问在这类物质的核磁测量时需注意哪些问题呢?浓度有要求吗?
我在做一金属配合物1H-nmr的时候,TMS和溶剂峰都很好,但样品峰分辨率非常的槽糕,没有遇到锁场、匀场方面的问题,化学位移变化也不大。请教各位在做金属配合物H谱的时候需要注意些什么,尤其是有什么办法可以提高分辨,谢谢!
请问有谁知道一个铅的配合物的拉曼光谱中,Pb-S键和Pb-N键的峰出现在什么位置啊? 有谱图库可以查吗? 谢谢~
http://ng1.17img.cn/bbsfiles/images/2012/03/201203010012_351698_2440466_3.gif这个药物和铜、锌等金属离子怎样才能形成配合物,其稳定常数如何求
样品是一个Ir配合物,结构还不知道,但是可以肯定的是里面有含氢的配体。用CDCl3作溶剂,呈均一的黄色透明溶液,浓度肯定是够的,但是氢谱就是没有峰,麻烦大家指点一下,究竟是什么问题
科研需要金属配合物的红外光谱一书,请大家帮忙了!谢谢!
XRD可定性胶体物质么?金属配合物呢?