在做实验的时候,用40%的以乙醇提取的中药,把浓缩液挥干得到浸膏。现在用水溶解后,准备用乙酸乙酯、正丁醇萃取。但是总有一部分不溶解,怎么办呢?是不是还要加一点醇才好使啊?
各位高手: 我最近做了一批五味子的浸膏,是用80%的酒精加热回流提取的,提取后加了微粉硅胶等辅料,然后放入烤箱进行烘干,可是都已经烤了好几天了,浸膏还是粘粘的,根本不能打粉,如果我再继续加入辅料的话,会对它的含量有影响吧,请各位高手指教,有什么方法可以使浸膏干燥?
[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=103247]不同提取工艺下黄芩浸膏粉中黄芩苷含量测定研究[/url]
今天做乌药干浸膏中乌药醚内酯含量测定时没有出现目标峰,对照品峰良好;先前已经对乌药中乌药醚内酯的含量进行了测定(第一种,按药典方法,加适量乙醚用索氏提取器提取了4小时,再用甲醇洗涤定容过滤就行了;第二种,直接精密加甲醇50毫升超声提取30分钟,再补重就行了;两种方法得出的含量相差无几,且高出标准3倍),今天测乌药干浸膏含量测定时也都用了上述药材提取这两种方法,但基本都没有什么响应,取样量也比较大,跟药材差不多(药材是1克),按道理峰响应应该比药材更高!!!但怎么会没峰呢?是提取方法有问题吗?还是其他方面的原因?请做过这方面工作的大侠帮忙分析分析乌药干浸膏提取工艺( 1 .提取 取净乌药片,置提取罐内加水煎煮二次,第一次加水量为药材重量的3倍,密闭煎煮2小时,第二次加水量为药材重量的2倍,密闭煎煮2小时,气压均恒定在0.2—0.5kg/平方厘米,温度恒定在100℃—110℃。合并煎煮液滤过,静置24小时。 2 .浓缩 取静置滤液,用新型三效浓缩器浓缩。浓缩温度控制在75℃左右,真空度/蒸汽压力为0.06/0.09Mpa,浓缩至流体相对密度为1.10-1.20左右(60℃)3.干燥 流体用不锈钢盘盛好放入真空干燥炬内进行减压干燥,水分控制在3—3.5%之间。)
牛肉浸膏,这玩意怎么闻起来这么香
烟用香精含有酊剂、浸膏能不能乙醇溶解后进样,对于酊剂和浸膏里面的高沸点物质对机器影响大吗?用的是有玻璃棉的衬管,不挥发物质是不是都留在衬管了呢?书读的少了,有介绍的吗
本标准代替GB 3263-1982本标准规定了食品添加剂茉莉浸膏的要求、试验方法、检验规则、标志、包装、运输、贮存及保质期。本标准适用于对以香花规格石油醚为溶剂,经浸提茉莉鲜花制得的食品添加剂茉莉浸膏的质量进行分析评价。
用乙醇回流提取天南星,浓缩的浸膏,但是发现不管怎样都很难干,总是黏糊糊的,曾经放在80度的烘箱中,也没有干。请各位恩前辈,赐教 谢谢喽。

[size=3][font=Times New Roman]1[/font][font=宋体]、质量标准中浸膏相对密度存在的问题[/font][font=Times New Roman] [/font][font=宋体]个别品种提取药液浓缩时的相对密度与温度的描述实际操作时有困难,有以下几种情况:[/font][/size][size=3][font=Times New Roman]1.1[/font][font=宋体]浸膏测量相对密度的温度要求过高[/font][font=Times New Roman] [/font][font=宋体]如“十全大补颗粒制法规定浓缩至相对密度为[/font][font=Times New Roman]1.30~1.32(90~95[/font][font=宋体]度[/font][font=Times New Roman])[/font][font=宋体]的清膏”等,如药液浓缩设备多为真空浓缩,浓缩过程中浸膏温度基本在[/font][font=Times New Roman]80[/font][font=宋体]度左右。使浸膏达到[/font][font=Times New Roman]90~95[/font][font=宋体]度就需要降低设备真空度,这样既浪费能源又降低效率。另处在[/font][font=Times New Roman]90~95[/font][font=宋体]度相对密度为[/font][font=Times New Roman]1.30~1.32[/font][font=宋体]的浸膏在室温进基本状态为半固体,制剂生产时浸膏不易混合均匀。[/font][/size][size=3][font=Times New Roman]1.2[/font][font=宋体]没有规定测量温度,操作无法可依[/font][font=Times New Roman] [/font][font=宋体]如“参苓健脾胃颗粒制法规定滤液浓缩至相对密度为[/font][font=Times New Roman]1.30~1.34[/font][font=宋体]的稠膏”。[/font][/size][size=3][font=Times New Roman]1.3[/font][font=宋体]浸膏要求相对密度为一定固定值[/font][font=Times New Roman] [/font][font=宋体]如“益肾灵颗粒”制法规定滤液浓缩至相对密度为[/font][font=Times New Roman]1.35[/font][font=宋体]的清膏”。该类品种很多、在实际操作中控制困难。[/font][/size][size=3][font=Times New Roman]1.4[/font][font=宋体]醇沉前规定清膏相对密度过大[/font][font=Times New Roman] [/font][font=宋体]如“感冒舒颗粒制法规定滤液浓缩至相对密度为[/font][font=Times New Roman]1.20~1.25(90[/font][font=宋体]度[/font][font=Times New Roman])[/font][font=宋体],加乙醇使含醇量达到[/font][font=Times New Roman]60%[/font][font=宋体]等”,在[/font][font=Times New Roman]90[/font][font=宋体]度时相对密度[/font][font=Times New Roman]1.20~1.25[/font][font=宋体]的浸膏是很稠的,醇沉时会对有效万分产生包裹,影响产品质量。[/font][/size][size=3][font=宋体]本人建议在质量标准中浓缩操作改为“浓缩至适量或浓缩至[/font][font=Times New Roman]***[/font][font=宋体](热测)”,([/font][font=Times New Roman]***[/font][font=宋体]应为一个范围值)各企业根据自己的设备、工艺规程中明确规定相对密度及检测温度。[/font][/size]
安息香浸膏的状态应该是淡褐色粘稠液体还是乳白色带小碎片的膏状?这两种状态哪种才是正确的?是时间问题?还是因为加工工艺不一样导致的?麻烦有知道详情的老师帮忙解下疑惑。
有文献报道利用固相微萃取头顶空萃取浸膏中挥发性成分再与GC-MS联用,分析其中的挥发性化学成分。在这里有几点问题想请教大家:1、药材若使用水提取的,那浸膏需要浓缩到什么程度才行呢?浓缩稀了怕水分太多萃取头吸附打入气质中影响仪器,浓缩稠了怕浸膏里面的挥发性成分都挥发了,请问有经验的老师们,一般浓缩到什么程度就认为可以了?2、记得有说如果物质挥发性成分萃取不明显,可以加入少量食盐水,这里的食盐水浓度有没有受限制呢?一般加多少呢?3、水分过多对萃取头吸附性能有什么影响嘛?如果有,那在第二点中,食盐水中的水分会不会进入色谱中损坏仪器呢?如果影响了主要是针对仪器的哪个部分呢?还希望各位老师多多指点!
刚到药厂上班时配培养基经常用的牛肉浸膏还都是八几年的产品,一打开确实能闻到很香的肉汤味,当时同事都说它真是用牛肉做的,后来新买的牛肉浸膏味道就不那么香了,不知道牛肉浸膏真是用牛肉做出来的?后来的产品偷工减料了?
[size=5]GB 6780-86 食品添加剂 桂花浸膏[/size]
[size=5]GB 6779-86 食品添加剂 茉莉浸膏[/size]
[size=5]GB 15559-1995 食品添加剂 杭白菊浸膏[/size]
QB/T 2798-2006 食品添加剂 杭白菊浸膏 原标准号GB 15559-1995
请问大家谁有甘草颗粒甘草浸膏 检验记录的模板 借鉴一下
求2010版《药典》甘草浸膏含甘草酸、甘草苷两个成分的图谱http://simg.instrument.com.cn/bbs/images/brow/em09512.gif做了一下,没做出来。感觉不太对。有做过的给点经验。谢谢
黄连【英文名】Coptis Root, Golden Thread【别名】王连、支连【来源】药材基源:为毛茛科植物黄连、三角叶黄连或云南黄连的根茎。拉丁植物动物矿物名:1.Coptis chinensis Franch.2.Coptis deltoidea C.Y.Cheng et Hsiao3.Coptis teetoides C.Y.Cheng采收和储藏:黄连栽后5-6年的10-11月间收获。用黄连抓子连根抓起,抖掉泥土,剪去须根和叶,取根茎在黄连炕上供炕干燥,烘时用操板翻动,并打掉已干燥的泥土。五六成平时出炕,根据根茎大小,分为3-4等,再分别细炕,勤翻动,待根茎断面呈干草色时即可出炕,装入槽笼,撞掉泥土和须根即成。每1hm2可产干黄连1500-2250kg。【原形态】1.黄连,多年生草本。根茎黄色,常分枝,密生多数须根。叶全部基生;叶柄长5-12(-16)cm;叶片坚纸质,卵状三角形,宽达10cm,3全裂;中央裂片有细柄,卵状菱形,长3-8cm,宽2-4cm,顶端急尖,羽状深裂,边缘有锐锯齿,侧生裂片不等2深裂,表面沿脉被短柔毛。花葶l-2,高12-25cm,二歧或多歧聚伞花序,有花3-朵;总苞片通常3,披针形,羽状深裂,小苞片圆形,稍小;萼片5,黄绿色,窄卵形,长9-12.5mm;花瓣线形或线状披针形,长5-7mm,中央有蜜槽;雄蕊多数,外轮雄蕊比花瓣略短或近等长;心皮8-12,离生,有短柄。蓇葖果6-12,长6-8mm,具细柄。种子7-8粒,长椭圆形,长约2mm,宽约0.8mm,褐色。花期2-4月,果期3-6月。2.三角叶黄连,根茎黄色,不分枝或少分枝,节间明显,密生多数细根,匍匐茎横走。叶片卵形,宽达15cm,3全裂;中央裂片三角状卵形,长3-12cm,宽3-10cm,羽状深裂,深裂片多少彼此密接。花瓣近披针形,雄蕊短,仅为花瓣的1/2左右。3.云南黄连,根茎黄色,节间密,较少分枝,生多数须根。叶片卵状三角形,长6-12cm,宽5-9cm,三全裂,中央裂片卵状菱形,先端长渐尖至渐尖,羽状深裂,深裂片彼此流离,相距最宽处可达1.5cm。花瓣匙形至卵状匙形,先端钝。【生境分布】生态环境:1.生于海拔1000-2000m山地密林中或山谷阴凉处。野生或栽培。2.栽培于四川峨眉及洪雅-带海拔1600-2200m之间的山地林下。3.生于海拔1500-2300m之间的高山寒湿的林荫下,野生或栽培。资源分布:1.分布于陕西、湖北、湖南、四川、贵州等地;在四川东部。湖北西部和陕西南部有较大量栽培。2.分布于云南西北部及西藏东南部。【栽培】1.生物学特性 黄连性喜冷凉阴湿,在川东、鄂西海拔1200-1800m的高山地区有大量栽培,产区多雨多雾,年平均温度在10℃左右,7月份平均21℃,1月份平均-3--4℃,冬季在冰雪覆盖下越冬,叶可保持常绿不枯。年平均降雨量1300-1700mm,大气相对湿度90%左右。耐肥力很强;土壤以上泡下实,土壤上层以富含腐殖质肥沃疏松的沙壤土,下层以保水保肥力较强的粘壤上最适宜;酸性至微酸性土,pH5.5左右。黄连为阴地植物,有强大的叶面积群,可利用林间间隙照射的阳光,忌直射强光。2.栽培技术 用种子繁殖。种子底胚后熟类型。5月上旬种子成熟采收后,选择阴凉较平坦的山坡用树枝搭荫棚,雨水能自然淋入棚内,挖20cm深地作窖,将种子与湿沙在窖内层积贮藏。经早晚及秋季低温,胚逐渐发育形成。10- 11月间种子裂口后撒播于高畦,每1hm2播种子22.5-37.5kg,用牛马粪覆盖。次年2月下旬在畦面搭矮棚遮荫,3月初出苗,拣去畦面落叶,并除净杂草。苗期5-6月间应追施速效性氮肥催苗,10-11月间撒细碎牛马粪及火灰腐殖土以利越冬。传统的栽连技术都采用搭棚遮荫,于冬季砍树搭1.2m高荫棚,荫蔽度70%左右,棚内作1.6m宽高畦(厢)。播种后第3年3月间苗圃幼苗已长出4-6片真叶时移栽,行株距10cm×10cm,栽深3-5cm,每1hm2栽苗75-90万株。近年有用玉米间作与林间栽连技术,冬季在畦面以行株距1.6m见方,间隔栽植麻、桑等灌木及松、杉等乔木。早春2月末在塑料矮棚中作营养钵培育玉米苗。苗高30cm左右时,在高畦沟两边以株距30cm,叶对叶定向移栽玉米苗,6、7月份玉米叶封垄后即在行间栽黄连。冬季玉米收获后,用玉米秆编织矮棚,为黄连遮荫。次年复栽玉米,约4-5年后灌木已成林,可为黄连遮荫,不再栽种玉米。黄连收获后在林间整地,施足底肥,还可再栽连;灌木林栽黄连2-3季后,乔木已成林,便可砍伐灌木,在乔木林下栽连。采用玉米和造林遮荫技术栽连,不但不影响黄连产量,同时省工、省料、节约投资,活立木积蓄量比不栽黄连的树林快1倍。3.田间管理 栽植后,立即撒施少量牛马粪及熏土称刀口肥。每年早春、夏季种子收获后及冬季10-11月间各追肥1次,春夏以氮磷等速效性肥料为主,冬肥以牛马粪及熏土为主,施各肥后应培土。第1、第2年培土约1cm,第3、第4年2-3cm。追肥前应除草,移栽后一二年苗小露地孔隙大,易生杂草,每年应拔草4-5次,四五年生黄连已封垄,结合追肥每年拔草3次。搭棚栽连,当年5月种子采收后应揭去盖棚敞阳,抑制叶的生长,促使根茎充实;林间栽连,栽后第3年开始冬季应修枝亮棚,使荫蔽度由栽连时的70%左右降低到20%-30 %。4.病虫害防治 主要病害有白粉病,应降低荫蔽度增加光照并可用石硫合剂防治。虫害有蛴螬、蝼蛄等,可用毒饵诱杀。早春有麂子、锦鸡为害花苔和种子,应围以篱笆,加强人工捕杀,减较为害。

刺五加浸膏仪器:伍丰LC-100高压恒流泵、紫外检测器;色 谱 柱:上海月旭Ultimate® XB-C18 4.6×250mm 5μm ; 检测波长:220nm; 流 动 相:梯度方法;A:乙腈 B:0.1%的磷酸水溶液 流 速:1.0ml/min; 进 样 量:20μl; 对 照 品:紫丁香苷 对照品色谱图:http://ng1.17img.cn/bbsfiles/images/2011/11/201111291420_333910_1615307_3.jpg供试品色谱图:http://ng1.17img.cn/bbsfiles/images/2011/11/201111291420_333911_1615307_3.jpg供试品放大:http://ng1.17img.cn/bbsfiles/images/2011/11/201111291420_333912_1615307_3.jpg
黄连味苦性寒,具有清热燥湿、泻火解毒的功效。《中国药典》2020年版规定黄连为毛茛科黄连属植物黄连Coptis chinensis Franch.、三角叶黄连C. deltoidea C. Y. Cheng et Hsiao或云连C. teeta Wall.的干燥根茎。以上3种分别习称“味连”“雅连”“云连”,经课题组前期调研以味连产量最多,主产于我国重庆、湖北、四川等地[1]。现代研究表明,黄连含有多种活性成分,可发挥多种药理作用[2],包括抗炎、抗病毒、抗菌、抗癌、镇痛、抗抑郁、降血糖等作用,临床应用极广[3]。苦参性寒、味苦,为豆科苦参属植物苦参Sophora flavescens Ait.的干燥根,主产于我国内蒙古、河南、山东、安徽等地[1],具有抗菌、抗肿瘤、镇痛、抗炎、防治心力衰竭、心律失常及心肌缺血等多种功效[4-5]。 现代研究表明,生物碱类化合物是黄连及苦参的主要活性成分。苦参碱、氧化苦参碱可发挥抗炎、镇痛效果[6-7],其机制可能与降低促炎因子,升高抗炎因子有关;氧化苦参碱、苦参碱也可发挥抗肿瘤作用,其机制可能与抑制癌症基因表达,促进肿瘤细胞凋亡,抑制肿瘤细胞生长有关[8];而苦参碱、氧化苦参碱、槐定碱也可对多种菌株具有一定的抑菌作用[9]。木兰花碱可通过活性氧(reactive oxygen species,ROS)/鼠类肉瘤病毒癌基因(Kirsten rat sarcoma viral oncogene,KRAS)/单磷酸腺苷活化蛋白激酶(adenosine monophosphate activated protein kinase,AMPK)通路抑制结直肠癌SW480细胞的增殖和有氧糖酵解,从而发挥对结直肠癌的治疗效果[10];药根碱、巴马汀、表小檗碱、黄连碱、小檗碱可联合发挥降糖作用[11],其效果可能与调控丝氨酸-苏氨酸激酶1(serine/threonine kinase 1,LKB1)/ AMPK/CREB分子调节转录共激活剂2(CREB-regulated transcription coactivator 2,TORC2)信号通路抑制肝脏糖异生等有关[12];小檗碱具有抗炎作用,可保护螺旋神经节细胞免受巨细胞病毒诱导的凋亡作用,其机制与通过途径抑制线粒体活性氧的产生有关[13]。 除此之外,小檗碱、表小檗碱、巴马汀等生物碱类成分也可联合发挥抗心律失常作用[14]。基于此,选择苦参中苦参碱、槐定碱、氧化苦参碱及黄连中木兰花碱、非洲防己碱、药根碱、表小檗碱、黄连碱、巴马汀、小檗碱来作为黄连-苦参药对的代表性药效成分,用于研究该类成分溶出量与药对配比的关系。药对作为中药配伍的最小单元,是复方研究的重要组成部分之一[15]。用于不同疾病的治疗时,不同量的配比会有不同效果的相关呈现,因此,首先需要对黄连-苦参药对配比的不同物质基础,即量-质[16]相关性进行剖析比较,为进行量-效[17]相关性提供依据,为临床合理配比提供参考[18]。 1 仪器与试药 1.1 主要仪器 Waters e2695型高效[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]系统,Waters 2998型二极管阵列检测器(PDA),美国Waters公司;BBA224S-CW型电子天平,赛多利斯科学仪器(北京)有限公司;TGL-16C型离心机,上海安亭科学仪器厂;EPED-E2-20TS型超纯水一体机系统,南京易普易达科技发展有限公司;GM-0.5B型真空泵,天津市津腾实验设备有限公司;KH-500V型超声器,昆山禾创超声仪器有限公司。 1.2 药品及试剂 1.2.1 药材与饮片 本研究所选择黄连(产地重庆石柱黄水,批号20230411)及苦参(产地内蒙古赤峰市,批号2020121604)药材,均经南京中医药大学药学院刘圣金教授鉴定,分别为毛茛科黄连属植物黄连C. chinensis Franch.的干燥根茎和豆科苦参属植物苦参S. flavescens Ait.的干燥根。 1.2.2 对照品 表小檗碱(批号J24HB186173)、盐酸小檗碱(批号S01A10K94340)、盐酸黄连碱(批号T21S11C125202)、药根碱(批号D18GB171805)、盐酸巴马汀(批号Z16J10X79792)、非洲防己碱(批号W14J8Z37548)、木兰花碱(批号R21M9F61834)、苦参碱(批号M14GB141405)、氧化苦参碱(批号G14N11KL130769)、槐定碱(批号F18F7S9784),HPLC质量分数均≥98%,均购自上海源叶生物科技有限公司。 1.2.3 试剂 乙腈、甲醇,色谱纯,安徽天地高纯溶剂有限公司;磷酸、盐酸、无水乙醇,分析纯,国药集团化学试剂有限公司;纯净水,屈臣氏集团(香港)有限公司;磷酸二氢钾,分析纯,南京化学试剂股份有限公司。 2 方法与结果 2.1 不同配比黄连-苦参药对指纹图谱的建立 2.1.1 色谱条件 色谱柱为Venusil XBP C18(2)(250 mm×4.6 mm,5 μm);柱温30 ℃;体积流量0.8 mL/min;流动相为乙腈-3 g/L磷酸二氢钾溶液(加入200 μL磷酸调节pH值),梯度洗脱:0~10 min,10%乙腈;10~25 min,10%~24%乙腈;25~35 min,24%乙腈;35~60 min,24%~35%乙腈;60~62 min,35%~60%乙腈;62~65 min,60%~10%乙腈;65~70 min,10%乙腈;分析时间70 min,进样量10 μL;检测波长220 nm。 2.1.2 混合对照品溶液的制备 取非洲防己碱、药根碱、表小檗碱、盐酸小檗碱、盐酸巴马汀、盐酸黄连碱、木兰花碱、苦参碱、氧化苦参碱、槐定碱对照品各适量,分别置于10 mL量瓶中,加甲醇溶解并定容,即得各对照品储备液。分别取适量上述11种对照品储备液,置于同一10 mL量瓶中,加甲醇稀释并定容,制得上述成分质量浓度分别为0.20、0.16、0.24、0.25、0.25、0.44、0.26、0.21、0.80、0.36 mg/mL的混合对照品溶液。 2.1.3 供试品溶液的制备 制备黄连药材粉末(过二号筛)及苦参药材粉末(过三号筛),将上述黄连及苦参依照5∶1、4∶1、3∶1、2∶1、1∶1、1∶2、1∶3、1∶4、1∶5共9个质量比例,进行称取后分别充分混合,并称取单一黄连药材粉末及单一苦参药材粉末作为对照药材,各比例药对总质量及单一药材质量均为12 g。每个比例平行称取各药对3份,将药对以10倍量水浸泡0.5 h后,煎煮1.5 h,取1次滤液;将滤渣加入8倍量水煎煮1.5 h,取2次滤液。将2次滤液混合后抽滤,12 000 r/min离心(离心半径10.4 cm)10 min,取上清液,取1 mL上清液加入4 mL甲醇,以0.45 μm微孔滤膜滤过,即得供试品溶液。 2.1.4 精密度试验 依照黄连与苦参比例1∶3,精密称取黄连药材粉末3 g及苦参药材粉末9 g,按照“2.1.3”项下方法制备供试品溶液,再按“2.1.1”项下色谱条件进样测定6次,考察特征峰的保留时间和峰面积一致性。以盐酸小檗碱的保留时间和峰面积为参照分别计算相对保留时间及相对峰面积。计算得各共有峰相对保留时间的RSD<0.20%,相对峰面积的RSD<2.13%,结果表明仪器精密度良好。 2.1.5 稳定性试验 依照黄连与苦参比例1∶3,精密称取黄连药材粉末3 g及苦参药材粉末9 g,按照“2.1.3”项下方法制备供试品溶液,再按“2.1.1”项下色谱条件每隔4 h进样1次,共测定24 h,考察特征峰保留时间和峰面积的一致性。以盐酸小檗碱的保留时间和峰面积为参照分别计算相对保留时间及相对峰面积。计算得各共有峰相对保留时间的RSD<0.21%、相对峰面积的RSD<2.46%,结果表明该供试品溶液在室温放置24 h内稳定性良好。 2.1.6 重复性试验 依照黄连与苦参比例1∶3,精密称取黄连药材粉末3 g及苦参药材粉末9 g,平行制6份,按照“2.1.3”项下方法制备供试品溶液,分别按“2.1.1”项下色谱条件进样分析,考察特征峰保留时间和峰面积的一致性。以盐酸小檗碱的保留时间和峰面积为参照分别计算相对保留时间及相对峰面积。计算得各共有峰相对保留时间的RSD<0.18%、相对峰面积的RSD<1.57%,表明该方法重复性较好。 2.1.7 黄连-苦参药对指纹图谱的建立及相似度评价分析 将黄连及苦参药材依照“2.1.3”项下方法制备成供试品溶液(S1~S9依次为黄连-苦参比例为5∶1、4∶1、3∶1、2∶1、1∶1、1∶2、1∶3、1∶4、1∶5),再按“2.1.1”项下色谱条件进样分析,记录色谱图。将图谱输入《中药色谱指纹图谱相似度评价系统(2012版)》,设置编号S7的样品(黄连-苦参为1∶3)图谱为参照,采取中位数法[19],将时间窗宽度设置为0.1 s,进行多点校正,建立黄连-苦参药对的HPLC指纹图谱和对照指纹图谱(R,图1),指认9批黄连-苦参药对的16个共有峰。采用《中药色谱指纹图谱相似度评价系统(2012版)》对9批黄连-苦参药对进行相似度评价[20]。结果显示,9批黄连-苦参药对和R之间的相似度均大于0.95,这表明各批次黄连-苦参药对的相似性较好,整体质量稳定,可以用于考察黄连-苦参药对水煎液。以分离度较好、峰面积较大的小檗碱(峰16)为参照峰(S),得到9批黄连-苦参药对16个共有峰相对保留时间的RSD为0.175%~0.894%,提示各批次黄连-苦参药对共有峰的保留时间稳定 2.1.8 黄连-苦参药对指纹图谱色谱峰归属认定 通过比对单味药的色谱峰[21],不同比例配伍黄连-苦参药对HPLC指纹图谱16个共有峰中峰2~6号共5个峰均来源于单味药苦参,峰1、7~16号共11个峰来源于单味药黄连(图1)。通过对比混合对照品溶液色谱图(图2)及黄连、苦参及样品HPLC叠加图(图2)对各样品指纹图谱的各峰进行定性认证[22],得到2、3、6号峰分别为苦参碱、槐定碱、氧化苦参碱,属于单味药苦参;8、11~16号峰分别为木兰花碱、非洲防己碱、表小檗碱、药根碱、黄连碱、巴马汀、小檗碱,属于单味药黄连。 2.1.9 黄连-苦参药对各共有峰相对峰面积差异分析 将各比例药对中黄连-苦参药对生药量以黄连、苦参单煎样品的生药量为标准,换算成一致的量,并以黄连及苦参单煎样品峰面积作为参比,比较不同配比黄连-苦参药对的共有峰相对峰面积,结果见表2。可知在不同程度配比下,各共有峰相对峰面积均有不同程度的变化,绝大部分表现出显著性差异。除属黄连药材的10、13号峰各相对峰面积相比药材单提均有所下降外,其余峰均表现为升高,表明配比后成分的溶出对苦参总体表现为促进作用,而对黄连的不同成分表现为促进和抑制的不同作用。1、5、7号峰在黄连-苦参为2∶1时相对峰面积最大;2~4、8、10号峰在黄连-苦参为5∶1时相对峰面积最大;11~16号峰在黄连-苦参为4∶1时相对峰面积最大;6号峰在黄连-苦参为1∶3时相对峰面积最大;9号峰在黄连-苦参为3∶1时相对峰面积最大,提示在方剂中使用不同配比黄连-苦参药对治疗疾病,可能与不同配比下药对中成分的溶出变化有关[23]。 2.2 不同配比黄连-苦参药对中差异性成分含量测定 2.2.1 色谱条件 按照“2.1.1”项下色谱条件进行测定。设定在波长为205 nm时,对苦参碱、槐定碱、氧化苦参碱进行测定;在波长为220 nm时,对木兰花碱进行测定;345 nm时,对非洲防己碱、表小檗碱、药根碱、黄连碱、巴马汀、小檗碱进行测定。此时各指标性成分均为最大吸收波长。 2.2.2 混合对照品溶液的制备 依照“2.1.2”项下方法制备混合对照品溶液。 2.2.3 供试品溶液的制备 依照“2.1.3”项下方法制备9个比例的黄连-苦参药对供试品溶液,每个比例制备3个供试品溶液作为平行对照。 2.2.4 线性关系考察及检测限、定量限 对照品母液的配制:取苦参碱、槐定碱、氧化槐果碱、木兰花碱、非洲防己碱、表小檗碱、药根碱、黄连碱、巴马汀、小檗碱对照品各适量,分别置于10 mL量瓶中,加甲醇溶解并定容,制得上述成分质量浓度分别为0.98、0.40、0.85、0.35、0.31、0.35、0.36、0.36、0.35、0.81 mg/mL的对照品溶液。 取各对照品母液,逐级稀释0、2、4、8、16、32、64倍,按照“2.1.1”项下色谱条件进行测定。以各差异性成分的质量浓度为横坐标(X)、峰面积为纵坐标(Y)绘制标准曲线,进行线性回归,得回归方程,结果见表3,表明各成分线性关系良好。 依照信噪比,即S/N为3∶1及S/N为10∶1对各成分的检测限及定量限进行检测,结果见表3。 2.2.5 精密度试验 依照黄连与苦参比例1∶3,精密称取黄连药材粉末3 g及苦参药材粉末9 g,按照“2.1.3”项下方法制备供试品溶液,按“2.1.1”项下色谱条件连续进样6次,记录各差异性成分的峰面积。结果显示,苦参碱、槐定碱、氧化苦参碱、木兰花碱、非洲防己碱、表小檗碱、药根碱、黄连碱、巴马汀、小檗碱峰面积的RSD分别为1.40%、2.13%、1.37%、2.11%、0.91%、0.69%、1.25%、1.19%、0.17%、0.14%,结果表明仪器精密度良好。 2.2.6 稳定性试验 依照黄连与苦参比例1∶3,精密称取黄连药材粉末3 g及苦参药材粉末9 g,按照“2.1.3”项下方法制备供试品溶液,于室温放置0、4、8、12、16、20、24 h,按“2.1.1”项下色谱条件进样分析,记录各差异性成分的峰面积。结果显示,苦参碱、槐定碱、氧化苦参碱、木兰花碱、非洲防己碱、表小檗碱、药根碱、黄连碱、巴马汀、小檗碱峰面积的RSD分别为1.57%、2.24%、2.22%、2.46%、0.22%、0.16%、0.65%、0.05%、0.14%、0.20%,表明各差异性成分在室温放置24 h内稳定性较好。 2.2.7 重复性试验 依照黄连与苦参比例1∶3,精密称取黄连药材粉末3 g及苦参药材粉末9 g,按照“2.1.3”项下方法平行制备供试品溶液6份,再按“2.1.1”项下色谱条件进样分析,记录各差异性成分的峰面积,并根据标准曲线计算含量。结果显示,苦参碱、槐定碱、氧化苦参碱、木兰花碱、非洲防己碱、表小檗碱、药根碱、黄连碱、巴马汀、小檗碱质量分数的RSD分别为1.16%、1.24%、1.33%、1.57%、1.05%、1.19%、1.42%、1.30%、1.21%、1.22%,表明该方法重复性良好。 2.2.8 加样回收率试验 依照黄连与苦参比例1∶3,精密称取黄连药材粉末3 g及苦参药材粉末9 g,平行称取6份,分别加入含有苦参碱0.31 mg、槐定碱0.20 mg、氧化苦参碱1.52 mg、木兰花碱0.07 mg、非洲防己碱0.08 mg、表小檗碱0.27 mg、药根碱0.06 mg、黄连碱0.22 mg、巴马汀0.21 mg、小檗碱0.79 mg的对照品溶液5 mL,按照“2.1.3”项下方法制备供试品溶液,再按“2.1.1”项下色谱条件进样分析,记录各标志性成分的峰面积,并计算平均加样回收率。结果显示,苦参碱、槐定碱、氧化苦参碱、木兰花碱、非洲防己碱、表小檗碱、药根碱、黄连碱、巴马汀、小檗碱的平均加样回收率分别为100.2%、100.1%、100.3%、100.2%、101.2%、100.7%、99.8%、101.1%、100.60%、101.0%,RSD分别为0.67%、0.97%、0.89%、0.97%、0.56%、0.70%、0.57%、0.71%、0.99%、0.85%,表明该方法准确度良好。 2.2.9 不同配比黄连-苦参药对水煎液成分含量测定及比较 取9个不同比例的黄连-苦参药对药材粉末,精密称定,按照“2.1.3”项下方法制备供试品溶液,再按“2.1.1”项下色谱条件进样分析,记录各差异性成分的峰面积,并根据标准曲线计算苦参碱、槐定碱、氧化苦参碱、木兰花碱、非洲防己碱、表小檗碱、药根碱、黄连碱、巴马汀、小檗碱的含量。将各比例药对中黄连-苦参药对生药量以黄连、苦参单煎样品的生药量为标准,换算成一致的量,计算各特征性成分的含量。通过SPSS 27.0软件,对数据进行单因子方差分析和显著性检验[24],结果见表4。 对含量测定结果进行系统分析。黄连-苦参比例为4∶1时,所得非洲防己碱、表小檗碱、巴马汀、小檗碱含量为各比例最高,且黄连总生物碱含量最高,与单药材提取具有显著性差异(P<0.05);黄连-苦参比例为5∶1时,所得苦参碱、槐定碱、木兰花碱含量为各比例最高,与单药材提取具有显著性差异(P<0.05);黄连-苦参比例为1∶3时,氧化苦参碱含量为各比例最高,与单药材提取具有显著性差异(P<0.05);黄连-苦参比例为1∶1时,苦参总生物碱含量为各比例最高。与黄连、苦参各药材单提相比,各比例下苦参中总生物碱类成分的溶出均有不同程度的提升,黄连中总生物碱类成分在黄连-苦参5∶1及4∶1比例下溶出表现为提升,其他比例表现为降低。随着药对中黄连比例的降低,黄连中整体生物碱类成分呈现下降趋势。对苦参中差异性成分进行比较,随着药对中黄连比例的降低,苦参碱、槐定碱在药液中的溶出降低,而氧化苦参碱的溶出提升,3种成分呈现“U”型分布,提示3者之间的相互影响关系。 3 讨论 本研究考虑与临床应用一致,黄连-苦参药对选择水回流提取法,选择分离效果最佳的乙腈-磷酸二氢钾溶液体系,对黄连及黄连-苦参药对的色谱条件进行优化,并在190~440 nm进行全波长扫描,于220 nm下进行指纹图谱建立以求全面对待测样品的差异性成分进行测定。结果表明,本研究建立的黄连-苦参药对指纹图谱稳定有效,可全面的测定黄连-苦参药对中的标志性成分。 大量文献研究发现,黄连-苦参药对在方剂中多采用1∶5至5∶1区间配比,故选择典型的9个配比进行量-质传递对比性研究。生物碱类成分作为黄连-苦参药对的主要药效成分,研究生物碱类成分在传统方剂煎煮过程中的溶出差异,可以为临床用药提供参考。故采用建立指纹图谱方式进行定性验证,确定稳定可测的生物碱类成分,并根据“2.1.8”项下结果,选择苦参中苦参碱、槐定碱、氧化苦参碱及黄连中木兰花碱、非洲防己碱、表小檗碱、药根碱、黄连碱、巴马汀、小檗碱进行研究[25-26]。 本研究在最佳吸收波长下,对黄连-苦参药对不同配比中10个差异性成分进行含量测定,分析差异性成分在不同配比下的溶出变化。苦参中3种差异性成分的溶出量随黄连比例的降低呈现“U”型分布,而黄连中7种差异性成分溶出量随黄连比例的降低整体呈现降低趋势。在黄连-苦参药对中,高黄连比例更容易促进药对中差异性成分的溶出。初步分析,当黄连-苦参药对中黄连占比的降低,可能会通过改变溶液中pH值、酸碱度等性质,对二者差异性成分的溶出产生影响,也可能对其中成分的相互转化产生促进作用,其具体产生机制有待深入研究。黄连-苦参药对被应用与各类中医经典方及现代经验方剂中[27-28],但其配伍面对临床不同疾病的合理应用仍需深入研究。 本研究首次将黄连-苦参相须药对与中医传统经验方剂药效相结合,探究差异性成分药理作用与临床疾病治疗的联系。黄连-苦参比例为5∶1时,所得苦参碱、槐定碱、木兰花碱含量为各比例最高;非洲防己碱、表小檗碱、药根碱、黄连碱、巴马汀、小檗碱含量较高,相比各药材单提含量有所提升,与单药材提取均具有显著性差异(P<0.05),与《普济方》中“相须为用,其效益彰”的方解一致,发挥各成分共同药效,达到“清热燥湿”效果。氧化苦参碱具有抗肿瘤作用,当黄连-苦参比例为1∶3时,其溶出量达到最大并与单药材提取具有显著性差异(P<0.05),与临床上使用参白解毒方进行抗结直肠道腺瘤[29]的治疗方式一致。药根碱可发挥降糖作用,在黄连-苦参比例为1∶1时含量最高,与国医大师李玉奇治疗消渴症时采用方剂中黄连-苦参药对[30]的配比一致,证明了方剂中黄连-苦参使用该比例配比的合理性。 综上所述,本研究成果预期可为开展黄连-苦参药对的量-效关系研究提供数据支撑,为临床不同疾病采用药对适宜配比用量、开发黄连-苦参药对新方剂提供借鉴。
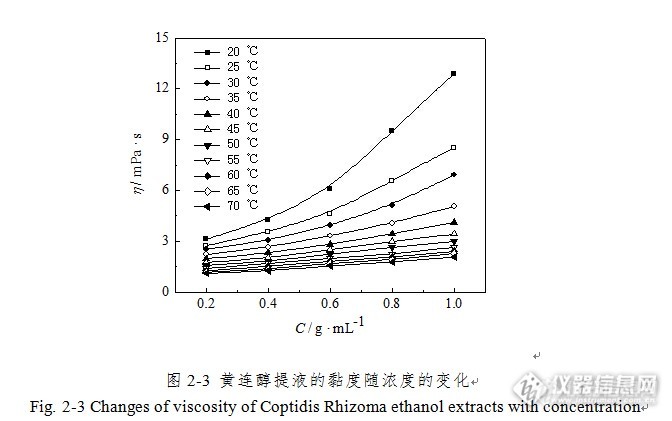
黄连提取液物性参数的测定及相关性研究摘要 黄连为毛茛科植物黄连(Coptis chinensis Franch.)、三角叶黄连(Coptis deltoidea C.Y.Cheng et Hsiao)、或云连(Coptis teeta Wall.)的干燥根茎,首载于《神农本草经》,列为上品,是临床最常用的清热类药物之一。其性味苦寒,入心、肝、胆、脾、胃、大肠诸经,具有清热燥湿、泻火解毒之功效。临床上多用于治疗湿热痞满、呕吐、泻痢、黄疸、心火亢盛、高热神昏、心烦不寐、目赤吞酸、牙痛、消渴及痈肿疔疮;外治湿疹、湿疮、耳道流脓。黄连的主要有效成份为异喹啉类生物碱,包括小檗碱(berberine)、黄连碱(coptisine)、药根碱(iatrordfizine)、巴马亭(palmatine)等。现代药理研究发现,黄连具有抗病原微生物、抗氧化、抗炎、抗血栓形成、降血糖、抗溃疡、抗癌、防治动脉硬化、保护胃黏膜、提高机体免疫功能等药理作用。 黄连的提取方法有:稀硫酸法、石灰水法、乙醇浸提法、超声波提取法、酶解法、微波-索氏工艺联合提取法、解吸-内部沸腾两步法、液膜法等。本实验采用回流提取的方法进行黄连提取液的制备,用旋转蒸发仪进行减压浓缩。1实验部分1.1仪器及试药1.1.1仪器RE-2000A旋转蒸发器(上海亚荣生化仪器厂);密度计(燕河仪器仪表有限公司);NDJ-5S旋转黏度计(上海伦捷机电仪表有限公司);DRE-2A导热系数测试仪(湘潭市仪器仪表有限公司)。1.1.2试药黄连片(北京同仁堂健康药业股份有限公司),经北京中医药大学刘春生教授鉴定符合2010版《中国药典》的要求;乙醇(95%),分析纯,北京化工厂;去离子水,自制。1.2样品的制备1.2.1不同浓度黄连水提液的制备 分别称取30、60、90、120、150 g黄连片,加入8倍量的水,加热回流提取3次,每次1 h,过滤,合并滤液。将滤液分别浓缩至150 mL,得到含生药质量浓度分别为0.2、0.4、0.6、0.8、1.0 g/mL的黄连水提液。1.2.2不同浓度黄连醇提液的制备 分别称取30、60、90、120、150 g黄连片,加入10倍量体积分数为60%的乙醇,加热回流提取3次,每次1 h,过滤,合并滤液。将滤液分别减压浓缩至稠膏状,用60%乙醇少量多次溶解洗出,再加60%乙醇至150 mL,得到含生药质量浓度分别为0.2、0.4、0.6、0.8、1.0 g/mL的黄连醇提液。1.3物性参数的测定方法 用浮子式密度计在20°C下测量各浓缩液的密度;在20~75°C下,用NDJ-5S型数显旋转黏度计分别测定不同浓度黄连水提液和醇提液的黏度;采用DRE-2A型导热系数测试仪在20~70°C下分别测定不同浓度黄连水提液和醇提液的导热系数。1.4分析方法 采用Excel对实验数据进行一元线性回归分析(ρ-C、η-C、η-T、λ-C、λ-T);采用1stOpt数据分析软件进行二元非线性拟合(η-C-T);采用SPSS数据分析软件进行二元线性回归(λ-C-T)。2结果与讨论2.1密度与浓度的关系 测定不同浓度的黄连水提液和黄连醇提液密度(表2-1),以线性回归分别考察其密度与浓度的关系(图2-1)。黄连水提液和醇提液密度与浓度关系的回归方程分别为ρ = 0.1105C+ 1.0002(r = 0.9992),ρ = 0.1157C + 0.9067(r = 0.9967)。结果表明,提取液的浓度与密度呈正相关,提取液浓度越高,提取液密度越大,二者具有良好的直线回归关系。http://ng1.17img.cn/bbsfiles/images/2015/09/201509171041_566383_3004888_3.jpg2.2黏度与浓度、温度的关系 测定不同温度不同浓度黄连水提液和黄连醇提液的黏度,结果分别见表2-2、2-3。http://ng1.17img.cn/bbsfiles/images/2015/09/201509171043_566384_3004888_3.jpghttp://ng1.17img.cn/bbsfiles/images/2015/09/201509171043_566385_3004888_3.jpg2.2.1黏度与浓度的关系 以浓度C为横坐标,黏度η为纵坐标,作出黄连水提液和黄连醇提液黏度随浓度的变化关系(图2-2、2-3)。结果显示,在同一温度水平下,提取液的黏度随浓度的增大而上升;温度越高,黏度随浓度增大而上升的幅度越小;在较高温度下,黄连醇提液浓度增大,黏度的变化不明显,曲线趋近于一条直线。http://ng1.17img.cn/bbsfiles/images/2015/09/201509171045_566386_3004888_3.jpghttp://ng1.17img.cn/bbsfiles/images/2015/09/201509171045_566387_3004888_3.jpg3结论3.1密度与浓度 黄连水提液和醇提液的密度与浓度均为直线正相关关系,即黄连提取液的密度随浓度的增大而增大,说明提取液的浓缩程度与其含固量直接相关。由于溶剂本身密度及其提取强度的影响,相同浓度的黄连水提液密度均大于醇提液密度。二者密度与浓度的回归方程分别为ρ = 0.1105C+ 1.0002 (r = 0.9992) 和ρ = 0.1157C + 0.9067(r = 0.9967)。3.2黏度与浓度、温度 比较黄连水提液和醇提液的黏度实测值发现,在相同温度下,相同浓度(0.2、0.4、0.6、0.8g/mL)的水提液黏度均小于醇提液黏度。这一点与黄芩相反,在相同温度下,相同浓度的黄芩水提液黏度均大于醇提液黏度。出现差异的原因可能是溶剂本身性质及提取液中所含成分的综合影响导致。 根据实测黏度值作出黄连提取液黏度随浓度、黏度随温度的变化关系曲线,结果显示:(1) 在同一温度水平下,提取液的黏度随浓度的增大而上升;温度越高,黏度随浓度增大而上升的幅度越小。(2) 在同一浓度水平下,提取液的黏度随温度的上升而降低;浓度越高,黏度随温度升高而下降的幅度越大。用实测值验证浓度对黏度影响的2种经典数学模型η = a1 Cb1和η = a2 exp(b2C),二者分别为幂和指数的形式,并得到各温度下η-C拟合方程。结果说明,实测值对后者的拟合度明显高于前者,即指数形式更能准确反映黄连提取液黏度与浓度的变化关系特征。

黄连上清片高温灭菌后,黄连对照药材薄层鉴别的点变红是怎么回事?[img=,690,388]https://ng1.17img.cn/bbsfiles/images/2019/07/201907101138123673_5943_1782490_3.jpg!w690x388.jpg[/img]
[b]黄连[/b]来源于毛茛科多年生草本植物黄连、三角叶黄连或云连的干燥根茎,具有显著的清热燥湿和泻火解毒作用,常用于治疗由湿热、火毒引起的多种病症。黄连,作为一味传统中药,其功效可概括为“清热燥湿,泻火解毒”,性味苦寒,归心、脾、胃、肝、胆、大肠经。在中医临床中,黄连因其独特的药性而被广泛应用,需注意其苦寒之性易伤脾胃,脾胃虚寒者慎用。[font='PingFang SC', system-ui, -apple-system, BlinkMacSystemFont, 'Helvetica Neue', 'Hiragino Sans GB', 'Microsoft YaHei UI', 'Microsoft YaHei', Arial, sans-serif][size=17px]苦口良药,清热燥湿的典范,黄连以其独特的苦味和卓越的药用价值,成为了备受推崇的中药材之一。黄连,又称味连、雅连、云连,来源于毛茛科植物黄连、三角叶黄连或云连的干燥根茎,因其味极苦而著称,素有“哑巴吃黄连,有苦说不出”的俗语流传。然而,正是这份苦涩,赋予了黄连清热燥湿、泻火解毒的神奇功效。[/size][/font]
[font=宋体]黄连味苦性寒,具有清热燥湿、泻火解毒的功效。《[color=var(--weui-LINK)]中国药典[i][/i][/color]》[/font]2020[font=宋体]年版规定黄连为毛茛科黄连属植物黄连[/font][i]Coptis chinensis[/i] Franch.[font=宋体]、三角叶黄连[/font][i]C. deltoidea [/i]C. Y. Cheng et Hsiao[font=宋体]或云连[/font][i]C. teeta[/i] Wall.[font=宋体]的干燥根茎。以上[/font]3[font=宋体]种分别习称“味连”“雅连”“云连”,经课题组前期调研以味连产量最多,主产于我国重庆、湖北、四川等地[/font][sup][1][/sup][font=宋体]。现代研究表明,黄连含有多种活性成分,可发挥多种药理作用[/font][sup][2][/sup][font=宋体],包括抗炎、抗病毒、抗菌、抗癌、镇痛、抗抑郁、降血糖等作用,临床应用极广[/font][sup][3][/sup][font=宋体]。苦参性寒、味苦,为豆科苦参属植物苦参[/font][i]Sophora flavescens [/i]Ait.[font=宋体]的干燥根,主产于我国内蒙古、河南、山东、安徽等地[/font][sup][1][/sup][font=宋体],具有抗菌、抗肿瘤、镇痛、抗炎、防治心力衰竭、心律失常及心肌缺血等多种功效[/font][sup][4-5][/sup][font=宋体]。[/font] [font=宋体]现代研究表明,生物碱类化合物是黄连及苦参的主要活性成分。苦参碱、氧化苦参碱可发挥抗炎、镇痛效果[/font][sup][6-7][/sup][font=宋体],其机制可能与降低[color=var(--weui-LINK)]促炎因子[i][/i][/color],升高抗炎因子有关;氧化苦参碱、苦参碱也可发挥抗肿瘤作用,其机制可能与抑制癌症基因表达,促进肿瘤细胞凋亡,抑制肿瘤细胞生长有关[/font][sup][8][/sup][font=宋体];而苦参碱、氧化苦参碱、槐定碱也可对多种菌株具有一定的抑菌作用[/font][sup][9][/sup][font=宋体]。木兰花碱可通过活性氧([/font]reactive oxygen species[font=宋体],[/font]ROS[font=宋体])[/font]/[font=宋体]鼠类肉瘤病毒癌基因([/font]Kirsten rat sarcoma viral oncogene[font=宋体],[/font]KRAS[font=宋体])[/font]/[font=宋体]单磷酸腺苷活化蛋白激酶([/font]adenosine monophosphate activated protein kinase[font=宋体],[/font]AMPK[font=宋体])通路抑制结直肠癌[/font]SW480[font=宋体]细胞的增殖和有氧糖酵解,从而发挥对结直肠癌的治疗效果[/font][sup][10][/sup][font=宋体];药根碱、[color=var(--weui-LINK)]巴马汀[i][/i][/color]、表小檗碱、黄连碱、小檗碱可联合发挥降糖作用[/font][sup][11][/sup][font=宋体],其效果可能与调控丝氨酸[/font]-[font=宋体]苏氨酸激酶[/font]1[font=宋体]([/font]serine/threonine kinase 1[font=宋体],[/font]LKB1[font=宋体])[/font]/ AMPK/CREB[font=宋体]分子调节转录共激活剂[/font]2[font=宋体]([/font]CREB-regulated transcription coactivator 2[font=宋体],[/font]TORC2[font=宋体])信号通路抑制肝脏糖异生等有关[/font][sup][12][/sup][font=宋体];小檗碱具有抗炎作用,可保护螺旋神经节细胞免受巨细胞病毒诱导的凋亡作用,其机制与通过途径抑制线粒体活性氧的产生有关[/font][sup][13][/sup][font=宋体]。[/font][font=宋体]除此之外,小檗碱、表小檗碱、巴马汀等生物碱类成分也可联合发挥抗心律失常作用[/font][sup][14][/sup][font=宋体]。基于此,选择苦参中苦参碱、槐定碱、氧化苦参碱及黄连中木兰花碱、非洲防己碱、药根碱、表小檗碱、黄连碱、巴马汀、小檗碱来作为黄连[/font]-[font=宋体]苦参药对的代表性药效成分,用于研究该类成分溶出量与药对配比的关系。[/font][font=宋体]药对作为中药配伍的最小单元,是复方研究的重要组成部分之一[/font][sup][15][/sup][font=宋体]。用于不同疾病的治疗时,不同量的配比会有不同效果的相关呈现,因此,首先需要对黄连[/font]-[font=宋体]苦参药对配比的不同物质基础,即量[/font]-[font=宋体]质[/font][sup][16][/sup][font=宋体]相关性进行剖析比较,为进行量[/font]-[font=宋体]效[/font][sup][17][/sup][font=宋体]相关性提供依据,为临床合理配比提供参考[/font][sup][18][/sup][font=宋体]。 [/font][b][back=#d6a841]1 [font=黑体]仪器与试药[/font][/back][/b]1.1 [font=黑体]主要仪器[/font]Waters e2695[font=宋体]型高效[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]系统,[/font]Waters 2998[font=宋体]型二极管阵列检测器([/font]PDA[font=宋体]),美国[/font]Waters[font=宋体]公司;[/font]BBA224S-CW[font=宋体]型电子天平,赛多利斯科学仪器(北京)有限公司;[/font]TGL-16C[font=宋体]型离心机,上海安亭科学仪器厂;[/font]EPED-E2-20TS[font=宋体]型超纯水一体机系统,南京易普易达科技发展有限公司;[/font]GM-0.5B[font=宋体]型真空泵,天津市津腾实验设备有限公司;[/font]KH-500V[font=宋体]型超声器,昆山禾创超声仪器有限公司。[/font]1.2 [font=黑体]药品及试剂[/font]1.2.1 [font=宋体]药材与饮片[/font] [font=宋体]本研究所选择黄连(产地重庆石柱黄水,批号[/font]20230411[font=宋体])及苦参(产地内蒙古赤峰市,批号[/font]2020121604[font=宋体])药材,均经南京中医药大学药学院刘圣金教授鉴定,分别为毛茛科黄连属植物黄连[/font][i]C. chinensis[/i] Franch.[font=宋体]的干燥根茎和豆科苦参属植物苦参[/font][i]S. flavescens[/i] Ait.[font=宋体]的干燥根。[/font]1.2.2 [font=宋体]对照品[/font] [font=宋体]表小檗碱(批号[/font]J24HB186173[font=宋体])、盐酸小檗碱(批号[/font]S01A10K94340[font=宋体])、盐酸黄连碱(批号[/font]T21S11C125202[font=宋体])、药根碱(批号[/font]D18GB171805[font=宋体])、盐酸巴马汀(批号[/font]Z16J10X79792[font=宋体])、非洲防己碱(批号[/font]W14J8Z37548[font=宋体])、木兰花碱(批号[/font]R21M9F61834[font=宋体])、苦参碱(批号[/font]M14GB141405[font=宋体])、氧化苦参碱(批号[/font]G14N11KL130769[font=宋体])、槐定碱(批号[/font]F18F7S9784[font=宋体]),[/font][color=var(--weui-LINK)]HPLC[i][/i][/color][font=宋体]质量分数均≥[/font]98%[font=宋体],均购自上海源叶生物科技有限公司。[/font][b][/b]1.2.3 [font=宋体]试剂[/font] [font=宋体]乙腈、甲醇,色谱纯,安徽天地高纯溶剂有限公司;磷酸、盐酸、无水乙醇,分析纯,国药集团化学试剂有限公司;纯净水,屈臣氏集团(香港)有限公司;磷酸二氢钾,分析纯,南京化学试剂股份有限公司。[/font][size=17px][b][back=#d6a841]2 [font=黑体]方法与结果[/font][/back][/b][/size]2.1 [font=黑体]不同配比黄连[/font][b]-[/b][font=黑体]苦参药对指纹图谱的建立[/font]2.1.1 [font=宋体]色谱条件[/font] [font=宋体]色谱柱为[/font]Venusil XBP C[sub]18[/sub][font=宋体]([/font]2[font=宋体])([/font]250 mm[font=宋体]×[/font]4.6 mm[font=宋体],[/font]5 μm[font=宋体]);柱温[/font]30 [font=宋体]℃;体积流量[/font]0.8 mL/min[font=宋体];流动相为乙腈[/font]-3 g/L[font=宋体]磷酸二氢钾溶液(加入[/font]200 μL[font=宋体]磷酸调节[/font]pH[font=宋体]值),梯度洗脱:[/font]0[font=宋体]~[/font]10 min[font=宋体],[/font]10%[font=宋体]乙腈;[/font]10[font=宋体]~[/font]25 min[font=宋体],[/font]10%[font=宋体]~[/font]24%[font=宋体]乙腈;[/font]25[font=宋体]~[/font]35 min[font=宋体],[/font]24%[font=宋体]乙腈;[/font]35[font=宋体]~[/font]60 min[font=宋体],[/font]24%[font=宋体]~[/font]35%[font=宋体]乙腈;[/font]60[font=宋体]~[/font]62 min[font=宋体],[/font]35%[font=宋体]~[/font]60%[font=宋体]乙腈;[/font]62[font=宋体]~[/font]65 min[font=宋体],[/font]60%[font=宋体]~[/font]10%[font=宋体]乙腈;[/font]65[font=宋体]~[/font]70 min[font=宋体],[/font]10%[font=宋体]乙腈;分析时间[/font]70 min[font=宋体],进样量[/font]10 μL[font=宋体];检测波长[/font]220 nm[font=宋体]。[/font]2.1.2 [font=宋体]混合对照品溶液的制备[/font] [font=宋体]取非洲防己碱、药根碱、表小檗碱、盐酸小檗碱、盐酸巴马汀、盐酸黄连碱、木兰花碱、苦参碱、氧化苦参碱、槐定碱对照品各适量,分别置于[/font]10 mL[font=宋体]量瓶中,加甲醇溶解并定容,即得各对照品储备液。分别取适量上述[/font]11[font=宋体]种对照品储备液,置于同一[/font]10 mL[font=宋体]量瓶中,加甲醇稀释并定容,制得上述成分质量浓度分别为[/font]0.20[font=宋体]、[/font]0.16[font=宋体]、[/font]0.24[font=宋体]、[/font]0.25[font=宋体]、[/font]0.25[font=宋体]、[/font]0.44[font=宋体]、[/font]0.26[font=宋体]、[/font]0.21[font=宋体]、[/font]0.80[font=宋体]、[/font]0.36 mg/mL[font=宋体]的混合对照品溶液。[/font]2.1.3 [font=宋体]供试品溶液的制备[/font] [font=宋体]制备黄连药材粉末(过二号筛)及苦参药材粉末(过三号筛),将上述黄连及苦参依照[/font]5[font=宋体]∶[/font]1[font=宋体]、[/font]4[font=宋体]∶[/font]1[font=宋体]、[/font]3[font=宋体]∶[/font]1[font=宋体]、[/font]2[font=宋体]∶[/font]1[font=宋体]、[/font]1[font=宋体]∶[/font]1[font=宋体]、[/font]1[font=宋体]∶[/font]2[font=宋体]、[/font]1[font=宋体]∶[/font]3[font=宋体]、[/font]1[font=宋体]∶[/font]4[font=宋体]、[/font]1[font=宋体]∶[/font]5[font=宋体]共[/font]9[font=宋体]个质量比例,进行称取后分别充分混合,并称取单一黄连药材粉末及单一苦参药材粉末作为对照药材,各比例药对总质量及单一药材质量均为[/font]12 g[font=宋体]。每个比例平行称取各药对[/font]3[font=宋体]份,将药对以[/font]10[font=宋体]倍量水浸泡[/font]0.5 h[font=宋体]后,煎煮[/font]1.5 h[font=宋体],取[/font]1[font=宋体]次滤液;将滤渣加入[/font]8[font=宋体]倍量水煎煮[/font]1.5 h[font=宋体],取[/font]2[font=宋体]次滤液。将[/font]2[font=宋体]次滤液混合后抽滤,[/font]12 000 r/min[font=宋体]离心(离心半径[/font]10.4 cm[font=宋体])[/font]10 min[font=宋体],取上清液,取[/font]1 mL[font=宋体]上清液加入[/font]4 mL[font=宋体]甲醇,以[/font]0.45 μm[font=宋体]微孔滤膜滤过,即得供试品溶液。[/font]2.1.4 [font=宋体]精密度试验[/font] [font=宋体]依照黄连与苦参比例[/font]1[font=宋体]∶[/font]3[font=宋体],精密称取黄连药材粉末[/font]3 g[font=宋体]及苦参药材粉末[/font]9 g[font=宋体],按照“[/font]2.1.3[font=宋体]”项下方法制备供试品溶液,再按“[/font]2.1.1[font=宋体]”项下色谱条件进样测定[/font]6[font=宋体]次,考察特征峰的保留时间和峰面积一致性。以盐酸小檗碱的保留时间和峰面积为参照分别计算相对保留时间及相对峰面积。计算得各共有峰相对保留时间的[/font]RSD[font=宋体]<[/font]0.20%[font=宋体],相对峰面积的[/font]RSD[font=宋体]<[/font]2.13%[font=宋体],结果表明仪器精密度良好。[/font]2.1.5 [font=宋体]稳定性试验[/font] [font=宋体]依照黄连与苦参比例[/font]1[font=宋体]∶[/font]3[font=宋体],精密称取黄连药材粉末[/font]3 g[font=宋体]及苦参药材粉末[/font]9 g[font=宋体],按照“[/font]2.1.3[font=宋体]”项下方法制备供试品溶液,再按“[/font]2.1.1[font=宋体]”项下色谱条件每隔[/font]4 h[font=宋体]进样[/font]1[font=宋体]次,共测定[/font]24 h[font=宋体],考察特征峰保留时间和峰面积的一致性。以盐酸小檗碱的保留时间和峰面积为参照分别计算相对保留时间及相对峰面积。计算得各共有峰相对保留时间的[/font]RSD[font=宋体]<[/font]0.21%[font=宋体]、相对峰面积的[/font]RSD[font=宋体]<[/font]2.46%[font=宋体],结果表明该供试品溶液在室温放置[/font]24 h[font=宋体]内稳定性良好。[/font]2.1.6 [font=宋体]重复性试验[/font] [font=宋体]依照黄连与苦参比例[/font]1[font=宋体]∶[/font]3[font=宋体],精密称取黄连药材粉末[/font]3 g[font=宋体]及苦参药材粉末[/font]9 g[font=宋体],平行制[/font]6[font=宋体]份,按照“[/font]2.1.3[font=宋体]”项下方法制备供试品溶液,分别按“[/font]2.1.1[font=宋体]”项下色谱条件进样分析,考察特征峰保留时间和峰面积的一致性。以盐酸小檗碱的保留时间和峰面积为参照分别计算相对保留时间及相对峰面积。计算得各共有峰相对保留时间的[/font]RSD[font=宋体]<[/font]0.18%[font=宋体]、相对峰面积的[/font]RSD[font=宋体]<[/font]1.57%[font=宋体],表明该方法重复性较好。[/font]2.1.7 [font=宋体]黄连[/font]-[font=宋体]苦参药对指纹图谱的建立及相似度评价分析[/font] [font=宋体]将黄连及苦参药材依照“[/font]2.1.3[font=宋体]”项下方法制备成供试品溶液([/font]S1[font=宋体]~[/font]S9[font=宋体]依次为黄连[/font]-[font=宋体]苦参比例为[/font]5[font=宋体]∶[/font]1[font=宋体]、[/font]4[font=宋体]∶[/font]1[font=宋体]、[/font]3[font=宋体]∶[/font]1[font=宋体]、[/font]2[font=宋体]∶[/font]1[font=宋体]、[/font]1[font=宋体]∶[/font]1[font=宋体]、[/font]1[font=宋体]∶[/font]2[font=宋体]、[/font]1[font=宋体]∶[/font]3[font=宋体]、[/font]1[font=宋体]∶[/font]4[font=宋体]、[/font]1[font=宋体]∶[/font]5[font=宋体]),再按“[/font]2.1.1[font=宋体]”项下色谱条件进样分析,记[/font][font=宋体]录色谱图。将图谱输入《中药色谱指纹图谱相似度评价系统([/font]2012[font=宋体]版)》,设置编号[/font]S7[font=宋体]的样品(黄连[/font]-[font=宋体]苦参为[/font]1[font=宋体]∶[/font]3[font=宋体])图谱为参照,采取中位数法[/font][sup][19][/sup][font=宋体],将时间窗宽度设置为[/font]0.1 s[font=宋体],进行多点校正,建立黄连[/font]-[font=宋体]苦参药对的[/font]HPLC[font=宋体]指纹图谱和对照指纹图谱([/font]R[font=宋体],图[/font]1[font=宋体]),指认[/font]9[font=宋体]批黄连[/font]-[font=宋体]苦参药对的[/font]16[font=宋体]个共有峰。[/font][font=宋体]采用《中药色谱指纹图谱相似度评价系统([/font]2012[font=宋体]版)》对[/font]9[font=宋体]批黄连[/font]-[font=宋体]苦参药对进行相似度评价[/font][sup][20][/sup][font=宋体]。结果显示,[/font]9[font=宋体]批黄连[/font]-[font=宋体]苦参药对和[/font]R[font=宋体]之间的相似度均大于[/font]0.95[font=宋体],这表明各批次黄连[/font]-[font=宋体]苦参药对的相似性较好,整体质量稳定[/font],[font=宋体]可以用于考察黄连[/font]-[font=宋体]苦参药对水煎液。以分离度较好、峰面积较大的小檗碱(峰[/font]16[font=宋体])为参照峰([/font]S[font=宋体]),得到[/font]9[font=宋体]批黄连[/font]-[font=宋体]苦参药对[/font]16[font=宋体]个共有峰相对保留时间的[/font]RSD[font=宋体]为[/font]0.175%[font=宋体]~[/font]0.894%[font=宋体],提示各批次黄连[/font]-[font=宋体]苦参药对共有峰的保留时间稳定,结果见表[/font]1[font=宋体]。[/font][font=黑体][/font][img=图片,1,]data:image/svg+xml,%3C%3Fxml version='1.0' encoding='UTF-8'%3F%3E%3Csvg width='1px' height='1px' viewBox='0 0 1 1' version='1.1' xmlns='http://www.w3.org/2000/svg' xmlns:xlink='http://www.w3.org/1999/xlink'%3E%3Ctitle%3E%3C/title%3E%3Cg stroke='none' stroke-width='1' fill='none' fill-rule='evenodd' fill-opacity='0'%3E%3Cg transform='translate(-249.000000, -126.000000)' fill='%23FFFFFF'%3E%3Crect x='249' y='126' width='1' height='1'%3E%3C/rect%3E%3C/g%3E%3C/g%3E%3C/svg%3E[/img][img=图片,1,]data:image/svg+xml,%3C%3Fxml version='1.0' encoding='UTF-8'%3F%3E%3Csvg width='1px' height='1px' viewBox='0 0 1 1' version='1.1' xmlns='http://www.w3.org/2000/svg' xmlns:xlink='http://www.w3.org/1999/xlink'%3E%3Ctitle%3E%3C/title%3E%3Cg stroke='none' stroke-width='1' fill='none' fill-rule='evenodd' fill-opacity='0'%3E%3Cg transform='translate(-249.000000, -126.000000)' fill='%23FFFFFF'%3E%3Crect x='249
石柱黄连指纹图谱研究 黄小平,李隆云,瞿显有,崔广林(重庆市中药研究院,重庆400065)摘要目的:建立石柱道地药材黄连的HPLC指纹图谱,为科学评价与有效控制黄连质量提供新方法。方法:RP—HPLC法测定石柱GAP基地10批黄连样品。色谱条件:迪马Diamonsil C18。色谱柱,乙腈一0.05 molfL磷酸二氢钾(磷酸调pH值3)为流动相进行梯度洗脱,检测波长270 am,流速0.8 ml/min,柱温25。C。结果:10批黄连样品得到的指纹图谱有16个共有峰,通过与对照品的保留时间及紫外光谱比较,11,12,13,14,15号峰分别为伪小檗碱、药根碱、黄连碱、巴马汀和小檗碱。结论:建立的HPLC指纹图谱分析法能较好反映黄连中的主要生物碱成分,可用于黄连的质量控制。关键词 黄连;高效液相色谱法;指纹图谱PS:该文献也没有谱图
作者:http://d.g.wanfangdata.com.cn/Images/head_pic.gif王静单位:辽宁中医药大学摘要:1、血浆中盐酸小檗碱药代动力学数据表明,黄连药材中其他成分对盐酸小檗碱的药代动力学行为没有影响,黄连与吴茱萸配伍后盐酸小檗碱的药动学行为有一定的改善,Cmax提高,MAT缩短,大鼠灌胃药对提取物后盐酸小檗碱的Cmax是大鼠灌胃黄连提取物、盐酸小檗碱单体的1.8倍;大鼠灌胃药对提取物后盐酸小檗碱的MAT是大鼠灌胃黄连提取物、盐酸小檗碱单体的0.5倍。说明吴茱萸药材有可能促进盐酸小檗碱的吸收和排泄。 2、组织中盐酸小檗碱分布结果表明,盐酸小檗碱在体内组织中分布广泛,黄连与吴茱萸配伍后,促进盐酸小檗碱在胃和脾组织的吸收,促进盐酸小檗碱在小肠、肝、脾、肾、胰、睾丸组织中的代谢。 3、尿样中盐酸小檗碱的累计排泄量及占给药剂量中盐酸小檗碱量的百分比数据结果表明,黄连药材中其他成分对盐酸小檗碱在尿样中的排泄无影响。黄连与吴茱萸配伍后,盐酸小檗碱的尿样累计排泄量是大鼠灌胃黄连提取物或盐酸小檗碱单体的尿样累计排泄量1.18倍,吴茱萸药材与黄连药材配伍后,能促进盐酸小檗碱在体内的排泄。粪样中盐酸小檗碱的累计排泄量及占给药剂量中盐酸小檗碱量的百分比数据结果表明,黄连药材、吴茱萸药材能改善盐酸小檗碱在胃肠道的吸收,盐酸小檗碱以粪便排泄方式为主。 4、比较大鼠分别灌胃盐酸小檗碱单体、黄连提取物、最佳药对提取物后血浆中盐酸小檗碱的药代动力学差异,组织分布、尿样、粪样的排泄差异,研究结果表明,黄连中其他成分对盐酸小檗碱在体内的吸收、分布、排泄、代谢无显著影响,但是,吴茱萸药材与黄连药材配伍后,对盐酸小檗碱在机体内的吸收、分布、排泄、代谢有一定影响,说明吴茱萸药材有改进盐酸小檗碱的吸收、分布、排泄、代谢的作用,二者配伍有一定科学意义。http://ng1.17img.cn/bbsfiles/images/2012/07/201207231758_379283_2379123_3.jpg
最近在做黄连薄层鉴别,遇到以前未发生过的事情,以前用药典展开剂跑得效果挺好的,可是现在怎么也跑不上去,用的是对照药材,不知最近是否也有人在做黄连,是否遇到相同的情况
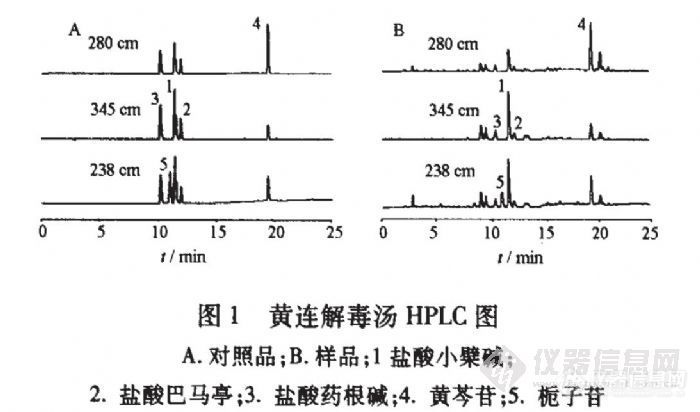
多波长高效液相色谱法同时测定黄连解毒汤中3类成分李新中1,雷鹏,刘韶(中南大学湘雅医院,湖南长沙410008) 目的:同时测定黄连解毒汤中3类有效成分(盐酸小檗碱、盐酸巴马亭、盐酸药根碱、黄芩苷、栀子苷)的含量。方法:三波长同时检测的高效液相色谱法;Diamonsil C18。色谱柱(4.6 mm×250 mm,5um);流动相水-甲醇旬.05%磷酸(梯度洗脱);柱温35℃;流速1 mL·min~;检测波长345,280,238 am。结果:建立了同时对黄连解毒汤中的5个成分进行定量的测定方法,本法快速、重复性好、灵敏度高。结论:为黄连解毒汤提供了更合理、可靠的质控方法。http://ng1.17img.cn/bbsfiles/images/2012/07/201207232347_379320_2355529_3.jpg
黄连的研究进展