[align=center]抗肿瘤单克隆抗体药物的研究进展[/align][align=center] [/align][align=center]摘 要[/align][align=center] [/align] 通过淋巴细胞杂交瘤技术或基因工程技术制备单克隆抗体药物,已经成为生物制药领域的一个重要方面,特别是对抗肿瘤单克隆抗体药物的研究已获得了重要进展。多年来,许多研究证实了抗肿瘤单克隆抗体药物的作用,为其应用于肿瘤治疗提供了重要依据。这类药物的特异性强,疗效显著。本文主要就近年来抗肿瘤单克隆抗体药物的研究进展进行了综述,并对抗肿瘤单克隆抗体药物的发展前景进行了展望。[align=left] [/align][align=left]关键词:抗肿瘤;单克隆抗体;研究进展[/align][align=center] [/align][align=center] [/align][b]一 引言[/b]抗肿瘤单抗药物因与烷化剂、抗代谢药、抗肿瘤抗生素、铂类配合物、植物药等抗肿瘤药物相比,具有高效价、高特异性、血清交叉反应少等特点与优点,在肿瘤治疗中起着不可替代的作用。单抗药物是当前生物技术药物领域甚为活跃的部分。针对特定的分子靶点(抗原),单抗有高度特异性。针对各种不同的抗原,可以制备为数众多的、各不相同的单抗;因此,作为药物来源,单抗又具有高度多样性。由于其特异性和多样性,研制单抗药物有巨大的潜力。单克隆抗体药物治疗恶性瘤主要机制有两种[sup][/sup]:一是利用单克隆抗体本身来阻断癌细胞生长的信号,单克隆抗体在癌细胞膜外与生长因子竞争结合受体,阻断信号传递过程,从而阻止癌细胞的生长和扩散,诱导细胞凋亡或者间接激活宿主的抗肿瘤免疫反应;二是利用单克隆抗体作为药物载体的靶向治疗,如将有细胞毒性的药物或有放射性的药物靶向性的运送到肿瘤细胞,从而杀伤肿瘤细胞。目前,国际上与肿瘤治疗相关的抗体研究主要集中在将抗体与耦联物作用后直接杀伤肿瘤细胞,利用抗体促进肿瘤细胞凋亡和抑制肿瘤血管生成等方面。此外,研究表明静脉内注射抗肿瘤单抗,在肿瘤部位的浓度较高,显示特异性定位;单抗与药物的偶联物通常仍保留原来单抗的分布特征,在靶肿瘤的浓度较高[sup][/sup]。[align=center]二 单克隆抗体药物作用靶点[/align]特定受体或特定的基因表达蛋白可能作为单抗药物的靶点。Rituxan是以B细胞的CD20分子作为靶点的人鼠嵌合抗体,对非霍奇金氏B细胞淋巴瘤有疗效,是第一个获美国FDA批准用于治疗恶性肿瘤的单抗。Herceptin是抗HER-2/neu癌基因编码蛋白的单抗,临床研究对乳腺癌有效,与化疗药物联合有更显著的疗效。Mylotarg是由抗CD33单抗与calicheamicin构成的偶联物,已获批准用于治疗急性复发性髓性白血病[sup][/sup]。表皮细胞生长因子受体(EGFr)在人的鳞癌、乳腺癌和脑胶质瘤等均有较高的表达。有报道,抗EGFr单抗与长春碱衍生物的偶联物在裸鼠体内试验,显示良好的抗癌效果。抗EGFr的人鼠嵌合抗体已进入临床研究。血管内皮生长因子(VEGF)在血管生成中有重要作用。据报道,抗VEGF的中和性单抗具有广谱的抗肿瘤作用,对移植于裸鼠的人体癌瘤有显著疗效[sup][/sup]。[b]三 单抗诱发肿瘤细胞凋亡[/b][align=left] 3.1 通过免疫细胞表面抗原的交联作用而诱导恶性肿瘤细胞的凋亡[/align]用于治疗血液系统恶性肿瘤的单克隆抗体药物大多是通过免疫细胞表面抗原的交联作用诱导恶性肿瘤细胞凋亡而起作用的,如目前用的抗-CD20的单克隆抗体——美罗华。其单克隆抗体的作用机制是通过诱导CD20分子在B细胞膜上的脂筏区聚集,再在一系列激酶的作用下使脂筏信号传导区域的CD20分子亲和性增强,从而形成CD20交联形式;交联的CD20分子启动了细胞内凋亡信号的传导通路,使线粒体释放出细胞色素C,激活下游的caspase级联反应,最终导致细胞凋亡[sup][/sup]。3.2 作用于恶性肿瘤细胞膜上的生长因子及其受体而诱导细胞凋亡许多生长因子及其受体通过作用于细胞的存活途径、刺激细胞的有丝分裂、促进细胞的生长增殖来阻止细胞凋亡。与正常细胞中生长因子信号传导的严格调控相比,肿瘤细胞中的失控则导致细胞的恶性增殖,从而使恶性细胞获得“永生”。单克隆抗体通过作用于恶性肿瘤细胞膜上的生长因子及其受体可阻断存活信号传导通路,从而导致其凋亡,同时还能对化疗和放疗有正协同作用。目前主要集中在对血管内皮生长因子(VEGF)及其受体、表皮生长因子受体(EGFR)等的研究。美国FDA于2006年批准了第一个用于治疗头颈部鳞状细胞癌的单克隆抗体药物——Cetuximab,它为一种IgG1单克隆抗体,主要通过干扰癌细胞表面EGFR的生长,从而减少癌细胞进入正常组织的概率,控制癌细胞的转移,达到抗癌目的[sup][/sup]。最初想到制备针对恶性肿瘤凋亡相关分子的单克隆抗体药物时,虽然从理论上来说无疑是给人们注入了一针兴奋剂,但在实际应用中则并不然,所以在通过单克隆抗体药物诱导恶性肿瘤细胞凋亡的研究和治疗中,还有待进一步开发新的、更经济、更有效地药物。[b]四 单克隆抗体耦联物[/b]4.1 抗体与化疗药物耦联目前,国内外研究较多的与单克隆抗体耦联的化学药物有平阳霉素、柔红霉素、丝裂霉素、多柔比星(阿霉素)、顺铂以及长春碱类衍生物等。同时还可以通过脂质体靶向制剂作为化疗药靶向治疗肿瘤,利用脂质体制剂将药物导向靶标进行有选择性地杀伤癌细胞和抑制癌细胞的繁殖,以达到提高疗效和高度定向作用。目前已上市的脂质体有复方氟脲嘧多相脂质体、喜树碱多相脂质体、阿霉素脂质体和紫杉醇脂质体等。4.2 抗体导向酶耦联利用抗体与肿瘤细胞表面抗原的特异性结合,将前体药物的专一性活化酶与单抗耦联,导向输入到靶细胞部分,再注入前体药物,使其在酶的作用下转化为活性药物,进而杀伤肿瘤细胞[sup][/sup]。目前这种用作前体药物的抗癌药有苦杏仁苷、氮芥、鬼臼乙叉苷、阿霉素、丝裂霉素等。而作为活化前体药物的导向酶有碱性磷酸酶、青霉素V或G酰胺酶、羧基酶肽、胸腺嘧啶核苷酶、β葡萄苷酶等。临床研究表明,单抗耦联物对于抗药性肿瘤细胞仍显示较强的杀伤活性。对由于长期使用氨甲蝶呤而出现抗药性的成骨肉瘤细胞,单抗氨甲蝶呤耦联物仍显示较强的杀伤作用。对于具有多药抗药性(MDR)的肿瘤细胞,抗P-170糖蛋白单抗构成的免疫毒素可显示选择性杀伤作用[sup][/sup]。这说明,单抗药物有可能用于克服肿瘤细胞抗药性。[b]五 单克隆抗体靶向药物[/b]单抗靶向药物是利用单抗对肿瘤表面相关抗原或特定的受体特异性识别,从而把药物直接导向肿瘤细胞,提高药物的疗效,降低药物对循环系统及其他部位的毒性。研究表明,单抗靶向药物具有很好的疗效,在免疫偶联物对移植于裸鼠的相应人体肿瘤生长有抑制作用。免疫偶联物与相应的游离物比较,具有更高更好的疗效和较低的细胞毒性[sup][/sup]。单克隆抗体体积小,能更有效地透入肿瘤;分子小、消除快、累积毒性小;所携带的弹头脱离后,可较快被清除 循环中免疫靶向结合物对靶细胞的竞争作用小;半衰期短;穿透性好;能穿过血脑屏障[sup][/sup],因而还可以作为新一代靶向载体。与化学药物、毒素、放射性核素、生物因子、基因、分化诱导剂、光敏剂、酶等物质构成单克隆抗体靶向药物,把杀伤肿瘤细胞的活性物质特异的输送到肿瘤部位,利用单抗对肿瘤表面相关抗原或特定的受体特异性识别,从而把药物直接导向肿瘤细胞,提高药物疗效,降低药物对循环系统及其他部位的毒性。近年来,随着医学、药学和生物工程学及技术的进步,临床对肿瘤的根治和对癌细胞的攻击锁定于表皮生长因子和血管内皮生长因子等靶位,使药物治疗的切入点由细胞水平提升到分子和抗体水平,从而提高了肿瘤综合治疗的效果。[align=center]六 人源化单克隆抗体[/align]单克隆抗体是近年竞相开发的品种,自1997年第1个单克隆抗体rituximab通过食品与药物管理局(FDA)批准应用于临床以来,目前已经上市的单克隆抗体靶向药物的疗效令人瞩目,在抗肿瘤、类风湿性关节炎和自身免疫系统缺陷治疗领域得到了有力的推广,其以独特的作用优势,在肿瘤的治疗中不但能够选择性杀伤癌细胞,且在体内表现出特异的分布特性,具有高效、低毒的特点,从而在生物技术产品领域中占据了1/3的市场[sup][/sup]。目前用于治疗肿瘤的单克隆抗体药已有多个,包括伊珠单抗奥加米星、帕尼单抗、曲妥珠单抗等。伊珠单抗奥加米星又名CMC-544,是以人源化抗CD22的抗体伊珠单抗与 CalichDMH偶联形成的ADC药物,用来治疗复发性或难治性B细胞非霍奇金淋巴瘤(B cell-NHL)和急性淋巴细胞白血病(ALL),目前已经进入临床 III期试验[sup][/sup]。帕尼单抗是一种IgG2单克隆抗体完全人源化可以与EGFR高度特异性地结合,进而阻断配体诱导的信号激活,从而抑制肿瘤生长。有临床研究选择既往未治疗过的ⅢB或Ⅳ期非小细胞肺癌患者比较卡铂(AUC=6,每3周),加紫杉醇(200mg/m21次/3周) 联合或不联合帕尼单抗(2.5 mg/m2,1次/周) 化疗的疗效及其安全性。研究结果显示,单纯化疗组与帕尼单抗联合化疗组之间在PFS(5.3个月对比4.2个月、P=0.55)和总生存( Overall survival,OS)(8.0个月对比8.5个月,P =0.81)上均无显著差异。结果提示帕尼单抗联合一线化疗方案可能对晚期非小细胞肺癌无明显疗效[sup][/sup]。曲妥珠单抗是一种抗Her2的单克隆抗体,他可以和肿瘤细胞的HER2/neu特异性地结合,从而阻断细胞内生长信号的转导,同时曲妥珠单抗还可以诱导体内巨噬细胞以及自然杀伤细胞攻击肿瘤细胞,以达到抑制和杀伤肿瘤细胞的目的。比较用或不用曲妥珠单抗联合一线化疗方案用以治疗ⅡB/Ⅲ期HER2/neu阳性的 NSCLC患者差异的两项大型的随机Ⅱ期临床试验,其结果显示两个试验结论相似,曲妥珠单抗不能提高化疗的疗效,但也不加重化疗的不良反应。试验中HER2/neu值为3+的患者对曲妥珠单抗治疗的反应性较好,提示曲妥珠单抗对这一较少见类型的NSCLC效果要更好[sup][/sup]。在临床治疗中使用鼠派生单抗的主要障碍之一是产生人抗鼠抗体(HAMA)反应,通过基因工程技术制备嵌合抗体的I-IPdVIA反应率较鼠源性单抗低,但完全的人源抗体才是单抗药物的发展目标。噬茵体抗体库技术和转基因小鼠技术是制备完全人源单抗的两种方法[sup][/sup]。因此,只有不断地完善单克隆抗体人源化的技术,才能更好地将完全人源化的单克隆抗体用于肿瘤分子靶向治疗中,从而使医学界迈向更高的台阶。[b]七 问题与对策[/b]在限制单克隆抗体临床治疗效果的因素有:(l)循环免疫复合物导致的肝肾功能损害。(2)可溶性肿瘤抗原释放造成的体液中的封闭作用。(3)异种蛋白反应。(4)特异性还不够专一,引起了正常细胞的伤害。(5)天然免疫功能低下(如补体介异的细胞毒,网状内皮系统清除和ADCC作用等)。(6)主要的问题还在这种免疫疗法会导致靶细胞(肿瘤细胞)上抗原的转换。为了解决这些问题,今后的研究应着重:(1)制备对肿瘤抗原有高度特异性的单克隆抗体。(2)选择不易诱导抗原转换的单克隆抗体。(3)研究副作用较少,既安全疗效又高的偶联制剂。单抗(Mab)药物存在的一个最关键问题就是人抗鼠抗体反应(HAMA)。由于用于临床研究的Mab药物一般使用鼠源Mab,这不可避免地会引起HAMA反应,所以尽量避免HAMA反应这一副作用才是Mab药物能否真正适合治疗肿瘤性疾病的重点[sup][/sup]。近些年来,Mab药物的研究主要是向减轻宿主对外源抗体的排斥,促进抗体人源化,改变抗体的氨基酸序列而增加或降低该抗体的生物学效应,加抗体的亲和力,制备双特异性抗体,改造抗体重链恒定区以增强抗体功能,以及寻找新的分子靶点(相对特异的肿瘤抗原)等方向发展[sup][/sup]。Mab药物的不断更新,必将为全球的肿瘤患者带来更大的希望。[align=center]八 总结与展望[/align]目前肿瘤治疗中使用最广泛的仍是化疗以及放射性疗法,其毒副作用较大。随着基因工程技术和DNA重组技术的兴起,利用单克隆抗体治疗肿瘤已经日渐取代副作用较大的传统疗法而成为新的发展趋向。所以,如何研制更多的单克隆抗体以及怎样更好的利用单克隆抗体治疗肿瘤,将成为肿瘤治疗研究中的又一艰巨任务。同时,生物技术以及抗肿瘤化学药物的发展也必将推动单抗药物的发展与进步,单克隆抗体药物将在各种肿瘤的治疗中发挥越来越重要的作用。在未来10年内,单克隆抗体药将成为国内、外生物药品发展的主旋律。此外,利用与肿瘤细胞相关抗原的特异结合力,相应的单克隆抗体可以用于肿瘤早期诊断和预后判定。例如用放射标记抗体能够确定肿瘤存在的位置,扩散的部位和范围,以便确定手术时机和化疗方案。通过测定抗体结合白血病细胞的增减,可以检查白血病的化疗效果[sup][/sup]。利用单克隆抗体检测某些癌的特异性产物,如前列腺癌产生的酸性磷酸酶,绒毛膜上皮癌产生的促性腺激素,结肠癌产生的癌胚抗原及肝癌产生的甲胎蛋白等,有助于癌肿的早期诊断[sup][/sup]。单克隆抗体在肿瘤的治疗中的作用功不可没,但同时也面临着巨大的挑战,例如如何选择优势人群、进一步提高疗效、降低不良反应的发生都是需要进一步解决的。如贝伐单抗的突出不良反应是出血,在NCCN指南中特别指出贝伐单抗仅适用非鳞癌的[sup][/sup],既往无咯血史的患者,限制了贝伐单抗的临床应用。而其他大部分单克隆抗体均需与其他化疗药物联用,单独应用的疗效仍有限,选择合适的指标以及合适人群应用单克隆抗体仍任重而道远。[b]参考文献[/b] Adams GP, Weiner LM.Monoclonalantibody therapy of cancer .Nat Biotechnol,2005,23(9):1147~1148 甄永苏.抗肿瘤抗生素和单克隆抗体药物的研究进展.中国抗生素杂志,2002,27(1):1~5 Sievers E L, Larson R A, Stadtmauer E A, [i]et al[/i].Effica-cy and safety ofgemtuzumab ozogamicin in patients withCD33-positive acute myeloid leukemia infirst relapse .Clin Oncol,2001,19(21):3244~3246 Kamiya K, Konno H, Tanaka T, [i]et al[/i].Antitumor effect on humangastric cancer and induction of apoptosis by vascular endothelial growth factorneutralizing antibody .Jpn J Cancer Res,1999,4(21):794~798 邹学,李俊,尹庆春.单克隆抗体药物诱发肿瘤细胞凋亡的研究进展.总装备部医学学报,2008,10(2):115~117 Rao AV, Schmader K.Monoclonalantibodies as targeted therapy in hematologic malignancies in older adults .Am J GeriatrPharmacother,2007,5(3):247~250 杨海东,罗傲雪,范益军.单克隆抗体在治疗肿瘤中的研究进展.时珍国医国药,2007,18(11):2685~2686 甄红英,薛玉川,甄永苏.抗肿瘤抗生素C1027抑制血管生成及其抗肿瘤转移作用.中华医学杂志,1997,77(21):657~660 刘霆.抗肿瘤单克隆抗体靶向药物的研究进展.国外医学生理、病理科学与临床分册,2003,23(3):254~257 Plw a JL,Britta E,Jayne L,[i]et al[/i].Targeting rat anti-mouse transferrinreceptor monoclonal antibody through blood-brain barrier in mouse .pharmacology andexperiment therapeu-ties,2000,4(21):1048~1057 刘德忠,张石革.分子和抗体靶向抗肿瘤药的研究进展.中国药房,2007,18(26):2067~2068 丰雪,龙亚一,廖翰.抗肿瘤抗体-药物偶联物的临床研究进展.现代生物医学进展,2013,16(21):3164~3168 江山,杨小琼.晚期非小细胞肺癌单克隆抗体治疗的研究进展.吉林医学,2013,34(35):7482~7483 SpicerJ,Harper P.Targetedtherapies for non-small cell lung cancer .In t J C l in Pract,2005,59(9):1055~1057 彭建柳,杨丽华.人源化单克隆抗体用于肿瘤分子靶向治疗的研究进展.现代医院,2009,9(5):8~11 王飞,董军,黄强等.转基因完全人抗体的制备及其抗肿瘤作用研究.中华神经外科疾病研究杂志,2002,1(1):90~91 Kim J A.Targeted therapies for thetreatment of cancer .Am J Surg,2003,186(9):264~269 侯盛,郭亚军.单克隆抗体在肿瘤治疗中的应用.中国处方药,2007,4(61):53~56 清水惠司.抗肿瘤用药的应用及进展.临床免疫,2009,13(11):912~915 沈倍奋.抗体药物研究进展.第二军医大学学报,2002,23(10):1047~1049
[align=center]抗肿瘤单克隆抗体药物的研究进展[/align][align=center] [/align][align=center]摘 要[/align][align=center] [/align] 通过淋巴细胞杂交瘤技术或基因工程技术制备单克隆抗体药物,已经成为生物制药领域的一个重要方面,特别是对抗肿瘤单克隆抗体药物的研究已获得了重要进展。多年来,许多研究证实了抗肿瘤单克隆抗体药物的作用,为其应用于肿瘤治疗提供了重要依据。这类药物的特异性强,疗效显著。本文主要就近年来抗肿瘤单克隆抗体药物的研究进展进行了综述,并对抗肿瘤单克隆抗体药物的发展前景进行了展望。[align=left] [/align][align=left]关键词:抗肿瘤;单克隆抗体;研究进展[/align][align=center] [/align][align=center] [/align][b]一 引言[/b]抗肿瘤单抗药物因与烷化剂、抗代谢药、抗肿瘤抗生素、铂类配合物、植物药等抗肿瘤药物相比,具有高效价、高特异性、血清交叉反应少等特点与优点,在肿瘤治疗中起着不可替代的作用。单抗药物是当前生物技术药物领域甚为活跃的部分。针对特定的分子靶点(抗原),单抗有高度特异性。针对各种不同的抗原,可以制备为数众多的、各不相同的单抗;因此,作为药物来源,单抗又具有高度多样性。由于其特异性和多样性,研制单抗药物有巨大的潜力。单克隆抗体药物治疗恶性瘤主要机制有两种[sup][/sup]:一是利用单克隆抗体本身来阻断癌细胞生长的信号,单克隆抗体在癌细胞膜外与生长因子竞争结合受体,阻断信号传递过程,从而阻止癌细胞的生长和扩散,诱导细胞凋亡或者间接激活宿主的抗肿瘤免疫反应;二是利用单克隆抗体作为药物载体的靶向治疗,如将有细胞毒性的药物或有放射性的药物靶向性的运送到肿瘤细胞,从而杀伤肿瘤细胞。目前,国际上与肿瘤治疗相关的抗体研究主要集中在将抗体与耦联物作用后直接杀伤肿瘤细胞,利用抗体促进肿瘤细胞凋亡和抑制肿瘤血管生成等方面。此外,研究表明静脉内注射抗肿瘤单抗,在肿瘤部位的浓度较高,显示特异性定位;单抗与药物的偶联物通常仍保留原来单抗的分布特征,在靶肿瘤的浓度较高[sup][/sup]。[align=center]二 单克隆抗体药物作用靶点[/align]特定受体或特定的基因表达蛋白可能作为单抗药物的靶点。Rituxan是以B细胞的CD20分子作为靶点的人鼠嵌合抗体,对非霍奇金氏B细胞淋巴瘤有疗效,是第一个获美国FDA批准用于治疗恶性肿瘤的单抗。Herceptin是抗HER-2/neu癌基因编码蛋白的单抗,临床研究对乳腺癌有效,与化疗药物联合有更显著的疗效。Mylotarg是由抗CD33单抗与calicheamicin构成的偶联物,已获批准用于治疗急性复发性髓性白血病[sup][/sup]。表皮细胞生长因子受体(EGFr)在人的鳞癌、乳腺癌和脑胶质瘤等均有较高的表达。有报道,抗EGFr单抗与长春碱衍生物的偶联物在裸鼠体内试验,显示良好的抗癌效果。抗EGFr的人鼠嵌合抗体已进入临床研究。血管内皮生长因子(VEGF)在血管生成中有重要作用。据报道,抗VEGF的中和性单抗具有广谱的抗肿瘤作用,对移植于裸鼠的人体癌瘤有显著疗效[sup][/sup]。[b]三 单抗诱发肿瘤细胞凋亡[/b][align=left] 3.1 通过免疫细胞表面抗原的交联作用而诱导恶性肿瘤细胞的凋亡[/align]用于治疗血液系统恶性肿瘤的单克隆抗体药物大多是通过免疫细胞表面抗原的交联作用诱导恶性肿瘤细胞凋亡而起作用的,如目前用的抗-CD20的单克隆抗体——美罗华。其单克隆抗体的作用机制是通过诱导CD20分子在B细胞膜上的脂筏区聚集,再在一系列激酶的作用下使脂筏信号传导区域的CD20分子亲和性增强,从而形成CD20交联形式;交联的CD20分子启动了细胞内凋亡信号的传导通路,使线粒体释放出细胞色素C,激活下游的caspase级联反应,最终导致细胞凋亡[sup][/sup]。3.2 作用于恶性肿瘤细胞膜上的生长因子及其受体而诱导细胞凋亡许多生长因子及其受体通过作用于细胞的存活途径、刺激细胞的有丝分裂、促进细胞的生长增殖来阻止细胞凋亡。与正常细胞中生长因子信号传导的严格调控相比,肿瘤细胞中的失控则导致细胞的恶性增殖,从而使恶性细胞获得“永生”。单克隆抗体通过作用于恶性肿瘤细胞膜上的生长因子及其受体可阻断存活信号传导通路,从而导致其凋亡,同时还能对化疗和放疗有正协同作用。目前主要集中在对血管内皮生长因子(VEGF)及其受体、表皮生长因子受体(EGFR)等的研究。美国FDA于2006年批准了第一个用于治疗头颈部鳞状细胞癌的单克隆抗体药物——Cetuximab,它为一种IgG1单克隆抗体,主要通过干扰癌细胞表面EGFR的生长,从而减少癌细胞进入正常组织的概率,控制癌细胞的转移,达到抗癌目的[sup][/sup]。最初想到制备针对恶性肿瘤凋亡相关分子的单克隆抗体药物时,虽然从理论上来说无疑是给人们注入了一针兴奋剂,但在实际应用中则并不然,所以在通过单克隆抗体药物诱导恶性肿瘤细胞凋亡的研究和治疗中,还有待进一步开发新的、更经济、更有效地药物。[b]四 单克隆抗体耦联物[/b]4.1 抗体与化疗药物耦联目前,国内外研究较多的与单克隆抗体耦联的化学药物有平阳霉素、柔红霉素、丝裂霉素、多柔比星(阿霉素)、顺铂以及长春碱类衍生物等。同时还可以通过脂质体靶向制剂作为化疗药靶向治疗肿瘤,利用脂质体制剂将药物导向靶标进行有选择性地杀伤癌细胞和抑制癌细胞的繁殖,以达到提高疗效和高度定向作用。目前已上市的脂质体有复方氟脲嘧多相脂质体、喜树碱多相脂质体、阿霉素脂质体和紫杉醇脂质体等。4.2 抗体导向酶耦联利用抗体与肿瘤细胞表面抗原的特异性结合,将前体药物的专一性活化酶与单抗耦联,导向输入到靶细胞部分,再注入前体药物,使其在酶的作用下转化为活性药物,进而杀伤肿瘤细胞[sup][/sup]。目前这种用作前体药物的抗癌药有苦杏仁苷、氮芥、鬼臼乙叉苷、阿霉素、丝裂霉素等。而作为活化前体药物的导向酶有碱性磷酸酶、青霉素V或G酰胺酶、羧基酶肽、胸腺嘧啶核苷酶、β葡萄苷酶等。临床研究表明,单抗耦联物对于抗药性肿瘤细胞仍显示较强的杀伤活性。对由于长期使用氨甲蝶呤而出现抗药性的成骨肉瘤细胞,单抗氨甲蝶呤耦联物仍显示较强的杀伤作用。对于具有多药抗药性(MDR)的肿瘤细胞,抗P-170糖蛋白单抗构成的免疫毒素可显示选择性杀伤作用[sup][/sup]。这说明,单抗药物有可能用于克服肿瘤细胞抗药性。[b]五 单克隆抗体靶向药物[/b]单抗靶向药物是利用单抗对肿瘤表面相关抗原或特定的受体特异性识别,从而把药物直接导向肿瘤细胞,提高药物的疗效,降低药物对循环系统及其他部位的毒性。研究表明,单抗靶向药物具有很好的疗效,在免疫偶联物对移植于裸鼠的相应人体肿瘤生长有抑制作用。免疫偶联物与相应的游离物比较,具有更高更好的疗效和较低的细胞毒性[sup][/sup]。单克隆抗体体积小,能更有效地透入肿瘤;分子小、消除快、累积毒性小;所携带的弹头脱离后,可较快被清除 循环中免疫靶向结合物对靶细胞的竞争作用小;半衰期短;穿透性好;能穿过血脑屏障[sup][/sup],因而还可以作为新一代靶向载体。与化学药物、毒素、放射性核素、生物因子、基因、分化诱导剂、光敏剂、酶等物质构成单克隆抗体靶向药物,把杀伤肿瘤细胞的活性物质特异的输送到肿瘤部位,利用单抗对肿瘤表面相关抗原或特定的受体特异性识别,从而把药物直接导向肿瘤细胞,提高药物疗效,降低药物对循环系统及其他部位的毒性。近年来,随着医学、药学和生物工程学及技术的进步,临床对肿瘤的根治和对癌细胞的攻击锁定于表皮生长因子和血管内皮生长因子等靶位,使药物治疗的切入点由细胞水平提升到分子和抗体水平,从而提高了肿瘤综合治疗的效果。[align=center]六 人源化单克隆抗体[/align]单克隆抗体是近年竞相开发的品种,自1997年第1个单克隆抗体rituximab通过食品与药物管理局(FDA)批准应用于临床以来,目前已经上市的单克隆抗体靶向药物的疗效令人瞩目,在抗肿瘤、类风湿性关节炎和自身免疫系统缺陷治疗领域得到了有力的推广,其以独特的作用优势,在肿瘤的治疗中不但能够选择性杀伤癌细胞,且在体内表现出特异的分布特性,具有高效、低毒的特点,从而在生物技术产品领域中占据了1/3的市场[sup][/sup]。目前用于治疗肿瘤的单克隆抗体药已有多个,包括伊珠单抗奥加米星、帕尼单抗、曲妥珠单抗等。伊珠单抗奥加米星又名CMC-544,是以人源化抗CD22的抗体伊珠单抗与 CalichDMH偶联形成的ADC药物,用来治疗复发性或难治性B细胞非霍奇金淋巴瘤(B cell-NHL)和急性淋巴细胞白血病(ALL),目前已经进入临床 III期试验[sup][/sup]。帕尼单抗是一种IgG2单克隆抗体完全人源化可以与EGFR高度特异性地结合,进而阻断配体诱导的信号激活,从而抑制肿瘤生长。有临床研究选择既往未治疗过的ⅢB或Ⅳ期非小细胞肺癌患者比较卡铂(AUC=6,每3周),加紫杉醇(200mg/m21次/3周) 联合或不联合帕尼单抗(2.5 mg/m2,1次/周) 化疗的疗效及其安全性。研究结果显示,单纯化疗组与帕尼单抗联合化疗组之间在PFS(5.3个月对比4.2个月、P=0.55)和总生存( Overall survival,OS)(8.0个月对比8.5个月,P =0.81)上均无显著差异。结果提示帕尼单抗联合一线化疗方案可能对晚期非小细胞肺癌无明显疗效[sup][/sup]。曲妥珠单抗是一种抗Her2的单克隆抗体,他可以和肿瘤细胞的HER2/neu特异性地结合,从而阻断细胞内生长信号的转导,同时曲妥珠单抗还可以诱导体内巨噬细胞以及自然杀伤细胞攻击肿瘤细胞,以达到抑制和杀伤肿瘤细胞的目的。比较用或不用曲妥珠单抗联合一线化疗方案用以治疗ⅡB/Ⅲ期HER2/neu阳性的 NSCLC患者差异的两项大型的随机Ⅱ期临床试验,其结果显示两个试验结论相似,曲妥珠单抗不能提高化疗的疗效,但也不加重化疗的不良反应。试验中HER2/neu值为3+的患者对曲妥珠单抗治疗的反应性较好,提示曲妥珠单抗对这一较少见类型的NSCLC效果要更好[sup][/sup]。在临床治疗中使用鼠派生单抗的主要障碍之一是产生人抗鼠抗体(HAMA)反应,通过基因工程技术制备嵌合抗体的I-IPdVIA反应率较鼠源性单抗低,但完全的人源抗体才是单抗药物的发展目标。噬茵体抗体库技术和转基因小鼠技术是制备完全人源单抗的两种方法[sup][/sup]。因此,只有不断地完善单克隆抗体人源化的技术,才能更好地将完全人源化的单克隆抗体用于肿瘤分子靶向治疗中,从而使医学界迈向更高的台阶。[b]七 问题与对策[/b]在限制单克隆抗体临床治疗效果的因素有:(l)循环免疫复合物导致的肝肾功能损害。(2)可溶性肿瘤抗原释放造成的体液中的封闭作用。(3)异种蛋白反应。(4)特异性还不够专一,引起了正常细胞的伤害。(5)天然免疫功能低下(如补体介异的细胞毒,网状内皮系统清除和ADCC作用等)。(6)主要的问题还在这种免疫疗法会导致靶细胞(肿瘤细胞)上抗原的转换。为了解决这些问题,今后的研究应着重:(1)制备对肿瘤抗原有高度特异性的单克隆抗体。(2)选择不易诱导抗原转换的单克隆抗体。(3)研究副作用较少,既安全疗效又高的偶联制剂。单抗(Mab)药物存在的一个最关键问题就是人抗鼠抗体反应(HAMA)。由于用于临床研究的Mab药物一般使用鼠源Mab,这不可避免地会引起HAMA反应,所以尽量避免HAMA反应这一副作用才是Mab药物能否真正适合治疗肿瘤性疾病的重点[sup][/sup]。近些年来,Mab药物的研究主要是向减轻宿主对外源抗体的排斥,促进抗体人源化,改变抗体的氨基酸序列而增加或降低该抗体的生物学效应,加抗体的亲和力,制备双特异性抗体,改造抗体重链恒定区以增强抗体功能,以及寻找新的分子靶点(相对特异的肿瘤抗原)等方向发展[sup][/sup]。Mab药物的不断更新,必将为全球的肿瘤患者带来更大的希望。[align=center]八 总结与展望[/align]目前肿瘤治疗中使用最广泛的仍是化疗以及放射性疗法,其毒副作用较大。随着基因工程技术和DNA重组技术的兴起,利用单克隆抗体治疗肿瘤已经日渐取代副作用较大的传统疗法而成为新的发展趋向。所以,如何研制更多的单克隆抗体以及怎样更好的利用单克隆抗体治疗肿瘤,将成为肿瘤治疗研究中的又一艰巨任务。同时,生物技术以及抗肿瘤化学药物的发展也必将推动单抗药物的发展与进步,单克隆抗体药物将在各种肿瘤的治疗中发挥越来越重要的作用。在未来10年内,单克隆抗体药将成为国内、外生物药品发展的主旋律。此外,利用与肿瘤细胞相关抗原的特异结合力,相应的单克隆抗体可以用于肿瘤早期诊断和预后判定。例如用放射标记抗体能够确定肿瘤存在的位置,扩散的部位和范围,以便确定手术时机和化疗方案。通过测定抗体结合白血病细胞的增减,可以检查白血病的化疗效果[sup][/sup]。利用单克隆抗体检测某些癌的特异性产物,如前列腺癌产生的酸性磷酸酶,绒毛膜上皮癌产生的促性腺激素,结肠癌产生的癌胚抗原及肝癌产生的甲胎蛋白等,有助于癌肿的早期诊断[sup][/sup]。单克隆抗体在肿瘤的治疗中的作用功不可没,但同时也面临着巨大的挑战,例如如何选择优势人群、进一步提高疗效、降低不良反应的发生都是需要进一步解决的。如贝伐单抗的突出不良反应是出血,在NCCN指南中特别指出贝伐单抗仅适用非鳞癌的[sup][/sup],既往无咯血史的患者,限制了贝伐单抗的临床应用。而其他大部分单克隆抗体均需与其他化疗药物联用,单独应用的疗效仍有限,选择合适的指标以及合适人群应用单克隆抗体仍任重而道远。[b]参考文献[/b] Adams GP, Weiner LM.Monoclonalantibody therapy of cancer .Nat Biotechnol,2005,23(9):1147~1148 甄永苏.抗肿瘤抗生素和单克隆抗体药物的研究进展.中国抗生素杂志,2002,27(1):1~5 Sievers E L, Larson R A, Stadtmauer E A, [i]et al[/i].Effica-cy and safety ofgemtuzumab ozogamicin in patients withCD33-positive acute myeloid leukemia infirst relapse .Clin Oncol,2001,19(21):3244~3246 Kamiya K, Konno H, Tanaka T, [i]et al[/i].Antitumor effect on humangastric cancer and induction of apoptosis by vascular endothelial growth factorneutralizing antibody .Jpn J Cancer Res,1999,4(21):794~798 邹学,李俊,尹庆春.单克隆抗体药物诱发肿瘤细胞凋亡的研究进展.总装备部医学学报,2008,10(2):115~117 Rao AV, Schmader K.Monoclonalantibodies as targeted therapy in hematologic malignancies in older adults .Am J GeriatrPharmacother,2007,5(3):247~250 杨海东,罗傲雪,范益军.单克隆抗体在治疗肿瘤中的研究进展.时珍国医国药,2007,18(11):2685~2686 甄红英,薛玉川,甄永苏.抗肿瘤抗生素C1027抑制血管生成及其抗肿瘤转移作用.中华医学杂志,1997,77(21):657~660 刘霆.抗肿瘤单克隆抗体靶向药物的研究进展.国外医学生理、病理科学与临床分册,2003,23(3):254~257 Plw a JL,Britta E,Jayne L,[i]et al[/i].Targeting rat anti-mouse transferrinreceptor monoclonal antibody through blood-brain barrier in mouse .pharmacology andexperiment therapeu-ties,2000,4(21):1048~1057 刘德忠,张石革.分子和抗体靶向抗肿瘤药的研究进展.中国药房,2007,18(26):2067~2068 丰雪,龙亚一,廖翰.抗肿瘤抗体-药物偶联物的临床研究进展.现代生物医学进展,2013,16(21):3164~3168 江山,杨小琼.晚期非小细胞肺癌单克隆抗体治疗的研究进展.吉林医学,2013,34(35):7482~7483 SpicerJ,Harper P.Targetedtherapies for non-small cell lung cancer .In t J C l in Pract,2005,59(9):1055~1057 彭建柳,杨丽华.人源化单克隆抗体用于肿瘤分子靶向治疗的研究进展.现代医院,2009,9(5):8~11 王飞,董军,黄强等.转基因完全人抗体的制备及其抗肿瘤作用研究.中华神经外科疾病研究杂志,2002,1(1):90~91 Kim J A.Targeted therapies for thetreatment of cancer .Am J Surg,2003,186(9):264~269 侯盛,郭亚军.单克隆抗体在肿瘤治疗中的应用.中国处方药,2007,4(61):53~56 清水惠司.抗肿瘤用药的应用及进展.临床免疫,2009,13(11):912~915 沈倍奋.抗体药物研究进展.第二军医大学学报,2002,23(10):1047~1049
缺血性脑卒中是人类死亡的主要原因之一,也是全球范围内成人致残的主要原因[1]。2019年我国有缺血性脑卒中患者2 418万例,给我国医疗卫生系统造成巨大负担[2]。缺血后大脑血液供应的中断会引发一系列病理生理改变。尽管恢复脑血流对挽救缺血组织至关重要,但血流恢复可能会进一步加重脑损伤[3]。再灌注损伤的机制包括活性氧(reactive oxygen species,ROS)的突然产生、自噬的激活和细胞因子的释放,其中线粒体功能障碍在介导这些病理生理过程中发挥重要作用[4]。目前,重组组织纤溶酶原激活剂(recombinant tissue plasminogen activator,rt-PA)已被批准应用于缺血性脑卒中的治疗[5]。由于治疗时间窗窄,能够应用rt-PA治疗的患者不足10%[6]。因此,寻找更有效的防治缺血性脑卒中的药物至关重要。 在中医理论中,缺血性脑卒中属于“中风”范畴。补阳还五汤是治疗缺血性脑卒中的经典方剂,已有数百年的临床应用历史[7-8]。方中以生黄芪为君药,补益元气,旨在气旺则血行,瘀去则络通,对中风之气虚血瘀证有显著疗效。现代药理学研究证实,芒柄花素是黄芪的主要活性成分之一,具有抗炎[9]、抗氧化[10]、神经保护[11]等作用。但是,水溶性差限制了其在中枢神经系统的应用。通过磺化反应合成的芒柄花素磺酸钠(sodium formononetin-3?-sulphonate,Sul-F)克服了其水溶性差的难题,为其应用于缺血性脑卒中的研究提供了物质基础。 本研究通过建立大脑中动脉栓塞模型(middle cerebral artery occlusion,MCAO)大鼠模型,考察Sul-F对大鼠脑缺血再灌注(ischemia-reperfusion, I/R)损伤的改善作用和对线粒体凋亡通路的影响,旨在探讨Sul-F是否通过调控线粒体凋亡通路改善脑I/R损伤。 1 材料 1.1 动物 SPF级雄性SD大鼠75只,体质量(300±10)g,购自斯贝福(北京)有限公司,许可证号SYXK(冀)2021-006。大鼠饲养于动物房,温度(25±1)℃,相对湿度(50±10)%,昼夜周期为12 h,自由摄食饮水,实验开展前适应性饲养1周。本实验所有操作均严格按照动物伦理要求进行,且经河北中医学院实验动物管理和伦理委员会批准(批准号DWLL202306001)。 1.2 药品与试剂 依达拉奉注射液(国药准字H20080056,批号2109050)购自国瑞药业有限公司;Sul-F(质量分数>95%,批号160901)由河北国金药业有限责任公司提供;2,3,5-氯化三苯基四氮唑(2,3,5-triphenyltetrazolium chloride,TTC)染液(批号1222A23)购自美国Sigma-Aldrich公司;苏木素-伊红(hematoxylin-eosin,HE)染液试剂盒(批号MD070823)购自碧云天生物技术有限公司;原位末端标记(TdT-mediated dUTP nick end labeling,TUNEL)检测试剂盒(批号061223240108)、线粒体膜电位(JC-1)检测试剂盒(批号C2006)购自碧云天生物技术有限公司;谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)测定试剂盒(批号A005-1)、超氧化物歧化酶(superoxide dismutase,SOD)测定试剂盒(批号A001-3)、丙二醛(malondialdehyde,MDA)测定试剂盒(批号A003-1)均购自南京建成生物工程研究所;电镜固定液(批号02607-BA)、包埋剂(批号90529-77-4)、醋酸双氧铀(批号H60602624A8)购自SPI公司;无水乙醇(批号100092183)、丙酮(批号10000418)购自国药集团化学试剂有限公司;铜网(批号BZ100205a)购自北京中镜科仪技术有限公司;锇酸(批号18456)购自Ted Pella公司;柠檬酸铅(批号180705-C5382)购自EMS公司;β-actin抗体(批号86e1489)、B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)抗体(批号35y4418)、Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)抗体(批号43z8686)、半胱氨酸天冬氨酸蛋白酶-3(cystein-asparate protease-3,Caspase-3)抗体(批号53j2158)购自Affinity公司;HRP标记的山羊抗兔二抗(批号20220521)购自北京百奥思科生物科技有限公司;Trizol(批号342430AX)购自艾德莱公司;ExonScript First-Strand Synthesis SuperMix with dsDNase试剂盒(批号231106-A5)购自成都市蓉为基因生物科技有限公司;硅胶线栓(批号230701162)购自长沙迈越生物科技有限公司。 1.3 仪器 JT-12J型全自动脱水机、JB-L5型加热石蜡包埋系统(武汉俊杰电子有限公司);RM2235型石蜡切片机、UC7型超薄切片机(德国Leica公司);XS-2100型光学显微镜(NOVEL公司);ELCIPSE-CI型正置荧光显微镜(日本Nikon公司);7800型透射电子显微镜(日本Hitachi公司);LF-2000型SDS-PAGE电泳系统(北京龙方科技有限公司);JYO2S型凝胶成像系统(北京君意东方电泳设备有限公司);chemiscope 6100型化学发光成像系统(上海勤翔科学仪器有限公司);272005652型实时荧光定量[url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url]仪(美国Life Techologies公司);BeamCyte-1026型流式细胞仪(必达科生物科技有限公司);680型酶标仪(美国Bio-Rad公司)。 2 方法 2.1 动物造模、分组及给药 大鼠I/R损伤模型的建立参照文献方法[12],大鼠ip 1%戊巴比妥钠(50 mg/kg)麻醉后,置于加热垫上,保持肛温37 ℃。颈前皮肤备毛,在前正中线做切口,暴露颈总动脉、颈内动脉和颈外动脉,结扎颈外动脉远端,夹闭颈内动脉远端颈总动脉近端,将线栓经颈内动脉送入大脑中动脉,推送线栓18~20 mm,缺血2 h后拔出线栓并且结扎端口。再灌注0 h时,选择神经功能评分为1~3分的大鼠,随机分为模型组、依达拉奉(3 mg/kg)[13]组和Sul-F高、低剂量(80、40 mg/kg)组,每组15只。另取15只大鼠仅分离血管不插线栓作为假手术组。分别于再灌注0、12 h尾iv给药(4 mL/kg),假手术组和模型组给予等体积的生理盐水。再灌注24 h后取材进行后续实验。 2.2 神经功能评分 再灌注0、24 h时,采用盲法对各组大鼠进行Zea-Longa评分[14]:0分,活动基本正常;1分,提起时对侧前爪无法完全伸展;2分,向手术对侧转圈;3分,向手术对侧倾倒;4分,意识丧失。 2.3 TTC染色测定脑梗死体积 大鼠麻醉,断头取脑,?20 ℃冷冻30 min,以1.5~2 mm厚度进行冠状面切片。置于TTC染液玻璃皿中,37 ℃避光孵育30 min,吸出多余的TTC染液,倒入4%多聚甲醛固定过夜,相机拍照后用Image J软件进行分析,记录脑梗死面积(灰白色)及全脑面积(红色),计算脑梗死体积率[15]。 脑梗死体积率=(脑梗死面积×厚度)/(全脑面积×厚度) 2.4 HE染色观察脑组织病理变化 大鼠麻醉,断头取脑,4%多聚甲醛固定24 h,沉糖1周,石蜡包埋,以4 μm厚度行冠状切片,HE染色后于光学显微镜下进行观察与拍照。 2.5 TUNEL荧光染色观察脑组织细胞凋亡情况 将石蜡切片标本进行脱蜡、复水、抗原修复以及H2O2封闭,按照TUNEL凋亡检测试剂盒说明书进行TUNEL染色,并使用DAPI对细胞核进行复染。封片后置于荧光显微镜下观察与拍照,并计算细胞凋亡率。 细胞凋亡率=TUNEL阳性细胞数/DAPI阳性细胞数 2.6 JC-1探针检测脑缺血半暗带组织线粒体膜电位情况 取脑缺血半暗带组织,经300目钢网研磨、滤过到60 mm培养皿中,将滤过后的组织悬液转入15 mL新离心管中。加入Hank平衡盐溶液稀释至10 mL,反复吹打30次,冰上静置5 min,取上清液至15 mL新离心管中。滤过2次,滤液经1 000 r/min离心10 min,弃上清,加入Hank平衡盐溶液重悬,离心后弃上清。加入1 mL Hank平衡盐溶液重悬,细胞计数板计数,并调整细胞密度为1×106个/mL。取200 μL细胞,重悬于0.5 mL细胞培养液中。按照试剂说明书进行染色,流式细胞仪上机检测,以红绿荧光的比值表示线粒体膜电位变化。 2.7 透射电镜观察脑缺血半暗带组织超微结构 取缺血半暗带脑组织,剪成1 mm3小块,经PBS漂洗、4 ℃固定(2.5%戊二醛,12 h)、PBS漂洗、固定(1%锇酸,2 h)、PBS漂洗、丙酮脱水(30%、50%、70%、80%、95%、100%)、渗透包埋(Epon812)、超薄切片、染色(醋酸双氧铀和柠檬酸铅)后,在透射电子显微镜下采集图像分析。 2.8 ELISA检测脑缺血半暗带组织匀浆中MDA水平和SOD、GSH-Px活性 取缺血半暗带脑组织匀浆,按照试剂盒说明书进行操作,采用酶标仪测量吸光度(A)值,并计算MDA水平和SOD、GSH-Px活性。 2.9 qRT-[url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url]检测脑缺血半暗带组织Caspase-3、Bcl-2和Bax mRNA表达 取缺血半暗带脑组织,Trizol法提取总RNA,紫外分光光度计测定总RNA浓度。利用逆转录试剂盒Superscript III将RNA反转录成cDNA,加入引物,以β-actin为内参,荧光定量[url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url]仪扩增,采用2???Ct法计算缺血半暗带Caspase-3、Bcl-2和Bax mRNA表达水平。 图片 2.10 Western blotting检测脑缺血半暗带组织Caspase-3、Bcl-2和Bax蛋白表达 取缺血半暗带脑组织,加入裂解液提取蛋白,采用BCA试剂盒测定蛋白浓度。蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,于5%牛血清白蛋白中封闭,分别加入Caspase-3、Bcl-2、Bax抗体(1∶1 000),4 ℃孵育过夜,洗膜后,加入二抗(1∶20 000),37 ℃孵育1 h。滴加ECL混合液反应4 min后,采用化学发光成像系统显影并对条带灰度值进行分析。 2.11 统计学分析 采用SPSS 20.0软件进行数据分析,正态分布计量资料以表示,非正态分布计量资料以M(P25~P75)表示。多组间均数比较,服从正态分布与方差齐者,采用单因素方差分析(One-way ANOVA),两两比较采用LSD检验;不服从正态分布者,采用Kruskal-Wallis检验。 3 结果 3.1 Sul-F对MCAO大鼠神经功能评分的影响 如表2所示,与假手术组比较,模型组大鼠神经功能评分显著升高(P<0.01);与模型组比较,依达拉奉组和Sul-F高剂量组大鼠神经功能评分均显著降低(P<0.01),Sul-F低剂量组神经功能评分无显著变化;依达拉奉组与Sul-F高剂量组比较,神经功能评分无统计学差异。 图片 3.2 Sul-F对MCAO大鼠脑梗死体积的影响 如图1-A、B所示,与假手术组比较,模型组大鼠脑梗死体积率显著升高(P<0.01);与模型组比较,依达拉奉组和Sul-F高剂量组大鼠的脑梗死体积率显著降低(P<0.05);依达拉奉组与Sul-F高剂量组比较差异无统计学意义。 图片 3.3 Sul-F对MCAO大鼠脑缺血半暗带病理损伤与细胞凋亡的影响 如图1-C所示,假手术组大鼠脑缺血半暗带神经细胞形态结构正常,结构致密,核仁清晰;模型组脑缺血半暗带神经细胞肿胀,空泡增多,细胞核大小不一,形态不规则,核固缩偏于细胞一侧,部分核溶解。与模型组比较,依达拉奉组与Sul-F高剂量组脑缺血半暗带组织病理损伤情况明显改善,Sul-F低剂量组脑缺血半暗带组织病理损伤情况无明显改善。 如图1-D、E所示,与假手术组比较,模型组脑缺血半暗带TUNEL阳性细胞数显著增多(P<0.01);与模型组比较,各给药组TUNEL阳性细胞数显著降低(P<0.01);依达拉奉组与Sul-F高剂量组比较,TUNEL阳性细胞数无统计学差异。 3.4 Sul-F对MCAO大鼠脑缺血半暗带线粒体膜电位变化的影响 如图2所示,与假手术组比较,模型组大鼠脑缺血半暗带线粒体膜电位显著降低(P<0.01);与模型组比较,依达拉奉组和Sul-F高剂量组线粒体膜电位显著升高(P<0.05),两组之间比较无明显差异。 图片 3.5 Sul-F对MCAO大鼠脑组织超微结构的影响 如图3所示,假手术组大鼠脑组织线粒体丰富,分布均匀,线粒体嵴清晰可见,未见明显损伤的线粒体,无典型的线粒体自噬结构。模型组线粒体总体数量减少,线粒体嵴不清晰、水肿,可见典型自噬小体形成。与模型组比较,依达拉奉组线粒体数量增多,大部分线粒体嵴清晰,偶见线粒体自噬结构;Sul-F低剂量组线粒体数量增多,一部分线粒体嵴清晰,另一部分线粒体水肿,可见典型自噬小体形成;Sul-F高剂量组线粒体数量增多,大部分线粒体嵴清晰,偶见线粒体自噬结构。 图片 3.6 Sul-F对MCAO大鼠脑缺血半暗带组织氧化应激水平的影响 如图4所示,与假手术组比较,模型组大鼠脑缺血半暗带区组织MDA水平显著升高(P<0.01),SOD和GSH-Px活性显著降低(P<0.01);与模型组比较,各给药组MDA水平显著降低(P<0.05、0.01),SOD活性显著升高(P<0.01);Sul-F高剂量组GSH-Px活性显著升高(P<0.01)。 图片 3.7 Sul-F对MCAO大鼠脑缺血半暗带组织Bcl-2、Bax和Caspase-3 mRNA和蛋白表达的影响 如图5所示,与假手术组比较,模型组大鼠缺血半暗带区Caspase-3和Bax mRNA表达水平显著升高(P<0.01),Bcl-2 mRNA表达水平显著降低(P<0.01);与模型组比较,各给药组大鼠缺血半暗带区Caspase-3和Bax mRNA表达水平显著降低(P<0.01),Bcl-2 mRNA表达水平显著升高(P<0.01);与依达拉奉组比较,Sul-F高剂量组大鼠缺血半暗带区Caspase-3、Bax和Bcl-2 mRNA表达水平无显著差异。 图片 如图6所示,与假手术组比较,模型组大鼠缺血半暗带区Caspase-3和Bax蛋白表达水平显著升高(P<0.01),Bcl-2蛋白表达水平显著降低(P<0.01);与模型组比较,各给药组大鼠缺血半暗带区Caspase-3和Bax蛋白表达水平显著降低(P<0.01),Bcl-2蛋白表达水平显著升高(P<0.01);与依达拉奉组比较,Sul-F高剂量组大鼠缺血半暗带区Caspase-3、Bax和Bcl-2蛋白表达水平无显著差异。 图片 4 讨论 缺血性脑卒中占所有脑卒中的80%~85%,具有较高的致死率和致残率[16]。目前,缺血性脑卒中的治疗手段有机械取栓和药物溶栓,以尽快恢复脑血流、挽救缺血脑组织,但复流复氧可能加重脑组织损伤[3,17]。脑I/R损伤会引发一系列的病理反应,如离子失衡、细胞膜通透性改变、能量代谢障碍等,最终触发凋亡程序,引发细胞凋亡。细胞凋亡涉及线粒体通路和死亡受体通路,其中线粒体通路是启动凋亡程序的关键。因此,改善线粒体功能、保护神经元是治疗脑I/R损伤的关键。 正常情况下,线粒体产生的自由基及其清除处于动态平衡,在缺血等应激条件下,ROS生成过多,氧化还原平衡受损线粒体膜脂质过氧化和结构破坏,造成线粒体功能紊乱和氧化应激损伤[17]。SOD与GSH-Px是机体抗氧化酶系统的重要物质,通过清除线粒体ROS来减轻氧化应激损伤。线粒体膜电位(mitochondrial membrane potential,MMP)是由三羧酸循环产生的能量传递给电子并经呼吸链传递过程中,将质子从线粒体内膜的基质侧泵到内膜外所形成的跨膜电位差,MMP的下降是线粒体氧化应激损伤的早期指标[18]。本研究显示,在脑I/R损伤时,脑组织线粒体受损,主要表现有线粒体肿胀变形、线粒体嵴结构不清,可见线粒体自噬小体。同时,线粒体膜电位显著下降,氧化应激反应被激活,MDA含量显著升高,SOD和GSH-Px活力显著降低。 线粒体途径作为细胞凋亡的关键途径,主要受到Bcl-2家族和Caspase家族相关基因的调控。线粒体功能受损产生大量ROS,ROS过度累积会触发线粒体膜通透性转换孔打开,线粒体膜电位下降[19]。Bcl-2家族蛋白通过调节线粒体外膜通透性在细胞内凋亡信号转导中发挥重要作用。Bax和Bcl-2是Bcl-2家族的主要成员,二者通常以异源二聚体的形式存在。MMP升高时,Bcl-2表达上调,抑制细胞色素C释放以维持线粒体平衡,当Bax高表达时,MMP降低,线粒体中的细胞色素C释放入胞质中,在三磷酸腺苷(adenosine triphosphate,ATP)和dATP的协助下生成凋亡复合物,招募并启动Caspase-9,Caspase-9解体形成cleaved Caspase-9并进一步启动Caspase-3,激活下游Caspase级联瀑布,启动线粒体介导的细胞凋亡[20-21]。Caspase-3是Caspase家族中参与细胞凋亡的关键酶,可导致线粒体膜通透性增加、DNA断裂和染色质浓缩,可能是缺血性神经元核降解的关键执行者[17]。本研究中,脑I/R损伤使促凋亡基因Bax表达显著上调,抑凋亡基因Bcl-2表达显著下调,Caspase-3表达显著上调,提示脑I/R损伤时,线粒体介导的细胞凋亡途径启动。 芒柄花素是经典名方补阳还五汤君药黄芪的活性成分之一。体外研究发现,芒柄花素能够抑制多腺苷二磷酸核糖聚合酶1/凋亡诱导因子/蛋白激酶B(poly-adenosine diphosphate ribose polymerase/ apoptosis inducing factor/protein kinase B,PARP1/ AIF/Akt)信号通路减轻糖氧剥夺/复氧复糖条件下HT22小鼠神经元细胞损伤[22]。为提高其水溶性和生物利用度,经磺化反应合成芒柄花素磺酸钠。前期研究证实,Sul-F能够通过血脑屏障、低毒[23-25]。本研究发现,Sul-F能够减低脑I/R损伤大鼠的神经功能评分、降低脑梗死体积、减轻脑缺血半暗带的病理损伤及细胞凋亡,进而改善脑I/R损伤。 线粒体功能障碍是脑缺血再灌注诱导神经元死亡的标志之一[26],因此机制研究旨在探讨Sul-F对线粒体介导的细胞凋亡途径的影响。结果显示,Sul-F能够降低脑组织氧化应激水平,部分逆转线粒体膜电位的降低,改善线粒体超微结构损伤,调节Bcl-2/Bax平衡,降低Caspase-3表达,进而抑制线粒体凋亡途径,降低细胞凋亡,对脑I/R损伤具有潜在的治疗价值。 本研究以大鼠大脑中动脉栓塞模型模拟脑I/R损伤,结果显示Sul-F干预能够降低脑组织氧化应激水平,部分逆转线粒体膜电位的降低,改善线粒体超微结构损伤,降低细胞凋亡,改善脑梗死体积和神经功能评分。进一步研究发现,Sul-F能够降低Bax表达、升高Bcl-2表达,降低下游Caspase-3表达,抑制线粒体凋亡信号通路。综上,Sul-F通过调控Bcl-2/Bax平衡,降低线粒体介导的细胞凋亡,改善脑缺血再灌注损伤。
乳腺癌是世界范围内女性最常见的致死性恶性肿瘤,据统计,2020年女性乳腺癌已超越肺癌成为全球癌症发病率最高的癌种[1-2]。其中三阴性乳腺癌(triple-negative breast cancer,TNBC)是雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)和人表皮生长因子受体2(human epidermal growth factor receptor 2,HER-2)均呈阴性表达的乳腺癌亚型,占所有乳腺癌的15%~20%[3],具有侵袭力强、转移率高、术后复发率高、预后差的特点[4]。由于TNBC内分泌治疗的不确定性及靶向治疗的不应答性,导致临床上的治疗效果不理想[5-6]。因此,寻找有效抑制TNBC增殖转移的药物、降低患者的病死率一直是乳腺癌基础研究的一个重要方向[7-8]。 石蒜碱是石蒜Lycoris radiata (L'Hér.) Herb.、文殊兰Crinum asiaticum L. var. sinicum (Roxb. et Herb.) Baker、朱顶红Hippeastrum rutilum (Ker.-Gawl.) Herb.等石蒜属植物鳞茎中含量较高的异喹啉类生物碱,具有抗肿瘤、抗病毒、抗菌、抗炎镇痛、保肝等药理活性[9-10],近年来石蒜碱的抗肿瘤作用受到众多研究者的关注。有文献报道石蒜碱对人乳腺癌MCF-7细胞[11]、人宫颈癌Hela细胞[12-13]、人肝癌HepG-2细胞[13-16]、人胃癌SGC-7901细胞[17]、人结肠腺癌LoVo细胞[18-19]具有显著的抑制作用,但对其作用机制的研究仍然处于初始阶段。本研究以人乳腺癌MDA-MB-231细胞为研究对象,主要通过体外实验从细胞水平和分子水平探讨石蒜碱对MDA-MB-231细胞的体外抑制活性及其通过线粒体氧化损伤诱导肿瘤细胞自噬及凋亡的机制,为今后石蒜碱抗肿瘤新药的深入研发和临床实践提供理论基础和实验参考。 1 材料 1.1 细胞株 MDA-MB-231细胞由国家教育部抗肿瘤天然药物工程技术研究中心提供。 1.2 药品与试剂 石蒜碱(批号34296,质量分数98%)购自阿拉丁试剂有限公司;胎牛血清(批号0201021)购自浙江杭天生物科技公司;RPMI 1640细胞培养基(批号AD123707271)购自美国HyClone公司;二甲基亚砜(dimethyl sulfoxide,DMSO,批号20200901)购自天津中和盛泰化工有限公司;Hoechst 33258染液(批号C1011)、SDS-PAGE蛋白上样缓冲液(批号P0015)、吉姆萨染液(批号C0131)、CCK-8试剂盒(批号C0043)、活性氧(reactive oxygen species,ROS)检测试剂盒(批号S0033S)、PMSF(批号ST505)、HRP标记的山羊抗大鼠IgG二抗(批号A0192)、Western blotting及IP细胞裂解液(批号072318180723)、30% Acr-Bis(批号093018181017)购自碧云天生物技术研究所;碘化丙啶(propidium iodide,PI)染液(批号R20285)、Rhodamine 123(批号R8004)购自美国Sigma公司;台盼蓝(批号72-52-1)购自美国默克公司;Reagent A染液(批号5000113)购自北京诺博莱德科技有限公司;聚山梨酯20(批号20190207)购自美国Biotopped公司;Tris(批号181127)购自美国Amresco公司;兔抗半胱氨酸天冬氨酸蛋白酶-3(cystein-asparate protease-3,Caspase-3)抗体(批号WL02512)、兔抗B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)抗体(批号WL01506)、兔抗Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)抗体(批号WL02385)、兔抗细胞色素C(cytochrome-C,Cyt-C)抗体(批号WL04963)、兔抗甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体(批号WL01114)购自沈阳万类生物科技有限公司;兔抗线粒体内膜转位酶(translocase of inner membrane,TIM)抗体(批号PSI-RF16109)、兔抗线粒体外膜转位酶(translocase of outer membrane,TOM)抗体(批号PSI57577)、兔抗E3泛素连接酶(E3 ubiquitin protein ligase,PARKIN)抗体(批号PSI50248)、兔抗PTEN诱导的激酶1(PTEN induced putative kinase 1,PINK1)抗体(批号PSI7859)、兔抗微管相关蛋白轻链3(microtubule-associated protein light chain 3,LC3-B)抗体(批号BS79705)、兔抗p62抗体(批号p196-269)购自艾美捷科技有限公司。 1.3 仪器 ECO-170P-230型细胞培养箱、Model 680型酶标仪(美国NBS公司);Adventurer型万分之一电子天平(美国OHAUS公司);EPICS-XL型流式细胞仪、AllegraTM 64R型低温高速离心机(美国Beckman-Coulter公司);CKX-41-32型倒置显微镜(日本Olympus公司);荧光显微镜、TCS-SP2激光共聚焦扫描显微镜(德国Leica公司);680型全自动酶标仪(美国Bio-Rad公司);P型微量[url=https://insevent.instrument.com.cn/t/9p][color=#3333ff]移液器[/color][/url](芬兰百得公司);标准型PB-10 pH计(德国Sartorius公司);GIS-2019型Tannon凝胶成像系统(天能科技有限公司);DYY-7C型电泳仪、M344039型垂直电泳转印槽(北京六一仪器厂)。 2 方法 2.1 细胞培养 MDA-MB-231细胞复苏后接种于含10%胎牛血清的RPMI 1640培养基中,置于5% CO2、37 ℃恒温培养箱中培养,待细胞长势良好时进行传代,取对数生长期的细胞进行实验。 2.2 CCK-8法检测细胞增殖活性 MDA-MB-231细胞以2×103个/孔接种于96孔板中,细胞培养24 h后,给药组每孔加入不同浓度(2、4、8、16、32 μmol/L)的石蒜碱100 μL,对照组加入100 μL细胞培养基,每组均设置6个平行孔,处理48 h后,每孔加入10 μL CCK-8试剂,继续培养4 h。采用酶标仪检测490 nm处的吸光度(A)值,计算各组细胞的增殖抑制率与石蒜碱对MDA-MB-231细胞的半数抑制浓度(half inhibitory concentration,IC50)。 2.3 倒置显微镜、荧光显微镜、激光共聚焦扫描显微镜观察细胞形态变化 MDA-MB-231细胞以3×103个/孔分别接种于2块6孔板中,细胞培养24 h后,根据石蒜碱对MDA-MB-231细胞的IC50设定3个给药剂量,分别以3、6、12 μmol/L的给药浓度每孔加入石蒜碱1 mL,对照组加入1 mL细胞培养基,继续处理48 h。取1块板用倒置显微镜观察并拍照后,每孔加入1 mL多聚甲醛固定1 h,冲洗后加入200 μL Hoechst 33258染液,37 ℃孵育30 min后,用荧光显微镜观察并拍照;取另1块板收集各组细胞,用预冷的PBS重悬细胞并弃去上清液,加入Annexin V-FITC于37 ℃避光孵育15 min,冲洗后加入PI染液于4 ℃避光孵育15 min后,用激光共聚焦扫描显微镜观察并拍照。 2.4 集落实验检测细胞克隆能力 MDA-MB-231细胞以1×103个/孔接种于6孔板中,细胞培养24 h后,按“2.3”项下方法对细胞进行分组和给药,连续培养7 d后弃去培养基。PBS洗涤后用甲醇固定10 min,冲洗后加入吉姆萨染液染色后,用倒置显微镜观察细胞集落形成率并拍照。 2.5 划痕实验检测细胞迁移能力 MDA-MB-231细胞以1×105个/孔接种于6孔板中,细胞培养24 h,细胞融合至70%~80%后,用200 μL[url=https://insevent.instrument.com.cn/t/9p][color=#3333ff]移液器[/color][/url]倚靠直尺,枪头垂直于每孔底部竖直划痕。PBS冲洗后,按“2.3”项下方法对细胞进行分组和给药,培养48 h后,用倒置显微镜观察细胞的迁移情况并拍照记录,比较各组间的划痕宽度,使用Image J软件测量并计算划痕愈合率。 2.6 流式细胞仪检测细胞凋亡率 按“2.3”项下方法对细胞进行分组和给药,培养48 h后,收集各组细胞,加入70%冷乙醇2 mL于4 ℃固定24 h后离心。弃去上清液,PBS冲洗后,加入800 μL PI染液,4 ℃避光孵育30 min,经尼龙网滤过后,采用流式细胞仪进行检测,激发波长为488 nm。 2.7 流式细胞仪检测ROS水平 按“2.3”项下方法对细胞进行分组和给药,培养48 h,收集各组细胞,PBS洗涤后加入5 μmol/L DCFH-DA染液0.2 mL,37 ℃避光孵育20 min,经尼龙网滤过后,采用流式细胞仪进行检测。 2.8 流式细胞仪检测线粒体膜电位 按“2.3”项下方法对细胞进行分组和给药,培养48 h后,收集各组细胞,PBS洗涤后,避光加入Rhodamine 123染料,避光孵育30 min后离心弃去上清液,用PBS洗涤并混匀细胞,经尼龙网滤过后,采用流式细胞仪进行检测。 2.9 激光共聚焦扫描显微镜检测线粒体膜通透性转换孔(mitochondrial permeability transition pore,MPTP)活性 按“2.3”项下方法对细胞进行分组和给药,培养48 h后,收集各组细胞,加入37 ℃预热的Reagent A染液500 μL,离心后弃去上清液。37 ℃避光加入染色工作液,混匀后孵育20 min,离心去除上清液,将细胞吹打混匀后,经尼龙网滤过,采用激光扫描共聚焦显微镜检测并进行拍照。 2.10 Western blotting检测线粒体自噬相关蛋白TIM、TOM、PARKIN、PINK1、LC3-B、p62和凋亡相关蛋白Caspase-3、Bax、Bcl-2、Cyt-C表达 按“2.3”项下方法对细胞进行分组和给药,培养48 h后,收集各组细胞,加入含PMSF的细胞裂解液,冰上裂解30 min后将细胞加入EP管中,离心15 min。取上清液,煮沸使蛋白变性,采用BCA试剂盒定量蛋白浓度。采用SDS-PAGE凝胶电泳,转至PVDF膜,5%脱脂奶粉封闭2 h后,加入一抗,4 ℃孵育过夜。TBST洗膜后加入二抗,37 ℃孵化2 h,洗膜后加入化学发光试剂,采用凝胶成像系统拍照并进行分析。 2.11 统计学分析 用SPSS 21.0软件进行统计分析,数据以表示,多样本均数比较采用One-way ANOVA分析,通过Graphpad Prism 8软件绘图。 3 结果 3.1 石蒜碱对MDA-MB-231细胞增殖的影响 如图1所示,石蒜碱对MDA-MB-231细胞具有显著的增殖抑制作用(P<0.01),且呈浓度相关性。石蒜碱对MDA-MB-231细胞的IC50为6.21 μmol/L,并参考IC50值设定后续石蒜碱给药浓度分别为3、6、12 μmol/L。 3.2 石蒜碱对MDA-MB-231细胞形态的影响 采用倒置显微镜、荧光显微镜、激光共聚焦显微镜观察石蒜碱对MDA-MB-231细胞形态的影响,如图2所示,与对照组比较,石蒜碱给药后,随着给药浓度增加,细胞生长逐渐变稀疏,细胞膜破裂现象更加明显,细胞间轮廓更加模糊,细胞核固缩形成凋亡小体,发出较强荧光。 3.3石蒜碱对MDA-MB-231细胞克隆、迁移的影响 集落实验结果表明,石蒜碱可以抑制MDA-MB-231细胞的克隆能力(图3-A),且随着浓度的增加细胞集落数量逐渐减少,且呈浓度相关性。划痕实验结果显示,石蒜碱可以显著抑制MDA-MB-231细胞的迁移能力(P<0.01,图3-B、C),呈剂量相关性。 3.4 石蒜碱对MDA-MB-231细胞凋亡率、ROS水平的影响 如图4-A、B所示,经流式细胞仪PI单染法检测出现明显的凋亡峰,表明DNA的合成受到抑制,且随着给药浓度增加,凋亡峰越明显,凋亡率也呈上升趋势,与对照组比较有显著性差异(P<0.01),且呈浓度相关性。如图4-C、D所示,随着给药浓度增加,细胞内ROS水平逐渐升高,具有显著性差异(P<0.01),且呈浓度相关性。 3.5 石蒜碱对MDA-MB-231细胞线粒体膜电位和MPTP的影响 如图5-A、B所示,经流式细胞仪检测,随着石蒜碱给药浓度增加,细胞内线粒体膜阳性表达率逐渐降低,具有显著性差异(P<0.01),且呈浓度相关性。如图5-C、D所示,应用激光扫描共聚焦显微镜结合AM染色技术对不同浓度的石蒜碱作用48 h后的MDA-MB-23细胞进行检测,激光扫描共聚焦显微镜扫描得到的荧光象素强度反映出细胞膜通透性的改变,随着给药浓度增加,细胞内线粒体膜通透性逐渐升高,具有显著性差异(P<0.01),且呈浓度相关性。 3.6 石蒜碱对MDA-MB-231线粒体自噬和凋亡相关蛋白表达的影响 应用凝胶成像系统分析MDA-MB-231细胞中线粒体自噬和凋亡相关蛋白表达的情况。如图6所示,随着石蒜碱浓度增加,细胞自噬相关蛋白TIM、TOM和p62蛋白表达量逐渐降低,PARKIN、PINK1和LC3-B蛋白表达量逐渐升高,均具有显著性差异(P<0.01)。如图7所示,随着石蒜碱浓度增加,细胞凋亡相关蛋白Bcl-2蛋白表达量逐渐降低,Bax、Caspase-3和Cyt-C蛋白表达量逐渐升高,均具有显著性差异(P<0.01)。 4 讨论 乳腺癌已成为全球最常见的恶性肿瘤,与乳腺癌的其他分子亚型相比,TNBC最具侵袭性和高度异质性[20-22],使其在临床上难以得到有效治疗。因此如何有效抑制TNBC侵袭、增殖和转移是目前亟待解决的问题。近年来,有研究表明中药在抗肿瘤方面具有显著的优势[23-25]。石蒜碱是异喹啉类生物碱,广泛分布于石蒜属植物鳞茎中,具有较强的抗肿瘤活性[26-27]。基于石蒜碱的抗肿瘤作用,结合课题组前期研究中TNBC细胞活性筛选,发现石蒜碱对MDA-MB-231细胞较为敏感,故选择MDA-MB-231细胞作为研究对象,本研究结果发现石蒜碱对MDA-MB-231细胞的增殖和迁移具有显著抑制作用,且呈浓度相关性。 ROS水平升高和线粒体功能障碍是诱导肿瘤细胞自噬和凋亡的重要途径[28]。研究发现,过量ROS的产生会诱发肿瘤细胞的损伤、自噬及凋亡并降低细胞的多药耐药性[29]。此外,肿瘤细胞对外源性ROS比正常细胞更敏感且ROS具有一定的细胞毒性。因此,促进ROS水平升高的药物可表现出一定的抗癌活性。有研究表明,线粒体功能障碍与多种恶性肿瘤的发生及ROS的过量产生密切相关[30]。本研究通过激光共聚焦显微镜和流式细胞仪检测结果表明,石蒜碱可以显著提高MDA-MB-231细胞凋亡率和ROS水平,并使线粒体膜电位下降,MPTP开放。这表明石蒜碱诱导细胞自噬和凋亡作用可能与线粒体的氧化损伤有关。 TOM及TIM是线粒体膜蛋白,当线粒体自噬增强时,其细胞内表达水平下降。研究表明线粒体损伤会使线粒体膜电位降低,导致PINK1在线粒体外膜上表达,从而使PINK1-PARKIN依赖性线粒体自噬反应被激活[31]。LC3-B是自噬体形成的特异性标志物,其含量与自噬泡数量成正比,因此被广泛用于监测细胞自噬。p62作为自噬降解的产物,自噬增强,p62水平会下降。p62还可与自噬体膜上的LC3-B蛋白及泛素化的蛋白形成复合物,在自噬溶酶体内完成降解[32]。ROS的过度累积,会触发MPTP开放,导致线粒体膜电位下降,引起Cyt-C从线粒体释放并进入细胞质中,进而激发Caspase的级联反应并启动细胞线粒体凋亡[33]。Bcl-2为抗凋亡蛋白,Bax为促凋亡蛋白,当接收到凋亡刺激信号后可转位至线粒体膜上,Bcl-2和Bax可形成二聚体或多聚体,从而增加细胞线粒体膜的通透性,进一步激活Caspase级联反应,Caspase-3可通过抑制凋亡抑制物,从而破坏细胞结构使蛋白丧失功能[34]。本研究通过Western blotting检测自噬相关蛋白和凋亡相关蛋白的表达,结果显示石蒜碱能够上调PARKIN、PINK1、LC3-B、Caspase-3、Bax和Cyt-C蛋白表达,下调TIM、TOM、p62和Bcl-2蛋白表达,表明石蒜碱可通过线粒体的氧化损伤介导MDA-MB-231细胞的自噬及凋亡。 综上,石蒜碱对MDA-MB-231细胞具有生长抑制作用,并可通过调控线粒体氧化损伤介导MDA-MB-231细胞的自噬及凋亡。本研究为石蒜碱抗肿瘤新药的深入研发和临床实践提供理论基础。
一、实验目的1、掌屋凋亡细胞的形态特征 2、学会用荧光探针对细胞进行双标记来检测正常活细胞、凋亡细胞和坏死细胞的方法二、实验原理 细胞死亡根据其性质、起源及生物学意义区分为凋亡和坏死两种不同类型。凋亡普遍存在于生命界,在生物个体和生存中起着非常重要的作用。它是细胞在一定生理条件下一系列顺序发生事件的组合,是细胞遵循一定规律自己结束生命的自主控制过程。细胞凋亡具有可鉴别的形态学和生物化学特征。在形态上可见凋亡细胞与周围细胞脱离接触,细胞变园,细胞膜向内皱缩、胞浆浓缩、内质网扩张、细胞核固缩破裂呈团块状或新月状分布、内质网和细胞膜进一步融合将细胞分成多个完整包裹的凋亡小体,凋亡小体最后被吞噬细胞吞噬消化。在凋亡过程中细胞内容物并不释放到细胞外,不会影响其它细胞,因而不引起炎症反应。在生物化学上,多数细胞凋亡的过程中,内源性核酸内切酶活化,活性增加。核DNA随机地在核小体的连接部位被酶切断,降解为180-200bp或它的整倍数的各种片断。如果对核DNA进行琼脂糖电泳,可显示以180-200bp为基数的DNA ladder(梯状带纹)的特征。相比之下,坏死是细胞处于剧烈损伤条件下发生的细胞死亡。细胞在坏死早期即丧失质膜完整性,各种细胞器膨胀,进而质膜崩解释放出其中的内容物,引起炎症反应,坏死过程中细胞核DNA虽也降解,但由于存在各种长度不等的DNA片断,不能形成梯状带纹,而呈弥散状。一些温和的损伤刺激及一些抗肿瘤药物可诱导细胞凋亡,通常这些因素在诱导凋亡的同时,也可产生细胞坏死,这取决于损伤的剧烈程度和细胞本身对刺激的敏感程度。三尖杉酯碱(HT)是我国自行研制的一种对急性粒细胞白血病,急性单核白血病等有良好疗效的抗肿瘤药物。研究表明HT在0.02~5μg/ml范围内作用2小时,即可诱导HL-60细胞凋亡,并表现出典型的凋亡特征。本实验用1μg/ml HT在体外诱导培养的HL-60细胞发生凋亡,同时也有少数细胞发生坏死。用Hoechst33342和碘化丙啶(propidium iodide,PI)对细胞进行双重染色,可以区别凋亡、坏死及正常细胞。细胞膜是一选择性的生物膜,一般的生物染料如PI等不能穿过质膜。当细胞坏死时,质膜不完整,PI就进入细胞内部,它可嵌入到DNA或RNA中,使坏死细胞着色,凋亡细胞和活细胞不着色。而一些活细胞染料由于为亲脂性物质,可跨膜进入活细胞,因而可进行活细胞染色。Hoechst33342是一种活性荧光染料且毒性较弱,它是双苯并咪唑的一种衍生物。与DNA特异结合(主要结合于A-T)碱基区),显示凋亡细胞和活细胞。凡是看到有凋亡小体的细胞都是凋亡细胞。三、实验用品1、试剂:三尖杉酯碱(HT),300μg/ml,100mmol/L Tris-HCl(pH7.5),5mol/L EDTA缓冲液、碱性裂解液:0.2mol/L NaOH, 1%SDS、醋酸钠:3mol/L KAc(pH4.8);异丙醇;70%乙醇;溴酚蓝,蔗糖指示剂。TBE电泳缓冲液,1%琼脂糖,溴乙锭。PI母液:500μg/ml;Ho33342母液:2mmol/L。 2、仪器设备:荧光显微镜,电泳仪,电泳槽,微量加样器(1ml,100μl)0.5、1.5ml离心管,载玻片,盖玻片。四、实验材料人早幼粒白血病HL-60细胞,用含10%小牛血清的RPMI1640培养基在37℃,5%CO2条件下培养。五、方法步骤 1、三尖杉酯碱诱发HL-60细胞凋亡 (1)实验前约24小时,接种两瓶HL-60细胞,标记①、②,每瓶含约6ml培养液,置37℃,5%CO2培养箱培养。 (2)实验前约2.5小时,当细胞密度达到70%,①号瓶加入三尖杉酯碱200μl,使终浓度为1μg/ml,②号瓶中加入同等量PBS(pH7.4)作对照。共同放入培养箱中继续培养2.5小时。2、Ho33342和PI双重染色鉴别三种细胞 (1)染色:将瓶中的细胞摇匀取200μl于1.5ml的离心管中,加入Ho33342母液2μl,PI 20μl,染色15分钟。 (2)滴片:取一载玻片用双面胶围成一小室,从离心管中各取以上染色后的细胞悬液10μl,加入小室内盖上盖玻片,荧光镜下用紫外激发光,高倍镜下观察,区别三种细胞,并注意三者比例。六、注意事项1、诱导培养HL-60细胞时间要准确; 2、荧光显微镜下观察细胞时,由于荧光易碎灭,观察时要尽量快。
摘要激光扫描共聚焦显微镜作为80年代发展起来的一种高精度分子细胞生物学分析仪器,具有组织细胞断层扫描、活细胞动态荧光监测、三维图像重建、共聚焦图像定量分析等先进功能,在近年的细胞凋亡这一研究热点中得到了大量创造性的应用。本文拟就对激光扫描共聚焦显微镜在凋亡的形态学、分子水平变化及重要生理过程三方面研究中的应用及其成果做一综述。细胞凋亡(apoptosis)是不同于细胞坏死的一种细胞主动死亡方式,并由特定的基因控制。凋亡细胞在形态上出现变圆皱缩、染色质浓缩边集、核碎裂、凋亡小体形成等变化,并最终由非炎症过程清除。由于细胞凋亡独特地影响着机体的细胞发育和代谢,在监测和清除肿瘤细胞与突变细胞等方面也可能发挥重要的作用,近年来受到了细胞生物学、分子生物学、免疫学等多学科的广泛关注。激光扫描共聚焦显微镜(laser scaing confocal microscopy, LSCM)是80年代发展起来的一种高精度分子细胞生物学分析仪器,辅以各类免疫荧光探针或荧光染料与被测物质特异性结合,不仅可观察固定的细胞组织切片,还可对活细胞的结构、分子和离子进行实时动态地观察和检测。在细胞凋亡的研究中,激光扫描共聚焦显微镜已被广泛地应用于形态学、分子水平监测及重要生理改变等各方面,其中不乏新颖之处,并获得了大量成果,以下将就此做一简单的介绍。激光扫描共聚焦显微镜与凋亡的形态学激光扫描共聚焦显微镜用点光源扫描标本的光学横断面,以代替普通光学显微镜所使用的场光源,并用探测针孔滤去离焦光线,所以消除了来自焦平面以外的衍射或散射光的干扰,可实现高清晰、高分辨率的组织细胞断层扫描。并且由于激光扫描共聚焦显微镜采用数字化成像,因而辅以一定的软件就能对图像进行定量分析及三维重建等操作。过去对细胞凋亡的形态学研究方法局限于活性细胞和组织切片染色、荧光镜观察,或者石蜡切片原位末端标记法。由于普通光镜的分辨率和清晰度有限,而电镜又显然不适合对凋亡这一复杂动态过程的监测,激光扫描共聚焦显微镜的应用使人们对细胞凋亡的形态学观察分析提高到了一个前所未有的新水平。细胞核核膜的破坏对于染色质聚集并形成凋亡小体起重要作用。lamin是构成核片层的蛋白质,位于核膜的内表面,由caase-6介导的lamin裂解可影响核膜的完整性。在McCall等的研究中,对果蝇卵子发生晚期的细胞凋亡现象进行了动态观察。以单抗mAb101标记其哺育细胞核内膜的laminDm0(哺乳类laminB的同源体),用激光扫描共聚焦显微镜加以观察。正常哺育细胞到11期时,染色的lamin呈弥散的雾状分布并围绕核周,而dcp-1GLC哺育细胞即使到了较晚的14期时,仍然显示界线明确的染色。可见dcp-1突变体在核lamin蛋白的酶切或解聚方面存在缺陷。细胞器Li 等在对C(6)-酰基鞘氨醇诱导胞内囊泡产生的研究中,在不产生中毒效应的情况下,加入10microM C(6)-酰基鞘氨醇以诱导鼠纤维母细胞(3T3-L1和3T3-F442A)凋亡。观察到囊泡的形成与C(6)-酰基鞘氨醇的诱导呈时间依从和剂量依从关系。大量小泡在其加入后8小时内出现,并且随时间而增大;大泡最终分布在核周,而小泡分布在细胞边缘。用抗-溶酶体膜蛋白抗体和共聚焦免疫荧光显微分析,证明增大的囊泡为晚期内吞体/溶酶体。另外,胞内的细胞器都有其适用的荧光探针,如高尔基复合体常用的探针有Dceramide、BODIPY ceramide等,内质网常用的有Dil、DiOC6等,经标记均可进行精细的观察。当然,激光扫描共聚焦显微镜在形态学中的优势更在于其对图像的三维重建功能,从而揭示过去只能在平面上显现的凋亡细胞在三维空间中的结构;而对细胞凋亡的动态过程,它可以用三维加时间的四维方式进行观察,来获取最逼真的形态学资料。凋亡过程中一些特征性的三维形态变化正期待着进一步具体的工作去发现。激光扫描共聚焦显微镜对凋亡细胞的分子水平监测随着分子生物学突飞猛进的发展,关于细胞凋亡分子机制的研究已有了很大的突破。细胞凋亡的信号传递途径及其调控涉及到大量的酶级联反应、生物大分子的空间转移等。而激光扫描共聚焦显微镜以其定性、定量、定时的优点,结合众多荧光探针的应用,成为了研究细胞凋亡分子水平变化的有力手段。DNA大分子DNA断裂以及染色质的异常凝聚,是细胞凋亡的关键,同时也是细胞核在细胞凋亡中具有标志性的变化。Columbara等报道将激光扫描共聚焦显微镜与原位TdT和Poll免疫荧光技术相结合,进而确定双链和单链DNA的断裂点。而在对细胞凋亡和细胞坏死区别的研究中,Kreel等在培养的K562细胞中加入放线菌素D以诱导凋亡,并对细胞的DNA片段进行了3’-末端标记。经激光扫描共聚焦显微镜观察发现K562细胞凋亡早期有大量DNA片段出现,且DNA片段弥散分布于除核仁外的细胞核区。伴随着凋亡的进展,细胞核内出现大量高标记密度的圆形小体。而采用NaN3或快速冻融法使细胞坏死,经激光扫描共聚焦显微镜观察证实,在坏死开始阶段并无DNA片段的出现,至少在坏死发生24小时后才有DNA片段产生。Caase家族Caases是一组高度保守的半胱氨酸蛋白酶,目前发现有11个成员。多数细胞凋亡是以Caase家族蛋白的激活并作用于其关键底物而实现的,而caases激活的关键又在于该家族蛋白间的级联反应,因此caases被认为是细胞凋亡的中心环节和执行者,成为研究的热点。Mandal等用激光扫描共聚焦显微镜对细胞凋亡中激活的caase-3的重分布进行了研究。用丁酸处理细胞后,观察到DNA-PKcs的裂解与caase-3的激活成正相关,而Bcl-2的过度表达则可抑制上述两个过程。同时还证明(1)激活后的caase-3重分布到核区,(2)裂解局部的DNA-PKcs和PARP(polyADP-ribosepolymerase,聚腺苷二磷酸核糖多聚酶),(3)裂解产物又被释放到核外的细胞液。caase-3的抑制物四肽DEVD-CHO又可抑制上述的三个连续的步骤。该研究提示:激活的caase-3在核内的重分布构成了丁酸所诱导的细胞凋亡中的一个重要凋亡信号。另外,在用激光扫描共聚焦显微镜对Q79诱导大鼠神经元凋亡的研究中,Sanchez等发现了Q79对caase-8的聚集和激活,而对caase-8的抑制则阻止了被诱导的细胞凋亡;加以Westernblot分析,还建立了caase-8的激活和某些神经退行性疾病(如舞蹈病)的联系。Grazyme丝氨酸蛋白酶grazyme为另一种重要的凋亡信号分子,对某些caase家族蛋白也有激活作用。Trapani等就证明了杀伤淋巴细胞利用穿孔素和grazymeB的协同作用来诱导靶细胞的凋亡,在其研究中通过激光扫描共聚焦显微镜观察到(1)50%细胞的胞核内快速聚集了以FITC荧光标记的grazymeB(最长7分钟,t1/2为2分钟),然后发生凋亡;(2)其它的细胞只有细胞液内有FITC-grazyme B的摄取,避免了凋亡。此间至少在13分钟后才有DNA碎片的出现,说明核内的grazyme B聚集出现在凋亡的执行阶段之前。并且通过对核内液的处理(加入70KDa FITC-dextran),间接观察到grazyme B的转移并非是因为核膜受caases的作用而破损,而是由于穿孔素的协同。其它以上的介绍显示,激光扫描共聚焦显微镜在检测活细胞酶活性动态变化方面有着突出的优势。实际上,对于细胞凋亡的分子机制这样一个极其复杂的课题,激光扫描共聚焦显微镜的应用远不只限于上述的几种离子和大分子,而是渗透到了大量的分枝课题中去。如在对重要的凋亡负调控蛋白Bcl-2的研究中,Beham等利用基因毒性损害(genotoxic damage)诱导细胞凋亡,并以Bcl-2蛋白抑制其凋亡过程。用激光扫描共聚焦显微镜和Immunoblotting观察显示,Bcl-2的作用在于阻止了诱导产生的p53蛋白向核内的转运。而Ohsawa等对独立于caase家族的另一种重要蛋白酶—组织蛋白酶进行了研究,用血清剥夺法诱导PC12细胞凋亡,并用激光扫描共聚焦显微镜监测了其精细超微结构改变过程和细胞内组织蛋白酶B和D的免疫活度的对比变化。又如,在人胰岛淀粉样多肽(hIA)的研究中,Hiddinga等用表达hIA的质粒转染COS-1细胞诱导凋亡,辅以免疫组化染色,用激光扫描共聚焦显微镜证明了hIA在细胞的内质网和高尔基复合体内呈簇状沉积,并与细胞
摘要:细胞凋亡与坏死是两种完全不同的细胞凋亡形式,根据死亡细胞在形态学、生物化学和分子生物学上的差别,可以将二者区别开来。细胞凋亡的检测方法有很多,下面介绍几种常用的测定方法。一、细胞凋亡的形态学检测根据凋亡细胞固有的形态特征,人们已经设计了许多不同的细胞凋亡形态学检测方法。1. 光学显微镜和倒置显微镜(1) 未染色细胞:凋亡细胞的体积变小、变形,细胞膜完整但出现发泡现象,细胞凋亡晚期可见凋亡小体。贴壁细胞出现皱缩、变圆、脱落。(2) 染色细胞:常用姬姆萨染色、瑞氏染色等。凋亡细胞的染色质浓缩、边缘化,核膜裂解、染色质分割成块状和凋亡小体等典型的凋亡形态。2. 荧光显微镜和共聚焦激光扫描显微镜一般以细胞核染色质的形态学改变为指标来评判细胞凋亡的进展情况。常用的DNA特异性染料有:HO 33342 (Hoechst 33342),HO 33258 (Hoechst 33258), DAPI。三种染料与 DNA的结合是非嵌入式的,主要结合在DNA的A-T碱基区。紫外光激发时发射明亮的蓝色荧光。Hoechst是与DNA特异结合的活性染料,储存液用蒸馏水配成1mg/ml的浓度,使用时用PBS稀释成终浓度为2~5mg/ml。DAPI为半通透性,用于常规固定细胞的染色。储存液用蒸馏水配成1mg/ml的浓度,使用终浓度一般为0.5 ~1mg/ml。结果评判:细胞凋亡过程中细胞核染色质的形态学改变分为三期:Ⅰ期的细胞核呈波纹状(rippled)或呈折缝样(creased),部分染色质出现浓缩状态;Ⅱa期细胞核的染色质高度凝聚、边缘化;Ⅱb期的细胞核裂解为碎块,产生凋亡小体(图1)。 http://img.dxycdn.com/trademd/upload/userfiles/image/2013/08/A1376376278_small.jpg3 透射电子显微镜观察结果评判:凋亡细胞体积变小,细胞质浓缩。凋亡Ⅰ期(pro-apoptosis nuclei)的细胞核内染色质高度盘绕,出现许多称为气穴现象(cavitations)的空泡结构(图2);Ⅱa期细胞核的染色质高度凝聚、边缘化;细胞凋亡的晚期,细胞核裂解为碎块,产生凋亡小体。 http://img.dxycdn.com/trademd/upload/userfiles/image/2013/08/A1376376295_small.jpg二、磷脂酰丝氨酸外翻分析(Annexin V法)磷脂酰丝氨酸(Phosphatidylserine, PS)正常位于细胞膜的内侧,但在细胞凋亡的早期,PS可从细胞膜的内侧翻转到细胞膜的表面,暴露在细胞外环境中(图3)。Annexin-V是一种分子量为35~36KD的Ca2+依赖性磷脂结合蛋白,能与PS高亲和力特异性结合。将Annexin-V进行荧光素(FITC、PE)或biotin标记,以标记了的Annexin-V作为荧光探针,利用流式细胞仪或荧光显微镜可检测细胞凋亡的发生。碘化丙啶(propidine iodide, PI)是一种核酸染料,它不能透过完整的细胞膜,但在凋亡中晚期的细胞和死细胞,PI能够透过细胞膜而使细胞核红染。因此将Annexin-V与PI匹配使用,就可以将凋亡早晚期的细胞以及死细胞区分开来。http://img.dxycdn.com/trademd/upload/userfiles/image/2013/08/A1376376296_small.jpg方法1. 悬浮细胞的染色:将正常培养和诱导凋亡的悬浮细胞(0.5~1×106)用PBS洗2次,加入100 ul Binding Buffer和FITC标记的Annexin-V(20ug/ml)10 ul,室温避光30 min,再加入PI(50 ug/ml)5 ul,避光反应5 min后,加入400 ul Binding Buffer,立即用FACScan进行流式细胞术定量检测(一般不超过1 h), 同时以不加AnnexinV-FITC及PI的一管作为阴性对照。2. 贴壁培养的细胞染色:先用0.25%的胰酶消化,洗涤、染色和分析同悬浮细胞。3. 爬片细胞染色:同上,最后用荧光显微镜和共聚焦激光扫描显微镜进行观察。结果 http://img.dxycdn.com/trademd/upload/userfiles/image/2013/08/A1376376298_small.jpg http://img.dxycdn.com/trademd/upload/userfiles/image/2013/08/A1376376300_small.jpg
西达本胺通过信号通路调节促进癌细胞凋亡在我国,西达本胺已获批作为PTCL临床用药。西达本胺属于苯酰胺类化合物,是我国自主研发的首个亚型选择性口服HDACI,国家食品药品监督管理局已批准其用于临床试验,其选择性抑制I类HDAC1、2、3亚型和II类HDAC10亚型,可抑制肿瘤细胞增殖、促进凋亡,阻滞周期、引发DNA损伤,还可以增强抗肿瘤免疫反应。与其他抗肿瘤药物相比,西达本胺疗效好、选择性高、不良反应少。西达本胺可激活死亡受体途径和线粒体凋亡途径诱导细胞凋亡,其中最为主要的是线粒体凋亡途径,该途径受Bcl-2家族介导的细胞色素C释放通路调控。抗凋亡蛋白Bcl-2表达受到抑制,促凋亡蛋白Bax表达上调,使线粒体膜电位降低,细胞色素C释放到细胞质中,Caspase途径被激活,细胞发生凋亡。例如:西达本胺增强B淋巴瘤细胞组蛋白H3、H4 乙酰化水平,使线粒体膜电位降低随后激活Caspase 3,促进细胞凋亡;在肾癌中,它可以下调Bcl-2表达,上调Bax表达,随着药物浓度增加引起786-O 细胞凋亡。西达本胺可以调控ROS水平。HDACI可以上调ROS水平,导致DNA双链损伤。研究证明,西达本胺作用于白血病细胞后,诱导细胞内ROS产生,细胞凋亡增加[17]。此外,在胰腺癌细胞系中,西达本胺明显增强细胞内ROS的产生,上调γH2AX(DNA双链断裂的标志物)表达水平,诱发细胞DNA损伤。西达本胺通过调控细胞周期蛋白(Cyclin)、细胞周期蛋白依赖性激酶(Cyclin-dependent kinases,CDKs)以及细胞周期蛋白依赖性激酶抑制剂(Cyclin-dependent kinases inhibition,CDKI)的表达阻滞细胞周期。例如,西达本胺使MM细胞系P21、P27的表达量增高,CDK4、CDK6、Cyclin D2表达量下降,阻滞MM细胞系于G1期[19]。在NK/T细胞淋巴瘤中,西达本胺上调P21表达,下调Cyclin E表达,诱导细胞发生G0/G1期阻滞,从而抑制细胞的增殖。
http://gene.bjmu.edu.cn/news/ap1.gif 细胞凋亡与坏死是两种完全不同的细胞凋亡形式,根据死亡细胞在形态学、生物化学和分子生物学上的差别,可以将二者区别开来。细胞凋亡的检测方法有很多,下面介绍几种常用的测定方法。 一、细胞凋亡的形态学检测 根据凋亡细胞固有的形态特征,人们已经设计了许多不同的细胞凋亡形态学检测方法。 1 光学显微镜和倒置显微镜 (1) 未染色细胞:凋亡细胞的体积变小、变形,细胞膜完整但出现发泡现象,细胞凋亡晚期可见凋亡小体。 贴壁细胞出现皱缩、变圆、脱落。 (2) 染色细胞:常用姬姆萨染色、瑞氏染色等。凋亡细胞的染色质浓缩、边缘化,核膜裂解、染色质分割 成块状和凋亡小体等典型的凋亡形态。 2 荧光显微镜和共聚焦激光扫描显微镜 一般以细胞核染色质的形态学改变为指标来评判细胞凋亡的进展情况。 常用的DNA特异性染料有:HO 33342 (Hoechst 33342),HO 33258 (Hoechst 33258), DAPI。三种染料与 DNA的结合是非嵌入式的,主要结合在DNA的A-T碱基区。紫外光激发时发射明亮的蓝色荧光。 Hoechst是与DNA特异结合的活性染料,储存液用蒸馏水配成1mg/ml的浓度,使用时用PBS稀释成终浓度为2~5mg/ml。 DAPI为半通透性,用于常规固定细胞的染色。储存液用蒸馏水配成1mg/ml的浓度,使用终浓度一般为0.5 ~1mg/ml。 结果评判:细胞凋亡过程中细胞核染色质的形态学改变分为三期:Ⅰ期的细胞核呈波纹状(rippled)或呈折缝样(creased),部分染色质出现浓缩状态;Ⅱa期细胞核的染色质高度凝聚、边缘化;Ⅱb期的细胞核裂解为碎块,产生凋亡小体(图1)。 3 透射电子显微镜观察 结果评判:凋亡细胞体积变小,细胞质浓缩。凋亡Ⅰ期(pro-apoptosis nuclei)的细胞核内染色质高度盘绕,出现许多称为气穴现象(cavitations)的空泡结构(图2);Ⅱa期细胞核的染色质高度凝聚、边缘化;细胞凋亡的晚期,细胞核裂解为碎块,产生凋亡小体。
肝癌是全球第3大癌症死亡原因,其中肝细胞癌约占所有肝癌类型的80%[1]。据世界卫生组织统计,每年因肝细胞癌死亡的人数高达83万例,且其发病率和死亡率仍呈现上升趋势,严重损害人类生命健康[2]。在慢性肝病的基础上,基因突变、表观遗传变化、信号通路失调和血管生成异常等分子机制相互作用,共同推动慢性肝病向肝细胞癌过程的发展[3]。目前肝细胞癌治疗的一线药物主要是索拉菲尼、仑伐替尼等靶向药及阿替利珠单抗、贝伐珠单抗等免疫治疗药物[4]。然而,靶向药及免疫治疗药的耐药性和不良反应导致肝细胞癌的5年生存率仍然不高。因此,亟需寻找安全性高、不良反应少的治疗药物,为肝细胞癌患者提供更有效、安全的治疗选择。 近年来,随着对肝细胞癌研究的不断深入,自噬在肝细胞癌中的作用逐渐被关注。在肝细胞癌的发展过程中,自噬一方面通过维持细胞内稳态来抑制肿瘤起始,另一方面通过影响信号通路的效应因子来抑制早期肝细胞癌的进程[5]。自噬受到多种机制的严格调控和影响,涉及自噬的几条重要信号通路有Wnt/β-catenin、丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)、磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)、p53通路等[6],这些通路在肝细胞癌中异常激活,参与肝癌细胞的增殖、凋亡和自噬等生物学行为。研究表明,mTOR通路在自噬调控机制中发挥至关重要的作用[7],mTOR是自噬的负性调控因子,可以与UNC-51样激酶1(Unc-51 like autophagy activating kinase 1,ULK1)的丝氨酸结合抑制自噬的启动过程,也可以通过磷酸化使自噬调节复合物失活影响自噬小体的发生,磷酸化自噬相关蛋白14(autophagy-related protein 14,Atg14)、自噬和Beclin-1调节器1(activating molecule in beclin-1 regulated autophagy protein 1,AMBRA1)和核受体结合因子2(nuclear receptor binding factor 2,NRBF2)直接调节自噬的成核步骤[8]。因此,针对自噬及其机制开展治疗可能是肝细胞癌的有效对抗策略。 地榆为蔷薇科植物地榆Sanguisorba officinalis L.的干燥根,具有凉血止血、解毒敛疮的功效。地榆皂苷II是从地榆中提取的一种三萜皂苷类化合物,现代药理学研究发现,地榆皂苷II不仅具有抗炎、抗氧化、免疫调节的药理作用,同时具有广泛的抗肿瘤活性[9-11],能通过多种途径抑制多种癌症的发生和发展,其机制可能与阻滞细胞周期、促进细胞凋亡和细胞自噬有关[12-15]。课题组前期研究发现,地榆皂苷II能够抑制小鼠肝细胞癌的发展[15]。然而,地榆皂苷II是否能通过影响Akt/mTOR通路诱导凋亡和自噬抑制肝细胞癌尚不明确。本研究中选择人肝癌HepG2细胞和小鼠肝癌Hepa1-6细胞作为研究对象,探究地榆皂苷II对肝癌细胞增殖、自噬和凋亡的影响,探讨地榆皂苷II在抗肝细胞癌方面的潜在作用机制,为将来用于临床治疗提供数据支持。 1 材料 1.1 细胞 HepG2细胞购自中国科学院上海细胞生物学研究所,Hepa1-6细胞购自上海富衡生物科技有限公司。 1.2 药品与试剂 地榆皂苷II(批号MUST-11051204,质量分数≥98%)购自上海源叶生物科技有限公司;PVDF膜(批号IPVH00010)购自美国Sigma公司;青霉素-链霉素(批号S11JV)购自上海源培生物科技股份有限公司;DMEM培养基(批号C11995500BT)、胎牛血清(批号A3160801)购自美国Gibco公司;PBS(批号WHB823K091)购自武汉普诺赛生命科技有限公司;0.25%胰酶消化液(批号C0203)、RIPA组织/细胞裂解液(批号P0013C)、蛋白酶抑制剂混合物(批号P1050-1)、磷酸酶抑制剂混合物(批号P1050-2)、EdU-555细胞增殖检测试剂盒(批号C0075S)购自上海碧云天生物技术有限公司;CCK-8试剂盒(批号A311-02)、BCA蛋白浓度测定试剂盒(批号E112-01)、高敏型ECL化学发光检测试剂盒(批号E412-01)、相对分子质量为1.8×105的蛋白marker(批号MP-102AA)购自南京诺唯赞生物科技股份有限公司;一抗稀释液(批号G2025)、二抗稀释液(批号G2009)、高相对分子质量marker(批号26625)购自武汉赛维尔生物科技有限公司;7.5% PAGE凝胶快速制备试剂盒(批号PG111)、10% PAGE凝胶快速制备试剂盒(批号PG112)、12.5% PAGE凝胶快速制备试剂盒(批号PG113)购自上海雅酶生物医药科技有限公司;β-actin、Beclin1抗体(批号分别为20536-1-AP、11306-1-AP)购自美国Proteintech公司;B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)、p62抗体(批号分别为ab196495、ab56416)购自英国Abcam公司;Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)、半胱氨酸天冬氨酸蛋白酶-3(cystein-asparate protease-3,Caspase-3)、Caspase-8、cleaved Caspase-3、Akt、p-Akt、mTOR、p-mTOR抗体(批号分别为5023T、9662S、4790T、9664T、4685S、4060T、2972S、5536T)购自美国CST公司;甲醇(批号10014118)购自国药集团化学试剂有限公司;山羊抗兔二抗(批号RS0002)购自美国ImmunoWay公司;Annexin V-FITC染色液(批号E-CK-A211)购自武汉伊莱瑞特生物科技股份有限公司。 1.3 仪器 AL104型电子分析天平(瑞士梅特勒-托利多有限公司);HH-S型恒温水浴锅(北京市永光明医疗仪器厂);CKX53型倒置生物显微镜、IX73倒置荧光显微镜(日本Olympus公司);3111型CO2培养箱、Multiskan Go-1510型全波长酶标仪(美国Thermo Fisher Scientific公司);Centrifuge 5424R型微量离心机(德国Eppendorf公司);SDS PAGE凝胶电泳及转膜电泳仪(美国Bio-Rad公司);BETS-M5型转移微型翘板摇床(海门市其林贝尔仪器制造有限公司);XH-C型涡旋混合器(金坛市医疗仪器厂);MINI-4K型微型离心机(杭州米欧仪器有限公司);5200型全自动化学发光图像分析系统(上海天能科技有限公司);CytoFLEX流式细胞仪(美国贝克曼库尔特有限公司);ThermoCell恒温金属浴(杭州博日科技股份有限公司)。 2 方法 2.1 CCK-8实验 将HepG2和Hepa1-6细胞分别以1×105个/mL接种于96孔板中,贴壁生长24 h,设置对照组、不同剂量地榆皂苷II组,对照组仅加入培养基,其余各组分别加入5、10、15、20、30、40、60、80、100 μmol/L相应药物,继续培养24 h,用CCK-8试剂盒测定各组吸光度(A)值,计算细胞存活率。 细胞存活率=(A实验-A空白)/(A对照-A空白) 2.2 EdU实验 将HepG2和Hepa1-6细胞分别以1×105个/mL接种于96孔板中,贴壁生长24 h,设置对照组和地榆皂苷II(10、20、40 μmol/L)组,给药组给予相应药物,对照组仅加入培养基,继续培养24 h。将EdU稀释到2×EdU工作液(20 μmol/L),预热后等体积加入96孔板中,孵育细胞2 h后去除培养液,加入100 μL固定液(4%多聚甲醛),孵育10 min后去除固定液,用100 μL洗涤液洗涤细胞3次后每孔加入100 μL通透液(含0.3% Triton X-100的PBS),室温孵育15 min。去除通透液,每孔用1 mL洗涤液洗涤细胞2次,每次5 min。参考说明书配制Click反应液。每孔加入50 μL Click反应液,轻轻摇晃培养板后室温避光孵育30 min。洗涤液洗涤3次,吸除洗涤液后,每孔加Hoechst 33342溶液100 μL,室温避光孵育10 min。用洗涤液洗涤3次,每次3~5 min,随后进行荧光检测。 2.3 细胞凋亡检测 将HepG2和Hepa1-6细胞分别以1×105个/mL接种于6孔板中,贴壁生长24 h,设置对照组和地榆皂苷II(10、20、40 μmol/L)组,给药组给予相应药物,对照组仅加入培养基,继续培养24 h。用胰酶消化细胞,300×g离心5 min,弃上清,收集细胞,PBS洗涤,轻轻重悬细胞,300×g离心5 min,弃上清。用PBS洗涤细胞,离心后弃上清,加入Annexin V Binding Buffer重悬细胞。细胞悬液中加入Annexin V-FITC Reagent和5 μL的碘化丙啶(PI),轻柔涡旋混匀后,室温避光孵育15~20 min,立即上机检测。 2.4 Western blotting检测相关蛋白表达 将HepG2和Hepa1-6细胞分别以1×105个/mL接种于6孔板中,贴壁生长24 h,设置对照组和地榆皂苷II(10、20、40 μmol/L)组,给药组给予相应药物,对照组仅加入培养基,继续培养24 h。加入RIPA中强度缓冲液裂解后收集细胞,使用BCA蛋白定量试剂盒检测蛋白浓度。蛋白样品经凝胶电泳,转至PVDF膜,加入5%脱脂奶粉,封闭1.5 h,加入一抗,4 ℃孵育过夜;洗膜3次后加入二抗,4 ℃孵育1.5 h;最后使用ECL化学发光检测试剂盒,用化学发光图像分析系统显影。 2.5 统计学分析 采用GraphPad Prism 9统计软件对实验数据进统计学分析,计量资料以表示,多组间比较采用单因素方差分析(One-way ANOVA)。 3 结果 3.1 地榆皂苷II对HepG2和Hepa1-6肝癌细胞增殖的影响 如图1所示,与对照组比较,随着地榆皂苷II浓度的升高,HepG2和Hepa1-6肝癌细胞的存活率明显降低,且呈剂量相关性。经GraphPad Prism 9软件分析,地榆皂苷II对HepG2、Hepa1-6细胞的IC50值分别为26.94、26.18 μmol/L,因此以10、20、40 μmol/L作为后续地榆皂苷II的给药剂量。 图片 3.2 地榆皂苷II对HepG2和Hepa1-6肝癌细胞增殖的影响 EdU-555阳性表示细胞正处于增殖状态,Hoechst33342阳性指示细胞为活细胞,EdU-555/Hoechst33342表示细胞的增殖率。如图2所示,与对照组比较,地榆皂苷II给药后HepG2和Hepa1-6细胞的EdU-555/Hoechst33342值明显降低(P<0.05、0.001),表明地榆皂苷II能够抑制肝癌细胞的增殖。 图片 3.3 地榆皂苷II对HepG2和Hepa1-6肝癌细胞凋亡的影响 如图3所示,与对照组比较,地榆皂苷II给药组HepG2和Hepa1-6细胞凋亡率显著升高(P<0.01、0.001)。凋亡蛋白(包括调控凋亡的激活因子和执行凋亡的效应因子)参与细胞凋亡的过程。采用Western blotting检测地榆皂苷II对HepG2细胞和Hepa1-6细胞凋亡相关蛋白表达的影响,如图4所示,与对照组比较,地榆皂苷II给药组Caspase-3、Caspase-8、Caspase-9、Bcl-2蛋白表达量显著降低(P<0.05、0.01、0.001),cleaved Caspase-3、Bax蛋白表达量显著升高(P<0.05、0.01)。以上结果说明地榆皂苷II促进HepG2和Hepa1-6细胞的凋亡。 图片 图片 3.4 地榆皂苷II对HepG2和Hepa1-6肝癌细胞自噬的影响 采用Western blotting检测细胞中代表自噬的核心蛋白LC3II、LC3Ⅰ、Beclin1、p62表达量,如图5所示,与对照组比较,地榆皂苷II给药组LC3Ⅱ/LC3Ⅰ值明显升高(P<0.05、0.01、0.001),Beclin1蛋白表达量上升(P<0.05、0.01),p62蛋白表达量明显下降(P<0.05、0.01),表明地榆皂苷II促进HepG2和Hepa1-6肝癌细胞的自噬。 图片 3.5 地榆皂苷II对HepG2和Hepa1-6细胞中Akt/mTOR信号通路蛋白表达的影响 采用Western blotting检测地榆皂苷II给药后Akt/mTOR信号通路蛋白表达量,如图6所示,与对照组比较,地榆皂苷II给药组p-Akt/Akt、p-mTOR/mTOR值明显下降(P<0.05、0.01、0.001),表明地榆皂苷II能够抑制Akt/mTOR信号通路。 图片 4 讨论 肝细胞癌具有高发病率、高病死率的特点,虽然目前肝细胞癌研究备受关注,但其5年生存率仍为14.1%[16]。因此,迫切需要发现新的治疗策略和候选药物。近年来,地榆皂苷II在抗肿瘤方面的研究不断深入,研究发现地榆皂苷II抑制肿瘤与细胞自噬和凋亡存在紧密的关联,地榆皂苷II可通过诱导细胞凋亡来显著抑制乳腺癌MDA-MB-435细胞和胃癌BGC-823细胞的增殖[14-15],诱导自噬显著抑制结直肠癌细胞增殖[17]。课题组既往研究证明,地榆皂苷II可在体内抑制肝细胞癌,其机制可能与抑制表皮生长因子受体(epidermal growth factor receptor,EGFR)信号通路有关[15]。然而,目前关于地榆皂苷II是否通过自噬和凋亡抑制肝细胞癌及其机制尚不明确。因此,本研究利用体外实验对地榆皂苷II刺激后肝癌细胞的增殖、自噬、凋亡及相关机制进行探究,结果表明,地榆皂苷II能抑制肝癌细胞的增殖,促进肝癌细胞的凋亡和自噬,其机制与抑制Akt/mTOR通路有关。 自噬又被称为II型程序性死亡,负责真核生物细胞质中细胞器、蛋白质和大分子的降解和回收。细胞中降解和回收的底物被吞噬后形成自噬体,自噬体与溶酶体结合形成自噬酶体最后降解。本研究检测了自噬中具有代表性的LC3、p62和Beclin1蛋白。Beclin1蛋白是一种自噬启动子,帮助自噬过程中囊泡的形成[18],地榆皂苷II作用于肝癌细胞后,Beclin1蛋白表达量上升,促进自噬启动,囊泡形成增多,从而自噬水平升高。在自噬形成时,LC3I通过泛素激活酶E1和泛素结合酶E2与磷脂酰乙醇胺偶联,生成LC3II,LC3II存在于自噬体的表面,负责膜的融合和选择性降解过程[19],p62在自噬体表面与LC3II相互作用后包裹进自噬体降解,与LC3II共同调节选择性降解过程[20]。地榆皂苷II给药后LC3II/LC3I值增高,p62蛋白表达量下降,促进自噬过程中自噬囊泡的融合和降解,进而促进自噬。Beclin1是自噬过程中的核心因子,已有研究证明Beclin1可以与抗凋亡因子Bcl-2相互作用,从而对凋亡过程产生影响[21]。细胞凋亡是一种生理性或病理性的程序性的死亡过程,近年来通过诱导促进癌细胞的凋亡来控制癌症一直是抗肿瘤的热点。Caspase级联反应是细胞凋亡过程的关键步骤,其启动受到抗凋亡因子和促凋亡因子Bcl-2和Bax的调节。在Caspase级联反应中,启动性Caspase包括Caspase-8、Caspase-9被激活后调控下游执行性Caspase如Caspase-3进而引起凋亡反应[22-24]。地榆皂苷II作用于肝癌细胞后,细胞中的Bcl-2蛋白表达量减少,Bax蛋白表达量增多,Bax蛋白在线粒体表面形成孔道,释放细胞色素C,引发Caspase级联反应,Caspase-8、Caspase-9激活进而诱导下游的Caspase-3活化为cleaved Caspase-3,切割下游多种底物,促进细胞凋亡典型形态变化。 Akt/mTOR信号通路在正常细胞生理过程中发挥关键作用,同时在多种癌症中,该通路的异常激活对自噬、细胞凋亡、化疗耐药性及转移过程产生重要影响[25]。诸多研究证据表明,Akt/mTOR途径是调控癌症细胞自噬反应的核心通路[26-28]。地榆皂苷II作用于肝癌细胞后,Akt和mTOR蛋白的磷酸化水平显著下降,Akt/mTOR信号通路被抑制,激活肝癌细胞凋亡和自噬,抑制肝癌细胞的增殖(图7,由Figdraw绘制)。 图片 上述体外研究结果初步解析了地榆皂苷II抑制肝细胞癌的机制,即地榆皂苷II通过抑制Akt/mTOR信号通路诱导肝癌细胞的凋亡和自噬,抑制肝癌细胞增殖,为地榆皂苷II在肝细胞癌治疗的药物研究开发中提供了药理学证据。
北京高信泰格贸易有限公司专营进口生化试剂,包括分子生物学产品,常规生化试剂,抗体,细胞凋亡,染色剂,分离试剂,生物缓冲液 常用试剂:大孔树脂xad-2 聚酰氨粉 葡萄糖G6152,1KG 蔗糖S1888,5KG TRISE,T1503,1KG 甘油G7757,2.5L 二乙基甲氧基硼烷328839-500ml 溶血卵磷脂62962-50ml aldrich d91055-1L二乙苯 fluka63559-250g甘露醇 sigma-a5710-100g acros-hydriodic acid,氢碘酸-50ml sigma-M6400-25ML SIGMA-C9538-100mg fluka-55200 sigma-c8667-5g acros-122020020咪唑 N-3甲基硅烷基咪唑100ml 氟氏完全左剂sigma-f5881 sigma-p5147 MOPS 99.5% MES 99.5% CAPS PIPES HEPES 99.5% CHAPS 丙烯酰铵 Acrylamide 99.9%适合电泳 甲叉双丙烯酰铵N,N-Methyline Bisacrylamide 99.9% 过硫酸胺Ammonium persulfate 十二烷基硫酸钠(SDS)分子生物级99.9% 蛋白胨(肉) Peptone 明胶高强度 丙酮酸钠 Pyruvic acid,sodium Deosyribonucleic acid,sodium salt 95% 三磷酸腺苷二钠盐 ATP 99% 胃蛋白酶抑制剂Pepstatin 纤维素酶Cellulase 750u/mg 果胶酶 Pectolase 50u/mg 溶菌酶 2wu/mg 蛋白酶抑制剂Aprotinin α-淀粉酶 4000uu/mg dNTPSMix(dATPdGTPdTTPdCTP10MMEach)原液 凝血酶 Thrombin (普通用300u/mg) 氨苄青霉素钠盐Ampicillin 水溶 盐酸四环素 (Tetracyclin Hcl)99% 卡那霉素硫酸盐 KanamycinSulfate99% 硫酸庆大霉素 GentamycinSulfate99% G418 (Geneticin) G-418硫酸盐 700u/mg 利福平 (Rifampicin) 99.5% 分子生物级 盐酸万古霉 (VancomycinHcl)1100u/mg97%不是去甲基万古霉素 硫酸链霉素 (Streptomycin Sulfate) 99% 噻孢霉素Cefotaxime Sodium 99.5%(别名头孢噻亏钠) 氯霉素 (Chloramphenicol)99% 羧苄青霉素 (Carbenicillin Na2) 盐酸壮观霉素 (Spectinomycin) 99% 制霉菌素 (Nystatin)4400u/mg 链脲佐菌素 (Streptozotocin STZ) 99.5% 丝裂霉素C Mitomycin C 950u/mg 99% 放线菌素D Actinomycin D 99.5% 染色剂: 考马斯亮蓝R250 Coomassie Brilliant Blue R-250 考马斯亮蓝G250 Coomassie Brilliant Blue G-250 3、3 5、5-四甲基联苯胺 溴酚兰 Bromphenol Blue MTT (Thiazolyl blue) 噻唑蓝 99% 十六烷基三甲基溴化铵CTAB 99.9% 叠氮钠 NaN3 99.5% 甘油 99.9% EGTA乙二醇-双-(2-氨基乙基)四乙酸 99% 乙二胺四乙酸二钠盐 EDTA-2Na99.99% 尿素Urea 99.5% 异硫氰酸胍 Guanidine Thiocyanate99.5% 盐酸胍 Guanidine Hyiochloride 99.8% 2-巯基乙醇 2-Mercaptoethanol 99.9% 咪唑 99.9% Imidazole 聚乙二醇4000 聚乙二醇6000-8000 聚乙二醇2000 二甲基亚砜 (DMSO) 笨甲基磺酰氟(PMSF)99.5%酶稳定剂 D-甘露醇 D-Mannitol 焦碳酸二乙脂 DEPC 97% 异丙基-B-D-硫代半乳糖苷(IPTG) 5-溴-4-氯-3-吲哚半乳糖苷 X-Gal 二硫代苏糖醇(DTT) 99.5% TWEEN20 99.5% TWEEN80 99.5% N,N-二甲基甲酰胺 (DMF) X-Gluc(Bromo-4-chloro-3-indolyl B-D-glucuronide cyclohexylamine salt)99% 植物试剂 6-苄氨基嘌呤 6-BA 99.9% D-生物素(可作标记用) 99.5% D-Biotine 葡萄糖Glucose(Dextrose) 肌醇 Inositol 99.5% 3-吲哚丁酸 IBA 99% 3-吲哚乙酸 IAA 99% a-萘乙酸 a-NAA 蛋白胨(肉) Peptone 硼酸 Boric actd 赤酶素 Gibberellic acid 玉米素 噻苯隆 适合HPLC,GC,农残,光谱分析,有机合成及组合化学的多用途高纯溶剂BJ101甲醇Methanol4×4L(长期现货)BJ102乙腈Acetonitrile4×4L(长期现货)BJ103丙酮Acetone4×4L(长期现货)BJ104异丙醇Isopropyl Alcohol4×4L(长期现货)BJ105异辛烷Iso-Octane4×4LBJ106乙酸乙酯Ethyl Acetate4×4L(长期现货)BJ107四氢呋喃Tetrahydrofuran4×4L(长期现货)BJ108石油醚Petroleum Ether4×4LBJ109氯仿Chloroform4×4LBJ110N,N-二甲基甲酰胺N,N-Dimethylformamide4×4L 北京高信泰格贸易有限公司地址:北京市西三旗金燕龙大厦1713室电话:010-62715771 62717893传真:010-62718548手机:13910810775联系人:程力
与 MSI1 相关的信号通路及凋亡相关机制研究进展Notch 信号通路Notch 信号通路在调节细胞增殖、干细胞维持、胚胎和成人发育期间的分化以及内环境稳定中起着重要作用。MSI1 可以特异性识别并结合 Numb mRNA 的 3'-UTR 区域,促进 Notch 信号通路的异常激活[33]。在肿瘤微环境中,Notch 信号通路起到了至关重要的作用,MSI1 和 Notch 信号通路是乳腺上皮细胞中干细胞不对称分裂的两个关键调节因子,而乳腺上皮干细胞被认为是乳腺癌病因的主要靶点。另有研究显示MSI1 通过激活 Notch 通路促进胶质瘤细胞的发展[35],在髓母细胞瘤中通过沉默 MSI1下调了 Notch 通路成员 Hes1、Hey2 和 Notch2 的表达,从而抑制了肿瘤的发生发展。在弥漫型胃癌的相关研究中发现,通过 MSI1 调节 Notch 通路中的 delta-1 配体和 Jagged-2 配体的表达来激活 Notch 信号通路,促进肿瘤细胞的发生发展。综上所述,MSI1 通过调节 Notch 信号通路,影响未分化细胞的分化、细胞周期和凋亡等方向和进程,从而促进肿瘤细胞的异常增殖。 Wnt 信号通路Wnt 信号通路控制发育、体内平衡、愈合和再生等各种生物过程[38]。该信号传导缺陷导会致发育缺陷、骨骼疾病和恶性肿瘤[39,40]。在肠道上皮组织稳态平衡中 MSI1 和APC 之间的负反馈起着关键调节作用,APC 是 Wnt 通路的一个组成部分,当 MSI1 表达下调时会增加 APC 的活性,进而导致而 Wnt 信号活性降低,当这种平衡失去时, 就会增加肠道息肉和肿瘤发生[41,42]。Chen[43]等人在肝细胞癌的研究中发现,MSI1 通过直接下调 APC 和 DKK1 激活 Wnt 通路来调节细胞生长和细胞周期。髓母细胞瘤的相关研究发现,电离辐射诱导的尿激酶纤溶酶原激活物受体(uPAR)在 Wnt/β-catenin 信号传导中起作用,并介导髓母细胞瘤细胞系 UW228 和 D283 中肿瘤干细胞(CSC)样特性的诱导,从而促进癌细胞的侵袭、迁移和转移。肿瘤中 MSI1 与 Wnt 信号通路的关系仍需要我们进一步探索。其他信号通路Akt信号参与调节细胞增殖、细胞周期进程、凋亡以及肿瘤细胞与细胞外基质之间的相互作用[44,45]。MSI1可以激活肺癌和胶质母细胞瘤中的AKT信号,从而促进恶性肿瘤[3,30]。敲除 MSI1 可通过上调胶质瘤细胞中的 PTEN 来降低 PI3 激酶 AKT 信号通路的活性[。Hh 信号通路对无脊椎动物和脊椎动物的正常发育至关重要。在哺乳动物的皮肤、神经、肺中 Hh 参与维持体细胞和多能干细胞的修复,当 Hh 途径被启动后能激活靶基因的转录[。在胃癌耐药性的研究中发现,CD44(+)/MSI1(+)的共表达通过 Hh 通路增强胃癌干细胞的耐药性。TGF-β 通路参与调节细胞分化、生长和增殖,并能激活免疫反应起到抑制肿瘤的作用,该通路直接促进上皮-间充质转化,从而促进肿瘤发展进程[55-57]。哺乳动物的 TGF-β 信号通路同样存在复杂的调控网络, 促进肿瘤细胞增殖、凋亡、血管生成、细胞侵袭[。综上所述,大量研究发现了 MSI1 与 Notch、Wnt、Akt、TGF-β和 Hedgehog(Hh) 等信号通路之间相互作用,这些信号通路在正常胚胎发育中起重要调控作用,并且这些信号通路失调均在肿瘤发生发展过程中发挥着重要作用。
[font='calibri'][size=13px]人源化抗体和全人源抗体区别[/size][/font][font='calibri'][size=13px]?[/size][/font][font='calibri'][size=13px]义翘[/size][/font][font='calibri'][size=13px]抗体人源化[/size][/font][font='calibri'][size=13px]服务内容[/size][/font][font='宋体']人源化抗体和全人源抗体区别:[/font][font='宋体']根据单克隆抗体的来源不同,可分为鼠源抗体、嵌合体抗体、人源化抗体和全人源抗体。[/font][font='宋体']所谓的全人源单抗,就是基因来源100%都是人源的。不过,事实上全人源单抗也是在小鼠身上产生的,通过把产生抗体相关的人类基因转移到小鼠,此后小鼠体内的抗体结构可以跟人类抗体结构一样。所以全人源抗体直接用人体[/font][font='宋体']细胞制作的抗体,只是抗体结构100%按照人类基因编码而成。[/font][font='宋体']人源化单抗则是大部分来源是人源,同时融合了鼠源成分。近年来,科学家通过基因工程特意将鼠抗的关键有利基因结构保留在人源框架上,起到特殊的作用,就像优化再加工(2l。例如,依奇珠单抗(人源化单抗)中保留了1.8%的鼠源成分,这部分整合了优势有利的基因,成就了依奇珠单抗的高亲和力,其起效速度快可能也和其亲和力高有关。[/font][font='宋体'] [/font][font='宋体'] [/font][font='宋体']义翘神州[url=https://cn.sinobiological.com/services/antibody-humanization-service][b]抗体人源化服务[/b][/url]:[/font][font='宋体']抗体人源化[/font][font='宋体']非人源性抗体进入人体内会引起严重的机体排异反应,进而影响抗体在临床应用时的安全性和治疗效果。抗体人源化通过基因改造,使鼠源抗体具有与人体内抗体类似的结构,从而逃避免疫系统的识别。抗体人源化经历了从嵌合抗体到CDR移植、SDR移植等技术演变,力求在保持高亲和力、高特异性结合能力的同时克服传统鼠源抗体的免疫原性,在肿瘤治疗等领域具有极为广泛的应用前景。[/font][font='宋体']义翘神州利用CDR置换技术及计算机辅助结构模拟设计可对鼠源单抗等进行人源化改造,保证人源化程度 95%,为客户提供优质的单克隆抗体人源化服务。[/font]
[font=宋体]磷酸化抗体是一种特殊的抗体,能够识别并结合到已经被磷酸化的蛋白质。磷酸化是一种重要的蛋白质修饰方式,通过将磷酸基团结合到特定的氨基酸残基上,可以改变蛋白质的结构和功能。在许多生物学过程中,磷酸化都扮演着重要的角色,因此磷酸化抗体成为了研究生物学和生物化学的重要工具。[/font][font=宋体] [/font][font=宋体]蛋白质磷酸化是指蛋白在激酶作用下在特定氨基酸位点(最常见的是丝氨酸、苏氨酸、酪氨酸残基)发生磷酸化的过程。蛋白磷酸化是极其重要的翻译后修饰,其动态调控是信号转导中不可或缺的一环,调控着细胞生长、分化、代谢、凋亡等等过程。[/font][font=宋体] [/font][font=宋体]磷酸化抗体主要是针对磷酸化位点制备的,可以特异性识别磷酸化氨基酸位点,对磷酸化蛋白进行定性、定量分析,检测蛋白受刺激后磷酸化水平变化情况。[/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州可以为客户提供一系列具有高特异性(经内源性、磷酸化特异性等多方面验证)、高灵敏度([/font][font=Calibri]1:200000[/font][font=宋体]稀释度)特点的磷酸化抗体,满足[/font][font=Calibri]WB[/font][font=宋体]、[/font][font=Calibri]IHC[/font][font=宋体]等应用。同时我们还可以为客户提供定制化的磷酸化抗体定制服务。[/font][/font][font=宋体] [/font][font=宋体][b]义翘神州磷酸化抗体服务优势:[/b][/font][font=宋体] [/font][font=宋体][font=宋体]①专业高效的多肽设计软件及高效偶联方法,保证多肽免疫成功率[/font][font=Calibri]95%[/font][font=宋体]以上。[/font][/font][font=宋体]②多种纯化策略,正负筛选平台,确保得到高特异识别指定磷酸化位点的抗体。[/font][font=宋体]③竞争性的价格[/font][font=宋体] [/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州提供多种生物的制备服务,包括磷酸化兔多克隆抗体制备服务、磷酸化鼠单克隆抗体制备服务、磷酸化兔单克隆抗体制备服务[/font][font=宋体]……详情可以关注[/font][font=Calibri]https://cn.sinobiological.com/services/phospho-specific-antibody-service[/font][/font][font=宋体] [/font][font=宋体]总之,义翘神州[url=https://cn.sinobiological.com/services/phospho-specific-antibody-service][b]磷酸化抗体定制服务[/b][/url]能够满足您的个性化需求,帮助您在研究领域获得更多的突破。我们致力于为您提供高质量、高效率的抗体定制服务,助力您的科研事业更上一层楼。[/font]
[font=宋体]抗体标记是一种生物技术,通过将标记物(如酶、荧光素、生物素等)共价连接到抗体上,使其与待检测物(如特定抗原)特异性反应,形成多元复合物。随后,借助相关仪器,可以直接观察试验结果或进行自动化测定,从而对抗原、抗体反应进行定性和定位研究,或进行定性和定量测定。下面为大家介绍几种高质量的标记抗体:[/font][font=宋体] [/font][font=宋体][b]①荧光色素标记抗体[/b][/font][font=宋体] [/font][font=宋体][font=宋体]这种标记方法是将荧光素与相应的抗体[/font][font=Calibri]([/font][font=宋体]或抗原[/font][font=Calibri])[/font][font=宋体]结合,将荧光标记的抗体[/font][font=Calibri]([/font][font=宋体]或抗原[/font][font=Calibri])[/font][font=宋体]与标本中相应的抗原形成荧光标记的抗体[/font][font=Calibri]-[/font][font=宋体]抗原复合物,用荧光显微镜观察。在显微镜若存在荧光则意味着存在抗原抗体复合物,因此可根据已知的抗体[/font][font=Calibri]([/font][font=宋体]或抗原[/font][font=Calibri])[/font][font=宋体]推断出另一种未知抗原[/font][font=Calibri]([/font][font=宋体]或抗体[/font][font=Calibri])[/font][font=宋体]的存在。[/font][/font][font=宋体] [/font][font=宋体][b]②[/b][url=https://cn.sinobiological.com/category/biotinylated-protein-elite][b]生物素标记抗体[/b][/url][/font][font=宋体] [/font][font=宋体][font=宋体]抗体标记中生物素的引入使整个过程灵敏度大大提高!这种方法可使抗体或其它蛋白质的[/font][font=宋体]ε[/font][font=Calibri]-[/font][font=宋体]氨基与酰化的生物素共价结合,生物素化的分子可以通过酶标记的抗生物素蛋白或荧光染料[/font][font=Calibri]-[/font][font=宋体]链霉抗生物素蛋白复合物来检测。小分子水溶性生物素对链霉亲和素的高亲和力是该方法的设计基础。[/font][font=Calibri]https://cn.sinobiological.com/category/biotinylated-protein-elite[/font][/font][font=宋体] [/font][font=宋体][b]③放射性碘标记抗体[/b][/font][font=宋体] [/font][font=宋体]蛋白质的碘标记方法有很多种,比如我们常用的化学法或酶促法通过氧化对蛋白质分子进行碘化等。[/font][font=宋体] [/font][font=宋体][b][font=宋体]④[/font][font=Calibri]PE[/font][font=宋体]标记抗体[/font][/b][/font][font=宋体][font=Calibri]PE[/font][font=宋体]标记抗体是指将[/font][font=Calibri]PE[/font][font=宋体]荧光染料与特定抗体结合而成的复合物,这种技术常用于生物医学研究中的荧光标记。[/font][font=Calibri]PE[/font][font=宋体]荧光染料是从红藻属藻类中提取得到的一种特殊色素,具有较高的荧光强度和稳定性。[/font][font=Calibri]PE[/font][font=宋体]标记抗体主要应用在流式细胞术和免疫组化等实验中。在流式细胞术中,[/font][font=Calibri]PE[/font][font=宋体]偶联抗体可以用于检测细胞表面标记物的表达情况,如[/font][font=Calibri]CD4[/font][font=宋体]、[/font][font=Calibri]CD8[/font][font=宋体]等,可以实现对免疫细胞亚群的研究。在免疫组化和免疫组织化学等实验中,[/font][font=Calibri]PE[/font][font=宋体]偶联抗体可以用于检测细胞内标记物的表达,如细胞因子、转录因子等,可以深入研究细胞内信号传导通路及相关的生物学功能。[/font][/font][font=宋体] [/font][font=宋体][b][font=宋体]⑤[/font][font=Calibri]PerCP[/font][font=宋体]标记抗体[/font][/b][/font][font=宋体][font=Calibri]PerCP-Cy5.5[/font][font=宋体]标记抗体是一种荧光标记的二抗,通常是在单抗上进行标记,具有很强的荧光强度和稳定性。[/font][font=Calibri]PerCP-Cy5.5[/font][font=宋体]标记抗体可以与细胞或细胞组分中的特定抗原结合,用于细胞表面标记、蛋白质定量分析、细胞周期和细胞凋亡研究等领域。[/font][/font][font=宋体] [/font][font=宋体][b][font=宋体]⑥[/font][font=Calibri]FITC[/font][font=宋体]标记抗体[/font][/b][/font][font=宋体][font=Calibri]FITC[/font][font=宋体]标记抗体是将[/font][font=Calibri]FITC[/font][font=宋体](异硫氰酸荧光素)与特异性抗体经适当方法连接而成的复合物。[/font][font=Calibri]FITC[/font][font=宋体]是一种荧光染料,能够与各种抗体蛋白结合,并产生强烈的荧光信号。这种标记技术常用于生物医学研究中的荧光标记,特别是在免疫学、细胞生物学和分子生物学等领域。[/font][/font][font=宋体] [/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州除了为客户提供抗体开发,还可以提供[url=https://cn.sinobiological.com/resource/antibody-technical/antibody-conjugation][b]抗体标记服务[/b][/url],可提供的标记物包括[/font][font=Calibri]HRP[/font][font=宋体]、生物素、荧光基团等。更多关于抗体标记及抗体标记方法详情可以参看[/font][font=Calibri]https://cn.sinobiological.com/resource/antibody-technical/antibody-conjugation[/font][/font]
[font=宋体][font=宋体]目前,用细胞工程制备人单抗在技术上和伦理上都存在一些难题,治疗性抗体的开发就集中在具有治疗前景的鼠源单抗上。但是鼠源单抗对人体具有异源性反应,可诱发人抗鼠抗体效应[/font][font=Calibri](Humananti-mouseantibodies,HAMA[/font][font=宋体]反应[/font][font=Calibri])[/font][font=宋体],使得单抗的治疗效果明显滞后。随着基因重组技术的发展和人们对抗体结构认识的深入,研究者们尝试对鼠源性抗体进行改造,致力于在保留与抗原结合的高亲和力的基础上,减少异源性抗体的免疫原性,推动抗体人源化研发的进程。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]人源化抗体主要指以用基因克隆及[/font][font=Calibri]DNA[/font][font=宋体]重组技术对鼠源单克隆抗体改造,重新表达产生的抗体。其大部分氨基酸序列被人源序列取代,基本保留亲本鼠单克隆抗体的亲和力和特异性,又降低了其异源性,有利应用于人体。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]根据人源化程度不同,单抗又可分为[url=https://cn.sinobiological.com/resource/antibody-technical/chimeric-monoclonal-antibody][b]嵌合抗体[/b][/url][/font][font=Calibri](60%-70%[/font][font=宋体]人源化氨基酸序列[/font][font=Calibri])[/font][font=宋体]和[/font][font=Calibri]CDR(complementarity-determiningregion)[/font][font=宋体]移植抗体[/font][font=Calibri](90%-95%[/font][font=宋体]人源化氨基酸序列[/font][font=Calibri])[/font][font=宋体]。[/font][/font][font=宋体] [/font][font=宋体][b][font=Calibri]1[/font][font=宋体]、人[/font][font=Calibri]-[/font][font=宋体]鼠嵌合抗体:[/font][/b][/font][font=宋体][font=宋体]人[/font][font=Calibri]-[/font][font=宋体]鼠嵌合抗体[/font][font=Calibri](chimericantibody)[/font][font=宋体]:第一代人源化抗体。其是在基因水平上将鼠源单克隆抗体的[/font][font=Calibri]V[/font][font=宋体]区和人抗体的[/font][font=Calibri]C[/font][font=宋体]区[/font][font=Calibri](variableregion,[/font][font=宋体]可变区[/font][font=Calibri])[/font][font=宋体]连接,在合适的宿主细胞内表达可得到人[/font][font=Calibri]-[/font][font=宋体]鼠嵌合抗体。嵌合抗体用于人体所产生的[/font][font=Calibri]HAMA[/font][font=宋体]反应比鼠源单抗明显减弱[/font][font=Calibri] [/font][font=宋体]另外,人源[/font][font=Calibri]C[/font][font=宋体]区[/font][font=Calibri](constantregion[/font][font=宋体],恒定区[/font][font=Calibri])[/font][font=宋体]可更有效地介导人体一些免疫反应,如[/font][font=Calibri]CDC(complement-dependentcytotoxicity,CDC,[/font][font=宋体]依赖补体的细胞毒性作用[/font][font=Calibri])[/font][font=宋体],[/font][font=Calibri]ADCC(antibodydependentcellmediatedcytotoxicity,[/font][font=宋体]抗体依赖的细胞介导的细胞毒性作用[/font][font=Calibri])[/font][font=宋体]。[/font][/font][font=宋体] [/font][font=宋体][b][font=Calibri]2[/font][font=宋体]、[/font][font=Calibri]CDR[/font][font=宋体]移植抗体[/font][/b][/font][font=宋体][font=宋体]嵌合抗体虽然可以部分解决异种蛋白的排斥问题,但由于其还含有鼠源[/font][font=Calibri]V[/font][font=宋体]区,依然有可能会诱发[/font][font=Calibri]HAMA[/font][font=宋体]反应,干扰抗体疗效,诱发超敏反应,在临床上其应用会受到一定限制。因此人们进一步研究鼠源可变区的改造,研发出了[/font][font=Calibri]CDR[/font][font=宋体]移植的人源化抗体,即第二代人源化抗体也是现在普遍所说的人源化抗体[/font][font=Calibri](humanizedantibody)[/font][font=宋体]。[/font][/font][font=宋体][font=Calibri]CDR[/font][font=宋体]移植抗体是研究者们在嵌合抗体的基础上进一步用人源框架区[/font][font=Calibri](Frameworkregion,FR)[/font][font=宋体]替代鼠源框架区[/font][font=Calibri](FR)[/font][font=宋体],仅保留了[/font][font=Calibri]3[/font][font=宋体]个鼠源性[/font][font=Calibri]CDR[/font][font=宋体],其他全部为人源结构,人源性可达[/font][font=Calibri]90%[/font][font=宋体]以上。但对于特定的抗原分子,[/font][font=Calibri]FR[/font][font=宋体]并不能随意替换。多方面研究均证实,具有支持作用的[/font][font=Calibri]FR[/font][font=宋体]不仅为[/font][font=Calibri]CDR[/font][font=宋体]的构象提供了环境,有时还参与抗体结合。因此简单的[/font][font=Calibri]CDR[/font][font=宋体]移植往往明显降低抗原[/font][font=Calibri]-[/font][font=宋体]抗体结合的亲和力,甚至是丧失抗原抗体结合的能力。[/font][/font][font=宋体] [/font][font=宋体]针对这种状况,目前主要有四种策略:[/font][font=宋体][font=宋体]①同源替换,使用与鼠源对应部分具有较大同源性的[/font][font=Calibri]FR[/font][font=宋体]进行替换[/font][font=Calibri] [/font][/font][font=宋体][font=宋体]②表面重塑,对鼠源[/font][font=Calibri]CDR[/font][font=宋体]和[/font][font=Calibri]FR[/font][font=宋体]表面氨基酸残基进行重塑,以使其类似于人抗体[/font][font=Calibri]CDR[/font][font=宋体]的轮廓或者[/font][font=Calibri]FR[/font][font=宋体]型式[/font][font=Calibri] [/font][/font][font=宋体][font=宋体]③补偿变化,改编关键位置氨基酸残基,以补偿完全的[/font][font=Calibri]CDR[/font][font=宋体]移植[/font][font=Calibri] [/font][/font][font=宋体][font=宋体]④定位保守,人源化单抗以[/font][font=Calibri]FR[/font][font=宋体]保守序列为模板进行人源化,但保留鼠源单抗可变区的关键氨基酸残基。[/font][/font][font=宋体] [/font][font=宋体][b][font=Calibri]3[/font][font=宋体]、全人源抗体[/font][/b][/font][font=宋体][font=宋体]为了彻底消除异源性抗体的不良影响,[/font][font=Calibri]90[/font][font=宋体]年代以后,人们将噬菌体展示技术应用到抗体的表达和克隆上,产生了噬菌体抗体库技术。由此,抗体工程技术进入到了一个新的发展阶段,全人源化抗体的生产和应用也逐渐走向成熟。[/font][/font][font=宋体][font=宋体]全人源化抗体是指将人类抗体基因通过转基因或转染色体技术,将人类编码抗体的基因全部转移至基因工程改造的抗体基因缺失动物中,使动物表达人类抗体,达到抗体全人源化的目的。目前已建立多种方法生产完全人源性抗体,主要有噬菌体展示技术、转基因小鼠技术、核糖体展示技术和[/font][font=Calibri]RNA-[/font][font=宋体]多肽技术。[/font][/font][font=宋体] [/font][font=宋体] [/font][font=宋体][b]人源化抗体的应用[/b][/font][font=宋体]目前,人源化抗体在肿瘤,器官移植排斥反应,病毒感染,血液性疾病,自身免疫性疾病等方面的治疗和临床诊断中显示出越来越大的应用前景。[/font][font=宋体][font=Calibri]1[/font][font=宋体]、在肿瘤治疗中的应用[/font][/font][font=宋体]近年来,兴起的分子靶向治疗,是根本意义上的肿瘤特异性治疗手段,是以肿瘤抗原特异性结合的单抗为载体,连接放射性核素,化疗药物等对肿瘤有杀伤作用的负载而成的抗体导向疗法。其靶向性好,毒性小等特点,非常适合肿瘤的内放射治疗。采用该技术用于临床的人源性抗体有治疗转移性乳腺癌的赫赛汀,用于治疗结直肠癌的西妥昔单抗等。[/font][font=宋体][font=Calibri]2[/font][font=宋体]、自身免疫性疾病治疗[/font][/font][font=宋体]自身免疫疾病多于自身抗体异常增多有关。很多临床研究发现,一些具有免疫疾病的病毒感染患者,体内病毒水平常伴随某些免疫分子水平的升高而升高,因此很多免疫分子的人源化抗体在此类病毒的治疗中显示出很好的效果。[/font][font=宋体][font=Calibri]3[/font][font=宋体]、病毒感染中的应用[/font][/font][font=宋体]病毒感染几乎无特效药,现有的核苷酸类抗病毒药物效果并不理想,且毒副作用大,单抗治疗因其针对性强,和相对比较安全,已越来越多研究者将其应用于抗病毒的治疗中。[/font][font=宋体] [/font][font=宋体][font=宋体]目前义翘神州提供[url=https://cn.sinobiological.com/services/antibody-humanization-service][b]抗体人源化服务[/b][/url],详情可以关注:[/font][font=Calibri]https://cn.sinobiological.com/services/antibody-humanization-service[/font][/font]
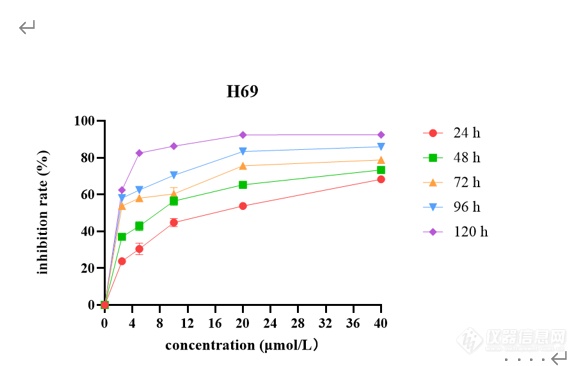
[font=黑体]西达本胺抑制[/font]SCLC[font=黑体]细胞增殖和凋亡[/font]CCK-8[font=宋体]药敏实验结果表明,[/font]SCLC[font=宋体]细胞系[/font]H69[font=宋体]、[/font]H446[font=宋体]、[/font]H526[font=宋体]、[/font]DMS114[font=宋体]经不同浓度西达本胺处理[/font] 24[font=宋体]、[/font]48[font=宋体]、[/font]72[font=宋体]、[/font]96[font=宋体]、[/font]120 h[font=宋体]后,细胞产生明显的增殖抑制现象,且随着药物浓度增加及作用时间延长,抑制作用逐渐增强,呈现出时间[/font]-[font=宋体]浓度依赖性,如图[/font]2[font=宋体]所示。同时得到西达本胺对四种细胞系作用[/font]72h[font=宋体]后的[/font]IC10[font=宋体]、[/font]IC20[font=宋体]、[/font]IC50[font=宋体]见表[/font]1-8[font=宋体]。结果显示四种细胞系对西达本胺均较为敏感,其中,与[/font]H69[font=宋体]相比,[/font]DMS114[font=宋体]对西达本胺相对不敏感。[/font][align=center][img]file:///C:/Users/Wang/AppData/Local/Temp/msohtmlclip1/01/clip_image002.png[/img] [img=,579,366]https://ng1.17img.cn/bbsfiles/images/2022/12/202212020948338518_7449_3237657_3.png!w579x366.jpg[/img][/align][align=center][font=宋体]不同浓度西达本胺作用不同时间后对[/font]H69[font=宋体]的增殖抑制情况[/font][/align][align=center] [/align][align=center][font=宋体]表[/font]1-8 [font=宋体]西达本胺作用[/font]72 h[font=宋体]后达到不同抑制效果的药物浓度([/font]μmol/L[font=宋体])[/font][/align] [table=95%][tr][td] [font=宋体]细胞名称[/font] [/td][td] [align=center] IC10[/align] [/td][td] [align=center] IC20[/align] [/td][td] [align=center] IC50[/align] [/td][/tr][tr][td] [align=center]H69[/align] [/td][td] [align=center][font='Times New Roman',serif]0.423[/font][/align] [/td][td] [align=center][font='Times New Roman',serif]0.632[/font][/align] [/td][td] [align=center][font='Times New Roman',serif]2.916[/font][/align] [/td][/tr][tr][td] [align=center]H446[/align] [/td][td] [align=center][font='Times New Roman',serif]0.404[/font][/align] [/td][td] [align=center][font='Times New Roman',serif]0.571[/font][/align] [/td][td] [align=center][font='Times New Roman',serif]1.033[/font][/align] [/td][/tr][tr][td] [align=center]H526[/align] [/td][td] [align=center][font='Times New Roman',serif]0.118[/font][/align] [/td][td] [align=center][font='Times New Roman',serif]0.261[/font][/align] [/td][td] [align=center][font='Times New Roman',serif]1.015[/font][/align] [/td][/tr][tr][td] [align=center]DMS114[/align] [/td][td] [align=center][font='Times New Roman',serif]1.272[/font][/align] [/td][td] [align=center][font='Times New Roman',serif]2.815[/font][/align] [/td][td] [align=center][font='Times New Roman',serif] 10.943[/font][/align] [/td][/tr][/table][font=黑体]西达本胺改变[/font]SCLC[font=黑体]细胞形态[/font][font=宋体]不同浓度([/font]0[font=宋体]、[/font]IC20[font=宋体]、[/font]IC50[font=宋体])西达本胺作用于[/font]H69[font=宋体]、[/font]H446[font=宋体]、[/font]H526[font=宋体]、[/font]DMS114[font=宋体]细胞[/font]48[font=宋体]及[/font]72 h[font=宋体]后在显微镜下观察细胞形态改变如图[/font]1-3[font=宋体]所示。随着药物浓度及作用时间的增加,[/font]SCLC[font=宋体]细胞系形态发生了变化,细胞增殖率减低。[/font]H69[font=宋体]团状细胞减少,单个凋亡细胞增多;[/font]H446[font=宋体]贴壁细胞减少,凋亡细胞增多,触角伸长,形状变得不规则;[/font]H526[font=宋体]细胞体积缩小,由片状变为球形团块,周围散在大量凋亡细胞;[/font]DMS114[font=宋体]由椭圆形变为长梭形,细胞内颗粒物增多,可见空泡,出现凋亡小体。由此可见,低剂量西达本胺即可影响[/font]SCLC[font=宋体]细胞形态,促进细胞凋亡,四种细胞系对西达本胺均较为敏感。[/font][img]file:///C:/Users/Wang/AppData/Local/Temp/msohtmlclip1/01/clip_image004.png[/img][align=center][img=,690,437]https://ng1.17img.cn/bbsfiles/images/2022/12/202212020948563335_146_3237657_3.png!w690x437.jpg[/img][/align][align=center] [/align][font=黑体]西达本胺诱导[/font]SCLC[font=黑体]细胞凋亡[/font][font=宋体]流式结果显示,用不同浓度([/font]0[font=宋体]、[/font]IC20[font=宋体]、[/font]IC50[font=宋体])西达本胺处理[/font]SCLC[font=宋体]细胞系[/font]48 h[font=宋体]后,四种亚型细胞系凋亡率均上升,且与加药浓度成正比,如图[/font]1-4 A[font=宋体]所示。[/font]48 h[font=宋体]检测在[/font]IC20[font=宋体]、[/font]IC50[font=宋体]浓度下[/font]H69[font=宋体]细胞凋亡率为[/font]8.45%[font=宋体]和[/font]14.46%[font=宋体],[/font]H446[font=宋体]细胞凋亡率为[/font]8.88%[font=宋体]和[/font]41.6%[font=宋体],[/font]H526[font=宋体]细胞凋亡率为[/font]11.48%[font=宋体]和[/font]20.77%[font=宋体],[/font]DMS114[font=宋体]细胞凋亡率为[/font]11.83%[font=宋体]和[/font]16.07%[font=宋体],与对照组相比,差异具有统计学意义([/font]P0.05[font=宋体])(图[/font]1-4 B[font=宋体])。为了进一步检测西达本胺在[/font]H69[font=宋体]、[/font]H446[font=宋体]、[/font]H526[font=宋体]、[/font]DMS114[font=宋体]四种细胞系中的作用差异,[/font][font=宋体]我们用[/font]1 μmol/L[font=宋体]的西达本胺分别处理[/font]H69[font=宋体]、[/font]H446[font=宋体]、[/font]H526[font=宋体]、[/font]DMS114[font=宋体]细胞[/font]48h[font=宋体]后进行流式细胞仪检测,结果如图[/font]1-4 C[font=宋体]所示,与[/font]DMS114[font=宋体]比较,[/font]H69[font=宋体]、[/font]H446[font=宋体]、[/font]H526[font=宋体]对西达本胺更敏感。[/font][img]file:///C:/Users/Wang/AppData/Local/Temp/msohtmlclip1/01/clip_image006.png[/img][align=center][img=,690,711]https://ng1.17img.cn/bbsfiles/images/2022/12/202212020949136557_2690_3237657_3.png!w690x711.jpg[/img][/align][align=center][font=黑体]图[/font][font=宋体]不同浓度([/font]0[font=宋体]、[/font]IC20[font=宋体]、[/font]IC50[font=宋体])西达本胺作用[/font]48 h[font=宋体]后[/font]H69[font=宋体]、[/font]H446[font=宋体]、[/font]H526[font=宋体]、[/font]DMS114[font=宋体]细胞凋亡率柱状图[/font][/align][align=center]. 1 μmol /L[font=宋体]西达本胺作用[/font]48 h[font=宋体]后对[/font]H69[font=宋体]、[/font]H446[font=宋体]、[/font]H526[font=宋体]、[/font]DMS114[font=宋体]细胞凋亡的影响[/font][/align][align=center] [/align] [font=黑体]西达本胺抑制[/font]SCLC[font=黑体]细胞克隆[/font][font=宋体]用不同浓度([/font]0[font=宋体]、[/font]IC20[font=宋体]、[/font]IC50[font=宋体])西达本胺处理[/font]SCLC[font=宋体]细胞系[/font]48 h[font=宋体]后,[/font][font=宋体]在细胞克隆第[/font]14[font=宋体]天,镜下观察细胞克隆情况并拍照(图[/font]1-5 A[font=宋体]),细胞单克隆数量随加药浓度增加而减少。各组细胞克隆形成率绘制成柱状图,如图[/font]1-5 B[font=宋体]所示,随着加药浓度增加细胞克隆形成率逐渐减小,与对照组相比,差异具有统计学意义([/font]P0.05[font=宋体])。[/font]H446[font=宋体]、[/font]DMS114[font=宋体]细胞[/font][font=宋体]进行了平板克隆实验,随着加药浓度的增加,克隆数明显减少,结果[/font][font=宋体]如图所示。[/font][b][img]file:///C:/Users/Wang/AppData/Local/Temp/msohtmlclip1/01/clip_image008.png[/img][/b][align=center][b][img=,690,425]https://ng1.17img.cn/bbsfiles/images/2022/12/202212020949347589_4119_3237657_3.png!w690x425.jpg[/img][/b][/align]
[font=宋体]在生物医药领域,抗体作为一类重要的生物分子,被广泛应用于疾病诊断、治疗以及基础研究中。其中,单克隆抗体和单链抗体是两种常见的抗体类型,尽管它们都是从杂交瘤或基因工程方法中获得,但在结构、功能和制备方法等方面存在显著差异。本文将对单克隆抗体和单链抗体的区别进行深入解析。[/font][font=宋体] [/font][b][font=宋体]一、结构差异[/font][/b][font=宋体] [/font][font=宋体][font=宋体][url=https://cn.sinobiological.com/resource/antibody-technical/mab-development][b]单克隆抗体[/b][/url]是由一个单一的[/font][font=Calibri]B[/font][font=宋体]细胞克隆产生,具有高度的均一性和特异性。其结构包括重链和轻链,通过二硫键连接在一起,形成一个完整的抗体分子。而单链抗体则是由一段柔性连接肽把抗体重链可变区([/font][font=Calibri]V~H[/font][font=宋体])和轻链可变区([/font][font=Calibri]V~L[/font][font=宋体])连接而成,是具有亲代抗体全部抗原结合位点的最小功能结构单位。单链抗体的结构相对简单,没有重链和轻链的连接,分子量也较小。[/font][/font][font=宋体] [/font][b][font=宋体]二、功能差异[/font][/b][font=宋体] [/font][font=宋体]单克隆抗体具有高度的特异性,可以用于疾病的诊断和治疗。由于其结构均一,单克隆抗体的生产和质量控制相对容易,因此在临床应用中具有较高的可靠性。而单链抗体则具有特异的抗原结合活性,能够较好地保持亲本抗体的抗原亲和活性,同时分子量小、结构简单,更适于抗体结构与功能的分析。此外,单链抗体还具有较好的组织穿透能力和低免疫原性等优点,使其在药物研发以及导向治疗等方面具有广泛的应用前景。[/font][font=宋体] [/font][b][font=宋体]三、制备方法差异[/font][/b][font=宋体] [/font][font=宋体][font=宋体]单克隆抗体的制备通常采用[url=https://cn.sinobiological.com/resource/antibody-technical/hybridoma-technology][b]杂交瘤技术[/b][/url],将能够产生特异性抗体的[/font][font=Calibri]B[/font][font=宋体]细胞与骨髓瘤细胞融合,形成杂交瘤细胞,再通过筛选和克隆化培养获得能够稳定分泌单克隆抗体的杂交瘤细胞系。这种方法需要经过多次筛选和克隆化培养,制备过程相对复杂。而单链抗体的制备则多采用基因工程方法,通过设计和构建基因表达载体,在体外表达单链抗体基因,然后进行分离和纯化得到单链抗体。这种方法相对简单快捷,但需要设计和构建基因表达载体,对技术要求较高。[/font][/font][font=宋体] [/font][font=宋体]综上所述,单克隆抗体和[url=https://cn.sinobiological.com/resource/antibody-technical/scfv-antibody-production][b]单链抗体[/b][/url]在结构、功能和制备方法等方面存在显著差异。在实际应用中,应根据具体需求选择合适的抗体类型。单克隆抗体具有高度的特异性和可靠性,适用于疾病的诊断和治疗;而单链抗体则具有特异的抗原结合活性、分子量小、结构简单等特点,适用于抗体结构与功能的分析、药物研发以及导向治疗等领域。随着生物技术的不断发展,相信单克隆抗体和单链抗体的应用前景将更加广阔。[/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州提供[url=https://cn.sinobiological.com/services/monoclonal-antibody-production-services][b]单克隆抗体制备服务[/b][/url]和[url=https://cn.sinobiological.com/services/fab-scfv-antibody-production-service][b]抗体片段生产服务[/b][/url],同时拥有一整套的抗体开发解决方案,包括免疫原制备、动物免疫、[/font][font=Calibri]scFv[/font][font=宋体]抗体库构建和筛选等步骤。此外,我们在[/font][font=Calibri]scFv[/font][font=宋体]抗体表达纯化方面具有丰富的经验,已成功为客户表达[/font][font=Calibri]di-scFvs[/font][font=宋体]、[/font][font=Calibri]tri-scFvs[/font][font=宋体]、[/font][font=Calibri]BiTE[/font][font=宋体]、[/font][font=Calibri]Diabody[/font][font=宋体]、[/font][font=Calibri]scFv-(H)IgG[/font][font=宋体]和[/font][font=Calibri]scFv-(L)IgG[/font][font=宋体]等多种[/font][font=Calibri]scFv[/font][font=宋体]形式。详情可以关注:[/font][font=Calibri]https://cn.sinobiological.com/services/fab-scfv-antibody-production-service[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]https://cn.sinobiological.com/services/monoclonal-antibody-production-services[/font][/font][font=宋体] [/font][b][font=宋体][font=宋体]义翘神州:蛋白与抗体的专业引领者,欢迎通过百度搜索[/font][font=宋体]“义翘神州”与我们取得联系。[/font][/font][/b]
[size=3][font=宋体]基本原理[/font][font=Times New Roman] [/font][/size][size=3][font=宋体]细胞凋亡早期改变发生在细胞膜表面,目前早期识别仍有困难。这些细胞膜表面的改变之一是磷脂酰丝氨酸([/font][font=Times New Roman]PS[/font][font=宋体])从细胞膜内转移到细胞膜外,使[/font][font=Times New Roman]PS[/font][font=宋体]暴露在细胞膜外表面。[/font][font=Times New Roman]PS[/font][font=宋体]是一种带负电荷的磷脂,正常主要存在于细胞膜的内面,在细胞发生凋亡时细胞膜上的这种磷脂分布的不对称性被破坏而使[/font][font=Times New Roman]PS[/font][font=宋体]暴露在细胞膜外。[/font][font=Times New Roman]Annexin V[/font][font=宋体]是一种[/font][font=Times New Roman]Ca+[/font][font=宋体]依赖的磷脂结合蛋白,最初发现是一种具有很强的抗凝血特性的血管蛋白,[/font][font=Times New Roman]Annexin V[/font][font=宋体]具有易于结合到磷脂类如[/font][font=Times New Roman]PS[/font][font=宋体]的特性。对[/font][font=Times New Roman]PS[/font][font=宋体]有高度的亲和性。因此,该蛋白可充当一敏感的探针检测暴露在细胞膜表面的[/font][font=Times New Roman]PS[/font][font=宋体]。[/font][font=Times New Roman]PS[/font][font=宋体]转移到细胞膜外不是凋亡所独特的,也可发生在细胞坏死中。两种细胞死亡方式间的差别是在凋亡的初始阶段细胞膜是完好的,而细胞坏死在其早期阶段细胞膜的完整性就破坏了。因此,可以建立一种用[/font][font=Times New Roman]Annexin V[/font][font=宋体]结合在细胞膜表面作为凋亡的指示并结合一种染料排除试验以检测细胞膜的完整性的检测方法。[/font][font=Times New Roman] [/font][/size][size=3][font=Times New Roman] [/font][/size][size=3][font=Times New Roman] [/font][/size][size=3][font=宋体]试剂与仪器[/font][font=Times New Roman] [/font][/size][size=3][font=Times New Roman] [/font][font=宋体]孵育缓冲液:[/font][font=Times New Roman]10mmol/L HEPES/NaOH[/font][font=宋体],[/font][font=Times New Roman]PH 7.4[/font][font=宋体],[/font][font=Times New Roman]140mmol/L NaCl[/font][font=宋体],[/font][font=Times New Roman]5mmol/L CaCl2 [/font][/size][size=3][font=Times New Roman] [/font][font=宋体]标记液:将[/font][font=Times New Roman]FITC- Annexin V[/font][font=宋体](宝灵曼公司产品)和[/font][font=Times New Roman]PI[/font][font=宋体]加入到孵育缓冲液中,终浓度均为[/font][font=Times New Roman]1ug/ml [/font][/size][size=3][font=Times New Roman] [/font][font=宋体]流式细胞仪[/font][font=Times New Roman] [/font][/size][size=3][font=Times New Roman] [/font][/size][size=3][font=Times New Roman] [/font][/size][size=3][font=宋体]实验步骤[/font][font=Times New Roman] [/font][/size][size=3][font=Times New Roman]1. [/font][font=宋体]细胞收集:悬浮细胞直接收集到[/font][font=Times New Roman]10ml[/font][font=宋体]的离心管中,每样本细胞数为([/font][font=Times New Roman]1~5[/font][font=宋体])×[/font][font=Times New Roman]106[/font][font=宋体],[/font][font=Times New Roman]/mL[/font][font=宋体] [/font][font=Times New Roman]500~1000r/min[/font][font=宋体]离心[/font][font=Times New Roman]5min[/font][font=宋体],弃去培养液。[/font][font=Times New Roman] [/font][/size][size=3][font=Times New Roman]2. [/font][font=宋体]用孵育缓冲液洗涤[/font][font=Times New Roman]1[/font][font=宋体]次,[/font][font=Times New Roman]500~1000r/min[/font][font=宋体]离心[/font][font=Times New Roman]5min[/font][font=宋体]。[/font][font=Times New Roman] [/font][/size][size=3][font=Times New Roman]3. [/font][font=宋体]用[/font][font=Times New Roman]100ul[/font][font=宋体]的标记溶液重悬细胞,室温下避光孵育[/font][font=Times New Roman]10~15min[/font][font=宋体]。[/font][font=Times New Roman] [/font][/size][size=3][font=Times New Roman]4. 500~1000r/min[/font][font=宋体]离心[/font][font=Times New Roman]5min[/font][font=宋体]沉淀细胞孵育缓冲液洗[/font][font=Times New Roman]1[/font][font=宋体]次。[/font][font=Times New Roman] [/font][/size][size=3][font=Times New Roman]5. [/font][font=宋体]加入荧光([/font][font=Times New Roman]SA-FLOUS[/font][font=宋体])溶液[/font][font=Times New Roman]4[/font][font=宋体]℃下孵育[/font][font=Times New Roman]20min[/font][font=宋体],避光并不时振动。[/font][font=Times New Roman] [/font][/size][size=3][font=Times New Roman]6. [/font][font=宋体]流式细胞仪分析:流式细胞仪激发光波长用[/font][font=Times New Roman]488nm[/font][font=宋体],用一波长为[/font][font=Times New Roman]515nm[/font][font=宋体]的通带滤器检测[/font][font=Times New Roman]FITC[/font][font=宋体]荧光,另一波长大于[/font][font=Times New Roman]560nm[/font][font=宋体]的滤器检测[/font][font=Times New Roman]PI[/font][font=宋体]。[/font][font=Times New Roman] [/font][/size][size=3][font=Times New Roman]7. [/font][font=宋体]结果判断:凋亡细胞对所有用于细胞活性鉴定的染料如[/font][font=Times New Roman]PI[/font][font=宋体]有抗染性,坏死细胞则不能。细胞膜有损伤的细胞的[/font][font=Times New Roman]DNA[/font][font=宋体]可被[/font][font=Times New Roman]PI[/font][font=宋体]着染产生红色荧光,而细胞膜保持完好的细胞则不会有红色荧光产生。因此,在细胞凋亡的早期[/font][font=Times New Roman]PI[/font][font=宋体]不会着染而没有红色荧光信号。正常活细胞与此相似。在双变量流式细胞仪的散点图上,左下象限显示活细胞,为([/font][font=Times New Roman]FITC-/PI-[/font][font=宋体]);右上象限是非活细胞,即坏死细胞,为([/font][font=Times New Roman]FITC+/PI+[/font][font=宋体]);而右下象限为凋亡细胞,显现([/font][font=Times New Roman]FITC+/PI-[/font][font=宋体])。[/font][/size]
[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=52162]流式细胞仪检测凋亡[/url][em03] [em03] [em04] [em04]

[font='calibri'][size=13px]什么是重组抗体?重组抗体的优势介绍[/size][/font]与传统抗体相比,重组抗体具有几个关键优势。这些包括良好的批次间一致性,持续供应以及对抗体工程的适应性. 因此,重组抗体在科学研究中的应用日益广泛,特别是作为解决持续存在的可重复性难题的一种手段。什么是重组抗体?传统的多克隆和单克隆抗体是正常 B 细胞发育和基因重组的产物。它们是通过用抗原免疫动物以引发免疫应答而产生的。多克隆抗体由许多不同的 B 细胞克隆分泌并识别多个抗原表位,而单克隆抗体则来自单个 B 细胞克隆,并且仅对单个表位具有特异性。重组抗体是单克隆抗体,但是其生产涉及体外遗传操纵。将抗体基因克隆到表达载体中后,将其转染到合适的宿主细胞系中进行抗体表达。哺乳动物细胞系最常用于重组抗体的生产,然而细菌、酵母或昆虫来源的细胞系也适用。①良好的批次间一致性由于重组抗体的生产涉及对抗体轻链和重链进行测序,因此这是一个高度可控且可靠的过程。相反,用于生产单克隆抗体的基于杂交瘤的系统容易发生遗传漂移和不稳定,从而增加了批次间变异或抗体表达缺失的可能性。重组抗体在批次之间高度一致,从而确保了可重复的实验结果。②可规模化体外生产抗体的方法适合大规模生产,这意味着抗体的可获得性不太可能成为限制因素。此外,由于重组抗体序列是已知的,因此确保了供应的连续性;如需将抗体用于大规模长期研究,这可能就是一个至关重要的因素。③顺应工程化了解抗体的肽序列为工程化提供了许多机会。这些包括同种型转换(也称为类转换)和种属转换,这两种方法都可以通过允许在实验中利用那个同种型或种属特定的二抗来增加多重实验的范围。工程学的进一步应用是使用体外抗体选择系统(例如抗体噬菌体展示)来改善抗体特异性。④无动物源性生产与传统的抗体生产方法不同,重组方法避免了使用动物的需要。多克隆抗体直接从免疫宿主血清中纯化,单克隆抗体从杂交瘤来源的组织培养上清液 (TCS) 或腹水中纯化,而重组抗体是从转染宿主细胞系的 TCS 中纯化。无论抗体是多克隆抗体、单克隆抗体还是重组抗体,在实验使用前都必须在预期应用中对其进行适当验证。在CST,我们遵守抗体验证标志,即在任何特定实验方法中的确定抗体特异性、敏感性和功能性的六个互补策略通过针对每种抗体产品精心定制这些策略,我们保证 CST 抗体适合用于帮助您获得可信赖的结果。[align=center][img=大规模重组抗体生产服务,690,191]https://ng1.17img.cn/bbsfiles/images/2023/05/202305241528536465_2058_5907840_3.png!w690x191.jpg[/img][/align]义翘神州已通过ISO9001认证,在规模化生产重组单克隆抗体方面积累了丰富的经验。我们拥有完善的大规模重组抗体表达生产平台,可提供从毫克级到公斤级重组抗体生产服务,满足客户高通量、大规模的生产要求。更多[url=https://cn.sinobiological.com/services/large-scale-antibody-production-service][b]大规模重组抗体生产服务[/b][/url]详情尽在:https://cn.sinobiological.com/services/large-scale-antibody-production-service
[font=宋体]抗体偶联是一种技术,它将抗体与另一种物质(如药物、毒素、荧光染料等)连接在一起,形成偶联物。这种偶联物可以用于治疗或诊断目的。在抗体偶联过程中,抗体的特异性结合能力被用来识别和结合靶细胞或靶分子,而偶联的物质则可以发挥治疗、标记或杀伤作用。抗体偶联技术在肿瘤治疗、免疫疗法、诊断试剂等领域有广泛应用。例如,在肿瘤免疫治疗中,抗体偶联技术可以用来制备抗体药物,通过结合肿瘤细胞表面的抗原,实现定向药物治疗,提高疗效并降低副作用。总之,抗体偶联技术是一种利用抗体的特异性识别能力与其它物质的特定功能相结合,实现定向治疗或诊断的技术。[/font][font=宋体] [/font][font=宋体][font=宋体]抗体药物偶联物[/font] [font=Calibri](antibody-drug conjugate[/font][font=宋体],[/font][font=Calibri]ADC)[/font][font=宋体]是一种生物技术药物,它通过将具有生物活性的小分子药物连接到[url=https://cn.sinobiological.com/resource/antibody-technical/monoclonal-antibody-production][b]单克隆抗体[/b][/url]上,利用单抗的特异性识别能力,将小分子药物精确地导向到目标细胞中。这样既提高了药物的疗效,又降低了对其他细胞的损伤。[/font][font=Calibri]ADC[/font][font=宋体]在癌症治疗等领域有广泛应用前景。[/font][/font][font=宋体] [/font][b][font=宋体]抗体偶联物研究前景如何?[/font][/b][font=宋体] [/font][font=宋体]一、肿瘤治疗领域[/font][font=宋体] [/font][font=宋体][font=宋体]抗体偶联物在肿瘤治疗领域具有巨大的潜力。利用抗体偶联物将药物定向输送至肿瘤细胞,可以实现对肿瘤的精准打击,提高疗效并降低副作用。随着免疫疗法的兴起,抗体偶联物在免疫治疗中也发挥着越来越重要的作用。例如,免疫检查点抑制剂、[/font][font=Calibri]CAR-T[/font][font=宋体]细胞疗法等免疫治疗方法中,抗体偶联物成为了重要的组成部分。未来,随着抗癌药物研发的不断推进,抗体偶联物在肿瘤治疗领域中的应用将更加广泛。[/font][/font][font=宋体] [/font][font=宋体]二、诊断领域[/font][font=宋体] [/font][font=宋体]抗体偶联物在诊断领域也有广泛的应用前景。通过将抗体偶联物与荧光染料、放射性同位素等标记物结合,可以对疾病进行灵敏、特异的诊断。例如,在免疫组织化学、[url=https://cn.sinobiological.com/services/immunofluorescence-service][b]免疫荧光染色[/b][/url]等病理学诊断中,抗体偶联物被广泛应用于标记抗原,提高检测的敏感性和特异性。此外,抗体偶联物还可以用于制备免疫检测试剂盒,用于临床检验和科研实验。未来,随着诊断技术的发展和个性化医疗的需求,抗体偶联物在诊断领域的应用将更加多样化。[/font][font=宋体] [/font][font=宋体]三、细胞疗法和基因治疗领域[/font][font=宋体] [/font][font=宋体]随着基因工程和细胞疗法的不断发展,抗体偶联物在细胞治疗和基因治疗等领域也展现出巨大的潜力。例如,将抗体偶联物与细胞因子、生长因子等结合,可以实现对细胞生长、分化的调控,为细胞疗法和再生医学提供新的手段。此外,抗体偶联物还可以用于基因治疗的靶向输送,提高基因治疗的效率和安全性。未来,抗体偶联物在细胞疗法和基因治疗领域中的应用将不断拓展,为疾病的治疗提供更多的可能性。[/font][font=宋体] [/font][font=宋体]四、技术进步和应用拓展[/font][font=宋体] [/font][font=宋体]抗体偶联物的应用前景还与其技术进步密切相关。随着抗体工程、连接子技术和药物递送技术的不断发展,抗体偶联物的稳定性、活性和靶向性将得到进一步提高。此外,随着生物技术的不断创新,抗体偶联物的研究也将不断拓展新的应用领域。例如,利用抗体偶联物进行体内成像、药物研发和疫苗开发等领域都可能取得重要进展。总之,抗体偶联物的研究前景非常广阔,随着技术的不断进步和应用领域的拓展,相信抗体偶联物将会在未来的生物医学领域中发挥更加重要的作用。[/font][font=宋体] [/font][font=宋体][font=宋体]更多[url=https://cn.sinobiological.com/resource/antibody-technical/recombinant-antibody-overview][b]重组抗体[/b][/url]详情可以参看:[/font][font=Calibri]https://cn.sinobiological.com/resource/antibody-technical/recombinant-antibody-overview[/font][/font][font=宋体] [/font][font=宋体] [/font][b][font=宋体][font=宋体]义翘神州:蛋白与抗体的专业引领者,欢迎通过百度搜索[/font][font=宋体]“义翘神州”与我们取得联系。[/font][/font][/b][font=Calibri] [/font]
[size=3][font=宋体]基本原理[/font][font=Times New Roman] [/font][/size][size=3][font=宋体]细胞凋亡早期改变发生在细胞膜表面,目前早期识别仍有困难。这些细胞膜表面的改变之一是磷脂酰丝氨酸([/font][font=Times New Roman]PS[/font][font=宋体])从细胞膜内转移到细胞膜外,使[/font][font=Times New Roman]PS[/font][font=宋体]暴露在细胞膜外表面。[/font][font=Times New Roman]PS[/font][font=宋体]是一种带负电荷的磷脂,正常主要存在于细胞膜的内面,在细胞发生凋亡时细胞膜上的这种磷脂分布的不对称性被破坏而使[/font][font=Times New Roman]PS[/font][font=宋体]暴露在细胞膜外。[/font][font=Times New Roman]Annexin V[/font][font=宋体]是一种[/font][font=Times New Roman]Ca+[/font][font=宋体]依赖的磷脂结合蛋白,最初发现是一种具有很强的抗凝血特性的血管蛋白,[/font][font=Times New Roman]Annexin V[/font][font=宋体]具有易于结合到磷脂类如[/font][font=Times New Roman]PS[/font][font=宋体]的特性。对[/font][font=Times New Roman]PS[/font][font=宋体]有高度的亲和性。因此,该蛋白可充当一敏感的探针检测暴露在细胞膜表面的[/font][font=Times New Roman]PS[/font][font=宋体]。[/font][font=Times New Roman]PS[/font][font=宋体]转移到细胞膜外不是凋亡所独特的,也可发生在细胞坏死中。两种细胞死亡方式间的差别是在凋亡的初始阶段细胞膜是完好的,而细胞坏死在其早期阶段细胞膜的完整性就破坏了。因此,可以建立一种用[/font][font=Times New Roman]Annexin V[/font][font=宋体]结合在细胞膜表面作为凋亡的指示并结合一种染料排除试验以检测细胞膜的完整性的检测方法。[/font][font=Times New Roman] [/font][/size][size=3][font=Times New Roman] [/font][/size][size=3][font=Times New Roman] [/font][/size][size=3][font=宋体]试剂与仪器[/font][font=Times New Roman] [/font][/size][size=3][font=Times New Roman] [/font][font=宋体]孵育缓冲液:[/font][font=Times New Roman]10mmol/L HEPES/NaOH[/font][font=宋体],[/font][font=Times New Roman]PH 7.4[/font][font=宋体],[/font][font=Times New Roman]140mmol/L NaCl[/font][font=宋体],[/font][font=Times New Roman]5mmol/L CaCl2 [/font][/size][size=3][font=Times New Roman] [/font][font=宋体]标记液:将[/font][font=Times New Roman]FITC- Annexin V[/font][font=宋体](宝灵曼公司产品)和[/font][font=Times New Roman]PI[/font][font=宋体]加入到孵育缓冲液中,终浓度均为[/font][font=Times New Roman]1ug/ml [/font][/size][size=3][font=Times New Roman] [/font][font=宋体]流式细胞仪[/font][font=Times New Roman] [/font][/size][size=3][font=Times New Roman] [/font][/size][size=3][font=Times New Roman] [/font][/size][size=3][font=宋体]实验步骤[/font][font=Times New Roman] [/font][/size][size=3][font=Times New Roman]1. [/font][font=宋体]细胞收集:悬浮细胞直接收集到[/font][font=Times New Roman]10ml[/font][font=宋体]的离心管中,每样本细胞数为([/font][font=Times New Roman]1~5[/font][font=宋体])×[/font][font=Times New Roman]106[/font][font=宋体],[/font][font=Times New Roman]/mL[/font][font=宋体] [/font][font=Times New Roman]500~1000r/min[/font][font=宋体]离心[/font][font=Times New Roman]5min[/font][font=宋体],弃去培养液。[/font][font=Times New Roman] [/font][/size][size=3][font=Times New Roman]2. [/font][font=宋体]用孵育缓冲液洗涤[/font][font=Times New Roman]1[/font][font=宋体]次,[/font][font=Times New Roman]500~1000r/min[/font][font=宋体]离心[/font][font=Times New Roman]5min[/font][font=宋体]。[/font][font=Times New Roman] [/font][/size][size=3][font=Times New Roman]3. [/font][font=宋体]用[/font][font=Times New Roman]100ul[/font][font=宋体]的标记溶液重悬细胞,室温下避光孵育[/font][font=Times New Roman]10~15min[/font][font=宋体]。[/font][font=Times New Roman] [/font][/size][size=3][font=Times New Roman]4. 500~1000r/min[/font][font=宋体]离心[/font][font=Times New Roman]5min[/font][font=宋体]沉淀细胞孵育缓冲液洗[/font][font=Times New Roman]1[/font][font=宋体]次。[/font][font=Times New Roman] [/font][/size][size=3][font=Times New Roman]5. [/font][font=宋体]加入荧光([/font][font=Times New Roman]SA-FLOUS[/font][font=宋体])溶液[/font][font=Times New Roman]4[/font][font=宋体]℃下孵育[/font][font=Times New Roman]20min[/font][font=宋体],避光并不时振动。[/font][font=Times New Roman] [/font][/size][size=3][font=Times New Roman]6. [/font][font=宋体]流式细胞仪分析:流式细胞仪激发光波长用[/font][font=Times New Roman]488nm[/font][font=宋体],用一波长为[/font][font=Times New Roman]515nm[/font][font=宋体]的通带滤器检测[/font][font=Times New Roman]FITC[/font][font=宋体]荧光,另一波长大于[/font][font=Times New Roman]560nm[/font][font=宋体]的滤器检测[/font][font=Times New Roman]PI[/font][font=宋体]。[/font][font=Times New Roman] [/font][/size][size=3][font=Times New Roman]7. [/font][font=宋体]结果判断:凋亡细胞对所有用于细胞活性鉴定的染料如[/font][font=Times New Roman]PI[/font][font=宋体]有抗染性,坏死细胞则不能。细胞膜有损伤的细胞的[/font][font=Times New Roman]DNA[/font][font=宋体]可被[/font][font=Times New Roman]PI[/font][font=宋体]着染产生红色荧光,而细胞膜保持完好的细胞则不会有红色荧光产生。因此,在细胞凋亡的早期[/font][font=Times New Roman]PI[/font][font=宋体]不会着染而没有红色荧光信号。正常活细胞与此相似。在双变量流式细胞仪的散点图上,左下象限显示活细胞,为([/font][font=Times New Roman]FITC-/PI-[/font][font=宋体]);右上象限是非活细胞,即坏死细胞,为([/font][font=Times New Roman]FITC+/PI+[/font][font=宋体]);而右下象限为凋亡细胞,显现([/font][font=Times New Roman]FITC+/PI-[/font][font=宋体])。[/font][/size]
[font='calibri'][size=13px]抗体fc段和Fab段什么意思?抗体的功能有哪些?[/size][/font]抗体(antibody),是一种由浆细胞(效应B细胞)分泌,被免疫系统用来鉴别与中和外来物质如细菌、病毒等的大型Y形蛋白质,仅被发现存在于脊椎动物的血液等体液中,及其B细胞的细胞膜表面。抗体能识别特定外来物的一个独特特征,该外来目标被称为抗原。Fab段:抗原结合片段(fragment of antigen binding,Fab),相当于抗体分子的两个臂,由一个完整的轻链和重链的VH和CH1结构域组成。Fc段:可结晶段(fragment crystallizable,Fc)相当于Ig的CH2和CH3结构域,是Ig与效应分子或者细胞相互作用的部位。由以上信息可以看出:Fab段包含完整的可变区,以及恒定区的CH1区域。Fc段仅指Ig恒定区CH2和CH3的区域,相当于Y字结构下面那一部分。抗体的功能有哪些?(1)特异性结合抗原:抗体本身不能直接溶解或杀伤带有特异抗原的靶细胞,通常需要补体或吞噬细胞等共同发挥效应以清除病原微生物或导致病理损伤。然而,抗体可通过与病毒或毒素的特异性结合,直接发挥中和病毒的作用。(2)激活补体:IgM、IgG1、IgG2和IgG3可通过经典途径激活补体,凝聚的IgA、IgG4和IgE可通过替代途径激活补体。(3)结合细胞:不同类别的免疫球蛋白,可结合不同种的细胞,参与免疫应答。(4)可通过胎盘及粘膜:免疫球蛋白G(IgG)能通过胎盘进入胎儿血流中,使胎儿形成自然被动免疫。免疫球蛋白A(IgA)可通过消化道及呼吸道粘膜,是粘膜局部抗感染免疫的主要因素。(5)具有抗原性:抗体分子是一种蛋白质,也具有刺激机体产生免疫应答的性能。不同的免疫球蛋白分子,各具有不同的抗原性。(6)抗体对理化因子的抵抗力与一般球蛋白相同:不耐热,60~70℃即被破坏。各种酶及能使蛋白质凝固变性的物质,均能破坏抗体的作用。抗体可被中性盐类沉淀。在生产上常可用硫酸铵或硫酸钠从免疫血清中沉淀出含有抗体的球蛋白,再经透析法将其纯化。(7)通过与细胞Fc受体结合发挥多种生物效应。①调理作用 IgG、IgM的Fc段与吞噬细胞表面的FcγR、FcμR结合,增强其吞噬能力,通常将抗体促进吞噬细胞吞噬功能的作用称为抗体的调理作用 (opsonization)。②发挥抗体依赖的细胞介导的细胞毒作用。义翘神州在重组抗体表达方面具有丰富的经验,除了表达全长抗体外,还可以表达各种形式的抗体片段,如单链抗体 (scFv)、抗原结合片段(Fab)、纳米抗体 (VHH) 和抗体融合蛋白 (antibody-fusion proteins)等。基于优化的哺乳动物蛋白平台,义翘神州可在HEK293或CHO细胞中的表达和生产Fab抗体片段。 利用此技术生产的Fab片段较酶切全长抗体获得的Fab片段具有更好的质量。scFv可以在微生物系统如E. coli中表达, 也可以通过瞬转技术在哺乳动物细胞中表达。义翘神州具备在不同系统中表达不同抗体片段的能力,您可以根据实际需求进行选择。您只需将抗体片段的基因序列发送给我们,义翘神州负责完成从基因合成到最终纯化抗体片段的整个过程。更多抗体片段生产服务可以参看:https://cn.sinobiological.com/services/fab-scfv-antibody-production-service
[font=宋体]主流的[url=https://cn.sinobiological.com/resource/antibody-technical/antibody-development][b]抗体开发平台[/b][/url]有多个,其中最常用的是基于杂交瘤技术的平台。该技术通过将免疫细胞与肿瘤细胞融合,产生能够产生抗体的杂交瘤细胞,从而制备出单克隆抗体。随着技术的发展,基于噬菌体展示技术的平台也逐渐成为主流。该技术通过将抗体片段与噬菌体蛋白融合,展示在噬菌体表面,从而筛选出具有所需特性的抗体。此外,基于转基因小鼠技术的平台也是常用的抗体开发平台之一。这些平台为抗体开发提供了强大的技术支持,使得研究人员能够快速、高效地开发出针对特定抗原的抗体。[/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州提供一站式的[url=https://cn.sinobiological.com/services/custom-antibody-services][b]定制抗体开发服务[/b][/url],包括多克隆抗体开发、单克隆抗体开发,以及针对特定应用的抗体开发,例如[/font][font=Calibri]ELISA[/font][font=宋体]、蛋白免疫印迹、免疫组化和流式细胞术。多年来,从抗原设计到抗体纯化和鉴定,我们花费了多年时间优化和调整抗体开发过程中的关键参数。我们以自主研发的技术和极具竞争力的效率为优势,为客户提供专业服务。由我们开发的高成功率和更高质量的抗体将使我们的客户受益其中。下面是义翘神州抗体开发平台:[/font][/font][font=宋体] [/font][font=宋体] [/font][font=宋体]①抗原制备[/font][font=宋体][font=宋体]义翘神州利用计算机辅助模拟和设计机制,开发出应用在多肽抗原设计中的自主研发技术。这种经过优化的方法大大地提高了抗体的质量和成功的概率。义翘神州还成功制备出[/font][font=Calibri]6000[/font][font=宋体]多种重组蛋白质,可线上购买,作为抗原用于免疫反应和筛选。[/font][/font][font=宋体] [/font][font=宋体] [/font][font=宋体]②优化小鼠杂交瘤技术[/font][font=宋体]义翘神州多年来一直致力于优化小鼠杂交瘤技术,极大程度提高抗体质量和成功率。因此,义翘神州已经开发出适用多种应用的优质抗体。[/font][font=宋体] [/font][font=宋体] [/font][font=宋体]③自主研发二代兔单克隆技术[/font][font=宋体]义翘神州花费多年时间优化其自主研发的兔单克隆抗体开发平台,该平台能以合理的成本制备出高亲和力的抗体。义翘神州曾利用该平台制备出优质兔单克隆抗体产品作为目录产品,还为定制客户开发过治疗性抗体候选产品,并取得了巨大的成功。义翘神州利用这一先进平台助力于全球客户开发兔单克隆抗体,作为试剂或治疗性候选产品。[/font][font=宋体] [/font][font=宋体] [/font][font=宋体]④重组抗体生产[/font][font=宋体][font=宋体]经过多年的工艺开发,义翘神州已建立四种抗体生产平台,可用于快速[url=https://cn.sinobiological.com/services/high-throughput-antibody-production-service][b]高通量抗体生产[/b][/url]和大规模抗体批量生产。从基因序列到纯化抗体([/font][font=Calibri]10[/font][font=宋体]克),只需几周时间,即可将成品送至您手中。义翘神州拥有先进的技术,极大节省了抗体生产的时间和成本。很多大型医药公司都利用我们的平台来支撑他们的抗体研究和开发项目。在过去的几年里,我们实现了几乎[/font][font=Calibri]100%[/font][font=宋体]的成功率,生产了成千上万的高质量单克隆抗体产品。为制药和生物技术领域客户带来了好的业务发展和市场营销。[/font][/font][font=宋体] [/font][font=宋体] [/font][font=宋体]⑤抗体应用验证平台[/font][font=宋体][font=宋体]义翘神州建立了多个抗体应用验证平台,包括[/font][font=Calibri]WB[/font][font=宋体]检测平台、免疫组化([/font][font=Calibri]IHC[/font][font=宋体])检测平台、流式([/font][font=Calibri]FACS[/font][font=宋体])检测平台、免疫荧光([/font][font=Calibri]IF[/font][font=宋体])检测平台以及免疫沉淀([/font][font=Calibri]IP[/font][font=宋体])检测平台。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]更多详情可以关注[/font][font=Calibri]https://cn.sinobiological.com/resource/antibody-technical/antibody-development[/font][/font]
[font=宋体][b]什么是纳米抗体?[/b][/font][font=宋体][font=宋体][url=https://cn.sinobiological.com/resource/antibody-technical/nanobody][b]纳米抗体[/b][/url]([/font][font=Calibri]nanobody, Nb[/font][font=宋体])是一种人工设计的抗体分子,又称为单域抗体([/font][font=Calibri]single-domain antibodies, sdAbs[/font][font=宋体])、[/font][font=Calibri]VHH[/font][font=宋体]抗体或[/font][font=Calibri]camelid[/font][font=宋体]抗体,是发现于羊驼、单峰驼等驼科以及鲨鱼、鳐鱼等软骨鱼中的一种天然缺失轻链的重链抗体([/font][font=Calibri]heavy-chain antibodies, HCAbs)[/font][font=宋体]。[/font][font=Calibri]1993[/font][font=宋体]年,比利时的科学家在骆驼的血清中发现了一种天然轻链缺失的重链抗体,分子量约[/font][font=Calibri]95 kDa[/font][font=宋体],其中包括两个恒定区([/font][font=Calibri]CH2[/font][font=宋体]和[/font][font=Calibri]CH3[/font][font=宋体])、一个铰链区和一个重链可变区([/font][font=Calibri]variable heavy chain domain, VHH[/font][font=宋体]),接着克隆得到只包含一个重链可变区的单域抗体,即[/font][font=Calibri]VHH[/font][font=宋体]抗体。[/font][font=Calibri]VHH[/font][font=宋体]抗体的晶体结构为[/font][font=Calibri]4 nm[/font][font=宋体]×[/font][font=Calibri]2.5 nm[/font][font=宋体]×[/font][font=Calibri]3 nm[/font][font=宋体]的椭圆形,分子量大小仅普通抗体的[/font][font=Calibri]1/10[/font][font=宋体],约[/font][font=Calibri]12-14 kDa[/font][font=宋体],是最小的完整抗原结合片段,因此又被称为纳米抗体。纳米抗体可用于肿瘤等疾病的治疗、疾病的检测、疫苗的研发等。[/font][/font][font=宋体] [/font][font=宋体] [/font][font=宋体][b]纳米抗体特性:[/b][/font][font=宋体] [/font][font=宋体][font=Calibri]1.[/font][font=宋体]高耐热性和稳定性[/font][/font][font=宋体] [/font][font=宋体][font=宋体]将不同的纳米抗体在[/font][font=Calibri]37[/font][font=宋体]℃放置[/font][font=Calibri]1[/font][font=宋体]周,结果其抗原结合活性均在[/font][font=Calibri]80%[/font][font=宋体]以上,表明纳米抗体在室温下保存相当稳定,这使其比常规抗体更易于储藏和运输。[/font][/font][font=宋体][font=宋体]比较了鼠单抗和纳米抗体在高达[/font][font=Calibri]90[/font][font=宋体]℃高温长时间处理的抗原结合活性,发现纳米抗体都保持了较高的活性仍能重新获得抗原结合能力,而所有常规抗体在[/font][font=Calibri]90[/font][font=宋体]℃处理后都丧失了活性,发生了不可逆的聚合。[/font][/font][font=宋体][font=宋体]在恶劣条件,如在高热、离液剂、存在蛋白酶和极度[/font][font=Calibri]pH[/font][font=宋体]值变性的条件下(如胃液和内脏中),正常抗体会失效或分解,而纳米抗体仍具有高度的稳定性。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]2.[/font][font=宋体]高抗原结合性:[/font][/font][font=宋体] [/font][font=宋体][font=宋体]纳米抗体独特的结构决定了其高抗原结合特性:纳米抗体较长的[/font][font=Calibri]CDR3[/font][font=宋体],可形成一稳定的暴露的凸环结构(凸环中具有稳定结构的二硫键),能够深入抗原内部以更好的结合抗原从而提高了其抗原特异性和亲和力。[/font][/font][font=宋体][font=宋体]而传统抗体[/font][font=Calibri]Fab[/font][font=宋体]片段及单链抗体[/font][font=Calibri]scFv[/font][font=宋体]的抗原结合表面常形成凹形拓扑结构[/font][font=Calibri], [/font][font=宋体]通常只能识别位于抗原表面的位点,因此纳米抗体[/font][font=Calibri]VHH[/font][font=宋体]单域具有更加广泛的抗原结合力,甚至当靶蛋白紧密包裹隐藏了普通抗体识别的位点时[/font][font=Calibri],[/font][font=宋体]纳米抗体也可以对其进行表位识别。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]3.[/font][font=宋体]较强的组织穿透力:[/font][/font][font=宋体] [/font][font=宋体]纳米抗体具有强而快的组织穿透能力,可以进入致密的组织如实体瘤发挥作用;并且多余未结合的纳米抗体能够很快的被清除,这相对于单克隆抗体组织穿透力差,不易被清除的不足,更有利于疾病的诊断。另外,纳米抗体能够有效的穿透血脑屏障,这样的特性为脑部给药提供了新方法,有望成为治疗老年痴呆症的新药。[/font][font=宋体] [/font][font=宋体][font=Calibri]4.[/font][font=宋体]高水溶性、高表达性[/font][/font][font=宋体] [/font][font=宋体][font=宋体]正常抗体[/font][font=Calibri]VH[/font][font=宋体]结构域单独表达时通常形成包涵体,或者暴露的疏水域相互黏附;而纳米抗体[/font][font=Calibri]VHH[/font][font=宋体]由于其[/font][font=Calibri]FR2[/font][font=宋体]中的疏水残基被亲水残基所取代,使得纳米抗体的水溶性增加,聚合性减少;而且即使以包涵体形式表达,也很容易复性,这样可以大大提高作为药物的利用率。[/font][/font][font=宋体][font=宋体]因纳米抗体分子量小、结构简单,由单一的基因编码,所以它很容易在微生物中合成,能在噬菌体、酵母等微生物中大量的表达,而且其相对价格低廉、可进行大规模生产,易于普及和应用。有报道,可通过酵母反应器酿造将纳米抗体的产量提高,每公升可达[/font][font=Calibri]1[/font][font=宋体]克的产量。[/font][/font][font=宋体] [/font][font=宋体][b]纳米抗体的应用优势[/b][/font][font=宋体] [/font][font=宋体][font=宋体]①用于生物医药研发(基因工程药物研发、[/font][font=Calibri]ADC[/font][font=宋体]药物研发);[/font][/font][font=宋体]②用于临床体外诊断(胶体金法、酶联免疫吸附法、电化学发光法);[/font][font=宋体]③用于肿瘤研究、免疫学研究等基础研究;申请具有自主知识产权的发明专利及科研奖项;[/font][font=宋体]④拓展研究思路、发表国际知名学术刊物。[/font][font=宋体] [/font][font=宋体][font=宋体]纳米抗体是一种非常有前景的下一代治疗性抗体技术,受到越来越多的研究机构和制药公司的关注。为支持纳米抗体药物的早期发现,义翘神州利用噬菌体抗体库技术自主研发了纳米抗体开发平台,已成功开发了多个纳米抗体候选分子。另外,我们的高通量纳米抗体表达平台,已成功表达和生产了多种纳米抗体形式,包括单价、多价或多特异性[/font][font=Calibri]VHH[/font][font=宋体],满足客户的各种定制需求。[/font][/font][font=宋体][font=宋体]更多详情可以关注:[/font][font=Calibri]https://cn.sinobiological.com/resource/antibody-technical/nanobody[/font][/font][font=Calibri] [/font]
[font='calibri'][size=13px]重组抗体的制备方法[/size][/font][font='calibri'][size=13px]及过程[/size][/font][font='calibri'][size=13px]分享[/size][/font]重组抗体,也称为基因工程抗体,是指通过DNA重组技术将抗体相应的基因序列根据需要进行改造和重组,并构建在质粒上,再通过蛋白外源表达技术将构建好的质粒转染/转化入适合的宿主细胞表达获得的抗体。重组抗体很好的解决了动物源抗体引起的人体排斥反应,使得抗体实现人源化,使抗体的效能更为完善抗体生产的三个阶段抗体广泛应用于疾病的诊断和治疗,是研究和应用领域最有价值的研究对象之一。抗体制备技术经历了三个阶段,第一阶段,通过抗原免疫高等动物,从动物的血清中纯化获得抗体,该抗体为多克隆抗体;第二阶段,杂交瘤技术问世,通过将无限增殖的骨髓瘤细胞与产生抗体的B淋巴细胞融合生产出针对单一抗原决定簇的单克隆抗体;第三阶段,通过基因工程技术改造动物生产的单克隆抗体的基因序列,使单抗性能更加符合应用需要,并能通过大规模细胞培养获得,该阶段抗体为重组抗体。重组抗体有哪些类型?重组抗体分为五大类:嵌合抗体、人源化抗体、全人源化抗体、小分子抗体、双特异性抗体嵌合抗体抗体的恒定区和可变区分别来源于不同的物种,常见的嵌合抗体是将动物源抗体的可变区与人源抗体的恒定区结合。嵌合抗体的特点:1. 抗体可变区为动物源区域,保留了抗体对抗原的特异性和亲和性 2. 抗体有近70%的部分是人源的,很大程度上降低了抗体的异源性,其中人源性Fc片段能有效介导ADCC(抗体依赖性细胞介导的细胞毒效应)和CDC(补体依赖的淋巴细胞毒效应)作用;3. 可以根据需要选择不同的抗体类型、亚型、大小、修饰位点等;4. 通过成熟的质粒构建体系及蛋白表达平台,可高效大量的获得目的抗体。嵌合抗体的生产方式:①免疫动物,获得杂交瘤细胞②杂交瘤细胞测序,获得抗体可变区序列③选择人源恒定去亚型④构建重组表达质粒⑤转入合适的宿主细胞表达⑥抗体纯化及检测人源化抗体将人抗体的CDR区域替换成动物源单抗的CDR,也称CDR嫁接抗体。CDR:即互补决定区(complementarity-determining regions),抗体每个可变区含有三个氨基酸顺序超变区,这些超变区是抗原的结合位点,与抗原决定簇结构互补,被称为CDR。可变区里其他氨基酸作为骨架支持部分,称为框架残基(Framework Residue)。人源化抗体特点:1. 人源化抗体在嵌合抗体的基础上将抗体中人源性区域进一步扩大,人源化比例可达80%-90%,使得抗体在应用过程中降低人体的异源排斥反应;2. CDR与抗原结合过程受到FR区域的影响,动物源CDR与人源Fr结合,可能会改变抗体原有CDR的空间结构,进而降低重组抗体与抗原的亲和力。在设计人源化抗体时,可将人源FR区域的关键性氨基酸残基更改为动物源FR,以减少对CDR结构域的影响。人源化抗体生产方式:重组抗体的类型及生产流程全人源化抗体采用基因敲出技术将动物抗体基因敲除,造成动物抗体基因缺失,将人类抗体基因通过转基因或转染色体技术,移至抗体基因缺失动物中,通过动物表达人类抗体,达到抗体完全人源化。采用动物基因敲除和插入的方式获得抗体,操作难度大,成本高,并且依然存在人体排斥反应,噬菌体展示技术应运而生。将人抗体的可变区基因插入到噬菌体外壳蛋白结构基因的适当位置,人抗体可变区随噬菌体外壳蛋白的表达而表达,同时,随噬菌体的重新组装而展示到噬菌体表面。再通过展示库筛选和细胞表达获得全人源抗体。重组抗体的载体如何选择?全人源化抗体特点:全人源化抗体对人体的免疫原性极小,是抗体药研发最重要的对象,在疾病和癌症的治疗中具备广泛的应用,非常具备研究和生产价值。全人源化抗体生产方式:重组抗体的类型及生产流程小分子抗体小分子抗体顾名思义是分子量较小的抗体,一般为完整Ig的一部分,现有的小分子抗体有Fab、Fv、 scFv、SdAb、微抗体、纳米抗体。重组抗体的类型及生产流程小分子抗体特点:小分子抗体分子量大小只有完整Ig大小的1/12~1/2,穿透性强,同时具备抗原亲和力,并且可通过基因工程系统来操作编辑,通过各种重组蛋白表达系统来大量生产。小分子抗体生产方式:重组抗体的类型及生产流程双特异性抗体具备两种特异性抗原结合位点的抗体,可同时与两种抗原结合,例如可同时结合靶细胞(癌症细胞)和效应细胞(T细胞),定向介导效应细胞对靶细胞的杀伤作用,是抗体药物领域的重要研究对象,在肿瘤治疗方面具有卓越的成效。双特异性抗体特点:1. 拥有两种特异性抗原结合位点,作为抗体药物,是治疗肿瘤的“抗体炸弹”,比普通的抗体药具有更强的导向性、更强的治疗效果,是最为理想的肿瘤治疗药物;2. 自然状态不存在,只能通过人工制备获得。双特异性抗体生产方式:[align=left][font='calibri'][size=13px]义翘神州推出[/size][/font][font='calibri'][size=13px]大规模重组抗体生产服务[/size][/font][font='calibri'][size=13px],服务周期大概在4-10周;[/size][/font][/align][size=13px]服务内容[/size][size=13px]可以查看:[/size][url=https://cn.sinobiological.com/services/large-scale-antibody-production-service][size=13px]https://cn.sinobiological.com/services/large-scale-antibody-production-service[/size][/url][size=13px] 里面有更详尽的内容服务。[/size]
[font=宋体][url=https://cn.sinobiological.com/resource/antibody-technical/recombinant-antibody-overview][b]重组抗体[/b][/url],也被称为重组免疫球蛋白,是通过基因工程技术将抗体的基因在合适的宿主细胞中表达并生产出来的一类抗体。与传统的多克隆抗体和单克隆抗体相比,重组抗体具有更高的特异性和亲和力,并且可以针对特定的抗原表位进行设计和优化。[/font][font=宋体] [/font][font=宋体][font=宋体]重组抗体的类型包括嵌合抗体、双特异性抗体、抗体片段和[/font][font=Calibri]Fc[/font][font=宋体]融合蛋白等。下面一起来看一下他们各种的应用:[/font][/font][font=宋体]①[url=https://cn.sinobiological.com/resource/antibody-technical/chimeric-monoclonal-antibody][b]嵌合抗体[/b][/url][/font][font=宋体][font=Calibri]1975[/font][font=宋体]年,杂交瘤技术的发现彻底改变了抗体研究和临床开发。然而,鼠源性抗体的疗效受到人抗鼠抗体([/font][font=Calibri]HAMA[/font][font=宋体])效应的限制,鼠源性单抗对人体具有异种蛋白的免疫原性 [/font][font=Calibri],[/font][font=宋体]在人体内半衰期较短。[/font][font=Calibri]1984[/font][font=宋体]年,研究人员通过基因工程构建了第一个嵌合抗体,也是公认的第一种重组抗体,以降低鼠源抗体在人体内的免疫原性。其中,约[/font][font=Calibri]30%-35%[/font][font=宋体]的分子来源于小鼠的抗体序列,约[/font][font=Calibri]65%-70%[/font][font=宋体]来源于人的抗体序列。所得嵌合抗体保留了亲代小鼠抗体的抗原结合能力。抗体嵌合是开发治疗性人源化抗体的第一步。义翘神州采用[/font][font=Calibri]CDR[/font][font=宋体]移植技术和计算机辅助分子建模,提供高质量的单克隆抗体人源化服务,成功率高,人源化程度[/font][font=Calibri]90%[/font][font=宋体]。[/font][/font][font=宋体] [/font][font=宋体]②抗体片段[/font][font=宋体][font=宋体]每一个完整的免疫球蛋白([/font][font=Calibri]IgG[/font][font=宋体])分子包含通过二硫键连接的两条重链和两条轻链。抗体片段(如[/font][font=Calibri]Fab[/font][font=宋体]、[/font][font=Calibri]scFv[/font][font=宋体]和[/font][font=Calibri]VHH[/font][font=宋体])体积小,比其全长抗体具有更好的组织或肿瘤穿透力。因此,它们在免疫治疗方面具有巨大的前景,尤其是在实体瘤方面。此外,它们的半衰期也较短,可用作放射性显像剂。然而,由于缺乏[/font][font=Calibri]Fc[/font][font=宋体]区,它们不能引起[/font][font=Calibri]Fc[/font][font=宋体]介导的抗体效应功能,如抗体依赖性细胞毒性([/font][font=Calibri]ADCC[/font][font=宋体])和补体依赖性细胞毒性([/font][font=Calibri]CDC[/font][font=宋体])。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]起初采用酶解法对[/font][font=Calibri]IgG[/font][font=宋体]抗体进行片段化。胃蛋白酶作用于铰链区二硫键所连接的两条重链的近[/font][font=Calibri]C[/font][font=宋体]端,水解产生被称为[/font][font=Calibri]F(ab[/font][font=宋体]’[/font][font=Calibri])2[/font][font=宋体]的二价[/font][font=Calibri]Fab[/font][font=宋体]片段。然后,通过木瓜蛋白酶将该片段裂解为两个相同的[/font][font=Calibri]Fab[/font][font=宋体]片段。然而,酶解法限制了可制备的抗体片段类型,而且不适合工业化大规模生产和纯化。随着抗体工程技术的进步,这些问题可以通过重组生产抗体片段来解决。抗体基因克隆测序成功后,可通过瞬时转染在原核表达系统(如大肠杆菌)和哺乳动物系统([/font][font=Calibri]HEK293[/font][font=宋体]细胞)中表达抗体片段。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]凭借丰富的重组生产经验,义翘神州建立了高通量[/font][font=Calibri]VHH[/font][font=宋体]表达平台,交付了多个[/font][font=Calibri]VHH[/font][font=宋体]抗体生产项目,总体成功率超过[/font][font=Calibri]90%[/font][font=宋体]。除了常见的[/font][font=Calibri]VHH[/font][font=宋体]形式,我们还可以表达双特异和多特异[/font][font=Calibri]VHH[/font][font=宋体]。此外,义翘神州还可以表达其他各种高特异性和亲和力的抗体片段,如[/font][font=Calibri]scFv[/font][font=宋体]和[/font][font=Calibri]Fab[/font][font=宋体]。[/font][/font][font=宋体] [/font][font=宋体]③[url=https://cn.sinobiological.com/resource/antibody-technical/bispecific-antibody][b]双特异性抗体[/b][/url][/font][font=宋体][font=宋体]与常规单克隆抗体不同,双特异性抗体([/font][font=Calibri]bsAb[/font][font=宋体])具有两个结合位点,可识别同一抗原上两个不同抗原或表位。由于这一特性,双特异性抗体备受研究者和制药业的关注。截止目前,美国食品药品监督管理局([/font][font=Calibri]FDA[/font][font=宋体])已批准了[/font][font=Calibri]4[/font][font=宋体]种双抗药物,而且[/font][font=Calibri]160[/font][font=宋体]多种双抗正在进行临床试验,用于治疗癌症、糖尿病、阿尔茨海默病和其他疾病。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]起初,双特异性抗体通过四源杂交瘤技术制备,但这对下游抗体生产和纯化构成了巨大的挑战。随着过去[/font][font=Calibri]20[/font][font=宋体]年重组[/font][font=Calibri]DNA[/font][font=宋体]技术的发展,出现了几种双特异性抗体形式,以适应所需的靶标[/font][font=Calibri]-[/font][font=宋体]产品特征。为了解决重链错配问题,[/font][font=Calibri]Genentech[/font][font=宋体]首先提出了“[/font][font=Calibri]knob-into-hole[/font][font=宋体]”([/font][font=Calibri]KiH[/font][font=宋体])技术,该技术通过对[/font][font=Calibri]CH3[/font][font=宋体]结构域进行改造,在每条重链中创建一个“[/font][font=Calibri]knob[/font][font=宋体]”或一个“[/font][font=Calibri]hole[/font][font=宋体]”,以诱导异源二聚化。同样地,研究人员也采用了[/font][font=Calibri]common light chain [/font][font=宋体]和[/font][font=Calibri]CrossMab[/font][font=宋体]等其他技术来解决轻链错配问题。表达双特异性抗体主要在哺乳动物细胞中进行。由于单克隆抗体和双特异性抗体之间的各种结构相似性,许多已建立的常规单抗纯化工艺也可适用于双特异性抗体。(参见另一篇文章:“双特异性抗体:抗体治疗中的新星”)[/font][/font][font=宋体] [/font][font=宋体][font=宋体]④[/font][url=https://cn.sinobiological.com/resource/protein-review/fc-fusion-proteins][b][font=Calibri]Fc[/font][font=宋体]融合蛋白[/font][/b][/url][/font][font=宋体][font=Calibri]Fc[/font][font=宋体]融合蛋白(又称[/font][font=Calibri]Fc[/font][font=宋体]嵌合融合蛋白、[/font][font=Calibri]Fc-Ig[/font][font=宋体]和[/font][font=Calibri]Fc[/font][font=宋体]标签蛋白)是一种同源二聚体,由免疫球蛋白的[/font][font=Calibri]Fc[/font][font=宋体]段与具有生物学活性的蛋白分子组成。虽然单克隆抗体是治疗性生物制剂开发的重点,但[/font][font=Calibri]Fc[/font][font=宋体]融合蛋白也是一类成功的生物制药产品,至少有[/font][font=Calibri]13[/font][font=宋体]种药物获得了欧洲药品管理局([/font][font=Calibri]EMA[/font][font=宋体])和美国[/font][font=Calibri]FDA[/font][font=宋体]的批准。除治疗应用外,[/font][font=Calibri]Fc[/font][font=宋体]融合蛋白还是基础研究中的检测试剂,包括流式细胞术、免疫组织化学和蛋白结合试验。事实上,与[/font][font=Calibri]Fc[/font][font=宋体]区的连接可以提高一些结合蛋白的溶解度和稳定性。鉴于其大小和对糖基化的需求(大多数是糖蛋白),[/font][font=Calibri]Fc[/font][font=宋体]融合蛋白主要在哺乳动物表达系统中产生。[/font][/font][font=宋体] [/font][font=宋体] [/font][font=宋体][font=宋体]目前,抗体工程技术取得了一定的进步,这极大地促进了各种形式重组抗体的开发,用于疾病治疗。[/font][font=Calibri]FDA[/font][font=宋体]已批准了[/font][font=Calibri]100[/font][font=宋体]多种抗体药物,目前有多种抗体处于临床后期开发阶段。此外,重组抗体还可用于许多研究应用:蛋白免疫印迹([/font][font=Calibri]WB[/font][font=宋体])、免疫组织化学([/font][font=Calibri]IHC[/font][font=宋体])、免疫荧光([/font][font=Calibri]IF[/font][font=宋体])、流式细胞术([/font][font=Calibri]FC[/font][font=宋体])和表面等离子体共振([/font][font=Calibri]SPR[/font][font=宋体])。[/font][/font][font=宋体] [/font][font=宋体]总之,重组抗体是基因工程技术的重要应用之一,其类型多样,具有广泛的应用前景。随着基因工程技术的发展,重组抗体的生产成本和安全性问题也将得到进一步优化,为临床治疗和科学研究提供更多有效的工具。同时,我们也应该认识到重组抗体的潜在风险和挑战,加强对其安全性和有效性的评估和监管,以确保其能够更好地服务于人类的健康事业。[/font][font=宋体] [/font][font=宋体][font=宋体]更多重组抗体详情关注:[/font][font=Calibri]https://cn.sinobiological.com/news/recombinant-antibodies-formats[/font][/font][font=宋体] [/font][font=Calibri] [/font]
[font=宋体][font=宋体]抗体融合蛋白是一种将抗体片段与功能蛋白融合表达的重组蛋白,具有抗体的特性和功能蛋白的活性。它可广泛应用于免疫诊断、免疫治疗、抗体纯化、抗体和抗原的定量分析以及免疫导向药物的制备等领域。根据结合的[/font][font=Calibri]Ig[/font][font=宋体]片段的不同,可以将抗体融合蛋白分为[/font][font=Calibri]Fab[/font][font=宋体]融合蛋白、[/font][font=Calibri][url=https://cn.sinobiological.com/resource/protein-review/fc-fusion-proteins][b]Fc[/b][/url][/font][font=宋体][url=https://cn.sinobiological.com/resource/protein-review/fc-fusion-proteins][b]融合蛋白[/b][/url]与[url=https://cn.sinobiological.com/resource/antibody-technical/scfv-antibody-production][b]单链抗体([/b][/url][/font][font=Calibri][url=https://cn.sinobiological.com/resource/antibody-technical/scfv-antibody-production][b]scFv[/b][/url][/font][font=宋体][url=https://cn.sinobiological.com/resource/antibody-technical/scfv-antibody-production][b])[/b][/url]融合蛋白。制备抗体融合蛋白的方法主要有化学交联法和基因工程技术,其中基因工程技术是目前主要的方法。在制备过程中,需要注意两蛋白间的接头序列的长度,以确保蛋白质的折叠和稳定性。抗体融合蛋白在免疫学、生物制药和医学等领域具有广泛的应用前景,为疾病的诊断、治疗和药物研发提供了新的工具和方法。[/font][/font][font=宋体] [/font][b][font=宋体][font=宋体]双特异性抗体如何与蛋白融合[/font][font=Calibri]?[/font][/font][/b][font=宋体] [/font][font=宋体]双特异性抗体是一种特殊的抗体,具有两个不同的抗原结合位点。通过技术手段,可以将双特异性抗体与另一种蛋白质融合。[/font][font=宋体] [/font][font=宋体]①使用基因工程技术,将双特异性抗体的基因与目标蛋白质的基因进行融合,然后通过表达载体在细胞内表达融合蛋白质。[/font][font=宋体] [/font][font=宋体]②使用化学手段,将双特异性抗体与目标蛋白质进行化学偶联。这需要使用特定的化学偶联剂,将双特异性抗体的特定基团与目标蛋白质的特定基团连接起来。[/font][font=宋体] [/font][font=宋体]需要注意的是,融合蛋白质的功能和性质取决于其组成成分的特性和比例,因此在融合过程中需要谨慎选择和设计组成成分,以确保融合蛋白质具有所需的功能和性质。[/font][font=宋体] [/font][b][font=宋体]抗体融合蛋白具有广泛的应用,包括但不限于以下方面:[/font][/b][font=宋体] [/font][font=宋体]①免疫诊断:抗体融合蛋白可以用于检测抗原,如病毒、细菌、肿瘤标志物等。通过将抗体片段与荧光蛋白、酶等标记物结合,可以实现对抗原的高灵敏度检测。[/font][font=宋体]②免疫治疗:抗体融合蛋白可以用于治疗肿瘤、感染性疾病等。通过将抗体片段与细胞毒素、免疫调节因子等效应分子结合,可以实现对肿瘤细胞的靶向杀伤或调节免疫反应。[/font][font=宋体]③抗体纯化:抗体融合蛋白可以用于分离和纯化抗体。通过将抗体片段与亲和标签结合,可以利用亲和层析等技术实现对抗体的纯化和富集。[/font][font=宋体]抗体和抗原的定量分析:抗体融合蛋白可以用于定量分析抗体和抗原的浓度。通过将抗体片段与荧光染料等标记物结合,可以利用流式细胞术等技术实现对抗体和抗原的定量分析。[/font][font=宋体]④免疫导向药物的制备:抗体融合蛋白可以用于制备免疫导向药物,即将药物与抗体片段结合,利用抗体的特异性结合能力,将药物定向引导至病变部位,提高药物的疗效并降低副作用。[/font][font=宋体] [/font][font=宋体][font=宋体]更多[url=https://cn.sinobiological.com/resource/antibody-technical/bispecific-antibody][b]双特异性抗体[/b][/url]详情可以关注:[/font][font=Calibri]https://cn.sinobiological.com/resource/antibody-technical/bispecific-antibody[/font][/font][font=宋体] [/font][b][font=宋体][font=宋体]义翘神州:蛋白与抗体的专业引领者,欢迎通过百度搜索[/font][font=宋体]“义翘神州”与我们取得联系。[/font][/font][/b]
[em03] [em03] [em04] [em04] [img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=52163]流式细胞仪检测凋亡2[/url]把一 二放在一个文件夹下然后打开就行!!!