感受态细胞的制备(一)制备新鲜或冷冻的大肠杆菌感受态细胞 下述操作方案是由Hanahan(1983)提供的,所制备的大肠杆菌DHl、DH5和MM249感受态细胞培养物能使每微克超螺旋DNA以≥5x108转化菌落的频率进行转化,其他大多数大肠杆菌菌株的最高转化率大约只有前述菌株的1/10-1/5。尽管如此,实际上对所有克隆方面的用途来说,这已绰绰有余。一些大肠杆菌菌株(如MC1061)不适于此法。下列有3个因素对于获得持续高的转化频率来说是至关重要的:(1)转化缓冲液中试剂的纯度 务必使用所能得到的最高质量的试剂,这些试剂应分装成小份,避光保存于冷处。(2)细胞的生长状态 由于一些不清楚的原因,直接用贮存于-70┴冰冻培养基中的贮存原种搠种而进持培养的细菌,所得到的转化效率最高,不应使用在实验中的贮存原咱接种崦进持培养的细菌,所得到的转效率最高,不应使用在实验室中连续传代,贮存于4℃或贮存于室温的培养物。(3)玻璃和塑料器皿的清洁度 痕量的去污剂或其他化学物质的存在可能大大地降低细菌的论效率,所以最好拨出一批玻璃器皿专用于制备感受态细菌,而不作它用。这些玻璃器皿应用手洗刷,再灌满纯水(Milli-Q级或与其相当的级别),然后高压灭菌,临用前方把水倒掉。细心操作的话,几乎总是可以获得转化效率高的感受态细胞,每微克超螺旋DNA可能得到5x107-1x108个转化菌落。然而甚至经验最为丰富的工作者也不可能保证持有必要用标准的螺旋质粒DNA制品来检测每一批新的感受态细胞的转化效率。制备感受态细胞前,先制备一大批黧的螺旋质粒DNA,分装成许多小份贮存于-70℃。这些标准制品可用来检验每一批新的感受态细胞的转化效率,并检查每一个实验的转化效率。设立这样一个阳性对照后,如果某一次实验得不到转化菌落,就可以根据对照的情况查明宣究竟是感受态细菌方面有庇漏,还是DNA制品间有差异。分装的感受态细菌可在-70℃保存几个月而转效率无明显下降。1)用无菌铂丝直接蘸取冻存有大肠杆菌DHl株(或DH5株、MM249株原种)(贮存于-70℃的冻培养基上,见附录A),在SOB琼脂平板表面划线, 于37℃培养16小时。将冰冻的细菌融化,铂丝在冻存细菌原种的表面划过时,已带上足量的细菌,因此一管冻存细菌原种可使用多次。2)将4-5个分隔良好的菌落转移到1ml含20mmol/L MgSo4的SOB中,菌落直径为1-2mm。中速振荡使细菌分散,然后在1L锥瓶中用30-100ml含20mmol/LMgSO4的SOB稀释培养物。3)于37℃将细菌培养0.5-3.0小时,为达到高效转化,活细胞数务必少于108细胞/ml,可每隔20-30分钟测定OD600值来检测培养物的生长情况。在菌株与菌株之间,OD600值和每毫升中活细胞数间的关系变化很大,因此有必要通过测量特定大肠杆菌菌株的生长培养物在生长周期的不同时相的OD600值,并将各稀释度的培养物铺于无抗生素的LB琼脂平皿以计算每时相的活细胞数,从而使分光光度读数得到标化。4)在无菌条件下将细菌转移到一个无菌、一次性使用的、用冰预冷的50ml聚丙烯管(Falcon 2070)中,在冰上放置10分钟,使培养物冷却至0℃。切记:下述所有步骤均需无菌操作。5)于4℃用Sorvall GS3转头(或与其相当的转头)以4000转/分离心10分钟, 回收细胞。6)倒出培养液,将管倒置1分钟以使最后残留的痕量培养液流尽。7)用约20ml(每个50ml管)用冰预冷的转化缓冲液(对于TFB''见表1.3;对于FSB,可参见表1,4)轻轻振荡,重悬沉淀(若制备需立即使用的感受态细胞可用TFB:若制备需要贮存于-70℃的感受态细胞则用FSB),将重悬细胞冰浴10分钟。8)于4℃用Sorvall GS3转头或与其相当的转头)以4000转.分离心10分钟,回收细胞。9)倒出培养液,将管倒置1分钟以使最后残留的痕量培养液流尽。10)用4ml(每个50ml管)用冰预冷的TFB或FSB轻轻振荡重悬沉淀。按步骤11)a给出的操作程序制备立即使用的感受态细胞,而步骤11)b制德贮存于-70℃留待以后使用的感受态细胞。11)a.新鲜感受态细胞的制备a)将140μl DnD溶液加到每一悬液的中心,立即轻轻旋转以混匀悬液,然后在冰上放置15分钟。DnD溶液二硫苏糖醇(DTT) 1.53gDMSO 9.0ML1mol/L乙酸钾(pH78.5) 100μl水至 10MLDnD溶液作可耐受人机溶剂的Millex SR膜(Millipore)过滤除菌,将DnD溶液分装成160μl小份放入0.5ml的无菌微量离心管中,密封管口,贮存于-20℃。DMSO的氧化产物,据推测可能是二甲硫醚,是转化的掏物。为避免这个问题,应购买质量最好的DMSO。应将所购试剂分装成10ml小份,放入无菌试管,密封管口,贮存于-70℃。每小份只用1次,用后弃去。1mol/L乙酸钾(pH7.5)的配法。b)每管再加140μlDnD溶液,轻轻旋转混匀之,将悬液置于冰上,再放15分钟。c)将小份悬液分装到冷却的无菌聚丙烯管(Falcon 2059''17x100mm)中,将管置于冰上。就大多数克隆方面的用途来说,50μl感受细胞悬液已绰绰有余。然而,如需要更大量的转化菌落(如构建cDNA文库),每小份感受态细胞的量可能需要加大些.加入DNA后,于42℃短暂加热感受态细胞,这是一个关键步骤,务必以正确的升温速度使细胞加温到正确的温度。下面给出的所有时间和温度是用Falcon 2059型管获得的数据,其他类型的管未必可产生相同的结果。b.冻存的感受态细胞的制备a)每4ml重悬细胞加140 μl DMSO,轻轻旋转混匀之,将悬液置冰上15分钟。b)每份悬液再加140μl DMSO,轻轻旋转混匀之,重新放入冰浴中。c)迅速将悬液分装到冷却的无菌的微时离心管中,封紧管口,没入液氮中快速冰冻感受态细胞。贮存于-70℃备用。就大多数克隆方面的用途来说,50μl感受态细胞悬液已绰绰有余。然而,如需要更大量的转化菌落(如构建cDNA文库),每小份感受态细胞的量可能需要加大些。d)需要时,从-70℃冰箱中取出一管感受态细胞,把管握于手民主,融化细胞。细胞一经融化,立即把管转移至冰浴中,在冰上放置10分钟。e)用一冷却的无菌吸头把感受态细胞转移到冷却的无菌聚丙烯管中(Falcon2059''17x100mm)中,放置在冰浴上。加入DNA后,于42℃短暂加热感受态细胞,这是一个关链步骤,务必以正确的升温速度使细胞如温到正确的温度。下面给出的所有时间和温度是用Falcon 2059试管获者的数据,其他类型的管未必可产生相同的结果。12)将DNA加入到感受态细胞中,轻轻旋转几认混匀内容物。在冰上放置30分钟。为得到最佳结果,DNA溶液的体积不应超过感受态细胞体积的5%。转化体的数量相对于所加入的DNA量近妣例地增加,直至系统达到饱和,尽管感受态细胞在不同批次之间有一些差异,50μl感受态细胞通常可被约lng超粒DNA所饱和。虽然再加DNA也不影响转化体的总产量,但使用过多的DNA将降低系统的效率(以每微克DNA所获转化体的数量来衡量)。当所转化的DNA很难得时(如用从相对难得的样品中提取mRNA而合成的cDNA),这就显得格外重要。为最大限度地提高转化菌落的数目,可把现有DNA分置于几小份感受态细胞中,以期系统不致饱和。试验中一定包括下面的对照:a.加入已知量的标准超螺旋质粒DNA制品的感受态细胞。b.完全不加质粒DNA的感受态细菌。13)将管放入预加温到42℃的循环水浴中放好的试管加架上,恰恰放置90秒,不要摇动试管。14)快速将管转移到冰浴中,使细胞冷却1-2分钟。15)每管加800μl SOC培养基(见附录A)。用水浴将培养基加温至37℃,然后将管转移到37℃摇床上,温育43分钏使细菌复苏并表达质粒编码的抗生素抗性标记基因。为最大限度地提高转化效率,复苏期中应温放地摇动细胞(转速225转/分)。16)将适当体积(每个90m平板达200μl)已转化的感受态细胞转移到含20mmol/L MgSO4和相应抗生素的SOB琼脂培养基上。如培养物体积太小(〈10μl),可再加肉汤培养基,用一无菌的弯头玻棒轻轻地将转化的细胞涂到琼脂平表面。如在一个90mm平板上铺200μl以上的感受态细胞,应离心浓缩细胞(于室温用Sorvall SS34转头(或与其相当的转头)以4000转/分离心10分钟),然后用适量SOC轻轻重悬细胞。如用四环素抗性作为选择标记,全部的转化混合物可以铺在一个单独的平皿上(或铺在软琼脂中)。然而如选用氨苄青霉素抗性,则只能将一部分培养物(根据实验决定)铺在单独的平皿上,氨苄青霉素抗性菌落数的曾加与平皿上所加细菌数的增加并无线性比例关系,这可能是因为被抗生素杀死的细胞可释放生长抑制物质的缘故。\par 17)将平板置于室温直至液体被吸收。18)倒置平皿,于37℃培养,12-16小时后可出现菌落。如检查氨苄青霉素抗性,用转化细胞铺平板时密度应较低(每个90mm平板不超过104菌落),于37℃培养平板时不应超过20小时。氨苄青霉素抗性的转化体可将β-内酰胺酶分泌到培养基中,迅速灭活菌落周围区域中的抗生素。这样,铺平板时懊度太高或培养时间太长都会导致出现对氨苄青霉敏感的卫星菌落。在造
[size=10px][font=&]大肠杆菌宿主菌株作为受体细胞,当这些受体细胞经过([/font][font=&]CaCl[/font][font=&][sub]2[/sub][/font][font=&])处理时,它们的细胞膜通透性会发生暂时性的改变,从而成为能够允许外源[/font][font=&]DNA[/font][font=&]分子进入的感受态细胞。[/font] [b]一、感受态细胞 [font=&]1.感受态:[/font][/b][font=&]受体细胞最容易接受外源基因并将其转化的一种[b]生理状态[/b]。[/font][b][font=&]2.感受态细胞:[/font][/b][font=&]受体细胞通过理化方法处理,使其处于最适摄取和容纳外来DNA的生理状态的细胞。[/font][b][font=&]3.感受态菌龄:[/font][/b][font=&][/font][font=&]细胞的感受态一般出现在[b]对数生长期[/b],新鲜幼嫩的细胞是制备感受态和实现成功转化的关键。[/font] [b][font=&]4.质粒转化:[/font][/b][font=&]质粒DNA或以他为载体构建的重组子导入细菌的过程。[/font] [/size] [b][size=10px]二、感受态细胞制备的原理[/size][/b] [size=10px][b][font=&]1.外源基因表达的条件:[/font][/b][font=&]重组[/font][font=&]质粒必须通过转化进入细菌细胞内,才能进行扩增和表达,从而获得大量的克隆基因。[/font][b][font=&]2.感受态制备原理:[/font][/b]将快速生长的大肠杆菌置于经低温0℃预处理的低渗氯化钙溶液中,便会造成细胞膨胀(渗透作用),同时,[font=&]Ca[/font][sup]2+[/sup]会使细胞膜磷脂双分子层形成液晶结构,促使细胞外膜与内膜间隙中的部分核酸酶解离开来,离开所在区域,诱导细胞成为感受态细胞。[b][font=&]3.质粒转化原理:[/font][/b]感受态细胞细胞膜通透性发生变化,极易与外源DNA相粘附并在细胞表面形成抗脱氧核糖核酸酶的羟基-磷酸钙复合物。将该体系转移到42℃下做短暂的热刺激90s,细胞膜的液晶结构会发生剧烈扰动,并随机出现许多间隙,外源DNA就可能被细胞吸收。 [b]4.外源基因表达:[/b]进入细胞的外源DNA分子通过复制、表达,实现遗传信息的转移,使受体细胞出现新的遗传性状。将转化后的细胞在选择性培养基上(相应抗生素抗性)培养,筛选出带有外源DNA分子的阳性克隆。 [b]三、感受态细胞的制备([font=&]CaCl[/font][font=&][sub]2[/sub][/font]法) [font=&]1. 受体菌种活化:[/font][/b][font=&]取[/font][font=&]-80℃[/font][font=&]冰箱中保藏的菌株(如[/font][font=&]DH5α[/font][font=宋体]、[/font][font=&]Top10、DE3、BL21等)[/font][font=&]在[/font][font=&]LB[/font][font=&]平板(无抗性)上划线分离,放置于[/font][font=&]37℃[/font][font=&]恒温培养箱中倒置培养。[/font][b][font=&]2. 受体菌培养:[/font][/b][font=&]从[/font][font=&]LB[/font][font=&]平板上挑取单菌落,接种于10mLLB液体培养基中,[/font][font=&]37℃[/font][font=&]震荡培养12h左右至对数生长中后期。[/font][b][font=&]3. 菌种的准备:[/font][/b][font=&]将受体菌菌悬液以2%的接种量接种于装有20mLLB液体培养基(无抗性)中,37℃震荡培养大约2-3h至OD600=0.4-0.5,菌落数[/font][font=&]<[/font][font=&]10[/font][font=&][sup]8[/sup][/font][font=&]cfu/mL[/font][font=&]。[/font][/size][align=center][size=10px] [/size][/align][size=10px][font=&][/font][b][font=&]4. 感受态细胞的制备:[/font][/b][font=&][/font][b][font=&](1)离心:[/font][/b][font=&]把上述菌液转移至1.5mL离心管中,冰浴10min,在4℃,3000r/min,离心10min。[/font][b][font=&](2)重悬冰浴:[/font][/b][font=&]弃上清液,加入10mL预冷的0.05M 的CaCl[sub]2[/sub]溶液,轻轻混匀,冰浴30min后,在4℃,3000r/min,离心10min。[/font][b][font=&](3)重悬:[/font][/b][font=&]弃上清,加入6mL预冷的含15%甘油的0.05MCaCl[sub]2[/sub]溶液,轻轻混匀,冰上放置几分钟,即成感受态细胞悬液。或弃上清,加入6mL预冷0.05MCaCl[sub]2[/sub]溶液,轻轻混匀,冰上放置几分钟,即成感受态细胞悬液,直接使用。[/font][b][font=&](4)分装:[/font][/b][font=&]用[url=https://insevent.instrument.com.cn/t/9p][color=#3333ff]移液枪[/color][/url]分装重悬液至1.5mL离心管中,每个离心管中分装50μL悬浮液。[/font][b][font=&](5)保藏:[/font][/b][font=&]标记贴标签[/font][font=&],使之迅速冷冻,-80℃保藏备用。 [/font][b]五、质粒化学转化[font=&]1.取感受态:[/font][/b][font=&]如果感受态细胞保藏于-80℃,从-80℃冰箱中取一支感受态,室温下解冻后立即冰浴;如果感受态细胞没有保藏,可以直接用于转化。[/font][b][font=&]2.质粒处理:[/font][/b][font=&]一般质粒为粉末,1ng质粒添加10μL缓冲液或蒸馏水,混匀。[/font][b][font=&]3.转化:[/font][/b][font=&][/font][font=&]在含有50μL感受态细胞的离心管中加入1μL稀释后的标准质粒充分混匀,冰上静置30min。[/font][b][font=&]4.热击:[/font][/b][font=&]将离心管置于42℃热击60-90s,然后迅速冰浴,使细胞冷却2-3 min。[/font][b][font=&]5.培养:[/font][/b][font=&]向离心管中加入已预热的无菌LB培养基(无抗性)300μL,150rpm、37℃恒温震荡培养45min。[/font][b][font=&]6.涂布:[/font][/b][font=&]吸取100μL菌液于LB固体培养基上(含抗性),用涂布器均匀涂布,放置于[/font][font=&]37℃恒温培养箱中倒置培养12-16h。 [/font][b][font=&]7.转化率计算:[/font][/b][font=&][/font] [font=&]转化后在含抗生素的平板上长出的菌落即为转化子,根据此皿中菌落数可计算出转化子总数和转化效率,公式如下:[/font] [font=Times New Roman, serif]转化总数=菌落数×稀释倍数×转化反应原液总体积/涂板菌液体积[/font] [font=Times New Roman, serif]转化率=转化子总数/质粒[/font][font=&]DNA[/font][font=Times New Roman, serif]加入量[/font][font=&]μg[/font] [font=&]理论上转化率最高为每微克的标准质粒转化的菌落数为1×10[/font][sup]10 [/sup][font=&]。[/font] [b]六、注意事项 [font=&]1. 严格无菌操作[/font][/b][font=&][/font] [font=&]操作过程,注意进行无菌操作,避免环境中杂菌污染。[/font] [b][font=&]2.严格控制温度[/font][/b][font=&][/font] [font=&] 操作过程,要注意操作温度,以保持细胞的状态;[/font] [font=&]加入抗生素时注意温度,避免过高温度导致抗生素失活。[/font] [b][font=&]3. 严格控制浓度[/font][/b][font=&][/font] [font=&]严格控制细胞的生长阶段和菌浓,严格控制质粒DNA的质量和浓度,以提高转化效率。 [/font] [font=&][/font] [b][font=&]4. 计算转化率[/font][/b][font=&][/font] [font=&]记录和计算转化率的指标如转化子总数、感受态细胞总数和转化频率以评估转化效率。[/font][/size]
酵母感受态的制备:1. 取500-1000微升的酵母感受态菌株,加入到3到5毫升的新YPDA培养基中,30度震荡5-8小时,250rpm2. 取5微升摇好的感受态菌液加到25-50毫升的新YPDA培养基中,30度震荡培养15-20小时,浓度0.15-0.3(视情况想快点可多取点少摇一会)3. 离心700g,5分钟室温下,倒掉上清加入25-100毫升的新YPDA培养基,把菌体摇起来摇匀,30度震荡培养3-5小时4. 离心700g,5分钟室温下,倒掉上清,无菌水重悬(5-10毫升)5. 离心700g,5分钟室温下,倒掉上清,1.5毫升(1倍TE和LiAc的混合液)重悬,并转移到2毫升的离心管中6. 高速离心15秒(12000就可以)去上清加入50微升乘以感受态管数的量(1倍TE和LiAc的混合液)重悬并分装。感受态已制成7. 吸取50微升感受态到1.5或2.0的离心管中,加入5到15微升的质粒100ng(及5微升的carrier DNA有了加没有可以不加)8. 加入500微升的PEG/LiAc(1倍TE和LiAc、 PEG 40%的混合液)轻轻混匀9. 30培养30min,10分钟震荡一次10. 加入20微升的DMSO混匀11. 42度热激15min,每5min混匀一次12. 高速离心15秒,去掉上清加入500-800微升的YPDA或YPD plus重悬,30度培养,(转化时是可选步骤,筛库转化时需要培养90min)13. 离心去上清,以0.9%的生理盐水重悬。(可选步骤)14. 吸取100微升涂板,pGBKT→SD/-Trp→Y2H pGADT→SD/-Leu→Y187
感受态是指细菌处于容易吸收外源DNA的状态。转化是指质粒DNA或以它为载体构建的重组子导人细菌的过程。其原理是细菌处于0℃,CaCl2低渗溶液中,菌细胞膨胀成球形。转化混合物中的DNA形成抗DNA酶的羟基—钙磷酸复合物粘附于细胞表面,经42℃短时间热击处理,促进细胞吸收DNA复合物。将细菌放置在非选择性]培养基[/url]中保温一段时间,促使在转化过程中获得的新的表型(如Amp[sup]r[/sup]等)得到表达,然后将此细菌培养物涂在含有氨苄青霉素的选择性[://]培养基[/url]上。重组质粒转化宿主细胞后,还需对转化菌落进行筛选鉴定。利用α互补现象进行筛选是最常用的一种鉴定方法。现在使用的许多载体都具有一段大肠杆菌β半乳糖苷酶的启动子及其编码α肽链的DNA序列,此结构称为[i]lac[/i]Z'基因。[i]lac[/i]Z'基因编码的α肽链是β半乳糖苷酶的氨基端的短片段(146个氨基酸)。任何携带着[i]lac[/i]Z'基因的质粒载体转化了染色体基因组存在着此种β半乳糖苷酶突变的大肠杆菌细胞后,便会产生出有功能活性的半乳糖苷酶,在IPTG(异丙基β—D—硫代半乳糖苷)诱导后,在含有Xgal(5-溴-4-氯-3-吲哚-6-D-半乳糖苷)的培养基平板上形成蓝色菌落(半乳糖苷酶能将无色的化合物Xgal切割成半乳糖和深蓝色的底物5-溴-4-靛蓝)。而当有外源DNA片段插入到位于[i]lac[/i]Z'中的多克隆位点后,就会破坏α肽链的阅读框,从而不能合成与受体菌内突变的β半乳糖苷酶相互补的活性α肽,而导致不能形成有功能活性的β半乳糖苷酶,也就不能分解Xgal而显蓝色,因此含有重组质粒载体的克隆往往是白色菌落。[仪器、材料与试剂](一) 仪器和材料 超净工作台、低温离心机、恒温摇床、恒温箱、恒温水浴、离心管、试管、培养皿、锥形瓶、接种针、玻璃涂棒、酒精灯、镊子、牙签、大肠杆菌DH5a 、质粒(二) 试剂0.1mol/L CaCl2溶液 LB液体培养基 LB固体培养基 氨苄青霉素(Amp):用无菌水配制成100mg/mL溶液,置—20℃冰箱保存。Xgal:将Xgal溶于二甲基甲酰胺,配成20mg/mL,不需过滤灭菌,分装小包装,避光贮存于-20℃。IPTG:取2g IPTG溶于8mL双蒸水中,再用双蒸水补至10mL,用0.22um滤膜过滤除菌,每份1mL,贮存于-20℃。[实验步骤](一) 制备感受态细胞1、吸取15µl E.coil菌液,接种于20ml LB液体培养基中,37℃振荡培养过夜,待OD600=0.5左右将该菌悬液以1:50接种量转于50ml LB液体培养基中,37℃振荡扩大培养,当培养液开始出现混浊后,每隔20-30min测一次OD600,至OD600=0.6左右,停止培养。2、培养液转入离心管中,在冰浴10min,4℃下5000rpm离心10min。3、弃上清液,用4ml冰预冷的0.1M CaCl2溶液轻轻悬浮菌体至均匀,冰上放置30min。4、4℃下5000rpm离心6min。5、弃上清液,用2ml冰预冷的0.1M CaCl2溶液轻轻悬浮菌体至均匀,冰上放置片刻后即制成感受态细胞悬液。6、以上制好的感受态细胞悬液可在冰上放置,24小时内直接用于转化实验,也可加入15%高压灭菌过的甘油,混匀后,分装于1.5ml离心管中,每管100µ l感受态细胞悬液,置-70℃条件下保存。.(二) 质粒DNA转化大肠杆菌1、取100µl摇匀后的感受态细胞悬浮液(如是冷冻保存液,则需化冻后马上进行下面的操作),加入5µl连接产物,轻轻摇匀,冰上放置30min后,于42 IPTG水浴中保温90s,然后迅速在冰上冷却2min。2、加入900µl LB液体培养基,则总体积约1ml,混匀于37℃振荡培养90分钟使受体菌恢复正常生长状态并使转化体产生抗药性Amp[sup]r[/sup]。3、在预制的LB琼脂平板上,加40uL 20mg/mL的Xgal和4uL 200mg/mL的IPTG溶液,并用灭菌玻璃推子(酒精灯上烧后冷却),均匀涂布于琼脂凝胶表面,37℃倒置吸收。4、将恢复培养的菌体4000rpm离心5min,移去上层900µl LB培养基,用余下的100µl重悬菌体至均匀。(四) α互补现象的检查将重悬菌体均匀涂布于含X-gal+IPTG+氨苄青霉素的LB平板上,37℃倒置培养12—24h,出现菌落。其中白色菌落从理论上讲为重组克隆。如果进一步验证,可挑取多个白色菌落分别接种到1ml含有氨苄青霉素的LB液体培养基中,37℃振荡培养6-8h,然后提取质粒酶切验证,或进行菌落PCR扩增鉴定。

两片段连接 通常是指目的片断和载体片断的连接,包括①小片段(目的片断小于载体片断的大小)和载体片段的连接,这种情况多些,也比较容易连接,按照说明书要求的比例进行即可,比如TAKARA的pMD19-T Simple Vector连接时Vector DNA和Insert DNA的摩尔比一般为1 :2~10即可,如果效果不佳,检测一下感受态细胞,如果片断过小比如几十bp,连接时要加大小片段的摩尔数,多连几管,挑选白斑,以上是指双酶切后的连接,即载体和目的片断俩端的酶切位点相同;②大片段(目的片断与载体片断的大小差不多甚至大于载体的大小)和载体片段的连接,目的片断与载体片断的大小差不多的情况应尽量避免,因为这会给目的片断胶回收带来麻烦,我就遇到过这种情况,胶回收时很是费尽,最后勉强分开,当然换个载体也许就解决问题了。我做过3000多bp和pMD19-T Simple Vector的连接,开始不行,后来成功了,连接率不高,我的经验是如果感受态细胞没问题,那就反复试目的片断和载体片断的连接比例,可以超出此范围1 :2~10一试。[img]http://ng1.17img.cn/bbsfiles/images/2017/10/200971143528_01_1613111_3.jpg[/img]
实验原理DNA重组是将外源DNA与载体分子连接,这样重新组合的DNA叫做重组体或重组子。DNA重组的方法主要有粘端连接法和平端连接法。 重组的DNA分子是在DNA连接酶的作用下,有Mg2+、ATP存在的连接缓冲系统中,将分别经酶切的载体分子与外源DNA分子进行连接。常用的DNA连接酶是T4噬菌体DNA连接酶,它不但能使粘性末端的DNA分子连在一起,而且能使平末端的双链DNA分子连接起来,但这种连接的效率比粘性末端的连接效率低,一般可通过提高T4噬菌体DNA连接酶浓度或增加DNA浓度来提高平末端的连接效率。如果是单酶切,为了防止载体本身的自身连接,可以用牛小肠碱性磷酸酶(CIP)处理,去掉酶切后5'端的磷酸。这样做能有效防止质粒的自身环化,降低转化的背景,大大提高重组子的筛出效率。连接反应的温度在37℃时有利于连接酶的活性,但是在这样的温度下,粘性末端的氢键结合是不稳定的。一般的连接条件是在12-16℃,反应12-16小时(过夜),这样既可最大限度地发挥连接酶的活性,又兼顾到粘性末端短暂配对结构的稳定。连接产物转化宿主细胞后,还须对转化菌落进行筛选鉴定,挑选出所需的重组质粒。仪器、材料与试剂一、仪器1.恒温摇床2.恒温水浴3.恒温培养箱4.小型高速离心机二、材料1. 氨苄青霉素2. BamHI3. HindIII4. T4 DNA连接酶5. pQE-31 和pUC18-CAT 质粒6. 培养皿7. 接种针8. 金属涂棒9. 1.5mL 离心管10.酒精灯11.镊子、灭菌牙签等三、试剂DNA琼脂糖胶纯化试剂盒实验步骤一、质粒DNA提取的pQE-31和pUC18-CAT 质粒。二、制备重组DNA1. 在灭菌的1.5mL 离心管中,加入pQE-31质粒10mL(2mg/mL),2mL酶切缓冲液,1mL BamHI 和HindIII酶 的混合液(各含10个单位),无菌双蒸水7mL,至反应混合物总体积为20mL,离心混匀,37℃反应过夜。2. 在另一无菌1.5mL 离心管中,加pUC18-CAT 质粒20mL,加入3mL酶切反应液,lmL BamHI和HindIII酶的混合液,无菌双蒸水补到30mL,37℃反应过夜。3. 反应完毕后取5mL pQE-31质粒的酶切液做电泳分析,检验酶切是否完全。酶切完全,进行下一步。4. 将酶切处理的后pQE-31和pUC18-CAT 质粒,分别上样跑琼脂糖凝胶电泳(注意加DNA分子量标准)。电泳结束后用DNA琼脂糖胶纯化试剂盒按照试剂盒说明书的方法回收DNA片段。前者回收的片段为3.5kb,后者为650bp。5. 将回收的pQE-31载体质粒均分为两份,其中一份与酶切后回收的CAT片段混合,做连接;另一份不加CAT片段,做对照。操作如下:在10mL DNA样品中,加T4 DNA连接酶缓冲液1mL,T4 DNA连接酶1mL,14℃(室温)过夜,然后做大肠杆菌的转化。三、转化感受态细胞1. 制备的感受态细胞(-20℃保存的)。2. 在100mL的融化后处于冰浴的感受态细胞中,加入10mL连接产物,混匀,冰上放置30分钟,以后的操作参照实验一进行。同时做未加CAT片段的空白pQE-31载体质粒连接处理后的感受态细胞转化的对照。实验结果过夜培养后,实验组和对照组的两个培养皿上都可能会出现一些菌落。如果实验组的菌落数明显多于对照组的菌落,则是好征兆,但实验组中出现的菌落是否含有所需的DNA重组子还须进一步鉴定。
所谓亚克隆就是对已经获得的目的DNA片段进行重新克隆,其目的在于对目的DNA进行进一步分析,或者进行重组改造等。亚克隆的基本过程包括:(1)目的DNA片段和载体的制备;(2)目的DNA片段和载体的连接;(3)连接产物的转化;(4)重组子筛选。 一、试剂准备1.LB液体培养基:胰化蛋白胨(细菌培养用)10g,酵母提取物(细菌培养用) 5g,NaCl 10g,加ddH2O 至1000ml,完全溶解,分装小瓶,15lbf/in2高压灭菌20min。2.1.5%琼脂LB固体培养基: 称取1.5g琼脂粉放入300ml锥形瓶,加100ml LB,15 lbf/in2 高压灭菌20min,稍冷却,制备平皿。3.IPTG、X-Gal4.0.1M MgCl2 :15 lbf/in2高压灭菌20min,0℃冰浴备用。5.0.1M CaCl2(以20%甘油水溶液配制):15 lbf/in2高压灭菌20min,0℃冰浴备用。6.限制性核酸内切酶、T4 DNA连接酶。二、目的DNA片段和载体的制备选择适宜的限制性核酸内切酶,消化已知目的DNA和载体,获得线性DNA,用于重组。根据目的DNA和载体的具体情况,选择一种或者两种适当的限制酶切割,分别产生对称性粘性末端(用一种限制性内切酶进行消化而产生带有互补突出端)、不对称粘性末端(用两种不同的限制性内切酶进行消化而产生带有非互补突出端)、平端。在亚克隆时,首选不对称相容末端连接,次选对称性粘性相容性末端连接,由于平末端连接效率较低,通常很少采用。但有时目的片段的末端与载体不匹配 ,一般先将不匹配末端补平,然后再以平末端连接。(实验操作同前述) 三、利用T4 DNA连接酶进行目的DNA片段和载体的体外连接(一)连接要求和结果外源DNA片段末端性质 连接要求 连接结果 不对称粘性末端 两种限制酶消化后,需纯化载体以提高连接效率 载体与外源DNA连接处的限制酶切位点常可保留;非重组克隆的背景较低;外源DNA可以定向插入到载体中。 对称性粘性末端 线形载体DNA常需磷酸酶脱磷处理 载体与外源DNA连接处的限制酶切位点常可保留;重组质粒会带有外源DNA的串联拷贝;外源DNA会以两个方向插入到载体中。 平端 要求高浓度的DNA和连接酶 载体与外源DNA连接处的限制酶切位点消失;重组质粒会带有外源DNA的串联拷贝;非重组克隆的背景较高 。 带有相同末端(平端或粘端)的外源DNA片段必须克隆到具有匹配末端的线性质粒载体中,但是在连接反应时,外源DNA和质粒都可能发生环化,也有可能形成串联寡聚物。因此,必须仔细调整连接反应中两个DNA 的浓度,以便使“正确”连接产物的数量达到最佳水平,此外还常常使用碱性磷酸酶去除5’磷酸基团以抑制载体DNA的自身环化。利用T4 DNA连接酶进行目的DNA片段和载体的体外连接反应,也就是在双链DNA 5’磷酸和相邻的3’羟基之间形成新的共价键。如载体的两条链都带有5’磷酸(未脱磷),可形成4个新的磷酸二酯键;如载体DNA已脱磷,则只能形成2个新的磷酸二酯键,此时产生的重组DNA带有两个单链缺口,在导入感受态细胞后可被修复。(二)T4 DNA连接酶对目的DNA片段和载体连接的一般方案1.连接反应一般在灭菌的0.5ml离心管中进行。2.10μl体积反应体系中:取载体50-100ng,加入一定比例的外源DNA 分子(一般线性载体DNA分子与外源DNA分子摩尔数为1∶1-1∶5),补足ddH2O 至8μl。3.轻轻混匀,稍加离心,56℃水浴5min后,迅速转入冰浴。4.加入含ATP的10×Buffer 1μl,T4 DNA连接酶合适单位, 用ddH2O 补至10μl,稍加离心,在适当温度(一般14-16℃水浴)连接8-14hr。四、连接产物的转化1.感受态细胞的制备⑴ 保存于-70℃的DH5α(或其他菌种)用接种环划菌于1.5%琼脂平板上,37℃恒温倒置培养至单菌落出现(约14-16 hr)。⑵ 挑取单菌落,接种于2.0ml LB液体培养基中,37℃恒温,250g振荡培养过夜(约12hr)。⑶ 取0.5ml 过夜培养液,接种于100ml LB液体培养基中,37℃振荡培养2-2.5hr,至OD600为0.4-0.5时,放置于4℃冰箱冷却1-2hr。(注:以下操作均应在冰浴中进行。)⑷ 将培养液分入两个50ml离心管中,4℃离心,4000g×10min,弃去上清,用冰浴的0.1M MgCl2 25ml悬浮30min。⑸ 4℃离心,4000g×10min,弃去上清,加入冰浴的0.1M CaCl2-甘油溶液1ml悬浮。⑹ 以100μl/管分装入1.5ml离心管中,-70℃冻存备用。注:此法制备感受态细胞,可使每微克超螺旋质粒DNA产生5×106-2×107个菌落,这样的转化效率足以满足所有在质粒中进行的常规克隆的需要,制备的感受态细胞可贮存于-70℃,但保存时间过长会使转化效率在一定程度上受到影响,一般三个月以内转化效率无多大改变。2. 连接产物的转化⑴ 取100μl贮存于-70℃钙化菌,冰浴化开;⑵ 加入适量连接产物(一般不超过10μl,轻轻混匀,冰浴20min;⑶ 于42℃热休克90s,迅速转移至冰浴中,继续冰浴2-3min;⑷ 加入LB液体培养基200μl,于37℃缓摇孵育45min;⑸ 将培养物适量涂于1.5%琼脂LB平板(根据质粒性质添加抗生素或/和X-Gal/IPTG),待胶表面没有液体流动时,37℃温箱倒置培养12-16hr。
【关键词】中检所对照品目录 药检所标准物质 标准物质网站 中华标准物质网 内容摘要:双链DNA片段与感受态受体菌的细胞表面特定位点结合,并激活临近的核酸酶。DNA双链中的一条单链逐步降解,同时另一条单链逐步进入细胞。 一、革兰氏阳性细菌,转化过程的几个阶段: 1.细菌感受态的形成 由于分泌一种称为感受态因子的小蛋白而导致细菌感受态的形成。 2.转化因子的吸收 双链DNA片段与感受态受体菌的细胞表面特定位点结合,并激活临近的核酸酶。DNA双链中的一条单链逐步降解,同时另一条单链逐步进入细胞。 3.整合复合物前体的形成 一种特殊蛋白与单链DNA结合,有效保护单链DNA免遭核酸酶的降解,并将其引导至受体菌染色体DNA处。 4.单链DNA转化因子的整合 转化DNA单链可以通过同源重组,置换受体细胞染色体DNA的同源区,形成异源杂合双链DNA结构。 5.转化子的形成 受体菌染色体组进行复制,杂合区段亦半保留复制,当细胞分裂后,此染色体发生分离,于是新形成一个转化子。 二、影响转化的因素 1.DNA能否进入细胞; 2.DNA进入细胞后的稳定性; 3.质粒DNA的大小,大质粒的转化效率低于小质粒,到目前,大于30kb的质粒,转化效率仍很低; 4.DNA的浓度、纯度和形状; 5.诱导感受态细菌所用的离子的种类和浓度; 6.热休克时间的长短及平板培养条件等。 本文参考了 国家标准物质网
PCR................................................................................................................................. 2RT-PCR............................................................................................................................ 4琼脂糖核酸电泳............................................................................................................... 6胶回收纯化DNA.............................................................................................................. 6大肠杆菌质粒DNA的提取(碱裂解法).......................................................................... 7乙醇沉淀DNA.................................................................................................................. 8酶 切............................................................................................................................. 8连 接............................................................................................................................... 8感受态细胞的制备............................................................................................................ 9转 化............................................................................................................................. 10重组子的筛选和鉴定...................................................................................................... 10真核细胞的转染.............................................................................................................. 11转染细胞的稳定筛选....................................................................................................... 11重组蛋白质的表达、纯化、复性和定量.......................................................................... 12肿瘤细胞体外传代培养及保种........................................................................................ 13肿瘤动物模型的建立...................................................................................................... 14小鼠尾静脉注射方法...................................................................................................... 14肿瘤蛋白疫苗预防性动物实验........................................................................................ 14人脐静脉内皮细胞(HUVEC)培养................................................................................. 14实验动物免疫方案.......................................................................................................... 15血清制备........................................................................................................................ 16ELISA............................................................................................................................ 16血清学筛选克隆新抗原/新基因....................................................................................... 17ELISPOT........................................................................................................................ 20藻酸盐包裹实验............................................................................................................. 21重组腺病毒构建,扩增及纯化基本技术操作................................................................... 21(细菌内同源重组AdEasy System)............................................................................... 21组织病理技术................................................................................................................. 26免疫组化染色................................................................................................................. 27流式细胞仪常用的几种检测方法..................................................................................... 29Western Blot(免疫印迹法)................................................................................................ 34PVDF膜上蛋白的可逆染色............................................................................................. 37人肿瘤抗原的识别与鉴定............................................................................................... 39-免疫沉淀实验流程...................................................................................................... 39蛋白质组实验流程.......................................................................................................... 41SDS-PAGE胶染色.......................................................................................................... 44数据库搜索(Databases search)......................................................................................... 45主要的公共数据库及网址............................................................................................... 46蛋白质的序列分析流程................................................................................................... 48聚丙烯酰胺凝胶的配制................................................................................................... 49双向电泳常用溶液配方................................................................................................... 51分子生物学常用溶液配制............................................................................................... 53另外给大家推荐一个资料共享的地方http://www.yiqi120.com/zlzx.asp,好东西大家一同分享.[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=128143]国内某重点实验室分子生物学实验方法与总结[/url]
前一阵子一直在做双酶切质粒重组,失败了 很多次,不过很快改善了 实验方法,用2周重组了 14个质粒。现就自己的体会,结合丁香园战友的宝贵经验,谈一下质粒重组的一些个人经验。1. 回收PCR产物 在进行PCR扩增时候,给引物两端设计好酶切位点,一般说来,限制酶的 选择非常重要,尽量选择粘端酶切和 那些酶切效率高的限制酶,如BamHI、HindIII,提前看好各公司的双切酶所用公用的BUFFER,以及各酶在公用BUFFER里的效率。选好酶切位点后,在各个酶的两边加上保护碱基,其原则可参照:http://img.dxy.cn/upload/2006/08/13/31219184.pdf。双酶切时间及其体系:需要强调的是很多人建议酶切过夜,其实完全没有必要,我一般酶切3个小时,其实1个小时已经足够。应用大体系,如100微升。纯化问题:纯化PCR产物割胶还是柱式,我推荐柱式,因为割胶手法不准,很容易割下大块的胶,影响纯化效率。现在的柱式纯化号称可以祛除引物,既然如此,酶切掉的几个碱基肯定也会被纯化掉了。所以,PCR产物和双酶切产物的纯化均可应用柱式纯化。我用的是TAKARA的纯化柱试剂盒。酶量的问题:以TAKARA的为例,其对1单位酶的定义如下:在50 μl 反应液中,30℃温度下反应1小时,将1 μg 的λDNA完全分解的酶量定义为1个活性单位(U)。 而该酶浓度约为15单位/微升,在除外酶降解的 因素外,该酶可分解15 μg的DNA,而一般从1-4 ml菌液提出的 DNA约为3 μg,而PCR纯化后的产物(50体系)约为3 μg,所以即便全部加进去,只要纯化的 质量好,酶切完全切得动。2. 酶切、回收后的PCR产物与载体的连接摩尔比的计算,很多人凭经验也可以。但对于初学者从头认真计算则 非常有必要。回收的载体片段:回收的PCR产物片段=1:10 ,一般取前者0.03 pmol,后者取0.3 pmol。pmol为单位的DNA转换为为μg单位的DNA:(X pmoles×长度bp×650)/ 1,000,000 (注:长度bp×650是该双链DNA的分子量)所得数值即为μg,也可以直接用这个公式套.1 pmol 1000 bp DNA=0.66 μg,如载体是5380 bp,则0.03 pmol为0.03×5.38×0.66=0.106524 μg。测DNA浓度可以在专用机子上测,注意OD值,一般约1.8-2.0,另外,如果嫌麻烦,也可用MARKER进行估测,如MARKER2000,5微升的 MARKER每个条带约50 ng。连接反应:TAKARA的 连接酶上的 说明写的过夜,而其对连接酶单位的定义为:在20 μl的连接反应体系中,6 μg的λDNA-Hind III的分解物在16℃下反应30分钟时,有90%以上的DNA片段被连接所需要的酶量定义为1个活性单位(U)。而它的浓度为350 U/μl ,所以完全够用。连接酶容易失活,注意低温操作,最好在冰上。时间3个小时足已。3. 转化a. 全量(10 μl)加入至100 μl JM109感受态细胞中,冰中放置30分钟。b. 42℃加热45秒钟后,再在冰中放置1分钟。c. 加入890 μl AMP阴性培养基,37℃振荡培养60分钟。取100 μl铺板。也可离心后余100 μl。几个非常重要的问题1. 做转化的时候,进行酶连接反应时,注意保持低温状态,因为LIGASE酶很容易降解,为保险起见,一般连接3小时,16度。2. 对含有AMP-RESISTENCE的质粒铺板时,注意加AMP时的温度,温度过高,会使克隆株无法筛选出来.我的方法是培基高温消毒后放在烤箱里,烤箱一般温度为55-60度,然后做的时候拿出来,这样好掌握温度。铺板前后注意用吹风机吹干。3. 对照的设立:为验证双酶切是否成功,可做如下对照:A 酶切反应时加各单酶分别切,两管,用同一种BUFFER,跑胶,看单切的两管是否成线性,如两管均成线性可初步判断双酶切成功。做转化时也要进行对照。设4个:A. 即拿双酶切的质粒产物也进行连接反应,这个对照可进一步看双酶切是否成功,如果长出克隆,说明很有可能只进行了单酶切,如没长出克隆,则证明双酶切成功,当然要保证感受态,培养基、连接酶都'正常'的情况下。B. 酶切过的未进行连接反应的双酶切产物,进行转化,这一步可以证明是否有残留的未被任何酶切的原始质粒。C. 设原始质粒为对照,意为检测整个操作过程中是否有误。D.AMP阴性板上用同一批感受态细胞铺板20微升足够,检测感受态状况。4. 所有的试剂切记低温保存 一步一个脚印,不要偷懒,图省事最后却更费事,注意设立对照。经PCR鉴定,克隆90%-100%的阳性率,所以在后面的 挑克隆中,我只挑选4个就足够了。然后双酶切鉴定,测序。
iCELLigence全自动细胞分析仪让您远离MTT实验不断重复还无法得到统一结果的烦恼,让您不再因只看到其中的一个点而损失了其它的细胞生物学信息而无计可施,因为它可以清楚的记录下细胞完整的一生! 一:全自动细胞分析仪仪器原理 iCELLigence实时无标记全自动细胞分析仪是一款新型的细胞分析平台,具有实时监测、高信息量、无需标记、全自动化、高灵敏度和高准确性等独特优点。该细胞分析仪通过嵌在E-plate板上孔底的微电子感应器阻抗变化去感受细胞的有无以及贴壁、黏附和生长程度的改变。在细胞毒性检测中,可实时、直观的反应细胞增殖、存活、凋亡、形态变化等细胞生物学变化。 二:全自动细胞分析仪仪器优势 iCELLigence全自动细胞分析仪的传感器阻抗技术在细胞分析中具有其独特的优势:它为整个的细胞毒性检测分析过程中提供了全程无损伤的监控,实时、连续显示的数据让您可以更加自信更加清楚的进行细胞毒性检测操作和其它的细胞分析,而不是假定细胞处于合适的处理阶段。一连串实时获取和显示的数据让您处理每一步结果都可以通过机理来预测,同时也可以结合全自动细胞分析仪实时的读数来决定传统终点细胞毒性检测分析的最佳时间点。只需几个简单的操作步骤您就可以获得高信息量的、直观的、准确的结果,就可以让您的细胞实验变得更加省时高效。 三:全自动细胞分析仪的应用领域基于iCELLigence全自动细胞分析仪的技术优势,该系统在基础生命科学领域具有广泛的应用,如细胞质量控制、细胞毒性检测、细胞粘附和细胞伸展等。
[b][font=宋体]前言[/font][/b][font=宋体]在蛋白质研究领域,稳定细胞系的应用已成为生产高质量结构生物学蛋白质的关键手段。随着技术的不断进步,稳定细胞系的生成与筛选方法得到了显著改进,从而推动了蛋白质生产的高效化与精准化。[/font][font=Calibri] [/font][b][font=宋体]细胞系的建立和应用[/font][font=宋体][font=Calibri]HEK293[/font][font=宋体]和[/font][font=Calibri]CHO[/font][font=宋体]细胞系[/font][/font][/b][font=宋体]因其稳定的蛋白表达和适当的翻译后修饰而被广泛用于结构生物学研究。这些细胞系能有效地生产具有复杂糖基化模式的蛋白质,这对于确保蛋白质的功能和稳定性至关重要。糖基化缺陷细胞系通过特定的基因改造,能够分泌脱糖基化糖蛋白,为蛋白质生产提供了更加纯净的原料。[/font][font=Calibri] [/font][b][font=宋体]稳定细胞系的生成[/font][/b][font=宋体][font=宋体]传统的稳定细胞系生成技术如瞬时转染,虽然方法简便,但存在整合频率低、转基因沉默等问题。为了克服这些困难,研究者们开发出了一系列新技术,如细胞分选技术、位点特异性重组(如[/font][font=Calibri]FLP/FRT[/font][font=宋体]系统)、转座子系统(如[/font][font=Calibri]piggyBac[/font][font=宋体])、慢病毒系统以及噬菌体整合酶等,提高了稳定细胞系的生成效率和稳定性。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]序列特异性基因组工程也为稳定细胞系的生成提供了新的思路。通过敲除或修饰特定的基因,研究者们能够实现对细胞功能的精准调控,从而优化蛋白质生产的效率和纯度。例如,一种同时缺乏[/font][font=Calibri]GnTI[/font][font=宋体]和谷氨酰胺合成酶([/font][font=Calibri]GS[/font][font=宋体])活性的[/font][font=Calibri]CHO[/font][font=宋体]细胞系被成功开发出来,为高效筛选具有[/font][font=Calibri]GS[/font][font=宋体]标记的稳定细胞系提供了有力工具。[/font][/font][font=Calibri] [/font][b][font=宋体]稳定细胞系与瞬时转染的比较[/font][/b][font=宋体]稳定细胞系相较于瞬时转染具有多个优点,包括能够进行大规模生产和保持高水平的蛋白表达稳定性。尽管瞬时转染在某些情况下能快速产生大量蛋白,但其表达水平和重复性通常不如稳定细胞系。[/font][font=Calibri] [/font][b][font=宋体]展望[/font][/b][font=宋体]近年来,利用稳定细胞系高效生产结构生物学蛋白质已成为研究的热点和趋势。通过引入新技术、优化筛选方法和改进整合系统,不仅能够提高蛋白质生产的效率和纯度,还能够为结构生物学研究提供更加精准、可靠的实验工具。随着基因编辑和细胞工程技术的进步,预计在未来,通过精确的基因操作能够更有效地创建和利用稳定细胞系。这些技术的进步将促进结构生物学和药物开发中蛋白质的高效和可持续生产。[/font][font=宋体] [/font][font=宋体]本文由义翘神州进行整理,同时提供[/font][url=https://cn.sinobiological.com/services/stable-cell-line-development-service][u][font=宋体][color=#0000ff]稳定细胞系构建服务[/color][/font][/u][/url][font=宋体],详情可点击了解![/font][font=Calibri] [/font][font=宋体]参考文献:[/font][font=Calibri]Büssow K. Stable mammalian producer cell lines for structural biology. [/font][i][font=Calibri]Curr Opin Struct Biol[/font][/i][font=Calibri]. 2015 32:81-90. doi:10.1016/j.sbi.2015.03.002[/font]

传统流式细胞仪繁琐的实验步骤是否一直困扰着您?它结果输出的不方便是否也影响着您的实验效率?大量用于流式细胞仪上机样本的得到是否也让您很烦躁?现在这些都将成为过去式……MuseTM智能触控细胞状态分析仪——一款新型基础型流式细胞仪可以成功的解决您的这些问题。以细胞活力分析为例,MuseTM只需三步即可搞定:细胞悬液内加入Muse检测试剂,室温孵育5分钟,上机检测——内置的Pad触控式操作系统让您只需动动手指就可以直接读数。采用的独特微毛细管液流系统,样本需要量只有传统流式细胞仪的1/10,为您节省大量宝贵的实验样本。另外,MuseTM智能触控细胞状态分析仪创新的微毛细管液流设计摒弃了传统流式细胞仪必须依赖鞘液的流体动力学聚焦原理,最大程度的保护细胞不受到高速鞘液流冲击的影响,保持上机前的细胞状态。精湛的紧凑型光路设计可以为您分析直径范围在2-60μm的广泛样本,让您的细胞状态分析实验与众不同。预置的多套实验方案以及高品质的预包装试剂盒,让您无需为复杂的试验参数设定头痛不已,获取与分析变得能够轻松掌握。在快速细胞计数,细胞活力分析,细胞凋亡分析,细胞周期等分析领域,MuseTM智能触控细胞状态分析仪定会为各位老师带来不同凡响全新的实验体验。想切身感受这炎热的夏天里MuseTM智能触控细胞状态分析仪为您实验带来的小清新吗?赶快报名,免费的试用在等着您哦•••活动期间,凡是参与试用的用户均可获得昊诺斯8GU盘或瑞士军刀背包一个(奖品以实物为准)。http://ng1.17img.cn/bbsfiles/images/2013/07/201307231142_453122_1622715_3.jpg真心英雄活动第二关试用报名网址:http://www.instrument.com.cn/custom/SH100700/20130522/free.shtml另外,您也可以致电北京昊诺斯科技有限公司市场部产品负责人孙健13710746995 sunjian@herosbio.com(因为区域划分,活动仅限北京区域、山西及内蒙古,具体问题欢迎来电垂询)。
胎盘亚全能干细胞定义: 亚全能干细胞自胚胎形成的第5到7天开始出现,能分化形成200 多种人体组织器官细胞,但不能形成一个完整的人体。胎盘亚全能干细胞是来源于新生儿胎盘组织的一族亚全能干细胞,其在发育阶段与胚胎干细胞接近,具备分化形成三个胚层的组织细胞的能力,但不会形成畸胎瘤。 胎盘亚全能干细胞的主要特性与功能: 胎盘亚全能干细胞是取自胎盘组织的一类亚全能干细胞,胎盘亚全能干细胞具有以下特性: 1. 具有强大的增殖能力和多向分化潜能,在适宜的体内或体外环境下具有分化为间充质干细胞,上皮干细胞、神经干细胞、肝干细胞,肌细胞、成骨细胞、软骨细胞、基质细胞等多种细胞的能力。可以用来修复受损或病变的组织器官,治疗心、脑血管疾病、神经系统疾病、肝脏疾病、骨组织病、角膜损伤、烧伤烫伤、肌病等多种疾病。 2.具有免疫调节作用,通过负性免疫调节功能,抑制机体亢进的免疫反应,使机体免疫功能恢复平衡,从而可以用来治疗造血干细胞移植之后的免疫排斥反应以及克隆氏病、红斑狼疮,硬皮病等自身免疫系统疾病。 3.胎盘亚全能干细胞定向培养的间充质干细胞是人体微环境的重要组成部分,移植间充质干细胞可以改变造血微环境,重建免疫系统,促进造血功能恢复,与造血干细胞共移植能显著提高白血病和难治性贫血等的治疗效果。 4.具有来源方便,细胞数量充足,易于分离、培养、扩增和纯化,传代扩增30多代后仍具有干细胞特性。 胎盘亚全能干细胞的用途: 胎盘作为理想的亚全能干细胞来源,在抗衰老及疾病治疗领域显示了其独特的功能,治疗疾病种类如下: 心脑血管系统疾病 糖尿病 肝肾损伤 脑及脊髓神经损伤 自身免疫性疾病 移植物抗宿主病 与造血干细胞共移植治疗血液病 缺血性血管病 肺及其它组织器官纤维化 抗衰老,恢复健康体态 胎盘亚全能干细胞的储存流程: 在新生儿娩出、胎盘剥离子宫排出后,由接生的医生尽快按照干细胞库胎盘标准采集规程进行胎盘的采集,然后放置在干细胞库特定的装置工具中,在限定时限内运送到干细胞库,由专业的技术人员进行亚全能干细胞的分离、提取、培养、检测等技术流程,直到根据最终检测结果来确认所获得的干细胞是否具有长期保存的价值。 保存和期限 目前国际上通用的干细胞保存技术是将获得的干细胞储存在-196℃深低温状态,医学研究与临床实践证明保存一百多年的细胞仍然具有活性。干细胞保存已有几十年的历史,胎盘干细胞库在与客户签订的合同期限内对干细胞库中所保管的胎盘亚全能干细胞活性负责。 安全性 胎盘的采集简便易行,不会引起母亲和新生儿任何不适的感觉或产生任何不良的影响。过去胎盘通常作为废物丢弃,而从胎盘中提取亚全能干细胞进行保存,是宝贵的生命资源再生。 而干细胞行业数据显示,胎盘亚全能干细胞基因稳定、不易突变,动物实验证明无致瘤性,使用安全可靠,对适应症范围疾病治疗效果好,优于传统医疗手段。 胎盘亚全能干细胞的优势 1.取材方便,原料来源充足,是生命资源的再生。 2.分化能力强可以定向诱导分化为间充质干细胞、血管干细胞、上皮干细胞、神经干细胞和肝干细胞等多种干细胞。 3.数量充足,使用方便,增殖能力强,培养后数目可达10亿,可以供多人多次使用。 4.在人群中使用不需要配型,不会产生免疫排斥反应,同时,血缘关系越亲近,生物利用度会越高,使用的效果越好。 5.治疗疾病范围广,抗衰老,恢复健康体态,心脑血管系统疾病,糖尿病,肝肾损伤,脑及脊髓神经损伤,自身免疫性疾病,移植物抗宿主病等多种疾病。

自去年我公司推出全自动核酸分析系统的免费试用后,今天我们又再次为各位老师奉上强大的细胞分析平台:一款可以解决您MTT实验烦恼、无需标记、全自动化,带给您高信息量、高灵敏度和高准确性的iCELLigence全自动细胞分析仪将会出现在您的面前。iCELLigence全自动细胞分析仪通过嵌在E-plate板上孔底的微电子感应器阻抗变化去感受细胞的有无以及贴壁、黏附和生长程度的改变,无需标记即可实时、直观的反应细胞增殖、存活、凋亡、形态变化等细胞生物学变化。iCELLigence全自动细胞分析仪的传感器阻抗技术在细胞分析中具有其独特的优势:它为整个的实验分析过程包括细胞黏附、细胞增殖和细胞融合提供了全程无损伤的监控,实时、连续显示的数据让您可以更加自信更加清楚的进行细胞操作和细胞增殖等分析,而不是假定细胞处于合适的处理阶段。一连串实时获取和显示的数据让您处理每一步结果都可以通过机理来预测,同时也可以结合iCELLigence全自动细胞分析仪连续的读数来决定传统终点细胞分析的最佳时间点。只需几个简单的操作步骤您就可以获得高信息量的、直观的、准确的结果,就可以让您的细胞增殖等分析实验变得更加省时与高效。莫再犹豫,快来参加体验吧,经历过你就会发现有时候细胞增殖等实验会是这么的easy。赶快报名,免费的试用在等着您哦···活动期间,凡是参与试用的用户均可获得昊诺斯8GU盘或瑞士军刀背包一个(奖品以实物为准)。http://ng1.17img.cn/bbsfiles/images/2017/01/201701191656_647437_1622715_3.jpg真心英雄活动第二关试用报名网址:http://www.instrument.com.cn/custom/SH100700/20130522/free.shtml另外,您也可以致电北京昊诺斯科技有限公司市场部产品负责人孙健13710746995sunjian@herosbio.com(因为区域划分,活动仅限北方区域,具体问题欢迎来电垂询)。
生物显微镜观察细胞,光强对细胞状态有影响吗
质粒环状 柔弱中带伤惨白的酚氯仿 勾住过往蛋白质变性 凝结成了霜是谁在离心机上 徘徊惆怅手轻轻压 加样用的枪我一瓶TBE 倒在板上那溴酚兰 指示着方向扫胶仪照出 你的模样感受态 满地伤瓶里LB 已泛黄热击菌迷茫 铺平板静静淌电泳乱 菌未长酶切总也剪不断徒留我Marker在胶面成双菌已暮年 飘落了灿烂残破的细胞壁命运不堪二次活化 菌液拆两半怕你上不了摇床 过夜振荡谁的冰箱 制冷声狂乱我一身实验服 奔波匆忙条带微亮 淡淡的荧光一夜转化 如此艰难
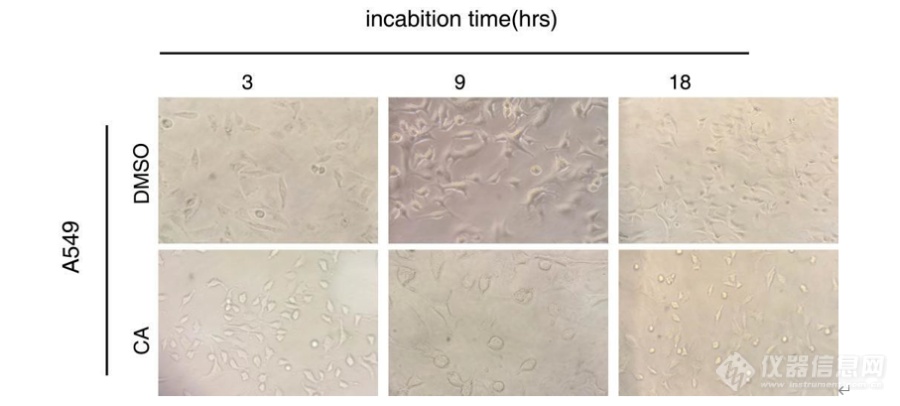
[b][font='Times New Roman',serif]CA[/font]对[font='Times New Roman',serif]A549[/font]细胞状态的影响[/b][font=宋体]首先探究了 [/font]CA [font=宋体]对细胞生长状态的影响。以 [/font]A549 [font=宋体]细胞为例,设置了终浓度为[/font]0[font=宋体]、[/font]300 μM [font=宋体]的 [/font]CA [font=宋体]浓度梯度,并观察其在不同时间([/font]3[font=宋体]、[/font]9[font=宋体]、[/font]18 h[font=宋体])的细胞状态。如图 [/font]3-1 [font=宋体]所示,加入 [/font]CA [font=宋体]后细胞的状态发生了显著的变化,在 [/font]3 h [font=宋体]时就已经出现细胞形态的改变;当 [/font]18 h [font=宋体]时,细胞已经有死亡的迹象。[/font][font=宋体] [/font][font=宋体] [/font][font=宋体] [/font][font=宋体] [/font][font=宋体] [/font][font=宋体] [/font][align=center] [/align][font='Times New Roman',serif][/font][img=,523,261]https://ng1.17img.cn/bbsfiles/images/2022/11/202211171003382232_7794_3237657_3.png!w690x311.jpg[/img][font=宋体]图 [/font] CA [font=宋体]刺激 [/font]A549 [font=宋体]细胞,终浓度为 [/font]0 μM[font=宋体]、[/font]300 μM[font=宋体],不同时间细胞状态图[/font][b][font='Times New Roman',serif]CA[/font]对 [font='Times New Roman',serif]A549[/font]细胞活力的影响[/b][font=宋体]本文设置了终浓度为 [/font]0[font=宋体]、[/font]50[font=宋体]、[/font]100[font=宋体]、[/font]300[font=宋体]、[/font]500[font=宋体]、[/font]1000[font=宋体]、[/font]1500[font=宋体]、[/font]2000[font=宋体]、[/font]3000 μM [font=宋体]的 [/font]CA [font=宋体]浓度梯度,细胞在 [/font]5% CO[sub]2[/sub][font=宋体]、[/font]37 ℃[font=宋体]的培养箱中无血清培养[/font]6 h[font=宋体],最终得出了浓度依赖型[/font][font=宋体]的曲线。如图 [/font]3-2 [font=宋体]所示,加入 [/font]600 μM [font=宋体]的 [/font]CA [font=宋体]对细胞的抑制率可达到 [/font]50%[font=宋体]左右;当 [/font]CA [font=宋体]加入浓度为 [/font]2.5 mM [font=宋体]时,细胞的存活率只有 [/font]20%[font=宋体];当 [/font]CA [font=宋体]的加入浓度为 [/font]3 mM [font=宋体]时,细胞[/font][font=宋体]已经死亡。[/font] [table][tr][td][img=文本框:,475,307]https://ng1.17img.cn/bbsfiles/images/2022/11/202211171003523300_7297_3237657_3.png!w690x370.jpg[/img][/td][/tr][/table][font=宋体] [/font][align=center]32[/align][font='Times New Roman',serif][/font][font=宋体]图 [/font] [font=宋体]不同浓度梯度([/font]0[font=宋体]、[/font]50[font=宋体]、[/font]100[font=宋体]、[/font]300[font=宋体]、[/font]500[font=宋体]、[/font]1000[font=宋体]、[/font]1500[font=宋体]、[/font]2000[font=宋体]、[/font]3000 μM[font=宋体])[/font]CA [font=宋体]刺激 [/font]A549[align=center][font=宋体]细胞测的细胞活力曲线图[/font][/align])[b]蛋白免疫印迹分析[/b] [table][tr][td] [table=100%][tr][td][img=,553,349]https://ng1.17img.cn/bbsfiles/images/2022/11/202211171004059904_8264_3237657_3.png!w690x378.jpg[/img] [/td][/tr][/table] [/td][/tr][/table][font=宋体]以 [/font]A549 [font=宋体]为例,本文选用不同浓度([/font]0[font=宋体]、[/font]20[font=宋体]、[/font]50[font=宋体]、[/font]100[font=宋体]、[/font]300[font=宋体]、[/font]500 μM[font=宋体])的 [/font]CA [font=宋体]处理[/font]1 h [font=宋体]后的细胞裂解液与生物素孵育,进一步进行免疫印迹分析。如图 [/font] [font=宋体]所示, [/font]Westerningblotting [font=宋体]分析表明,随着 [/font]CA [font=宋体]浓度增加,曝光后的条带逐渐加深,这进一步证明了 [/font]CA [font=宋体]已成功结合到蛋白上,从而在蛋白上引入可被酰肼生物素标记的醛基,同时也可进一步证明酰肼化学法能够实现[/font]CA [font=宋体]靶蛋白的标记。[/font][font=宋体] [/font][font=宋体] [/font][font=宋体] [/font][font=宋体] [/font][font=宋体] [/font][font=宋体] [/font][font=宋体] [/font][font=宋体] [/font][font=宋体] [/font][font=宋体] [/font][font=宋体] [/font][font=宋体] [/font][font=宋体] [/font][font=宋体] [/font][font=宋体] [/font][font=宋体] [/font][font=宋体]图 [/font] [font=宋体]一定浓度梯度([/font]0[font=宋体]、[/font]20[font=宋体]、[/font]50[font=宋体]、[/font]100[font=宋体]、[/font]300[font=宋体]、[/font]500 μM[font=宋体])[/font]CA [font=宋体]刺激 [/font]A549 [font=宋体]细胞的免疫印迹结果和[/font][align=center][font=宋体]考马斯染色结果[/font][/align][font='Times New Roman',serif][/font][b][font='Times New Roman',serif]CA[/font]修饰肽段分析[/b][font=宋体]选用 [/font]50[font=宋体]、[/font]100[font=宋体]、[/font]300μM[font=宋体]的 [/font]CA[font=宋体]处理 [/font]A549[font=宋体]、[/font]K562[font=宋体]细胞,每个样品各做三次生物学重复并进行分析。如图 [/font]3-4[font=宋体]所示,在浓度 [/font]50μM[font=宋体]的 [/font]CA[font=宋体]刺激下,可从 [/font]A549[font=宋体]细胞鉴定到 [/font]16[font=宋体]个高可信度的 [/font]CA[font=宋体]修饰位点,从 [/font]K562[font=宋体]细胞鉴定到了[/font]32 [font=宋体]个高可信度的 [/font]CA [font=宋体]修饰位点;在 [/font]100 μM [font=宋体]的 [/font]CA [font=宋体]刺激下,可从 [/font]A549 [font=宋体]细胞中鉴定到 [/font]43 [font=宋体]个高可信度的 [/font]CA [font=宋体]修饰位点,从 [/font]K562 [font=宋体]细胞中鉴定到了 [/font]100 [font=宋体]个高可信度的 [/font]CA [font=宋体]修饰位点;在 [/font]300 μM [font=宋体]的 [/font]CA [font=宋体]刺激下,可从 [/font]A549 [font=宋体]细胞中鉴定到 [/font]264 [font=宋体]个高可信度的 [/font]CA [font=宋体]修饰位点,从 [/font]K562 [font=宋体]细胞中鉴定到了 [/font]355 [font=宋体]个高可信度的 [/font]CA [font=宋体]修饰位点。[/font][font=宋体] [/font] [table][tr][td][img=,551,179]https://ng1.17img.cn/bbsfiles/images/2022/11/202211171004226161_3885_3237657_3.png!w690x461.jpg[/img][/td][/tr][/table][font=宋体] [/font][font=宋体]图 [/font]CA [font=宋体]刺激 [/font]A549 [font=宋体]和 [/font]K562 [font=宋体]细胞,终浓度为 [/font]50 μM[font=宋体]、[/font]100 μM [font=宋体]和 [/font]300 μM [font=宋体]三次生物学重复鉴定[/font][font=宋体]到的 [/font]CA [font=宋体]修饰位点的韦恩图[/font]
想问生物显微镜观察细胞,光强会对细胞状态有影响吗,有没有懂这方面的,麻烦说一下谢谢
试剂1M LiCl 50% PEG3350 (氯化锂转化法只能PEG3350,不能用PEG8000,PEG3350在北京莱博生物有售,80元/100克)2mg/ml salmon sperm DNA / TE(10mM Tris-Cl, pH8.0, 1.0mM EDTA)-20℃保存注:醋酸锂对毕氏酵母无效,对酿酒酵母有效,仅氯化锂有效;PEG3350可屏蔽高浓度LiCl的毒害作用。感受态毕氏酵母的制备1. 接种Pachia pastoris到50ml YPD培养基中,30℃摇菌过夜(约24~28h)培养到OD值为0.8~1.0(约108 Cells/ml);培养基里有流沙样的菌体在流动2. 收获细胞,用25ml无菌水洗涤一次,室温下1500g离心10min;3. 重悬细胞于1ml 100mM LiCl溶液中,将悬液转入1.5ml离心管;4. 离心机最大速度离心15秒沉淀菌体,重悬菌体于400ul 100mM LiCl溶液中;5. 按50ul/管分装,立即进行转化;注:不要将感受态酵母菌冰浴;
10月6日出版的新一期英国《自然》杂志刊登报告说,美国研究人员用人类卵细胞培养出了胚胎干细胞,虽然这项成果还存在一些缺陷,但已是“黄禹锡造假事件”后最接近培养出正常人类胚胎干细胞的成果。这一成果可能引起有关克隆问题的新一轮大争论。http://www.bioon.com/biology/UploadFiles/201110/2011100911202350.jpg(图片来自原文)将体细胞中的遗传物质植入卵细胞中,将其培育成为胚胎干细胞甚至最终培养出新的个体,就是常说的克隆技术,著名的克隆羊“多利”就是用这种技术得到的。2004年,韩国研究人员黄禹锡曾宣称用这种方法培育出了人类胚胎干细胞,引起一时轰动,但后来证明这是一起造假事件。此后,许多科研人员都进行了这方面的尝试,但一直没有成功。相关研究面临的障碍是,如果先将人类卵细胞中的遗传物质去掉,再植入另一个体细胞的遗传物质,这样得到的卵细胞分裂几次后就会停止发育。而美国纽约干细胞基金实验室等机构的研究人员报告说,如果留下一部分原有卵细胞中的遗传物质,再另外加上体细胞的部分遗传物质,这样得到的卵细胞可以发育到具有70至100个细胞的囊胚阶段,达到可以提取胚胎干细胞的阶段。胚胎干细胞具备发育成各种组织和器官的潜力,如果能够培育出人类胚胎干细胞,就意味着能够培育出属于某个人自己的组织和器官,可用于个性化的医疗。当然这也会引起有关克隆人的争议。本次研究虽然能够培育出人类胚胎干细胞,但也存在一些缺陷。最重要的是这些细胞中存在3组染色体,即卵细胞原有的1组染色体和来自体细胞的2组染色体,而正常的人类细胞只有2组染色体。因此,这种人类胚胎干细胞还不具备实用性。但是《自然》杂志同时发表的社论指出,这是自“黄禹锡造假事件”后最接近培养出可用人类胚胎干细胞的成果,在大方向上证明这仍然是一条可行的道路。社论认为,这将引起新一轮的有关克隆人的大争论,甚至提出联合国有必要开始考虑制订监管克隆的规章制度。

[size=16px]9月14-15日有幸受邀前去河南信阳伟业计量进行参观交流。在没去之前对标准[/size][size=16px]物质[/size][size=16px]的[/size][size=16px]概念[/size][size=16px]没有那么清晰。在[/size][size=16px]仪器信息网个人用户事业部总经理金昌权、社区部负责人[/size][size=16px]李亚辉的带领下,到了伟业后,对标准[/size][size=16px]物质[/size][size=16px]有了大致的了解,[/size][size=16px]也[/size][size=16px]对伟业计量这个企业有了更进一步的了解。[/size][size=16px]北方伟业计量集团,成立于2007年,[/size][size=16px]是[/size][size=16px]国家高新技术企业,标准物质研究中心,中国计量测试学会会员单位。伟业计量从最初的4名员工发展到了400余名员工。拥有研发基地2.4万平方,独立研制十三大系列标准物质30000余种,获批国家一级标准物质28种,国家二级标准物质600余种。产品涉及食品、环境、化工、临床医学以及药品等多个领域,为国内外数[/size][size=16px]千家[/size][size=16px]检测机构提供专业的检测标准。[/size][img]https://ng1.17img.cn/bbsfiles/images/2023/09/202309271520124204_22_3989257_3.png[/img][size=16px]伟业计量旗下豫南检测中心有限公司,是河南著名的第三方检验检测机构[/size][size=16px]。[/size][size=16px]其北纳生物([/size][size=16px]B[/size][size=16px]NCC[/size][size=16px])[/size][size=16px]品牌,专业提供微生物菌种、实验细胞、为生物质控样品等系列产品,同时提供丁量菌株、感受态细胞、基因D[/size][size=16px]NA[/size][size=16px]、核算参考品等定制服务。[/size][size=16px]在伟业计量感受到的是,员工的热情和工作的认真态度,实验室、办公室整洁有序,标准品生产、储存规范。公司对员工的关怀从吃住行以及休息上公司给与极大的照顾,让员工幸福指数直线上升。[/size][size=16px]对于后期标准物质的选择上,将会考虑伟业的标准。[/size][img]https://ng1.17img.cn/bbsfiles/images/2023/09/202309271520126200_7631_3989257_3.png[/img][img]https://ng1.17img.cn/bbsfiles/images/2023/09/202309271520128293_1993_3989257_3.png[/img]
实验用的细胞中同时存在吸附态的Cd和游离态的Cd离子,想用比色法直接测定其中的游离态Cd离子,怎样的前处理方式才不会导致吸附态的Cd发生脱附呢?或者有没有什么其他方法可以只测细胞中游离态Cd离子?请大家帮帮忙!先谢谢啦!
[b][size=15px][color=#595959]红三叶草[/color][/size][/b][size=15px][color=#595959](Trifolim pratense L.)是一种传统中药,具有调节更年期症状、心脏问题、炎症性疾病、牛皮癣和认知缺陷的作用。在以往的报道中,对红三叶草的研究主要集中在临床实践方面。红三叶草的药理作用尚未完全阐明。[/color][/size] [font=&][size=16px][color=#232323][/color][/size][/font][size=15px][color=#595959]为了确定调节[b]铁下垂[/b]的分子,检测了[b]红三叶草(Trifolium pratense L.)提取物(RCE)[/b]是否影响化学处理或[b]胱氨酸/谷氨酸反转运蛋白(xCT)[/b]缺乏引起的铁下[/color][/size][font=&][size=16px][color=#232323]垂。 [/color][/size][/font] [size=15px][color=#595959][/color][/size][size=15px][color=#595959][font=&][/font][/color][/size][b][size=15px][color=#595959]小鼠胚胎成纤维细胞(MEFs)[/color][/size][/b][size=15px][color=#595959]通过erastin/Ras-选择性致死3(RSL3)处理或xCT缺失诱导铁下垂细胞模型。用Calcein-AM和BODIPY-C荧光染料分别测定细胞内[b]铁和脂质过氧化水平[/b]。蛋白和mRNA分别用Western blot和real-time聚合酶链反应定量。对xCT MEFs进行RNA测序分析。 [/color][/size] [size=15px][color=#595959]RCE对erastin/RSL3处理和xCT缺失所致的铁下垂均有显著抑制作用。RCE的抗铁衰作用与细胞铁衰模型中细胞铁积累和脂质过氧化等铁衰表型变化相关。[/color][/size] [size=15px][color=#595959]重要的是,RCE影响铁代谢相关蛋白的水平,包括铁调节蛋白1、转运蛋白1 (FPN1)、二价金属转运蛋白1和转铁蛋白受体。通过RCE对xCT MEFs进行RNA测序分析,发现细胞防御基因表达上调,细胞死亡相关基因表达下调。[/color][/size] [size=15px][color=#595959][/color][/size][color=#3573b9]结论[/color][b][size=15px][color=#595959][/color][/size][/b][font=mp-quote, -apple-system-font, BlinkMacSystemFont, &][size=15px][color=#595959][/color][/size][/font] [b][size=15px][color=#595959][/color][/size][size=15px][color=#595959][/color][/size][size=15px][color=#595959][/color][/size][size=15px][color=#595959][/color][/size][size=15px][color=#595959][/color][/size][size=15px][color=#595959][/color][/size][/b][font=&][size=16px][color=#232323][/color][/size][/font][b][size=15px][color=#595959][/color][/size][size=15px][color=#595959][/color][/size][size=15px][color=#595959][/color][/size][size=15px][color=#595959][/color][/size][size=15px][color=#595959][/color][/size][size=15px][color=#595959][/color][/size][size=15px][color=#595959][/color][/size][/b][font=&][size=16px][color=#232323][/color][/size][/font][size=15px][color=#595959]RCE可通过[b]调节细胞铁稳态[/b],有效抑制由erastin/RSL3处理和xCT缺乏引起的铁下垂。这是首次报道RCE在与铁中毒细胞死亡相关的疾病中具有治疗潜力,特别是由细胞铁代谢失调引起的铁中毒。[/color][/size]
自去年10月开始,分子生物学家Katsuhiko Hayashi就陆陆续续收到了许多夫妻的邮件,这些夫妻大多人到中年,仍然在为了一件事情焦急:要一个孩子。其中有一位英国的更年期妇女,希望到他位于日本京都大学的实验室,在他的帮助下怀上孩子,她写道:“这是我唯一的愿望。”这些请求开始于Hayashi一篇文章的发表——他原以为只有发育生物学家才会对他的实验结果感兴趣。在体外条件下,利用小鼠的皮肤细胞创造可以发育成精子和卵子的原始生殖细胞(PGCs)。为了证明这些实验室培养的原始生殖细胞与自然发育而成的原始生殖细胞类似,他利用它们生成了卵子,进而创造小鼠生命。他表示,这个创造出来的小鼠生命仅仅是他研究的一个“副产品”,他的研究将意味着更多——利用不孕妇女的皮肤细胞为她们提供可受精的卵细胞。与此同时他还提出,男性的皮肤细胞也可以用来创造卵子,同样,女性的皮肤细胞也可以生成精子。(事实上,研究结果发表后,许多同性恋发邮件给Hayashi ,索要更多的信息。)尽管这是一项创新研究,但是公众的广泛关注还是令Hayashi和他的教授Mitinori Saitou感到非常惊讶。他们花了十多年不断挖掘哺乳动物配子产生的微妙细节,然后在体外条件下重新创建该过程——一切都是为了科研,而非医疗。现在他们的方法使研究人员能够创建无限的原始生殖细胞,这种在以前很难获得的珍贵细胞的正常供应有助于推动哺乳动物生殖研究。但是,当他们将这个科学挑战自小鼠到猴子,再到人类推进时,这一过程被公众定义为治疗不孕不育的过程,于是相关的道德争议随之出现。“毫无疑问,他们在小鼠身上给这一领域带来了重大的改变,” 洛杉矶加州大学的生育专家Amander Clark说,“但是,在这项技术展示它的实用性之前,我们必须讨论一下使用这种方式创造配子的伦理问题。”回到最初在小鼠体内,胚胎发育一周后,便出现约40个左右的原始生殖细胞。这个小小的细胞团进而在雌性小鼠体内形成成千上万的卵细胞,在雄性小鼠体内每天都能生成几百万个精细胞,并能够遗传小鼠的全套遗传信息。Saitou想要了解在这些细胞发育过程中受到了那些信号的控制。在过去的十年中,Saitou已经通过辛苦研究确定了几个基因——包括Stella, Blimp1 和Prdm14 ——这些基因的某种组合在某些时候对于PGCs的发育起到了至关重要的作用。利用这些基因作为标记,可以从其他细胞中筛选原始生殖细胞以观察这些细胞的变化。2009年,在日本神户的RIKEN发育生物学中心,他发现,当培养条件适当时,在精确的时间加入骨形态发生蛋白4(BMP4),可以胚胎干细胞转化为原始生殖细胞的。为了验证这一发现,他向胚胎干细胞提供高浓度的BMP4,结果显示,几乎所有的胚胎干细胞都变成了PGCs。他和科学家们都预计这一过程非常复杂。http://www.ibioo.com/data/attachment/portal/201308/25/095620gaqefeejnqejxuu3.jpg人造小鼠生殖细胞产生小鼠胚胎的过程(点击图片查看大图)Saitou的方法严格遵循了自然过程,这与其他从事类似研究的人形成了鲜明的对比,以色列魏茨曼科学研究所的干细胞专家Jacob Hanna说。许多科学家尝试通过信号分子轰击干细胞在体外创造特定类型的细胞,然后筛选细胞混合物得到他们想要的细胞。但是他们忽略了这些细胞的自然形成过程和这些人造细胞与自然形成细胞的相似程度。Saitou找出了形成生殖细胞所需的条件,去除多余的信号干扰并将每个过程的时间精确控制,给他的同事们留下了深刻的印象。英国谢菲尔德大学的干细胞生物学家Harry Moore将这种生殖细胞发育的精确重现视为一场“胜利”。到了2009年, Saitou在小鼠生殖细胞出现之前从外胚层取了一些细胞,这成了研究的起点。但是想要真正掌握这个过程中,Saitou希望从细胞培养开始。当时正值Hayashi从英国剑桥大学回到日本,和Saitou一样,Hayashi在该领域先驱Azim Surani英国的实验室里完成了4年的研究。Surani盛赞这两位科学家说,他们的“气质、风格和解决问题的方法能够相互补充”。 Saitou “处理事情时很有系统性、完成目标一心一意”,而Hayashi“工作时更有直觉、视角更广阔、处理问题方法相对更加宽松”,他说。“他们确实形成了一个非常强大的团队。”Hayashi加入了Saitou京都大学的团队,他很快就发现,那里不同于剑桥。在京都大学,Hayashi用在理论讨论上的时间比曾经少得多,而更多的时间都花在实验上。他说“在日本,我们只管‘做’,这有时是非常低效的,但有时又酝酿着巨大的成功”。Hayashi同样以外胚层细胞作为起点,但与Saitou不同的是,他试图培养一个能够产生原始生殖细胞的稳定细胞系。可惜这种方法没有奏效。Hayashi借鉴其他研究结果——一个关键调控分子(activin A)和生长因子(bFGF)可以将培养的早期胚胎干细胞转化成类似于外胚层细胞的细胞类型。这引发了Hayashi将这两个因素结合起来的想法,诱导胚胎干细胞分化为外胚层,然后采用Saitou之前的方法把这些细胞成为的PGCs。通过这种新的方法,他最终获得了成功。为了证明这些人造的原始生殖细胞是真实的拷贝,他们必须证明这些细胞可以进一步发育成精子和卵子。这一进程是非常复杂和难以理解的。所以研究小组将这一工作留给了自然——Hayashi将PGCs植入无法产生精子的小鼠的睾丸,观察这些细胞是否会发育。Saitou认为,这是可行的,但还是感到有些担忧。当实验进行到第3或4只小鼠时,他们发现小鼠的输精管里充满了精子。“这一切都发生得恰如其分,我知道他们会产生幼仔,”Hayashi说。研究小组将这些精子注入卵细胞中并植入雌性小鼠的胚胎,结果产生了大量的雌性和雄性后代。他们利用诱导多能干细胞(iPS)进行反复的实验,成熟的细胞被重新编程为胚胎状态。此外,精子被用于生产幼仔,证明它们具有基本功能——这是干细胞分化领域的罕见成就。Clark说:“这是整个多能性干细胞研究领域里在培养皿中生成全功能细胞类型少有的成功案例之一。”他们预计形成卵细胞更复杂,但是在去年,Hayashi在体外条件下制作有正常着色的原始生殖细胞并转入白化小鼠的卵巢,将产生的卵细胞体外受精后植入代孕。当透过幼崽半透明的眼睑看到黑色的眼睛时,他知道这一切又成功了。生殖细胞的回馈目前,许多研究人员已经能够复制验室培养原始生殖细胞的过程。人造原始生殖细胞特定用于表观遗传学研究:通过修饰DNA确定哪些基因表达。最常见的修饰就是为DNA碱基加上甲基,这些修饰在有些情况下,能够反映生物所经历的历史过程。与其它类型的细胞类似,表观遗传标记改变了原始生殖细胞在胚胎发育过程中的命运,但原始生殖细胞有个与众不同的特点,就是当它们发育成精子和卵子后,表观遗传标记被擦除。这就允许细胞创建能够形成任何类型细胞的受精卵。表观遗传微妙变化中出现错误将会导致不孕不育并出现器官故障,如如睾丸癌。Surani和Hanna的团队已经利用人造原始生殖细胞研究不同酶在表观遗传调控中的作用,也许有一天,能够解答表观遗传网络如何参与疾病调控。事实上,体外产生的原始生殖细胞可以为研究提供数百万个细胞,而不是供科学家研究了40个左右,这些细胞可以通过解剖早期胚胎获得。Hanna说:“这是一个大问题,因为我们这里有这些稀有的原始生殖细胞正在经历我们尚不了解的全基因组表观遗传变化。”“体外模型为科学家们提供了前所未有的方便,” Clark表示认同。临床意义但是Hayashi和Saitou没有办法向乞求帮助的不孕夫妻提供帮助。在这种方法被运用在临床之前,还有许多问题需要梳理。Saitou和Hayashi发现,虽然运用他们的技术所产生的后代通常似乎是健康和大量的,但这些后代产生的原始生殖细胞并生不完全“正常”。 第二代原始生殖细胞产生的卵细胞往往是脆弱、畸形的,并且从支持它们生长的组织上脱离。当受精时,卵细胞内部会分为三组染色体,而不是正常的两组,体外受精的成功率也只有正常原始生殖细胞的三分之一。哈佛医学院从事表观遗传学研究的Yi Zhang,使用Saitou的方法在研究中发现,体外受精过程中,人造的原始生殖细胞不能像自然状态下产生的原始生殖细胞一样,抹去它们的表观遗传标记。“我们必须要知道,这些都是PGCs的类似细胞,而不是真正的原始生殖细胞,”他说。此外,这项技术还存在两个大的挑战。首先是在不将PGCs放回睾丸或卵巢的前提下买入和使它们变成成熟的精子和卵子,Hayashi目前正在试图破解PGCs生成卵子或精子的生物信号,使人工培育条件下完成这一阶段成为可能。但最可怕的挑战是在人体重复上述所有的工作。该小组已经在利用Saitou找到的关键调控基因来调整人类的iPS细胞,但是Saitou 和Hayashi都知道,人类的信息调控网络不同于小鼠。此外,Saitou有无数的小鼠胚胎进行解剖,但无法在人类胚胎进行
美国南加州大学科学家表示,他们新发现的名为IQ-1的小分子在防止胞胎干细胞分化成一种或多种特殊细胞方面具有决定性作用,该研究成果有望帮助人们开发出无污染大规模培养胚胎干细胞的方法。有关研究刊登在美国《国家科学院院报》网站上。 干细胞疗法是许多科学家研究的热门项目,大规模培养胚胎干细胞是干细胞疗法成功发展的前提。目前,实验鼠纤维原细胞饲养层是唯一被证明为能够培养胚胎干细胞的方法。在此方法中,必要的化学信号能促使胚胎干细胞不断分裂而不分化。然而,南加州大学凯克医学院医学和药学教授迈克尔卡恩博士表示,人体胚胎干细胞用饲养层培养会遭受实验鼠糖蛋白标识的污染,如果将培养的干细胞用于人体,或许出现可怕的免疫反应。 作为发现IQ-1小分子的研究小组主要研究人员,卡恩表示,他们发现的小分子帮助人们向实现无实验鼠纤维原细胞饲养层培养胚胎干细胞的方法往前迈进了一步。对于IQ-1的工作原理,卡恩解释说,Wnt通道(也就是细胞信号通道)对干细胞具有分叉效应(dichotomouseffects),IQ-1能够在阻断Wnt通道一个分叉的同时,增强来自Wnt通道另分叉的信号。这样,人们可以从根本上维持干细胞的生长和所需的力量。 卡恩认为,如果人们能够创造出一个化学物质环境的系统来培养人体胚胎干细胞,那么就可以避免干细胞受污染的危险,它将让科学家的工作更加容易,这是研究小组的奋斗目标。凯克医学院干细胞和再生医学中心主任马丁佩拉博士表示,卡恩他们的研究让人们能够观察胚胎干细胞内部分子控制机制,其新发现有望帮助人们开发出大规模繁殖纯胚胎干细胞的技术。
关键词(必填项目):胚胎干细胞培养目的(必填项目):正确规范胚胎干细胞培养背景知识(选填项目):无。原理(选填项目):无主体内容:目录一、细胞二、一般培养-保持胚胎干细胞处于未分化状态培养基细胞复苏冻存细胞明胶包被细胞传代三、体外分化培养基包被有多聚鸟氨酸/纤维结合蛋白的培养板(使用或不使用盖玻片)体外分化方法四、移植细胞的准备细胞多能性胚胎干细胞产生于小鼠胚泡1.表达绿色荧光蛋白(EGFP)的B5-ES细胞。由Dr. Nagy的实验室制备。2.D3-ATCC; CRL-1934. 我们得到时大约传了17代。3.J1-由Dr. Jaenish的实验室友情提供。我们得到时大约传了7-9代。4.J1rtTA-rtTA表达J1细胞,由Dr. Jaenish的实验室友情提供。5.表达黄色荧光蛋白的YC5-ES细胞,由Dr. Nagy的实验室提供。一般培养--维持ES细胞处于未分化状态ES细胞培养用含有ESGRO(白血病抑制因子)的高糖培养基来阻止细胞的分化。为细胞提供包被有0.1%明胶的平板作为粘附细胞的基质。建议每2-3天从达到80%-90%融合的平板按1:8的比率传代细胞一次,细胞传代以后,在将细胞接种在0.1%明胶包被的培养皿之前,通过预先将细胞接种在没有经过包被的组织培养板2个小时,使分化细胞粘附,从而将分化和未分化细胞分开。将细胞全程置于37℃,5%CO2,100%湿度条件下培养。培养基ES:配制一20×不含DMEM,HS,ESGRO的溶液(该溶液也能用于EB培养基--见下文)。分装在50ml FALCON管中,(稀释为2×,每管42ml),贮存在-20℃。通过将21ml该溶液,HS和ESGRO加入450mlDMEM中制备培养基,0.2μm滤膜过滤。贮存于4℃。 注:一瓶DMEM是500ml。贮存液 DMEM(高糖) [/s
很荣幸,受仪器信息网的邀请走访了伟业计量位于河南信阳的科研和生产基地。围绕实验室、仪器、标准物质,以及拓展应用和不同行业间的经验共享,与会老师和伟业计量进行了深入的现场与座谈交流。两天的活动,收获颇多。伟业计量成立于2007年,是国家高新技术企业、国家标准物质研究中心;独立研制十三大系列标准物质30000余种,获批国家一级标准物质28种、国家二级标准物质近600种;产品涉及食品、环境、化工、临床医学及药品等多个领域,为国内外数千家检测机构提供专业的检测标准。另外,伟业计量“BNCC”品牌,专业提供微生物菌种、实验细胞、微生物质控样品等产品,同时提供订了菌株、感受态细胞、基因组DNA、核酸参考品等定制服务。之前通过展会,宣传媒体等对其有过一定的了解,这次是更深入的零距离接触。首先,是实验室环节,最近一两年在上海参观并检查了很多公司的实验室,每个实验室各有千秋,都有值得借鉴的地方。伟业计量在每个实验室入口处张贴了实验室内的主要仪器及主要功能,这对于领导检查有很好的了解提示作用。在实验室的安全管理方面也有特色,每个通风柜上面张贴了各种警示标志。在实验室的排风废气处理上采用活性炭等吸附过滤介质,这些都值得借鉴。在走访的过程中,与实验室人员交流了仪器的选型,探测下限,测量范围等,尤其深入交流了红外测油仪和低本底[font='等线']αβ[/font]测量仪。座谈环节,每位老师来自不同的领域,有海关的,第三方检测的,农残的,核电的。大家针对某一问题,分享自己的工作经验,达到了共同提高的效果。其实这种交流意义是非常大的,国内很多行业都存在产学研脱节的问题。搞科研的,不了解一线实际需求,设备厂家,不了解设备实际应用情况,一线用户,工作中的问题长期得不到解决,一些研发产品,没有切实解决用户的痛点。只有多方加强交流,才会良性促进发展。通过座谈也碰撞出若干合作的点,比如,工业循环冷却水中微生物的检测、氢氧化钠标准溶液的配制、水中氚的检测、起草标准、论文等。我个人也希望在论文和标准方面与同行多多合作。同时在座谈的过程中,针对营销的一些方法,与会人员也给出了一些建议。总之,两天的活动,参与者都有收获。最后引用其中一位老师的话,是忙里偷闲在大别山脚下的缅怀,号角一直在奏响。[img]https://ng1.17img.cn/bbsfiles/images/2023/09/202309261143092794_3825_2520561_3.jpeg[/img][img]https://ng1.17img.cn/bbsfiles/images/2023/09/202309261143095923_513_2520561_3.jpeg[/img]
各国争相发展的重点项目 iPS技术,即诱导性多能干细胞技术,是一种将成体成熟、分化的体细胞重编程获得类似胚胎干细胞的新兴技术。2007年11月美国和日本科学家分别独立宣布可将人类皮肤细胞转化为iPS细胞。这一发现被《自然》和《科学》杂志分别评为2007年第一和第二大科学进展。之后,iPS细胞研究迅猛发展,不同的国家和实验室纷纷报道了多种方法建立的iPS细胞系。就连世界第一只体细胞克隆动物多利羊的培育者伊恩·威尔莫特也宣布放弃人类胚胎干细胞克隆研究,转而进行 iPS 细胞研究,因为他认为这种细胞比胚胎干细胞更具潜在优势。 我国连续多年将干细胞研究列入“863”、“973”、国家自然基金重点项目。国务院2006年发布的《国家中长期科学和技术发展规划纲要(2006-2020年)》中,干细胞作为五项生物技术之一成为未来15年我国前沿技术的重点研究领域。 致瘤风险浮出水面 Yamanaka研究组在《自然·生物技术》上发表的文章显示,用iPS细胞诱导的神经干细胞,即使不含c-Myc(曾被认为是导致肿瘤的主要原因),在植入NOD/SCID免疫缺陷小鼠后仍有很强的致瘤性,甚至高于胚胎干细胞。 他们共研究了36个iPS细胞克隆,在诱导方式上,有些诱导剂配方中含有c-Myc基因,有些没有,因此具有较好的代表性。同时他们选择了3株胚胎干细胞作为对照。在45周的观察中,移植胚胎干细胞来源神经干细胞的34只小鼠有4只长出肿瘤。在100只移植胚胎成纤维细胞来源的iPS神经干细胞小鼠中34只发现肿瘤,概率和胚胎干细胞相当。在55只移植成人成纤维细胞来源的iPS神经干细胞小鼠中46只发现肿瘤,概率远高于胚胎干细胞。在36只移植肝细胞来源的iPS神经干细胞小鼠中10只发现肿瘤,概率高于胚胎干细胞。8只移植胃上皮细胞来源的iPS神经干细胞小鼠中未发现肿瘤。病理学检查证实肿瘤均为畸胎瘤,部分为恶性畸胎瘤。 研究还发现,以前认为致瘤性很强的c-Myc在去掉后并没有减少iPS神经干细胞的致瘤性,相反以前认为没有致瘤性的Nanog基因却可以明显增强iPS神经干细胞的致瘤性。 这次试验的另一个意外结果是并未发现在生成的肿瘤细胞中有c-Myc或其他基因的激活。以前的观点认为,转入的癌基因是iPS致瘤性的基础,只要在iPS细胞诱导成功后通过各种方法去除已完成使命的癌基因即可使iPS细胞免于致瘤性。这次试验的结果无疑给这些想法留下了阴影,而且使iPS致瘤的机制更加扑朔迷离。
[font=Calibri][font=宋体]仪器信息网于[/font]5[/font][font=Calibri][size=10.5pt][font=宋体]月[/font]19[font=宋体]日组织召开[/font][b] “安捷伦免疫治疗与肿瘤免疫细胞分析”网络研讨会[/b][/size][/font][font=Calibri][size=10.5pt][font=宋体],特邀嘉宾[url=https://www.instrument.com.cn/webinar/meetings/News/expert?id=3142]朱欢(安捷伦生物)[/url][/font][font=宋体],带来报告[b]《[url=https://www.instrument.com.cn/webinar/meetings/News/expert?id=3142]xCELLigence RTCA——细胞治疗高效评价技术[/url]》[/b];[/font][/size][/font][font=宋体]欢迎感兴趣的你,报名参会![/font][b][font='Times New Roman'][color=#0563c1][url]https://www.instrument.com.cn/webinar/meetings/immunotherapy/[/url][/color][/font][/b]