刚接触多肽物质的[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]液质[/color][/url]分析,对产生多电荷离子的机理以及多电荷离子的产生受哪些因素的影响?希望老师可以指点,或者有什么资料可以推荐,感谢!
请教各位老师: 1、盐酸克伦特罗质谱离子86、243、262的质荷比分别是多少?2、D9-盐酸克伦特罗质谱离子95的质荷比是多少?3、莱克多巴胺离子250、179、502质荷比是多少?
1.多肽合成的基本原理?多肽固相合成法是多肽合成化學的一個重大的突破。它的最大特點是不必純化中間產物,合成過程可以連續進行,進而為多肽合成的自動化奠定了基礎。目前全自動多肽的合成,基本都是固相合成。其基本過程如下:基於Fmoc化學合成,先將所要合成的目標多肽的C-端氨基酸的羧基以共價鍵形式與一個不溶性的高分子樹脂相連,然後以這一氨基酸的氨基作為多肽合成的起點,同其他的氨基酸已經活化的羧基作用形成肽鍵,不斷重複這一過程,即可得到多肽。根據多肽的氨基酸組成不同,多肽後處理方式不同,純化方式也有差異。2.做免疫用的多肽多長為合適?答:一般約10-15個氨基酸,當然長一些免疫效果好一些,不過合成費用也會增加。MAP多肽則希望長度在15aa以上,效果較好。另外,10aa以下的多肽免疫效果比較差。3.免疫用多肽的純度需要很高嗎?答:一般而言, 免疫用Peptide,70-85%即可。4.我們合成的多肽溶解性不好,多肽就有問題對嗎?答:很難準確預測一個多肽的溶解性及合適的溶劑是什麼。如果多肽難以溶解就認為多肽合成有問題這個觀念並不正確。5.多肽狀態是如何?如何保存儲存?答:我們提供的多肽是粉末狀,一般為灰白色,組成不同,多肽粉末的顏色有差異,多肽一般長期保存需要避光保存,並應保存在-20度,短期可以保存在4度。可以短時間的話是以室溫運輸。6.如何溶解多肽?答:溶解多肽是非常複雜的事情,一般很難一下子確定合適的溶劑。通常是先取一點試驗,在沒有確定合適的溶劑前千萬不要合部溶解。下列方法有助於您選擇合適的溶劑:(1)判定多肽的電荷特定,設定酸性氨基酸Asp(D),Glu(E)和C端COOH為-1;鹼性氨基酸Lys(K),Arg(R),His(H)及N端NH2為+1,其他氨基酸的電荷為0。計算出將電荷數。(2)如果淨電荷數 0,多肽為鹼性,用水溶解:如果不溶解或溶解性不大,加入醋酸(10%以上);如果多肽還不能溶解,加入少量TFA(25ul)溶解,然後加入500ul水稀釋。(3)如果淨電荷數0,多肽為酸性,用水溶解;如果不溶解或溶解性不大,加入氨水(25ul)溶解,然後加入500ul水稀釋。(4)如果淨電荷數=0,多肽為中性,一般需要用有機溶劑如乙腈,甲醇或異丙醇,DMSO等溶解。還有人建議需要尿素來溶解疏水性很大的多肽。7.非HPLC純化的多肽中有哪些雜質?答:粗品和脫鹽級別的多肽中多肽和非多肽類雜質:如非全長多肽和多肽後處理的一些原料如DTT、TFA等8.HPLC純化的多肽有哪些雜質?答:經過HPLC純化的多肽,仍會有一些一些雜質存在,其中的雜質主要是短肽和微量TFA。9.多長的多肽為合適?答:多肽合成需要考慮多肽的長度,電荷,親疏水性等因素。長度越長,合成粗品的純度和產率都隨著降低,純化的難度和無法合成的幾率就會大些。當然多肽功能區的序列是無法改變的,但是為了多肽的順利合成,有時不得不在功能取的上下游增加一些輔助氨基酸,以改善多肽的溶解性和親疏水性。如果多肽太短,合成也可能有問題,主要問題是合成的多肽在後處理過程中有一定的難度,5肽以下的多肽,一般要有疏水的氨基酸,否則後處理難度加大。15個氨基酸殘基以下的多肽一般都可以得到滿意的產率和得率。10.如何從多肽序列中判定多肽的溶解性?(1)多肽中如果含有高比例的疏水性很強的氨基酸如和Leu,Val,IIe,Met,Phe和Trp,多肽很難溶解與水性溶液中或根本不可能溶解。這些氨基酸無論是純化或合成,都有可能有問題。(2)一般情況下疏水性氨基酸的比例50%,不能連續5個連續aa為疏水性,帶電荷的氨基酸的(正電荷K,R,H,N-terminus,負電荷D,E,C- terminus)的比例達到20%,在多肽的N或C短如果能增加極性氨基酸,也可以改善溶解性。11.為什麼含有Cys,Met,或Trp的多肽難合成?答:含有Cys, Met,或Trp的多肽難以合成,同時難以獲得高純度的產品。主要因為這些基團不穩定,易氧化。這些多肽的使用和儲存都需要特別注意,避免反復開啟蓋子。12.為什麼有些多肽的合成產率或純度會比較低?答:多肽合成與引子合成有比較大的區別,不能合成的引子很少,但是不能合成的多肽經常有。如Val,Ile,Tyr,Phe,Trp,Leu,Gln,和Thr這些氨基酸比鄰或重複時,多肽鏈在合成過程中不能完全舒展溶解,合成效率下降。以下幾種情形,合成效率和產物的純度都比較低,如:重複Pro,Ser-Ser,重複Asp,4個連續Gly等.13.多肽是如何純化的?答:多肽純化一般使用反相柱(如C8,C18等),214nm。緩衝體系通常為含TFA的溶劑,pH 2.0 。Buffer A為含0.1%TFA in ddH2O,Buffer B為1%TFA/ACN/ pH 2.0。純化前用Buffer A溶解;如果溶解不好,用Buffer B溶解後,然後用Buffer A稀釋;對疏水性強的多肽,有時還需要加入少量的Formic Acid或醋酸。HPLC分析多肽粗產物,如果多肽不長(15aa以下),一般會有主峰,主峰通常為全長產物;對於20aa以上的長肽,如果沒有主峰,HPLC需搭配Mass來判定分子量,進而確定哪個峰是所要合成的多肽。
我近期要做一个分子量近4000的多肽,厂家提供的资料说是具有加2个氢的峰,如果这样的话是不是母离子的质荷比就会立马变成2000左右,理论上质荷比2000在API3000质谱的接受范围,由于还未知道确切的分子量,所以没有开始扫。请教一下各位,这用API3000是否可行,由于我们实验室只有API3000,没有TOF之类的仪器
醋酸作为一种重要的原料广泛应用于化工、有机合成、农药、生物医药等行业。在医药行业,醋酸可以作为一种合成原料药,也可以作为一种有机溶媒或者调节pH用。在药品质量控制中,控制有机溶媒的残留是一个重要的环节。有机溶媒的常规的检测方法有[url=https://insevent.instrument.com.cn/t/Mp][color=#3333ff]气相色谱[/color][/url]法、[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]法、滴定法、高效[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]法、分光光度法、比色法等。 [url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]法分析离子具有快速方便、灵敏度高、结果准确可靠、重复性好等优点,早已成为生物、化学相关领域至关重要的检测分析技术之一。微源检测拥有Dionex ICS5000+[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱仪[/color][/url],可以为客户提供各类物质阴阳离子检测完整解决方案。微源检测建立了药物中醋酸根残留的[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]法检测方案,并以多肽药物样品作为样本进行了方法考察。 分析条件: 仪器型号:赛默飞Dionex ICS5000+ 分离柱:Dionex IonPac AS19 4mm*250mm 保护柱:Dionex IonPac AG18 4mm*50mm 淋洗液:NaHCO3+Na2CO3溶液 检测器:抑制电导检测器 抑制电流:80mA 柱温:30℃ 进样器:AS-AP自动进样器 流速:1mL/min 进样量:10μL 多肽药物一般都是采用固相合成的方法制备,其中通常含有一定量的醋酸盐,因此其中醋酸根残留进行考察具有重要意义。检测中,采用醋酸钠作为对照品,对醋酸根的检出限定量限、线性、加标回收率、重复性和精密度等进行了考察。结果显示醋酸根浓度在50~150ppb浓度范围具有良好的线性关系,线性相关系数r=0.9997,精密度实验相对标准偏差RSD=0.2%,加标回收率96.1%~100.57%。各项指标符合可接受标准,该方法适用于多肽类药物中醋酸根残留的分析检测
各位大侠们你们好!我是刚使用[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]液质[/color][/url]的新手!我做的四个多肽分子量都是2000以上,在THERMO LCQ FLEET上先全扫描了一下都成多电荷的离子(一般2-4电荷),但是我需要在AB的API4000上做定量分析,可是在tune的时候Q1的信号强度很弱,tune完的检测下限太高了,请问如何加强他们的灵敏度啊!我已经用了0.1%的甲酸乙腈溶液稀释的!做多肽的质谱分析有什么需要注意的地方么?我是个刚毕业的新手(本科)很多都不知道!谢谢大侠们了!跪求![em09511][em09509]
现做多肽的裂解,请问多肽质谱裂解符合氮律吗?因为我看是针对分子离子峰所说的,我不知道如果多肽带多电荷的话,算不算是分子离子峰??
多肽合成又叫肽链合成,是一个固相合成顺序一般从C端(羧基端)向N端(氨基端)合成。过去的多肽合成是在溶液中进行的称为液相合成法。多肽的合成主要分为两条途径:化学合成多肽和生物合成多肽。请移步百度搜“合肥国肽生物”即可多肽合成的原理多肽合成就是如何把各种氨基酸单位按照天然物的氨基酸排列顺序和连接方式连接起来。由于氨基酸在中性条件下是以分子内的两性离子形式(H3+NCH(R)COO-)存在,因此,氨基酸之间直接缩合形成酰胺键的反应在一般条件下是难于进行的。氨基酸酯的反应活性较高。在100℃下加热或者室温下长时间放置都能聚合生成肽酯,但反应并没有定向性,两种氨基酸a1和a2的酯在聚合时将生成a1a2…、a1a1…、a2a1…等各种任意顺序的混合物。为了得到具有特定顺序的合成多肽,采用任意聚合的方法是行不通的,而只能采用逐步缩合的定向多肽合成方法。一般是如下式所示,即先将不需要反应的氨基或羧基用适当的基团暂时保护起来,然后再进行连接反应,以保证多肽合成的定向进行。式中的X和Q分别为氨基和羧基的保护基,它不仅可以防止乱接副反应的发生,还具有能消除氨基酸的两性离子形式,并使之易溶于有机溶剂的作用。Q在有的情况下也可以不是共价连接的基团,而是由有机强碱(如三乙胺)同氨基酸的羧基氢离子组成的有机阳离子。Y为一强的吸电子基团,它能使羧基活化,而有利于另一氨基酸的自由氨基,对其活化羧基的羧基碳原子进行亲核进攻生成酰胺键。由此所得的连接产物是N端和C端都带有保护基的保护肽,要脱去保护基后才能得到自由的肽。如果肽链不是到此为止,而是还需要从N端或C端延长肽链的话,则可以先选择性地脱去X或Q,然后再同新的N保护氨基酸(或肽)或C保护的氨基酸(或肽)进行第二次连接,并依次不断重复下去,直到所需要的肽链长度为止。对于长肽的多肽合成来说,一般有逐步增长和片段缩合两种伸长肽链的方式,前者是由起始的氨基酸(或肽)开始。每连接一次,接长一个氨基酸,后者则是用N保护肽同C保护肽缩合来得到两者长度相加的新的长肽链。对于多肽合成中含有谷氨酸、天冬氨酸、赖氨酸、精氨酸、组氨酸、半胱氨酸等等带侧链功能团的氨基酸的肽来说,为了避免由于侧链功能团所带来的副反应,一般也需要用适当的保护基将侧链基团暂时保护起来。多肽合成方法分类多肽的合成主要分为两条途径:化学合成多肽和生物合成多肽。化学合成主要是以氨基酸与氨基酸之间缩合的形式来进行。在合成含有特定顺序的多肽时,由于多肽合成原料中含有官能度大于2的氨基酸单体,多肽合成时应将不需要反应的基团暂时保护起来,方可进行成肽反应,这样保证了多肽合成目标产物的定向性。多肽的化学合成又分为液相合成和固相合成。多肽液相合成主要分为逐步合成和片段组合两种策略。逐步合成简洁迅速,可用于各种生物活性多肽片段的合成。片段组合法主要包括天然化学连接和施陶丁格连接。近年,多肽液相片段合成法发展迅速,在多肽和蛋白质合成领域已取得了重大突破。在多肽片段合成法中,根据多肽片段的化学特定性或化学选择性,多肽片段能够自发进行连接,得到目标多肽。因为多肽片段含有的氨基酸残基相对较少,所以纯度较高,且易于纯化。多肽的生物合成方法主要包括发酵法、酶解法,随着生物工程技术的发展,以DNA重组技术为主导的基因工程法也被应用于多肽的合成。多肽的固相合成多肽的合成是氨基酸重复添加的过程,通常从C端向N端(氨基端)进行合成。多肽固相合成的原理是将目的肽的第一个氨基酸C端通过共价键与固相载体连接,再以该氨基酸N端为合成起点,经过脱去氨基保护基和过量的已活化的第二个氨基酸进行反应,接长肽链,重复操作,达到理想的合成肽链长度,最后将肽链从树脂上裂解下来,分离纯化,获得目标多肽。1、Boc多肽合成法Boc方法是经典的多肽固相合成法,以Boc作为氨基酸α-氨基的保护基,苄醇类作为侧链保护基,Boc的脱除通常采用三氟乙酸(TFA)进行。多肽合成时将已用Boc保护好的N-α-氨基酸共价交联到树脂上,TFA切除Boc保护基,N端用弱碱中和。肽链的延长通过二环己基碳二亚胺(DCC)活化、偶联进行,最终采用强酸氢氟酸(HF)法或三氟甲磺酸(TFMSA)将合成的目标多肽从树脂上解离。在Boc多肽合成法中,为了便于下一步的多肽合成,反复用酸进行脱保护,一些副反应被带入实验中,例如多肽容易从树脂上切除下来,氨基酸侧链在酸性条件不稳定等。2、Fmoc多肽合成法Carpino和Han以Boc多肽合成法为基础发展起来一种多肽固相合成的新方法——Fmoc多肽合成法。Fmoc多肽合成法以Fmoc作为氨基酸α-氨基的保护基。其优势为在酸性条件下是稳定的,不受TFA等试剂的影响,应用温和的碱处理可脱保护,所以侧链可用易于酸脱除的Boc保护基进行保护。肽段的最后切除可采用TFA/二氯甲烷(DCM)从树脂上定量完成,避免了采用强酸。同时,与Boc法相比,Fmoc法反应条件温和,副反应少,产率高,并且Fmoc基团本身具有特征性紫外吸收,易于监测控制反应的进行。Fmoc法在多肽固相合成领域应用越来越广泛。多肽液相分段合成随着多肽合成的发展,多肽液相分段合成(即多肽片段在溶液中依据其化学专一性或化学选择性,自发连接成长肽的合成方法)在多肽合成领域中的作用越来越突出。其特点在于可以用于长肽的合成,并且纯度高,易于纯化。多肽液相分段合成主要分为天然化学连接和施陶丁格连接。天然化学连接是多肽分段合成的基础方法,局限在于所合成的多肽必须含半光氨酸(Cys)残基,因而限定了天然化学连接方法的应用范围。天然化学连接方法的延伸包括化学区域选择连接、可除去辅助基连接、光敏感辅助基连接。施陶丁格连接方法是另一种基础的片段连接方法,其为多肽片段连接途径开拓了更广阔的思路。正交化学连接方法是施陶丁格连接方法的延伸,通过简化膦硫酯辅助基来提高片段间的缩合率。其他多肽合成方法1、氨基酸的羧内酸酐法(NCA)氨基酸的羧内酸酐的氨基保护基也可活化羧基。NCA的原理:在碱性条件下,氨基酸阴离子与NCA形成一个更稳定的氨基甲酸酯类离子,在酸化时该离子失去二氧化碳,生成二肽。生成的二肽又与其他的NCA结合,反复进行。NCA适用于短链肽片段的多肽合成,其周期短、操作简单、成本低、得到产物分子量高,在目前多肽合成中所占比例较大,技术也较为通用。2、组合化学法20世纪80年代,以固相多肽合成为基础提出了组合化学法,即氨基酸的构建单元通过组合的方式进行连接,合成出含有大量化合物的化学库,并从中筛选出具有某种理化性质或药理活性化合物的一套多肽合成策略和筛选方案。组合化学法的多肽合成策略主要包括:混合-均分法、迭代法、光控定位组合库法、茶叶袋法等。组合化学法的最大优点在于可同时合成多种化合物,并且能最大限度地筛选各种新化合物及其异构体。3、酶解法酶解法是用生物酶降解植物蛋白质和动物蛋白质,获得小分子多肽。酶解法因其多肽产量低、投资大、周期长、污染严重,未能实现工业化生产。酶解法获得的多肽能够保留蛋白质原有的营养价值,并且可以获得比原蛋白质更多的功能,更加绿色,更加健康。4、基因工程法基因工程法主要以DNA重组技术为基础,通过合适的DNA模板来控制多肽的序列合成。有研究者通过基因工程法获得了准弹性蛋白-聚缬氨酸-脯氨酸-甘氨酸-缬氨酸-甘氨酸肽(VPGVG)。利用基因工程技术生产的活性多肽还有肽类抗生素、干扰素类、白介素类、生长因子类、肿瘤坏死因子、人生长激素,血液中凝血因子、促红细胞生成素,组织非蛋白纤溶酶原等。基因工程法合成多肽具有表达定向性强,安全卫生,原料来源广泛和成本低等优点,但因存在高效表达,不易分离,产率低的问题,难以实现规模化生产。5、发酵法发酵法是从微生物代谢产物中获得多肽的方法。虽然发酵法的成本低,但其应用范围较窄,因为现在微生物能够独立合成的聚氨基酸只有ε-聚赖氨酸(ε-PL)、γ-聚谷氨酸(γ-PGA)和蓝细菌肽。[align=center][img=,770,348]https://ng1.17img.cn/bbsfiles/images/2019/03/201903151633244062_8177_3531468_3.jpg!w770x348.jpg[/img][/align]请移步百度搜“合肥国肽生物”即可我们主要提供:多肽合成、定制多肽、同位素标记肽、人工胰岛素、磷酸肽、生物素标记肽、荧光标记肽(Cy3、Cy5、Fitc、AMC等)、目录肽、偶联蛋白(KLH、BSA、OVA等)、化妆品肽、多肽文库构建、抗体服务、糖肽、订书肽、药物肽、RGD环肽等。
在GC-MS质谱图上,质荷比(m/z)中的电荷通常被默认为是一个正电荷。问题:EI离子源只产生带一个正电荷的离子吗?能产生多电荷离子吗?为什么?
荷质比与相对离子强度的关系?
在GC-MS质谱图上,质荷比(m/z)中的电荷通常被默认为是一个正电荷。问题:EI离子源只产生带一个正电荷的离子吗?能产生多电荷离子吗?为什么?
调协标样PFTBA的什么碎片产生质荷比为69,219,502的离子?
[em04] 摘 要 综述了近几年来多肽类物质的提取分离与分析方法,主要包括高效液相色法、电泳、质谱及核磁共振等方法在肽类物质研究中的最新应用进展。 多肽类化合物广泛存在于自然界中,其中对具有一定生物活性的多肽的研究,一直是药物开发的一个主要方向。生物体内已知的活性多肽主要是从内分泌腺组织器官、分泌细胞和体液中产生或获得的,生命活动中的细胞分化、神经激素递质调节、肿瘤病变、免疫调节等均与活性多肽密切相关。随着现代科技的飞速发展,从天然产物中获得肽类物质的手段也不断得到提高。一些新方法、新思路的应用。不断有新的肽类物质被发现应用于防病治病之中。本文介绍了近几年肽类物质分离、分析的主要方法研究进展。 1 分离方法 采取何种分离纯化方法要由所提取的组织材料、所要提取物质的性质决定。对蛋白质、多肽提取分离常用的方法包括:盐析法、超滤法、凝胶过滤法、等电点沉淀法、离子交换层析、亲和层析、吸附层析、逆流分溶、酶解法等。这些方法常常组合到一起对特定的物质进行分离纯化,同时上述这些方法也是蛋白、多肽类物质分析中常用的手段,如层析、叫泳等。 1.1 高效液相色谱(HPLC) 1.1.1 反相高效液相色谱(RP-HPLC) 1.1.2 疏水作用色谱(Hydrophobic interaction chromatogrphy,HIC) 1.1.3 分子排阻色谱(Sizs-Exclusion chromatogrphy,SEC) SEC是利用多肽分子大小、形状差异来分离纯化多肽物质,特别对一些较大的聚集态的分子更为方便,如人重组生长激素(hgH)的分离,不同结构、构型的GH在SEC柱上分离行为完全不同,从而可分离不同构型或在氨基酸序列上有微小差异的变异体,利用SEC研究修饰化的PEG的分离方法,此PEC具有半衰期长、作用强的特点。一些分子量较大的肽或蛋白均可利用此法分离分析。 1.1.4离子交换色谱(Iron-Exchange chromatography,IEXC) IEXC可在中性条件下,利用多肽的带电性不同分离纯化具有生物活性的多肽。其可分为阳离子柱与阴离子柱两大类,还有一些新型树脂,如大孔型树脂、均孔型树脂、离子交换纤维素、葡聚糖凝胶、琼脂糖凝胶树脂等。在多肽类物质的分离分析研究中,对多肽的性质、洗脱剂、洗脱条件的研究较多,不同的多肽分离条件有所不同,特别是洗脱剂的离子强度、盐浓度等对纯化影响较大。Wu等报道利用离子交换柱层析法,探讨分离牛碳酸酐异构体和牛血清白蛋白、鸡血清白蛋白酶的提取条件,获得了有价值的数据供今后此类物质分离研究。 1.1.5膜蛋白色谱(Chromatography of Membrane Protein,CMP) CMP+分离强蔬水性蛋白、多肽混合物的层析系统,一般有去垢剂(如SDS)溶解膜蛋白后形成SDS-融膜蛋白,并由羟基磷灰石为固定相的柱子分离纯化。羟基磷灰石柱具有阴离子磷酸基团(P-端),又具有阳离子钙(C-端),与固定相结合主要决定于膜蛋白的大小、SDS结合量有关。利用原子散射法研究cAMP的分离机制发现,样品与SDS结合后在离子交换柱上存在SDS分子、带电荷氨基酸与固定相中带电离子间的交换,从而达到分级分离的目的。 1.1.6高效置换色谱(High-Performance Displacement Chromatography,HPDC) HPDC是利用小分子高效置换剂来交换色谱柱上的样品,从而达到分离的目的。它具有分离组分含量较少成分的特性。利用HPDC鉴定分离了低于总量1%组分的活性人重组生长激素(rHG )。在研究非毒性交换剂时Jayarama发现硫酸化葡萄糖(Detran Sulfate,DS)是对β乳球蛋白A和B的良好置换剂,一般DS的相对分子质量为1×104和4×104最宜。研究表明置换剂的相对分子质量越低,越易于与固定相结合,因此在分离相对分子质量小的多肽时,需要更小的置换剂才能将其置换纯化出来。 1.1.7 灌注层析(Perfusion Chromatography,PC) PC是一种基于分子筛原理与高速流动的流动相的层析分离方法,固定相孔径大小及流动相速度直接影响分离效果。试验证明其在生产、制备过程中具有低投入、高产出的特性。目前市场上可供应的PC固定相种类较多,适合于不同分子量的多肽分离使用。 1.2 亲和层析(Affinity Chromatography,AC) AC是利用连接在固定相基质上的配基与可以和其特异性产生作用的配体之间的特异亲和性而分离物质的层析方法。自1968年Cuatrecasas提出亲和层析概念以来,在寻找特异亲和作用物质上发现了许多组合,如抗原-抗体、酶-催化底物、凝集素-多糖、寡核苷酸与其互补链等等。对多肽类物质分离目前主要应用其单抗或生物模拟配基与其亲和,这些配基由天然的,也有根据其结构人工合成的。Patel等人利用一系列亲和柱分离纯化到了组织血浆纤维蛋白酶原激活剂蛋白多肽。 1.3 毛细管电泳(Capillary electrophoresis,CE)--分离分析方法 CE是在传统的电泳技术基础上于本世纪60年代末由Hjerten发明的,其利用小的毛细管代替传统的大电泳槽,使电泳效率提高了几十倍。此技术从80年代以来发展迅速,是生物化学分析工作者与生化学家分离、定性多肽与蛋白类物质的有利工具。CE根据应用原理不同可分为以下几种;毛细管区带电泳Capillary Zone electrophoresis,CZE)、毛细管等电聚焦电泳(Capillary Isoeletric Focusing,CIEF)毛细管凝胶电泳(CapillaryGelElectrophoresis,CGE)和胶束电动毛细管层析(Micellar Electokinetic Electrophoresis Chromatorgraphy,MECC)等。 1.3.1 毛细管区带电泳(Capillary Zone Electrophoresis,CZE) CZE分离多肽类物质主要是依据不同组分中的化合物所带电性决定,比传统凝胶电泳更准确。目前存在于CZE分离分析多肽物质的主要问题是天然蛋白或肽易与毛细管硅胶柱上的硅醇发生反应,影响峰形与电泳时间,针对这些问题不少学者做了大量实验进行改进,如调节电池泳液的PH值,使与硅醇反应的极性基团减少;改进毛细管柱材料的组成,针对多肽性质的不同采取不同的CZE方法研究分离5个含9个氨基酸残基的小肽,确定了小肽分析的基本条件,即在低PH条件下,缓冲液中含有一定浓度的金属离子如Zn2+等,此时分离速度快而且准确。 1.3.2细管等电聚电泳(Capillary Isleletric Focusing,CIEF) 由于不同的蛋白、多肽的等电点(PI)不同,因此在具有不同pH梯度的电泳槽中,其可在等电点pH条件下聚集沉淀下来,而与其他肽类分离开来。CIEF在分离、分析混合多肽物质中应用不多,主要应用与不同来源的多肽异构体之间的分离,如对rHG不同异构体分离。由于在CIEF柱表面覆盖物的不稳定性限制了此法的广泛应用。 1.3. 3毛细管凝胶电泳 (Capillary Gel Electrophoresis,CGE) CGE是基于分子筛原理,经十二烷基磺酸钠(SDS)处理的蛋白或多肽在电泳过程中主要靠分子形状、分子量不同而分离。目前,又有一种非交联欢、线性、疏水多聚凝胶柱被用于多肽物质的分离分析,此电泳法适于含疏水侧链较多的肽分离,这种凝胶易于灌注,使用寿命长,性质较为稳定。 1.3.4胶束电动毛细管层析(Micellar Electrokinetic Electorphoresis Chromatography, MECC) MECC的原理是在电泳液中加入表面活性剂,如SDS,使一些中性分子带相同电荷分子得以分离。特别对一些小分子肽,阴离子、阳离子表面活性剂的应用都可使之形成带有一定电荷的胶束,从而得到很好的分离效果。有文献报道在电解液中加入环糊精等物质,可使用权含疏水结构组分的多肽选择性与环糊精的环孔作用,从而利用疏水作用使多肽得到分离。 1.4多肽蛋白质分离工程的系统应用 以上提到的分离多肽的技术在实际应用过程中多相互结合,根据分离多肽性质的不同,采用不同的分离手段。特别是后基因组时代,对于蛋白质组深入的研究,人们对于分离多肽及蛋白质的手段不断改进,综合利用了蛋白质和多肽的各种性质,采用包括前面提到的常规蛋白多肽提取方法,同时利用了高效液相色谱,毛细管电泳,2-D电泳等手段分离得到细胞或组织中尽可能多的蛋白多肽。在蛋白质组学研究中系统应用蛋白和多肽分离鉴定的技术在此研究中即是分离手段也是分析方法之一。特别是以下提到的质谱技术的发展,大大的提高了蛋白多肽类物质的分析鉴定的效率。
请问下, 我现在想用离子交换柱来将细胞中复杂多肽样品,简化为多个样品进行分析,怎么选择柱子,洗脱液等,麻烦指教下

多肽合成方法分类多肽的合成主要分为两条途径:化学合成多肽和生物合成多肽。化学合成主要是以氨基酸与氨基酸之间缩合的形式来进行。在合成含有特定顺序的多肽时,由于多肽合成原料中含有官能度大于2的氨基酸单体,多肽合成时应将不需要反应的基团暂时保护起来,方可进行成肽反应,这样保证了多肽合成目标产物的定向性。多肽的化学合成又分为液相合成和固相合成。【合肥国肽生物】多肽液相合成主要分为逐步合成和片段组合两种策略。逐步合成简洁迅速,可用于各种生物活性多肽片段的合成。片段组合法主要包括天然化学连接和施陶丁格连接。近年,多肽液相片段合成法发展迅速,在多肽和蛋白质合成领域已取得了重大突破。在多肽片段合成法中,根据多肽片段的化学特定性或化学选择性,多肽片段能够自发进行连接,得到目标多肽。因为多肽片段含有的氨基酸残基相对较少,所以纯度较高,且易于纯化。多肽的生物合成方法主要包括发酵法、酶解法,随着生物工程技术的发展,以DNA重组技术为主导的基因工程法也被应用于多肽的合成。多肽的固相合成多肽的合成是氨基酸重复添加的过程,通常从C端向N端(氨基端)进行合成。多肽固相合成的原理是将目的肽的第一个氨基酸C端通过共价键与固相载体连接,再以该氨基酸N端为合成起点,经过脱去氨基保护基和过量的已活化的第二个氨基酸进行反应,接长肽链,重复操作,达到理想的合成肽链长度,最后将肽链从树脂上裂解下来,分离纯化,获得目标多肽。1、Boc多肽合成法Boc方法是经典的多肽固相合成法,以Boc作为氨基酸α-氨基的保护基,苄醇类作为侧链保护基,Boc的脱除通常采用三氟乙酸(TFA)进行。多肽合成时将已用Boc保护好的N-α-氨基酸共价交联到树脂上,TFA切除Boc保护基,N端用弱碱中和。肽链的延长通过二环己基碳二亚胺(DCC)活化、偶联进行,最终采用强酸氢氟酸(HF)法或三氟甲磺酸(TFMSA)将合成的目标多肽从树脂上解离。在Boc多肽合成法中,为了便于下一步的多肽合成,反复用酸进行脱保护,一些副反应被带入实验中,例如多肽容易从树脂上切除下来,氨基酸侧链在酸性条件不稳定等。2、Fmoc多肽合成法Carpino和Han以Boc多肽合成法为基础发展起来一种多肽固相合成的新方法——Fmoc多肽合成法。Fmoc多肽合成法以Fmoc作为氨基酸α-氨基的保护基。其优势为在酸性条件下是稳定的,不受TFA等试剂的影响,应用温和的碱处理可脱保护,所以侧链可用易于酸脱除的Boc保护基进行保护。肽段的最后切除可采用TFA/二氯甲烷(DCM)从树脂上定量完成,避免了采用强酸。同时,与Boc法相比,Fmoc法反应条件温和,副反应少,产率高,并且Fmoc基团本身具有特征性紫外吸收,易于监测控制反应的进行。Fmoc法在多肽固相合成领域应用越来越广泛。多肽液相分段合成随着多肽合成的发展,多肽液相分段合成(即多肽片段在溶液中依据其化学专一性或化学选择性,自发连接成长肽的合成方法)在多肽合成领域中的作用越来越突出。其特点在于可以用于长肽的合成,并且纯度高,易于纯化。多肽液相分段合成主要分为天然化学连接和施陶丁格连接。天然化学连接是多肽分段合成的基础方法,局限在于所合成的多肽必须含半光氨酸(Cys)残基,因而限定了天然化学连接方法的应用范围。天然化学连接方法的延伸包括化学区域选择连接、可除去辅助基连接、光敏感辅助基连接。施陶丁格连接方法是另一种基础的片段连接方法,其为多肽片段连接途径开拓了更广阔的思路。正交化学连接方法是施陶丁格连接方法的延伸,通过简化膦硫酯辅助基来提高片段间的缩合率。其他多肽合成方法1、氨基酸的羧内酸酐法(NCA)氨基酸的羧内酸酐的氨基保护基也可活化羧基。NCA的原理:在碱性条件下,氨基酸阴离子与NCA形成一个更稳定的氨基甲酸酯类离子,在酸化时该离子失去二氧化碳,生成二肽。生成的二肽又与其他的NCA结合,反复进行。NCA适用于短链肽片段的多肽合成,其周期短、操作简单、成本低、得到产物分子量高,在目前多肽合成中所占比例较大,技术也较为通用。2、组合化学法20世纪80年代,以固相多肽合成为基础提出了组合化学法,即氨基酸的构建单元通过组合的方式进行连接,合成出含有大量化合物的化学库,并从中筛选出具有某种理化性质或药理活性化合物的一套多肽合成策略和筛选方案。组合化学法的多肽合成策略主要包括:混合-均分法、迭代法、光控定位组合库法、茶叶袋法等。组合化学法的最大优点在于可同时合成多种化合物,并且能最大限度地筛选各种新化合物及其异构体。3、酶解法酶解法是用生物酶降解植物蛋白质和动物蛋白质,获得小分子多肽。酶解法因其多肽产量低、投资大、周期长、污染严重,未能实现工业化生产。酶解法获得的多肽能够保留蛋白质原有的营养价值,并且可以获得比原蛋白质更多的功能,更加绿色,更加健康。4、基因工程法基因工程法主要以DNA重组技术为基础,通过合适的DNA模板来控制多肽的序列合成。有研究者通过基因工程法获得了准弹性蛋白-聚缬氨酸-脯氨酸-甘氨酸-缬氨酸-甘氨酸肽(VPGVG)。利用基因工程技术生产的活性多肽还有肽类抗生素、干扰素类、白介素类、生长因子类、肿瘤坏死因子、人生长激素,血液中凝血因子、促红细胞生成素,组织非蛋白纤溶酶原等。基因工程法合成多肽具有表达定向性强,安全卫生,原料来源广泛和成本低等优点,但因存在高效表达,不易分离,产率低的问题,难以实现规模化生产。5、发酵法发酵法是从微生物代谢产物中获得多肽的方法。虽然发酵法的成本低,但其应用范围较窄,因为现在微生物能够独立合成的聚氨基酸只有ε-聚赖氨酸(ε-PL)、γ-聚谷氨酸(γ-PGA)和蓝细菌肽。[img=,457,333]https://ng1.17img.cn/bbsfiles/images/2019/04/201904221507346400_2482_3531468_3.jpg!w457x333.jpg[/img]我们主要提供:多肽合成、定制多肽、同位素标记肽、人工胰岛素、磷酸肽、生物素标记肽、荧光标记肽(Cy3、Cy5、Fitc、AMC等)、目录肽、偶联蛋白(KLH、BSA、OVA等)、化妆品肽、多肽文库构建、抗体服务、糖肽、订书肽、药物肽、RGD环肽等。合肥国肽生物官网:http://www.bankpeptide.com欢迎咨询服务热线:17718122172;17718122684;17730030476;17718122397

[font=宋体][size=10.5000pt]摘要:关于多肽的一个常见的误解是多肽像蛋白质一样是不稳定的。事实上,多肽比蛋白质稳定得多,由于两个影响蛋白质稳定性的要素不存在多肽合成中。这两个要素是第三次折叠和蛋白酶的污染。【详情请咨询国肽生物】[/size][/font][font=宋体][size=10.5000pt][font=宋体]([/font]1[font=宋体])多肽稳定性[/font][/size][/font][font=宋体][size=10.5000pt]关于多肽的一个常见的误解是多肽像蛋白质一样是不稳定的。事实上,多肽比蛋白质稳定得多,由于两个影响蛋白质稳定性的要素不存在多肽合成中。这两个要素是第三次折叠和蛋白酶的污染。[/size][/font][font=宋体][size=10.5000pt]蛋白质很容易变性,由于它的三级构造是由非共价键联合的,例如静电互相作用和疏水互相作用。由于长度短,大多数肽没有足够量的这种互相作用使每个分子折叠到规则的三级构造。结果多肽不能像蛋白质一样变性。在这种假定下,多肽只能经过共价修饰或者肽键断裂被毁坏。不像蛋白质是从充溢各种蛋白酶的细胞里被纯化,合成的多肽被蛋白酶污染的时机是极端小的。[/size][/font][font=宋体][size=10.5000pt][font=宋体]反响有可能会毁坏例如氧化需求极端[/font]pH[font=宋体]值的多肽。在中性[/font][font=Calibri]pH[/font][font=宋体]条件下,大多数生物实验的停止速度很慢。细菌污染可能是一个比那些反响更严重的要挟,由于多肽是细菌的一种良好的营养源。因而,溶剂过滤比多肽的稳定更重要。[/font][/size][/font][font=宋体][size=10.5000pt][font=宋体]普通状况下,在正常条件下,多肽溶液在室温下能保管几天,在[/font]4[font=宋体]度保管几个星期和在[/font][font=Calibri]-20[/font][font=宋体]度保管若干个月或更多;冻干的多肽粉末在室温下能保管几个月,在[/font][font=Calibri]-20[/font][font=宋体]度下保管几年。[/font][/size][/font][font=宋体][size=10.5000pt][font=宋体]([/font]2[font=宋体])多肽浓度[/font][/size][/font][font=宋体][size=10.5000pt]准确测定多肽浓度比许多人预期的更复杂。事实上,没有一个简单的通用办法能用。称重和紫外线吸收力是两个最常用的办法。[/size][/font][font=宋体][size=10.5000pt]a. [font=宋体]称重 它只能提供粗略估量的多肽含量。首先,多肽粉末是不容易处置的。准确称量少量([/font][font=Calibri] 40[/font][font=宋体]%。实践含量取决于多肽序列。反离子的类型和数量取决于用于多肽纯化的溶剂和多肽序列。由这些水分子产生的不肯定性不能被疏忽。[/font][/size][/font][font=宋体][size=10.5000pt]b. [font=宋体]紫外线吸收性 假如您的多肽含有一个酪氨酸或色氨酸残基,多肽的定量剖析就变得愈加简单。色氨酸在[/font][font=Calibri]282 nm[/font][font=宋体]处的摩尔吸光度[/font][font=Calibri][1 /[/font][font=宋体]([/font][font=Calibri]M *[/font][font=宋体]厘米)[/font][font=Calibri]][/font][font=宋体]是[/font][font=Calibri]5700[/font][font=宋体],酪氨酸在在[/font][font=Calibri]275 nm[/font][font=宋体]处的摩尔吸光度是[/font][font=Calibri]1400[/font][font=宋体]。在[/font][font=Calibri]0.1N[/font][font=宋体]的[/font][font=Calibri]NaOH[/font][font=宋体]中,酪氨酸的[/font][font=Calibri]-OH[/font][font=宋体]基团充沛去质子化。这就使酪氨酸的吸收峰为[/font][font=Calibri]293[/font][font=宋体]纳米。在此条件下,它的摩尔吸光度增加到[/font][font=Calibri]2400[/font][font=宋体]。值得关注的是,假如肽的侧链之间有互相作用,紫外线吸收率能够不同。关于小的亲水性肽,这不是问题。在水溶液中,这些肽通常采用伸展构象,一切的侧链是完整暴露于溶剂中的。但关于长的疏水性多肽,这种假定是不完整正确的。有时可察看到低水平聚合和折叠。出于这个缘由,我们以为,酪氨酸在[/font][font=Calibri]0.1N NaOH[/font][font=宋体]中,在[/font][font=Calibri]293 nm[/font][font=宋体]处的吸光度是最好的,由于在此条件下,肽是完整变性的。它独一的缺陷是,用于浓度测定的样品不能被恢复。 [/font][/size][/font][font=宋体][size=10.5000pt][font=宋体]假如您的肽不含有色氨酸或酪氨酸,精确理解肽的浓度是至关重要的,独一合理的选择是氨基酸定量剖析。当然,这超出大多数实验室的日常操作。[/font] [/size][/font][font=宋体][size=10.5000pt][font=宋体]基于上面的讨论,为了多肽的浓度的准确测定,我们激烈倡议在你的多肽的[/font]N-[font=宋体]或[/font][font=Calibri]C-[/font][font=宋体]末端添加一个酪氨酸残基。[/font][/size][/font][font=宋体][size=10.5000pt][font=宋体]([/font]3[font=宋体])[/font][font=Calibri]N-[/font][font=宋体]末端乙酰化和的[/font][font=Calibri]C-[/font][font=宋体]末端酰胺化[/font][/size][/font][font=宋体][size=10.5000pt]人们经常以为用乙酰基和酰胺基分别阻断肽的两端能增加肽的稳定性,实践上这是不正确的。[/size][/font][font=宋体][size=10.5000pt][font=宋体]大多数合成肽的序列都来源于蛋白质片段。在一个蛋白质中,多肽序列的[/font]N[font=宋体]末端和[/font][font=Calibri]C[/font][font=宋体]末端构成肽键。这不同于合成肽含有不带电荷的两端。带电荷和不带电荷的多肽的物理化学性质是完整不同的,反过来这些性质又影响多肽的功用。经过乙酰基和酰胺基分别封锁[/font][font=Calibri]N[/font][font=宋体]端和[/font][font=Calibri]C[/font][font=宋体]端,这些问题能够被处理,并且能够使合成肽的两端更像肽键。由于这个缘由,我们用于抗体消费的多肽是末端封锁的,除非抗原位于蛋白的末端。由于同样的缘由,我们倡议顾客在停止其它功用性研讨时封锁合成肽的两端。没有理论根底支持有自在端的多肽是不稳定的。[/font][/size][/font][font=宋体][size=10.5000pt][font=宋体]([/font]4[font=宋体])多肽溶解度[/font][/size][/font][font=宋体][size=10.5000pt][font=宋体]当试图将多肽溶解在执行多肽生物功用的水溶液中时,溶解度成为关注的焦点。关于有机溶剂,溶解度基本就不是问题[/font]—简直一切的多肽都能溶解在有机溶剂中。但是这并没有多大的协助,由于大多数肽的研讨不能再有机溶剂中停止。[/size][/font][font=宋体][size=10.5000pt][font=宋体]肽的溶解度最终取决于它的序列。假如您的肽含有高比例的疏水残基,您就交好运了。不幸的是,大多数研讨人员不得不以他们现有的肽停止工作,除非他们想改动他们的研讨项目。在能够操作的条件,[/font]pH[font=宋体]值可能是最重要的。我们发现,在许多状况下,改动[/font][font=Calibri]1-3[/font][font=宋体]个[/font][font=Calibri]pH[/font][font=宋体]值单位能够使十分稳定的多肽完整溶解。过渡曲线通常是很峻峭的。在一个很窄的[/font][font=Calibri]pH[/font][font=宋体]范围内,溶液从混浊变得明澈。这可能是由于某些残基电离状态的改动,比方组氨酸。 [/font][/size][/font][font=宋体][size=10.5000pt][font=宋体]还有另一个缘由使[/font]pH[font=宋体]值调整变得重要。由于用于肽纯化的[/font][font=Calibri]HPLC[/font][font=宋体]溶剂含有[/font][font=Calibri]0.1%[/font][font=宋体]的不能经过冻干彻底除去的[/font][font=Calibri]TFA[/font][font=宋体],收到的多肽通常含有少量的[/font][font=Calibri]TFA[/font][font=宋体]。从而使得肽溶液比你预期的更具有酸性。[/font][/size][/font][font=宋体][size=10.5000pt][font=宋体]关于难以溶解的肽,你能够在有机溶剂中制备更高浓度的原液,例如[/font]DMS[font=宋体],并且在生物功用检测期间稀释肽。大多数的检测能包容[/font][font=Calibri]1-2%[/font][font=宋体]的[/font][font=Calibri]DSMO[/font][font=宋体],一些以至是[/font][font=Calibri]5%[/font][font=宋体]。但是这并不是总是起作用的。一些肽当从[/font][font=Calibri]DMSO[/font][font=宋体]中稀释时以至在更低浓度时汇集和沉淀。[/font][/size][/font][font=宋体][size=10.5000pt][font=宋体][img=,690,177]https://ng1.17img.cn/bbsfiles/images/2020/07/202007021619442576_4938_3531468_3.jpg!w690x177.jpg[/img][/font][/size][/font][font=宋体][size=10.5000pt][font=宋体]国肽生物主要提供:多肽合成、多肽定制、同位素标记肽、人工胰岛素、磷酸肽、生物素标记肽、荧光标记肽(Cy3、Cy5、Fitc、AMC等)、目录肽、偶联蛋白(KLH、BSA、OVA等)、美容肽、化妆品肽、多肽文库构建、抗体服务、糖肽、订书肽、药物肽、RGD环肽等。详情请咨询国肽生物[/font][/size][/font]
一个80L的容器,原开口状态,后向内打压氦气至0.6Mpa,请问原来空气占比多少,过程怎么算,谢谢!
有关多肽质子化离子的裂解机理与途径[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=138314]多肽的裂解[/url]
[align=center][font=DengXian]什么是质荷比[/font](m/z)[font=DengXian]?什么是基峰?什么是分子离子?什么是碎片离子?[/font][/align][font=DengXian]质荷比,是指带电离子的质量与所带电荷之比值,以[/font]m/z[font=DengXian]表示。[/font][font=DengXian]基峰[/font](Basepeak)[font=DengXian]:在质谱图中,指定质荷比范围内强度最大的离子峰叫作基峰。基峰的相对丰度为[/font]100[font=DengXian]%[/font][font=DengXian]分子离子[/font]: [font=DengXian]分子被电离后失去一个电子生成的离子[/font], [font=DengXian]它既是个正离子,也是一个游离基,其质荷比等于分子量。分子离子峰是除同位素峰外,质量数最大的质谱峰,位于质谱图的高质荷比端。分子离子质量对应于中性分子的质量,因此可用其确定相对分子质量。[/font][font=DengXian]碎片离子[/font]: [font=DengXian]分子离子经过一级或多级裂解所生成的产物离子。[/font]
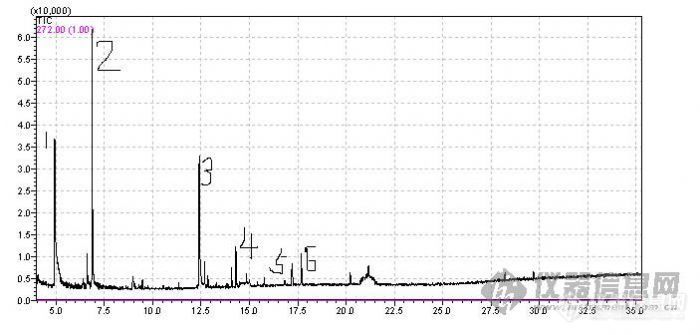
请教大家一个问题,做GCMS时,能不能知道所有单位质荷比的响应值是多少,简单的解释为:样品检测后,TIC上每个色谱峰对应的质谱图有多个质荷比不同的峰(包括基峰、分子离子峰、碎片离子峰、同位素峰等),能不能将TIC上所有色谱峰中相同质荷比的峰(包括基峰、分子离子峰、碎片离子峰、同位素峰等)的响应值加起来,即,一张TIC上所有色谱峰所对应的相同质荷比的峰(包括基峰、分子离子峰、碎片离子峰、同位素峰等)的响应值加起来成一个数据表。谢谢![img]http://ng1.17img.cn/bbsfiles/images/2009/08/200908251035_167514_1615816_3.jpg[/img]例如这个图上的1号峰对应的质谱图上有质荷比100、98、81、72、66、43;2号峰对应的质谱图上有质荷比112、102、98、72、66、43;3号峰对应的质谱图上有质荷比140、112、100、81、72、66、43;等等。能不能将1、2、3及其他号峰质荷比为43的响应值加起来,质荷比为66的响应值加起来,质荷比为72的响应值加起来,等等。我用的是岛津2010,不知道可不可以?谢谢!
采购光谱主机与辅助设备的价格比多少较为合理?
请问大家有没有做过卡比多巴中肼的含量检测呢,一般需要用什么条件才能检出?求指教!

[align=center][b][img=,600,336]https://ng1.17img.cn/bbsfiles/images/2019/09/201909121439522763_1873_932_3.jpg!w690x387.jpg[/img][/b][/align][b]质量研究与质量标准质量研究[/b]🔥 原料药的质量研究合成多肽原料药的质量研究除参考一般化学药物的研究思路进行常规项目的研究外,还应根据合成多肽的结构特征、制备工艺特点和生物学特点等进行针对性的研究,研究项目一般包括:外观性状、理化常数、鉴别、氨基酸组成分析、水分、反离子含量、纯度、有机溶剂和反应试剂残留量、生物学安全性检查、含量和/或活性效价测定等。检测方法研究和验证的基本思路和要求与已颁布的相关技术指导原则相一致。对于合成多肽药物,除常规项目外,理化常数一般需要关注其比旋度、等电点(pI)、溶解性(主要为水和缓冲液中)等。一般而言,多肽药物的常规检查项目与其它化学药物相同。此外,与多肽药物的结构及合成特点相关的一些检查项目,例如氨基酸组成分析、反离子(例如三氟醋酸或醋酸根)含量、反应试剂残留量(例如从树脂上裂解多肽使用了氢氟酸,需要检查氟化物残留量)等,则需要在原料药质量研究中予以重视。相关肽检查(或称有关物质检查)是反映多肽化学纯度的重要指标之一,根据多肽的理化性质、分子大小,可选择合适的色谱、电泳等方法进行。短肽可参考一般化学药品有关物质检查的研究思路选用适宜的方法;长肽的有关物质检查方法除常见的RP-HPLC外,还可考虑使用高效离子交换色谱(HPIEC)、毛细管电泳技术等,非解离条件下的高效分子排阻色谱(HPSEC)、聚丙烯酰胺凝胶电泳(PAGE)以及激光散射粒度测定等技术可用于聚合体/低聚体的检查。有关物质检查的方法学验证应能证明所采用的方法可以有效分离目标多肽与工艺杂质(例如缺失肽等)、降解产物(例如二硫键交换或氧化产物等)、聚合物等。一般应考察两种以上不同原理的方法,高效液相色谱法至少应包括一种梯度洗脱方法,并采用多肽粗品和强制降解试验等对方法的专属性等进行考察、对比,此外还应注意研究多波长检测的结果并选择合适的检测波长等。合成多肽因结构特征不同于通常的小分子化学药品,纯度检查有时难以从根本上有效控制产品安全性,需要进行必要的生物学安全性检查(如过敏试验、降压物质、升压物质、异常毒性等)以全面控制产品质量、保证安全性。此外,根据产品具体情况,对于长肽,有时尚需进行免疫原性或抗原活性等生物特性的研究。含量测定是评价多肽质量的重要指标之一,理化方法测定其含量时称为“含量测定”,生物学方法或酶化学方法测定其效价时称为“效价测定”。对于短肽,理化方法测得的含量可以反映其有效程度时,首选简单、通用的含量测定方法;对于具有一定空间结构才能发挥其活性的多肽,需进行生物学方法或酶化学方法测定药物活性(效价)的研究,包括含量与活性的关系、相应的方法学验证等。🔥 制剂的质量研究合成多肽制剂的质量研究基本思路和要求可参照《化学药物质量标准建立的规范化过程技术指导原则》、《化学药物制剂研究基本技术指导原则》等相关内容,根据合成多肽的具体特点,在原料药质量研究的基础上,结合剂型特点、处方工艺以及临床使用特点,重点研究所用辅料和制剂工艺对产品质量的影响、制剂辅料和制剂产生的降解产物对检测方法的影响以及与剂型相关的质量要素。研究项目一般亦应包括性状、鉴别、检查(安全性、均一性、纯度要求与有效性指标等)、含量或效价测定等几个方面。[b]质量标准[/b]合成多肽药物质量标准的制订原则、要求与《化学药物质量标准建立的规范化过程技术指导原则》是一致的。即,在系统的质量控制研究基础上,充分考虑药品安全、有效、质量可控的要求,以及生产、流通和使用等环节的影响,确定能够揭示、控制药物内在品质的检测项目、分析方法和限度要求,如原料药质量标准应包括氨基酸组成、等电点、中长肽的肽图等。合理可行的质量标准应能有效控制产品质量以保证临床用药的安全性和有效性,并有效地控制药品批间质量的一致性。相关质控项目的限度确定也应参考相关的指导原则,例如对于有关物质检查限度的确定可以参考《化学药物杂质研究的技术指导原则》、仿制品种同时还可参考《化学药品仿制研究技术指导原则》等的原则性要求,并结合产品本身的特性及临床使用情况,视具体情况而定。随着药物研发进程的深入,研究数据积累的不断丰富、方法学研究的完善和药物研究技术的不断发展,质量标准在不同研究阶段需要不断修订和完善。[b]稳定性研究[/b]合成多肽药物稳定性研究的基本原则应遵循《化学药物稳定性研究技术指导原则》的一般性要求。与一般化学药物相比,多肽药物的稳定性较差。引起多肽药物不稳定的原因主要有水解、氧化、外消旋化、二硫键的断裂及重排、β消除、凝聚、沉淀、吸附等。当多肽处于溶液中或高湿下保存时,其降解或聚合的速度会比干燥条件下大为增加。因此,稳定性研究应根据多肽药物稳定性的特点合理选择试验条件、考察项目。加速试验和长期留样试验的试验条件应依据药物对温度、湿度和光照等条件的敏感程度的考察(影响因素试验)基础上选择;考察项目除常规项目(例如原料药的比旋度、有关物质和含量等)外,根据具体情况,可能还需要考察其生物活性的变化。与其他化学药物不同,多肽药物可能具有一定程度的表面活性,有与直接接触药品的包装材料和容器发生吸附等相互作用的可能,从而引起制剂效价、生物活性下降。例如有些多肽分子能够与玻璃表面的硅醇基发生相互作用。因此,在包装材料的选择方面需注意其与多肽药物相互作用的研究,有些情况下可选择特殊处理后的包装容器,如表面经硅烷化处理的容器等。[b]名词解释非天然氨基酸:[/b][color=#717070]除自然界生物体中存在的氨基酸外,其它由人工合成制备的氨基酸。[/color][b]反离子:[/b][color=#717070]和多肽形成离子对的带有相反电荷的离子。[/color][b][b][/b][/b]参考文献1.Guidance for Industry for the Submission ofChemistry,Manufacturing,and Controls Information for Synthetic Peptide Substances,FDA,1994。2.合成多肽专题研讨会会议纪要,药品审评中心,2001。3.多肽药物分析方法研究进展,叶晓霞,俞雄,中国医药工业杂志,2003,34(7)。[b]著 者《合成多肽药物药学研究技术指导原则》课题研究组。[/b]
小弟最近做血浆中左旋多巴和卡比多巴的定量,样品预处理时参考文献有用高氯酸沉淀蛋白的,有用高浓度甲酸乙腈沉淀的,我都试了试,但检测不到,感觉是没有沉淀出来,请问大家有没有做过的,有什么建议和窍门吗?
随着制药企业对生物治疗药物的日益重视,在药物研究中使用LCMS定量分析蛋白和多肽药物已经引起越来越多研究者的兴趣。艾塞那肽是一种治疗性多肽,目前已被批准用于治疗I型和II型糖尿病。艾塞那肽可增强胰腺β细胞分泌葡萄糖依赖性胰岛素,以调节糖代谢和胰岛素分泌。近年来,血浆中艾塞那肽的浓度测定主要通过配体实验来完成,例如利用酶标免疫测定法进行艾塞那肽的 药代动力学研究。但是,由于某些具有相似理化性质的化合物的存在,致使酶标免疫测定法缺乏足够的特异 性和选择性,导致采用该方法分析将面临一定的风险。基于以上原因,采用AB SCIEX QTRAP® 5500系统的 MRM3模式确保分析血浆中多肽药物时能够达到更高的选择性。实验方法样品制备:提取人血浆中的艾塞那肽,用氮气吹干,复溶。在所有的操作步骤中,pH值及有机相都要严格控制。串联质谱技术在药物高通量筛选和生物分析中的应用液相色谱条件:UHPLC采用ShimadzuUFLC LC-20ACXR;反相色谱柱为C-18 2.0 x30mm,5μ;流速为 0.6mL/min;进样体积为5 μL;流动相A为含0.1%甲酸的水溶液,流动相B为含0.1%甲酸的甲醇溶液;梯度5分钟,流动相B浓度从2%升至95%。质谱条件:使用AB SCIEXQTRAP® 5500系统中的MRM3扫描模式进行LC/MS分析。开启离子阱的动态填充时间(DFT)功能,在10,000Da/s的扫描速度下进行MS3扫描。总周期时间为0.17s。采用质荷比 838→396→202进行MRM3分析。QTRAP® 5500系统进行MRM3分析原理展示在图2中。图1. 艾塞那肽结构。艾塞那肽是由39个氨基酸组成的多肽(MW =4186.6 Da),是糖代谢和胰岛素分泌的调节剂。图2. MRM3定量分析工作原理。首先在Q1四极杆中选择母离子,然后在Q2碰撞池中碎裂,其子离子在线性离子阱中富集并分离,接着通过激发产生第二级碎片,然后将第二级产物离子扫描至检测器。实验结果在增强全扫描模式(EMS)下,选择多电荷母离子5+838.3作为前体离子(母离子,图3,上左图)。当前体离子碎裂后,选择m/z 396.
[b][font=宋体]问题描述:液相色谱分析多肽药物时,采用什么溶剂作为流动相?如何确定检测波长?[/font][font=宋体]解答:[/font][/b][font=宋体]([/font]1[font=宋体])液相色谱法分析化学合成的,结构相似的小分子多肽可采用乙腈和水作为流动相,采用三氟乙酸调节流动相[/font]pH[font=宋体]值;[/font][font=宋体]([/font]2[font=宋体])三氟乙酸是作为离子对试剂存在的,常用于乙腈流动相中(反相色谱),目的是增加色谱峰的对称性。其作用原理为:乙腈中的三氟乙酸通过与疏水键合相及残留的极性表面以多种模式相互作用,从而改善峰形、克服峰的展宽以及拖尾的问题,同时三氟乙酸与蛋白质及多肽表面上的正电荷以及极性基团相结合以减少极性保留,把蛋白质或多肽带回到疏水的反相表面,另外三氟乙酸又以同样的方式,屏蔽了固定相上残留的极性表面。[/font][font=宋体]([/font]3[font=宋体])除了一些特殊蛋白质或多肽,如含铜离子、铁离子等,一般用波长[/font]280nm[font=宋体]或者[/font]210~220nm[font=宋体]检测;前者是蛋白质中特定氨基酸的检测波长,后者是多肽或蛋白质中特有的肽键的主吸收峰波长。[/font][font=宋体]([/font]4[font=宋体])作为药物分析,包括药物的含量分析、活性分析、以及杂质分析等。如果用液相分析多肽药物的杂质时,用正相色谱比其他色谱更方便、更有效、更准确,可优先选用正相色谱。[/font][font='微软雅黑','sans-serif'][color=black][back=white]领取更多《实战宝典》请进:[url]http://instrument-vip.mikecrm.com/2bbmrpI[/url][/back][/color][/font][font='微软雅黑','sans-serif'][color=black][back=white] [/back][/color][/font]

[font=宋体][size=10.5000pt][font=宋体]多肽固相合成法是多肽合成化学的一个重大的突破。它的最大特点是不必纯化中间产物,合成过程可以连续进行,进而为多肽合成的自动化奠定了基础。目前全自动多肽的合成,基本都是固相合成。其基本过程如下:[/font] [/size][/font][font=宋体][size=10.5000pt][font=宋体]基于[/font]Fmoc[font=宋体]化学合成,先将所要合成的目标多肽的[/font][font=Calibri]C-[/font][font=宋体]端氨基酸的羧基以共价键形式与一个不溶性的高分子树脂相连,然后以这一氨基酸的氨基作为多肽合成的起点,同其它的氨基酸已经活化的羧基作用形成肽键,不断重复这一过程,即可得到多肽。【详情请咨询国肽生物】根据多肽的氨基酸组成不同,多肽后处理方式不同,纯化方式也有差异。 [/font][/size][/font][font=宋体][size=10.5000pt]1.[font=宋体]做免疫用的多肽多长为合适[/font][font=Calibri]? [/font][/size][/font][font=宋体][size=10.5000pt][font=宋体]一般约[/font]10-15[font=宋体]个氨基酸,当然长一些免疫效果好一些,不过合成费用也会增加。[/font][font=Calibri]MAP[/font][font=宋体]多肽则希望长度在[/font][font=Calibri]15aa[/font][font=宋体]以上,效果较好。另外,[/font][font=Calibri]10aa[/font][font=宋体]以下的多肽免疫效果比较差。 [/font][/size][/font][font=宋体][size=10.5000pt]2.[font=宋体]免疫用多肽的纯度需要很高吗[/font][font=Calibri]? [/font][/size][/font][font=宋体][size=10.5000pt][font=宋体]一般而言,免疫用[/font]Peptide[font=宋体],[/font][font=Calibri]70-85%[/font][font=宋体]即可。 [/font][/size][/font][font=宋体][size=10.5000pt]3.[font=宋体]我们合成的多肽溶解性不好,多肽就有问题对吗[/font][font=Calibri]? [/font][/size][/font][font=宋体][size=10.5000pt][font=宋体]很难准确预测一个多肽的溶解性及合适的溶剂是什么。如果多肽难以溶解就认为多肽合成有问题这个观念并不正确。[/font] [/size][/font][font=宋体][size=10.5000pt]4.[font=宋体]多肽状态是如何[/font][font=Calibri]?[/font][font=宋体]如何保存储存[/font][font=Calibri]? [/font][/size][/font][font=宋体][size=10.5000pt][font=宋体]我们提供的多肽是粉末状,一般为灰白色,组成不同,多肽粉末的颜色有差异,多肽一般长期保存需要避光保存,并应保存在[/font]-20[font=宋体]度,短期可以保存在[/font][font=Calibri]4[/font][font=宋体]度。可以短时间的话是以室温运输。 [/font][/size][/font][font=宋体][size=10.5000pt]5.[font=宋体]如何溶解多肽[/font][/size][/font][font=宋体][size=10.5000pt][font=宋体]溶解多肽是非常复杂的事情,一般很难一下子确定合适的溶剂。通常是先取一点试验,在没有确定合适的溶剂前千万不要合部溶解。[/font] [font=宋体]下列方法有助于您选择合适的溶剂:[/font] [/size][/font][font=宋体][size=10.5000pt](1)[font=宋体]判定多肽的电荷特定,设定酸性氨基酸[/font][font=Calibri]Asp(D),Glu(E)[/font][font=宋体]和[/font][font=Calibri]C[/font][font=宋体]端[/font][font=Calibri]COOH[/font][font=宋体]为[/font][font=Calibri]-1[/font][font=宋体];碱性氨基酸[/font][font=Calibri]Lys(K),Arg(R),His(H)[/font][font=宋体]及[/font][font=Calibri]N[/font][font=宋体]端[/font][font=Calibri]NH2[/font][font=宋体]为[/font][font=Calibri]+1,[/font][font=宋体]其它氨基酸的电荷为[/font][font=Calibri]0[/font][font=宋体]。计算出将电荷数。 [/font][/size][/font][font=宋体][size=10.5000pt](2)[font=宋体]如果净电荷数[/font][font=Calibri]0[/font][font=宋体],多肽为碱性,用水溶解:如果不溶解或溶解性不大,加入醋酸[/font][font=Calibri](10%[/font][font=宋体]以上[/font][font=Calibri])[/font][font=宋体];如果多肽还不能溶解,加入少量[/font][font=Calibri]TFA(25ul)[/font][font=宋体]溶解,然后加入[/font][font=Calibri]500ul[/font][font=宋体]水稀释。 [/font][/size][/font][font=宋体][size=10.5000pt](3)[font=宋体]如果净电荷数[/font][font=Calibri]0[/font][font=宋体],多肽为酸性,用水溶解;如果不溶解或溶解性不大,加入氨水[/font][font=Calibri](25ul)[/font][font=宋体]溶解,然后加入[/font][font=Calibri]500ul[/font][font=宋体]水稀释。 [/font][/size][/font][font=宋体][size=10.5000pt](4)[font=宋体]如果净电荷数[/font][font=Calibri]=0[/font][font=宋体],多肽为中性,一般需要用有机溶剂如乙腈,甲醇或异丙醇,[/font][font=Calibri]DMSO[/font][font=宋体]等溶解。还有人建议需要尿素来溶解疏水性很大的多肽。[/font][/size][/font][font=宋体][size=10.5000pt]6.[font=宋体]非[/font][font=Calibri]HPLC[/font][font=宋体]纯化的多肽中有哪些杂质[/font][font=Calibri]? [/font][/size][/font][font=宋体][size=10.5000pt][font=宋体]粗品和脱盐级别的多肽中多肽和非多肽类杂质:如非全长多肽和多肽后处理的一些原料如[/font]DTT[font=宋体]、[/font][font=Calibri]TFA[/font][font=宋体]等。 [/font][/size][/font][font=宋体][size=10.5000pt]7.HPLC[font=宋体]纯化的多肽有哪些杂质[/font][font=Calibri]? [/font][/size][/font][font=宋体][size=10.5000pt][font=宋体]经过[/font]HPLC[font=宋体]纯化的多肽,仍会有一些一些杂质存在,其中的杂质主要是短肽和微量[/font][font=Calibri]TFA[/font][font=宋体]。 [/font][/size][/font][font=宋体][size=10.5000pt]8.[font=宋体]多长的多肽为合适[/font][font=Calibri]? [/font][/size][/font][font=宋体][size=10.5000pt][font=宋体]多肽合成需要考虑多肽的长度,电荷,亲疏水性等因素。长度越长,合成粗品的纯度和产率都随着降低,纯化的难度和无法合成的几率就会大些。当然多肽功能区的序列是无法改变的,但是为了多肽的顺利合成,有时不得不在功能取的上下游增加一些辅助氨基酸,以改善多肽的溶解性和亲疏水性。如果多肽太短,合成也可能有问题,主要问题是合成的多肽在后处理过程中有一定的难度,[/font]5[font=宋体]肽以下的多肽,一般要有疏水的氨基酸,否则后处理难度加大。[/font][font=Calibri]15[/font][font=宋体]个氨基酸残基以下的多肽一般都可以得到满意的产率和得率。 [/font][/size][/font][font=宋体][size=10.5000pt]9.[font=宋体]如何从多肽序列中判定多肽的溶解性[/font][font=Calibri]? [/font][/size][/font][font=宋体][size=10.5000pt](1)[font=宋体]多肽中如果含有高比例的疏水性很强的氨基酸如和[/font][font=Calibri]Leu,Val,IIe,Met,Phe[/font][font=宋体]和[/font][font=Calibri]Trp[/font][font=宋体],多肽很难溶解与水性溶液中或根本不可能溶解。这些氨基酸无论是纯化或合成,都有可能有问题。 [/font][/size][/font][font=宋体][size=10.5000pt](2)[font=宋体]一般情况下疏水性氨基酸的比例[/font][font=Calibri]50%[/font][font=宋体],不能连续[/font][font=Calibri]5[/font][font=宋体]个连续[/font][font=Calibri]aa[/font][font=宋体]为疏水性,带电荷的氨基酸的[/font][font=Calibri]([/font][font=宋体]正电荷[/font][font=Calibri]K,R,H,N-terminus,[/font][font=宋体]负电荷[/font][font=Calibri]D,E,C- terminus)[/font][font=宋体]的比例达到[/font][font=Calibri]20%[/font][font=宋体],在多肽的[/font][font=Calibri]N[/font][font=宋体]或[/font][font=Calibri]C[/font][font=宋体]短如果能增加极性氨基酸,也可以改善溶解性。 [/font][font=Calibri]11.[/font][font=宋体]为什么含有[/font][font=Calibri]Cys,Met,[/font][font=宋体]或[/font][font=Calibri]Trp[/font][font=宋体]的多肽难合成[/font][font=Calibri]? [/font][/size][/font][font=宋体][size=10.5000pt][font=宋体]含有[/font]Cys,Met[font=宋体],或[/font][font=Calibri]Trp[/font][font=宋体]的多肽难以合成,同时难以获得高纯度的产品。主要因为这些基团不稳定,易氧化。这些多肽的使用和储存都需要特别注意,避免反复开启盖子。 [/font][/size][/font][font=宋体][size=10.5000pt]10.[font=宋体]为什么有些多肽的合成产率或纯度会比较低[/font][font=Calibri]? [/font][/size][/font][font=宋体][size=10.5000pt][font=宋体]多肽合成与引子合成有比较大的区别,不能合成的引子很少,但是不能合成的多肽经常有。如[/font]Val,Ile,Tyr,Phe,Trp,Leu,Gln,[font=宋体]和[/font][font=Calibri]Thr[/font][font=宋体]这些氨基酸比邻或重复时,多肽链在合成过程中不能完全舒展溶解,合成效率下降。以下几种情形,合成效率和产物的纯度都比较低,如:重复[/font][font=Calibri]Pro,Ser-Ser[/font][font=宋体],重复[/font][font=Calibri]Asp[/font][font=宋体],[/font][font=Calibri]4[/font][font=宋体]个连续[/font][font=Calibri]Gly[/font][font=宋体]等。 [/font][/size][/font][font=宋体][size=10.5000pt]11.[font=宋体]多肽是如何纯化的[/font][font=Calibri]? [/font][/size][/font][font=宋体][size=10.5000pt][font=宋体]多肽纯化一般使用反相柱[/font]([font=宋体]如[/font][font=Calibri]C8[/font][font=宋体],[/font][font=Calibri]C18[/font][font=宋体]等[/font][font=Calibri])[/font][font=宋体],[/font][font=Calibri]214nm[/font][font=宋体]。缓冲体系通常为含[/font][font=Calibri]TFA[/font][font=宋体]的溶剂,[/font][font=Calibri]pH2.0[/font][font=宋体]。[/font][font=Calibri]Buffer A[/font][font=宋体]为含[/font][font=Calibri]0.1%TFA in ddH2O[/font][font=宋体],[/font][font=Calibri]Buffer B[/font][font=宋体]为[/font][font=Calibri]1%TFA/ACN/pH2.0[/font][font=宋体]。纯化前用[/font][font=Calibri]Buffer A[/font][font=宋体]溶解;如果溶解不好,用[/font][font=Calibri]Buffer B[/font][font=宋体]溶解后,然后用[/font][font=Calibri]Buffer A[/font][font=宋体]稀释;对疏水性强的多肽,有时还需要加入少量的[/font][font=Calibri]Formic Acid[/font][font=宋体]或醋酸。[/font][font=Calibri]HPLC[/font][font=宋体]分析多肽粗产物,如果多肽不长[/font][font=Calibri](15aa[/font][font=宋体]以下[/font][font=Calibri])[/font][font=宋体],一般会有主峰,主峰通常为全长产物;对于[/font][font=Calibri]20aa[/font][font=宋体]以上的长肽,如果没有主峰,[/font][font=Calibri]HPLC[/font][font=宋体]需搭配[/font][font=Calibri]Mass[/font][font=宋体]来判定分子量,进而确定哪个峰是所要合成的多肽。[/font][/size][/font][font=宋体][size=10.5000pt][font=宋体][img=,690,143]https://ng1.17img.cn/bbsfiles/images/2020/07/202007091611507608_3379_3531468_3.jpg!w690x143.jpg[/img][/font][/size][/font][font=宋体][size=10.5000pt][font=宋体]国肽生物主要提供:多肽合成、多肽定制、同位素标记肽、人工胰岛素、磷酸肽、生物素标记肽、荧光标记肽(Cy3、Cy5、Fitc、AMC等)、目录肽、偶联蛋白(KLH、BSA、OVA等)、美容肽、化妆品肽、多肽文库构建、抗体服务、糖肽、订书肽、药物肽、RGD环肽等。详情请咨询国肽生物[/font][/size][/font]

合成多肽是α-氨基酸以肽链连接在一起而形成的化合物,它也是蛋白质水解的中间产物。 由两个氨基酸分子脱水缩合而成的化合物叫做二肽,同理类推还有三肽、四肽、五肽等。合成多肽方法分类 多肽的合成主要分为两条途径:化学合成多肽和生物合成多肽。 化学合成主要是以氨基酸与氨基酸之间缩合的形式来进行。在合成含有特定顺序的多肽时,由于多肽合成原料中含有官能度大于2的氨基酸单体,多肽合成时应将不需要反应的基团暂时保护起来,方可进行成肽反应,这样保证了多肽合成目标产物的定向性。多肽的化学合成又分为液相合成和固相合成。 多肽液相合成主要分为逐步合成和片段组合两种策略。逐步合成简洁迅速,可用于各种生物活性多肽片段的合成。片段组合法主要包括天然化学连接和施陶丁格连接。近年,多肽液相片段合成法发展迅速,在多肽和蛋白质合成领域已取得了重大突破。在多肽片段合成法中,根据多肽片段的化学特定性或化学选择性,多肽片段能够自发进行连接,得到目标多肽。因为多肽片段含有的氨基酸残基相对较少,所以纯度较高,且易于纯化。 多肽的生物合成方法主要包括发酵法、酶解法,随着生物工程技术的发展,以DNA重组技术为主导的基因工程法也被应用于多肽的合成。合成多肽的原理 多肽合成就是如何把各种氨基酸单位按照天然物的氨基酸排列顺序和连接方式连接起来。由于氨基酸在中性条件下是以分子内的两性离子形式(H3+NCH(R)COO-)存在,因此,氨基酸之间直接缩合形成酰胺键的反应在一般条件下是难于进行的。氨基酸酯的反应活性较高。在100℃下加热或者室温下长时间放置都能聚合生成肽酯,但反应并没有定向性,两种氨基酸a1和a2的酯在聚合时将生成a1a2…、a1a1…、a2a1…等各种任意顺序的混合物。 为了得到具有特定顺序的合成多肽,采用任意聚合的方法是行不通的,而只能采用逐步缩合的定向多肽合成方法。一般是如下式所示,即先将不需要反应的氨基或羧基用适当的基团暂时保护起来,然后再进行连接反应,以保证多肽合成的定向进行。 式中的X和Q分别为氨基和羧基的保护基,它不仅可以防止乱接副反应的发生,还具有能消除氨基酸的两性离子形式,并使之易溶于有机溶剂的作用。 Q在有的情况下也可以不是共价连接的基团,而是由有机强碱(如三乙胺)同氨基酸的羧基氢离子组成的有机阳离子。Y为一强的吸电子基团,它能使羧基活化,而有利于另一氨基酸的自由氨基,对其活化羧基的羧基碳原子进行亲核进攻生成酰胺键。 由此所得的连接产物是N端和C端都带有保护基的保护肽,要脱去保护基后才能得到自由的肽。如果肽链不是到此为止,而是还需要从N端或C端延长肽链的话,则可以先选择性地脱去X或Q,然后再同新的N保护氨基酸(或肽)或C保护的氨基酸(或肽)进行第二次连接,并依次不断重复下去,直到所需要的肽链长度为止。 对于长肽的多肽合成来说,一般有逐步增长和片段缩合两种伸长肽链的方式,前者是由起始的氨基酸(或肽)开始。每连接一次,接长一个氨基酸,后者则是用N保护肽同C保护肽缩合来得到两者长度相加的新的长肽链。 对于多肽合成中含有谷氨酸、天冬氨酸、赖氨酸、精氨酸、组氨酸、半胱氨酸等等带侧链功能团的氨基酸的肽来说,为了避免由于侧链功能团所带来的副反应,一般也需要用适当的保护基将侧链基团暂时保护起来。[img=,690,163]https://ng1.17img.cn/bbsfiles/images/2019/02/201902191018209926_3198_3531468_3.jpg!w690x163.jpg[/img]我们主要提供:多肽合成、定制多肽、同位素标记肽、人工胰岛素、磷酸肽、生物素标记肽、荧光标记肽(Cy3、Cy5、Fitc、AMC等)、目录肽、偶联蛋白(KLH、BSA、OVA等)、化妆品肽、多肽文库构建、抗体服务、糖肽、订书肽、药物肽、RGD环肽等。请移步百度搜“合肥国肽生物”即可
在正常基线条件下,[url=https://insevent.instrument.com.cn/t/Mp]气相色谱[/url]信噪比多少是合理的?
与商家谈判往往“裸机”价格很吸引人,但是一旦加上必要的选购件,价格一下飙升不少,甚至高达1:1,让人有上当和愤怒的感觉,把仪器拆零卖是一些商家惯例,可以“裸机”价格与配件(必要的选购件)价格比多少算合理呢?