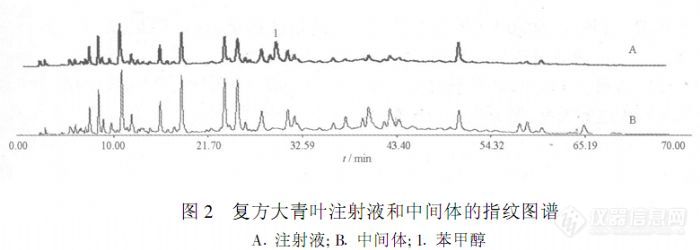
【作者中文名】刘瑞; 刘志刚; 李磊; 任冲; 袁波; 李发美;【作者英文名】LIU Rui; LIU Zhi-gang; LI Lei; REN Chong; YUAN Bo; LI Fa-mei(School of Pharmacy; Shenyang Pharmaceutical University; Shenyang 110016; China);【作者单位】沈阳药科大学药学院; 沈阳药科大学药学院 辽宁沈阳; 辽宁沈阳;【摘要】目的:采用HPLC建立复方大青叶注射液的指纹图谱测定方法。方法:采用Diamonsil C18色谱柱,甲醇-水-磷酸为流动相进行梯度洗脱,流速1.0 mL.min-1,检测波长254 nm。结果:建立了复方大青叶注射液的HPLC对照指纹图谱,标示了注射液中的20个共有峰,并初步确定注射液的相似度阈值为0.85。结论:该方法准确、重复性好,为复方大青叶注射液的质量控制提供了依据。http://ng1.17img.cn/bbsfiles/images/2012/08/201208131758_383604_2379123_3.jpg
复方氨基比林注射液说明书(兽用)【兽药名称】通用名:复方氨基比林注射液 英文名:Compound Aminophenzone Injection 汉语拼音:Fufang Anjibilin Zhusheye【主要成分】为氨基比林与巴比妥混合制成的灭菌水溶液。含氨基比林7.15%和巴比妥2.85%。【性 状】本品为无色或淡黄色的澄明液体。【药理作用】本品给药后即时产生镇痛作用,其解热镇痛作用强而持久,氨基比林与巴比妥合用能增强其镇痛作用,有利于缓解疼痛症状。本品还有抗风湿和消炎作用。半衰期为1~4小时。【适 应 症】用于发热性疾患、关节炎、肌肉痛和风湿症等。【用法用量】 肌内、皮下注射:一次量,马、牛20~50mg;羊、猪5~10mg。【注意事项】连续长期应用可引起粒性白细胞减少症,应定期检查血象。【停 药 期】28日,弃奶期7日。【有 效 期】二年【规 格】10ml【包 装】10ml /支×5支/盒【贮 藏】遮光、密闭保存。
复方氨基酸注射液采用丁基胶塞密封,胶塞中的硫磺可能会浸出到注射液中,需要对药液中的硫磺含量进行测定。但是,方法学建立过程中,进行药液的加标回收率测定,发现其不合格,并且随氨基酸浓度升高,硫磺回收率降低。求助可能的原因,有哪位大神做过相关的实验吗?请不吝赐教,大谢
利用[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]法建立复方苦参注射液中7个成分(甲基氧化偶氮甲醇樱草糖苷、苦参碱、槐果碱、槐定碱、氧化槐果碱、氧化苦参碱、番石榴酸)的含量测定方法。采用Waters Xselect CSHTM C18色谱柱(250 mm×4.6 mm, 5μm),以甲醇-0.2%磷酸二氢钾为流动相,梯度洗脱,流速0.6 mLmin-1,柱温30℃,检测波长211 nm。测定的甲基氧化偶氮甲醇樱草糖苷、苦参碱、槐果碱、槐定碱、氧化槐果碱、氧化苦参碱、番石榴酸7个成分的平均加样回收率分别为95.7%、101.3%、100.8%、101.7%、102.6%、102.5%、99.5%,RSD分别为2.0%、0.72%、0.90%、0.74%、1.4%、0.96%、1.8% 10批次样品中7个成分的含量分别为0.53~0.73、2.66~4.22、0.75~1.11、0.70~0.89、2.20~2.84、7.62~9.95、1.63~2.20 mgmL-1。该方法稳定可靠,可为复方苦参注射液的质量控制与评价提供参考。详见王鹏飞等,药物分析杂志. 2022,42(07)
复方氨基酸注射液 含量测定 是用液相色谱吗?哪位大侠知道怎么弄的,指导我呀。谢啦! 我13914681818 wcj.yc@163.com
求助文献:复方乳酸钠葡萄糖注射液中12个元素杂质的质量研究作者:李正艳、周芸芸

维权声明:本文为03yx2原创作品,本作者与仪器信息网是该作品合法使用者,该作品暂不对外授权转载。其他任何网站、组织、单位或个人等将该作品在本站以外的任何媒体任何形式出现的,均属侵权违法行为,我们将追究法律责任。 【第三届原创参赛】复方注射液标准图谱的建立与中间体相关性研究仅贴首页,其内容详见附件!http://ng1.17img.cn/bbsfiles/images/2010/10/201010061629_249426_1600062_3.jpg
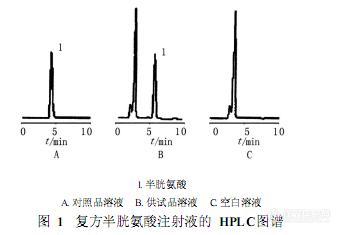
作者:靳文仙1,阎 卉2,刘 衡2,王春龙1, 2,赵广荣1(1 .天津大学化工学院 ,天津 300072; 2 .天津药物研究院 ,天津 300193)摘 要: 目的:建立以高效液相色谱法测定复方半胱氨酸注射液中半胱氨酸含量的方法。方法:采用迪马公司 C18钻石色谱柱 (250 mm × 4. 6 mm, 5μm) ,以磷酸二氢铵溶液 -甲醇 (95∶5, pH 5 . 0)为流动相 ,流速为 1 . 0 ml /min,进样量为 20μl,检测波长为 220 nm。结果:半胱氨酸在 240~560μg/ml ( r = 0 . 999 6)范围内线性关系良好 ,平均回收率为 99 . 32%(RS D = 1 . 06% , n = 9)结论:该方法操作简便快速 ,结果准确 ,可用于复方半胱氨酸注射液中半胱氨酸的含量测定。谱图:http://ng1.17img.cn/bbsfiles/images/2012/07/201207161420_377867_1606903_3.jpg
跪求! 复方氨基酸注射液(9AA)中的L-半胱氨酸盐酸盐的含量测定方法! 请高手赐教! 我用过了ACCQ-TAG法测了不行,有没有好点的方法
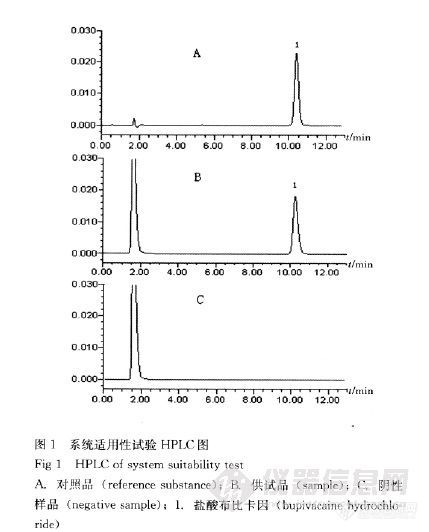
作者:兰文; 杨汉初; 黄莉;(湖南省药品检验所;)摘要:目的建立反相高效液相色谱法测定复方明矾布比卡因注射液的有关物质及盐酸布比卡因的含量。方法采用Diamonsil C18柱,以乙腈-磷酸盐缓冲液(取磷酸二氢钾1.94g,磷酸氢二钾2.48g,加水溶解并稀释至1 000mL,调节pH 6.8)(65∶35)为流动相;流速为1.0mL.min-1;有关物质检测波长为215nm,含量测定检测波长为263nm;柱温:30℃。结果在该色谱条件下,杂质峰与主峰均能有效分离,盐酸布比卡因在44.31~177.26μg.mL-1与峰面积线性关系良好(r2=0.999 7);平均回收率为99.7%(n=9),RSD=0.4%。结论本法简便、快速、准确,专属性好,可用于复方明矾布比卡因注射液的质量控制。谱图:http://ng1.17img.cn/bbsfiles/images/2012/08/201208061043_381724_1606903_3.jpg
我要做一个中药复方注射液的指纹图谱,各位大侠如果有什么资料和个人经验能不能分享一下?也是对我最大的帮助!谢谢了!
[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=102822]高效液相色谱法测定复方半胱氨酸注射液中半胱氨酸的含量[/url]
[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=102823]高效液相色谱法测定复方半胱氨酸注射液中半胱氨酸的含量[/url]
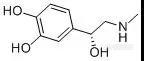
复方盐酸阿替卡因注射液为复方制剂,是盐酸阿替卡因与肾上腺素的灭菌水溶液,作为口腔用局部麻醉剂,适用于涉及切骨术及粘膜切开的外科手术过程。[img=,144,61]https://ng1.17img.cn/bbsfiles/images/2019/03/201903191545418661_4518_2222981_3.jpg!w144x61.jpg[/img][color=black] [/color][color=#3e3e3e]肾上腺素 L(-)-Epinephrine M.W. : 183.2 [/color][b]在国家药品标准(YBH17082004-2015Z)[/b]中,在对复方盐酸阿替卡因注射液中肾上腺素进行分析时,使用[b]甲醇-水[/b]进行梯度洗脱,但由于[b]肾上腺素极性较强[/b],即使初始梯度为纯水相条件,肾上腺素仍紧邻死时间出峰,[b]保留不佳,易受到溶剂峰干扰,无法进行准确定量。[/b]我们分别尝试使用反相柱CAPCELL PAK C18 MGII加离子对试剂,以及直接使用离子交换色谱柱CAPCELL PAK SCX UG80两种方式,对复方盐酸阿替卡因注射液中肾上腺素和硫酸肾上腺素进行保留分析(复方盐酸阿替卡因注射液由客户提供)。CAPCELL PAK C18 MGII液相色谱柱,其采用高纯度硅胶作为基质,通过减少硅胶微细孔的数量来增大有效比表面积;并且采用新包被技术Ultimate Polymer Coating,实现了对硅醇基极大程度的封锁,兼具分离性能和普适性能,通用性非常好。CAPCELL PAK SCX UG80是强阳离子交换柱,使用高纯度硅胶,填料中金属杂质很少,使配位化合物的吸附得到了极大程度抑制,兼具聚合物和硅胶填料的优点。[b][color=#0070c0]实验方法[/color][color=#0070c0]方法一[/color][color=#0070c0]使用[/color][color=#0070c0]CAPCELL PAK C18MGII[/color][color=#0070c0]色谱柱[/color][color=#0070c0]+[/color][color=#0070c0]离子对试剂[/color][/b]如图1,对肾上腺素对照品溶液进行分析,肾上腺素主峰保留时间为5.69 min,拖尾因子为1.19,理论塔板数为12538。在相同色谱条件下,尝试对亚硫酸肾上腺素标准品及注射液中的亚硫酸肾上腺素进行分析。如图3,亚硫酸肾上腺素标准品溶液能够得到良好分析结果,注射液(客户提供的样品)中未明显见亚硫酸肾上腺素出峰,保留时间为3.55min,拖尾因子为1.14,理论塔板数为14955。[b][color=#0070c0]方法二[/color][color=#0070c0] CAPCELL PAK SCX UG80[/color][color=#0070c0]色谱柱[/color][/b][color=#000000]考虑到使用离子对试剂的流动相条件具有流动相配制麻烦、有损色谱柱寿命、平衡时间长等缺点,我们也尝试使用键合磺酸基团的强阳离子交换柱 ——CAPCELL PAK SCX UG80进行分析。[/color][color=#000000]如图4,在流动相中添加磷酸二氢铵,通过对盐浓度进行调整,在5 mmol/L磷酸二氢铵(磷酸调pH=2.5)条件下,亚硫酸肾上腺素保留时间为3.32 min,然而出现峰形拖尾现象,拖尾因子为2.0,不如CAPCELL PAK C18 MGII色谱柱添加离子对试剂所得分析结果好。[/color][align=center][/align][align=left][img=,400,284]https://ng1.17img.cn/bbsfiles/images/2019/03/201903191547381421_926_2222981_3.jpg!w584x416.jpg[/img] [img=,400,276]https://ng1.17img.cn/bbsfiles/images/2019/03/201903191548310561_8067_2222981_3.jpg!w572x395.jpg[/img][/align][align=left][img=,400,166]https://ng1.17img.cn/bbsfiles/images/2019/03/201903191547576748_522_2222981_3.jpg!w612x254.jpg[/img] [img=,400,167]https://ng1.17img.cn/bbsfiles/images/2019/03/201903191548525761_4184_2222981_3.jpg!w624x262.jpg[/img][/align][align=left]图1 MGII分析肾上腺素对照品溶液结果(离子对条件) 图2 MGII分析注射液结果(离子对条件)[/align][align=center][/align][img=,400,258]https://ng1.17img.cn/bbsfiles/images/2019/03/201903191550354951_2539_2222981_3.jpg!w644x416.jpg[/img] [img=,400,250]https://ng1.17img.cn/bbsfiles/images/2019/03/201903191555486850_3396_2222981_3.jpg!w644x403.jpg[/img][img=,400,147]https://ng1.17img.cn/bbsfiles/images/2019/03/201903191551260881_9828_2222981_3.jpg!w696x256.jpg[/img] [img=,400,164]https://ng1.17img.cn/bbsfiles/images/2019/03/201903191556163846_9739_2222981_3.jpg!w632x260.jpg[/img][align=left]图3 MGII分析亚硫酸肾上腺素标准品和注射液结果(离子对条件) 图4 SCX UG80分析亚硫酸肾上腺素对照品溶液和供试品溶液[/align][align=left][/align][align=left]综上实验结果,使用中等极性色谱柱CAPCELL PAK C18 MGII S5 4.6 mm i.d. × 250 mm,在流动相中添加5 mM辛烷磺酸钠、30°C柱温条件下进行梯度洗脱,能够实现复方盐酸阿替卡因注射液中肾上腺素和亚硫酸肾上腺素的良好保留与分析。[/align][b][color=#0070c0][/color][/b][align=left][b][color=#0070c0] [/color][color=#0070c0] [/color][/b][/align]
看到氢化可的松注射液的辅料里有乙醇和注射用水,想扣除辅料干扰就得配制相应浓度的辅料,谁能透露下,这处方里头的乙醇大概浓度多少啊? 叩谢各位大大。
[color=black]复方盐酸阿替卡因注射液为复方制剂,是盐酸阿替卡因与肾上腺素的灭菌水溶液,作为口腔用局部麻醉剂,适用于涉及切骨术及粘膜切开的外科手术过程。[/color][color=black] [/color][img=,156,99]https://ng1.17img.cn/bbsfiles/images/2019/03/201903211036489419_4502_2297_3.jpg!w156x99.jpg[/img][align=center][/align][align=left][b][color=black]盐酸阿替卡因(Articaine hydrochloride M.W.:320.84)[/color][/b][/align][align=center][b][color=black] [/color][/b][/align][color=black]在现有国家药品标准(YBH17082004-2015Z)分析方法中,流动相添加了离子对试剂-庚烷磺酸钠,并在pH为2.0的强酸条件下进行相应分析,不利于色谱柱的使用寿命。大曹三耀实验室参考USP方法,以冰醋酸水溶液-乙腈作为流动相,选用CAPCELL PAK C18 MGII色谱柱,实现了复方盐酸阿替卡因注射液中盐酸阿替卡因的定量和有关物质的良好分析(复方盐酸阿替卡因注射液由客户提供)。[/color][color=black]CAPCELLPAK C18 MGII[/color][color=black]液相色谱柱,其采用高纯度硅胶作为基质,通过减少硅胶微细孔的数量来增大有效比表面积;并且采用新包被技术Ultimate Polymer Coating,实现了对硅醇基极大程度的封锁,兼具分离性能和普适性能,通用性非常好。[/color][align=left][b][color=#0070c0]实验方法[/color][/b][/align][align=left][img=,500,358]https://ng1.17img.cn/bbsfiles/images/2019/03/201903211037456969_5082_2297_3.jpg!w730x523.jpg[/img][/align][align=left]图1[color=black]盐酸阿替卡因[/color]对照品及供试品溶液[/align][align=left][img=,500,248]https://ng1.17img.cn/bbsfiles/images/2019/03/201903211038541919_2603_2297_3.jpg!w572x284.jpg[/img][/align][align=center][/align][align=center][/align][color=black]为进行有关物质分析,该实验将注射液样品以流动相稀释100倍,作为有关物质供试品溶液,再将该有关物质供试品溶液以流动相进一步稀释100倍,作为自身对照溶液。以冰醋酸水溶液-乙腈作为流动相,选用CAPCELL PAK C18 MGII色谱柱,通过调整流动相比例及柱温,最终在18%乙腈、柱温30℃条件下实现了盐酸阿替卡因供试品溶液及对照品的良好分析。[/color]如图2、3,使用CAPCELL PAK C18 MGII色谱柱进行分析,盐酸阿替卡因和有关物质均能得到良好分析结果,主峰与峰前杂质得到了良好分离,分离度为1.90(见表1)[img=,400,311]https://ng1.17img.cn/bbsfiles/images/2019/03/201903211045536855_9516_2297_3.jpg!w574x447.jpg[/img][img=,400,295]https://ng1.17img.cn/bbsfiles/images/2019/03/201903211045540875_8483_2297_3.jpg!w698x516.jpg[/img][align=left] 图2 [color=black]盐酸阿替卡因[/color]有关物质供试品溶液及空白 图3 自身对照溶液[/align][align=center][/align][align=left]表1 有关物质结果详表[/align][align=left][img=,600,323]https://ng1.17img.cn/bbsfiles/images/2019/03/201903211042513275_6690_2297_3.jpg!w786x424.jpg[/img][/align][align=center][/align]综上实验结果,使用CAPCELL PAK C18 MGII S5 4.6mm i.d.×250 mm色谱柱,以冰醋酸水溶液-乙腈为流动相体系,在30°C柱温条件下,能够实现复方盐酸阿替卡因注射液中盐酸阿替卡因的定量和有关物质的良好分析。[color=black] [/color]
为对庆大霉素和林可霉素注射液的安全性进行毒理学评价,采用急性毒性试验、溶血试验、局部血管刺激性试验、肌肉及皮肤刺激试验及豚鼠全身用药的过敏试验,考察庆大霉素和林可霉素注射液制剂的安全性。结果表明,庆大霉素和林可霉素注射液对小鼠肌肉注射的LD 。为4.989 mL/kg,0.1~0.5 mL该注射液在4 h内对兔红细胞不产生溶血和凝聚作用;静脉注射部位血管及周围组织均未见充血、水肿、出血和坏死等病理改变,肌肉注射部位充血范围在0.5 cm×1.0 cm 以下,4块股四头肌反应级的最高与最低之差等于0,家兔四块股四头肌反应级之和小于1O;以相当于临床用量2倍的剂量涂抹皮肤,停药后1、24、48、72 h镜下观察均未见明显异常的病理变化;豚鼠首次致敏后第14天及第21天静脉注射液攻击,在观察期内未见过敏反应。表明庆大霉素和林可霉素注射液在该试验条件下是安全的。过敏试验猪链球菌病是由猪链球菌引起的人畜共患传染病,是规模化养猪场中最常见的细菌病之一(蔡宝祥,2001)。本病一年四季均可发生,但以5一l1月发生较多,大小猪均能感染发病,但多见于断奶仔猪和育肥猪。庆大霉素和林可霉素注射液主要用于治疗断奶仔猪链球菌病,临床多肌肉注射给药。为了考察该给药方法的安全性,根据《新药注册管理办法》及有关法规的要求,作者对庆大霉素和林可霉素注射液进行了急性毒性试验、溶血试验、局部刺激性试验(肌肉、血管、皮肤)及全身过敏试验,供临床参考。
我测的是注射液里的钠,钾,铯,可是注射液里有葡萄糖和枸橼酸,是不是必须硝化啊,硝化的方法在那里着找啊,我是新手,忘各位前辈指点指点。我在一些专利网上没有查到。
注射液是常用的药品之一,而且因其药效迅速、作用可靠,正越来越广泛地应用于临床。因注射液直接进入血液,对其无菌性的要求非常高,《中国药典》规定,注射液中不应含有任何活的微生物,这就需要抗氧剂来帮忙。那么在注射液中常用的抗氧剂 有哪些?
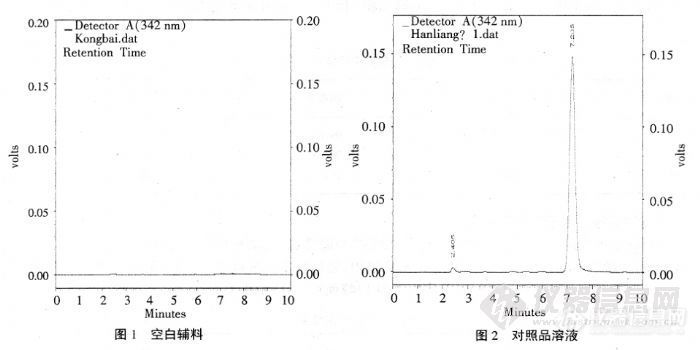
标题:5.1 甲钴胺注射液含量的方法学研究作者:常 明 1, 李 晶 1, 武玉洁 2, 张文双 2( 1.石家庄学院 化工学院, 河北 石家庄 050035; 2.石家庄栢奇制药有限公司, 河北 石家庄 050035)摘要: 摘 要: 以乙腈- 甲醇- 0.05 mol /L磷酸二氢钾溶液( 10∶ 20∶ 70) (用磷酸调节 pH 值为 4.0)为流动相, 采用迪马钻石 C18( 250 mm× 4.6 mm, 5 μ m)色谱柱及紫外检测器, 建立了甲钴胺注射液中甲钴胺含量的反相高效液相色谱检测方法. 柱温: 40℃; 检测波长为 264 nm; 流速: 1.0 mL /min. 本方法测定的日内精密度为 0.59%, 日间精密度为 0.67%, 回收率为 99.7%~ 100.5%, 在 160~ 240 μ g /mL范围内线性关系满足要求( r=0.999 9) ; 结果表明方法准确、 操作简单、 专属性强, 可用于定量测定甲钴胺注射液含量.http://ng1.17img.cn/bbsfiles/images/2012/07/201207161648_377914_2379123_3.jpg
近日有群友求助,群里尚未有人应答,现在版面上贴出,希望有人予以回应: 依据依######注射液处方,配制#####注射液作为制剂空白。精密量取B、Mg、Al、K、Ca、Cr、Fe、Zn、Ba、As、Cd、Pb、Co、Ti、Mn、Sb标准液适量于10ml量瓶中,用1%硝酸稀释至刻度,得对照储备液精密量取对照储备液适量于50ml量瓶中,加入制剂空白溶液10ml, 1%硝酸稀释至刻度,得系列浓度溶液。以含20%制剂空白的1%硝酸溶液为标准空白溶液。测定标准空白溶液和标准溶液系列,仪器自动绘制标准曲线。然后根据此线性进行样品测定,及方法学考察。不知这样的做法是否有不妥的地方?
多多药业有限公司生产的双黄连注射液被叫停。今天,国家食品药品监督管理局在其网站上发出通知,要求各地暂停销售使用标示为多多药业有限公司生产的双黄连注射液。 16日,国家药品不良反应监测中心报告称,标示为黑龙江多多药业有限公司生产的双黄连注射液在使用中出现严重不良事件。为确保公众用药安全,决定暂停销售和使用标示为多多药业有限公司生产的双黄连注射液。 目前,国家食品药品监督管理局和卫生部正在对该事件发生的原因进行调查。 大家对此事件如何看待的,有什么想法、看法、观点,说说,晒晒![em09502]
喜炎平脉络宁注射液引起严重过敏2012年06月27日08:47新华网国家食品药品监督管理局26日发布通报,提示生产企业和医患人员关注喜炎平注射液和脉络宁注射液引起严重过敏反应的问题。据了解,喜炎平注射液的成分是穿心莲内酯磺化物,主要用于解热消炎。2011年,国家药品不良反应监测中心病例报告数据库有关喜炎平注射液的病例报告数共计1476例,其中涉及14岁以下儿童报告达1048例。主要不良反应表现为过敏样反应、过敏性休克、紫绀、呼吸困难等。脉络宁注射液是2009版国家基本药目录品种,其功能与主治为清热养阴、活血化瘀。用于血栓闭塞性脉管炎、动脉硬化性闭塞症、脑血栓形成及后遗症、静脉血栓形成等。2011年,国家药品不良反应监测中心病例报告数据库共收到有关脉络宁注射液药品不良反应病例报告1500例,其中严重病例报告189例。严重不良反应主要为呼吸系统损害、全身性损害和心血管系统损害等。国家食品药品监管局建议,由于这两种注射液易发生过敏反应,建议医护人员在用药前详细询问患者的过敏史,特殊人群和过敏体质者应慎重使用。使用时应严格按照说明书规定的用法用量给药,不得超剂量使用;谨慎联合用药。如确需联合使用其他药品时,应谨慎考虑与此两种药品的间隔时间以及药物相互作用等问题。对于药品生产企业,国家食品药品监管局建议,加强临床合理用药的宣传,确保产品的安全性信息及时传达给患者和医生;完善生产工艺、提高产品质量标准,开展相应安全性研究。(新华网)
[size=3][font=宋体][color=#f10b00]维权声明:本文为03yx2原创作品,本作者与仪器信息网是该作品合法使用者,该作品暂不对外授权转载。其他任何网站、组织、单位或个人等将该作品在本站以外的任何媒体任何形式出现的,均属侵权违法行为,我们将追究法律责任。[/color][b] 摘要:目的[/b][/font][font=Times New Roman] [/font][font=宋体]采用混料均匀设计不同配比注射液,建立最佳配比标准特征图谱以及谱效学研究。[b]方法[/b][/font][font=Times New Roman] [/font][font=宋体]采用混料均匀设计不同配比,以经验方组为对照组,以小鼠脑组织保护为药理模型,确定最佳药效下的配方组,同时采用液相色谱梯度洗脱建立了[/font][font=Times New Roman]8[/font][font=宋体]个配比组方的指纹图谱,[/font][font=Times New Roman] [/font][font=宋体]并[/font][font=宋体]通过多元回归逐步法初步确定了最佳配比特征峰的谱效关系。[b]结果[/b][/font][font=Times New Roman] [/font][font=宋体]确定了最佳药效模型下的配比组方,建立了最佳配比组方特征图谱,确定[/font][font=Times New Roman]11[/font][font=宋体]个共有峰,其中[/font][font=Times New Roman]9[/font][font=宋体]号峰为阿魏酸峰,为该指纹图谱的参照峰。供试品溶液的指纹图谱与标准指纹图谱中的全部[/font][font=Times New Roman]10[/font][font=宋体]个共有峰对应,且顺序一致,具有显著性药效作用为[/font][font=Times New Roman]3[/font][font=宋体],[/font][font=Times New Roman]8[/font][font=宋体],[/font][font=Times New Roman]9[/font][font=宋体],[/font][font=Times New Roman]11[/font][font=宋体]号峰。[b]结论[/b][/font][b][font=Times New Roman] [/font][/b][font=宋体]研究所得的标准特征图谱稳定性、重复性好,可作为最佳配比复方注射液特征性指纹图谱,为中药注射液的研制和再评价提供初步参考。[/font][/size][size=3][b][font=宋体]关键词:[/font][/b][font=宋体]复方[/font][font=宋体]注射液;特征图谱;高效液相色谱;谱效关系;[/font][size=3][font=Times New Roman] [/font][/size][/size]
想配制一个不含主药成分的注射液空白,看了下某注射液的辅料,为丙二醇,但没写浓度。有人告诉我大概就按照1%~10%的浓度配制这个辅料溶液就可以了,但我一估算,主药成分是10ml:0.1g,相当于1%的浓度。想不到名为辅料,这个浓度居然跟主药浓度相当甚至还超过啊,所以有点吃不准,特来请教各位老师,还望赐教。
在英国药典附录colour of solution中指描述了标准比色液的配制,但如果注射液正文中没有对颜色的描述,是否就表明对该品种的颜色不做要求呢?还是说没有描述就是要求澄清无色?药典的其他地方有没有溶液颜色的规定?请指点,谢谢!
土霉素注射液用高效液相怎么检测?谢谢!
【中国药典】从1985年版至1995年版均采用显微镜法检查注射液中的不溶性微粒。检查≥10μm与≥25μm两档,与美国药典标准基本相同。在2000年版【中国药典】显微镜法检查注射液中不溶性微粒的基础上增加了第二法----光阻法。在2005年版【中国药典】中增加了对小剂量注射液的检测。【中国药典】2005年版初稿对注射液中不溶性微粒污染的监控作了修订,将光阻法修订为第一法,显微镜法为第二法。修订后的结果判定也与美、英、欧共体、日本基本一致。原文来自:http://pssnicomp.cn/zhuanti.html
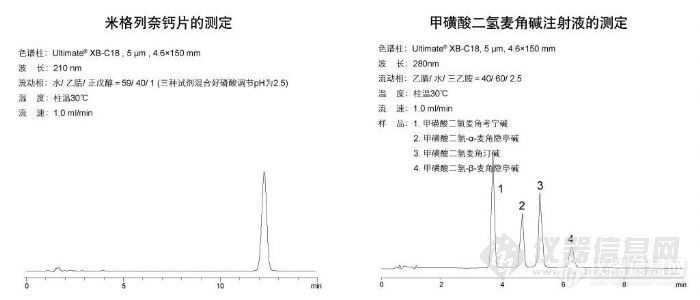
米格列奈钙片测定和甲磺酸二氢麦角碱注射液的测定http://ng1.17img.cn/bbsfiles/images/2009/11/200911021813_180160_1896702_3.jpg
中药注射液的前途渺茫还是?大家说说看[em0801]