[size=4]合成产品亚硝酰硫酸(NO.SO4H)后,产物液中可能有这些成分:亚硝酰硫酸,硫酸,硝酸,SO3...,怎么建立合适的仪器分析方法对各成分进行分析?亚硝酰硫酸溶液用途:主要应用于重氮化反应。亚硝酰硫酸性状:无色棱柱状结晶,溶于硫酸,在水中分解,与水反应剧烈。73.5摄氏度分解。合成方法:SO2通入到硫酸和硝酸中去,发生氧化-还原反应,硝酸被还原为亚硝酸,SO2被氧化为SO3,生成的亚硝酸与SO3结合生成亚硝酰硫酸。[/size][img]http://fm381.img.xiaonei.com/pic001/20080229/19/39/large_5165m68.jpg[/img]
味精的主要成分是谷氨酸钠,据说高温会分解成对人体有害的物质,是不是真的呀?分解成啥呀?
[em09509]用5ml硝酸+高氯酸(5:1)去分解0.5g植株样品,之后消解液有呈黄色的,有呈无色的。定容至50ml,在容量瓶中发现有白色晶体(味精形状)。不知道这白色晶体是什么?直接上机的话怕它堵塞物化器。想过滤吧又 怕白色晶体中含有待测成分。若把稀释倍数放大的话,个别元素的含量又太低,所以不能再稀释。该试验是分析植株中K,P,Ca,Mg,Cu,Fe,Mn,Zn,S,B等。请各位老师帮助:1,白色的晶体是什么?2,16个样品同时放在消解炉上消解,加入的酸的量,植物样品及消解条件都一样,为什么会呈现出不同的颜色?
热分解(或热裂解)是利用热能切断大分子量的有机物(碳氢化合物),使之转变为含碳数更少的低分子量物质的工艺过程。炼油工业早已用来裂解烃类制取低级烯烃。固体有机废物处理中应用热分解是后来发展起来的,可以说是热分解技术的新领域。热分解在固体废物方面的应用是物料干燥、蒸馏出其中的挥发性成分并导致某些化学反应。虽然热分解的形式也可包括燃烧,但热分解常用间接加热而不用直接加热。现在大多数热解固体废物的系统正是包含着一种一定限度空气不足的燃烧过程。通过热分解可在一定温度条件下,从有机废物中直接回收燃料油、气等。但是并非所有有机废物都适合于热分解,在选择热分解技术时,必需充分研究废物性质、组成和数量,充分考虑其经济性。适于热分解的固体废物有废塑料(含氯者除外)、废橡胶、废轮胎、废油及油泥、废有机污染物等。固体废物热分解一般采用竖炉、回转炉、高温熔化炉和流化床炉等。
热分解(或热裂解)是利用热能切断大分子量的有机物(碳氢化合物),使之转变为含碳数更少的低分子量物质的工艺过程。炼油工业早已用来裂解烃类制取低级烯烃。固体有机废物处理中应用热分解是后来发展起来的,可以说是热分解技术的新领域。热分解在固体废物方面的应用是物料干燥、蒸馏出其中的挥发性成分并导致某些化学反应。虽然热分解的形式也可包括燃烧,但热分解常用间接加热而不用直接加热。现在大多数热解固体废物的系统正是包含着一种一定限度空气不足的燃烧过程。通过热分解可在一定温度条件下,从有机废物中直接回收燃料油、气等。但是并非所有有机废物都适合于热分解,在选择热分解技术时,必需充分研究废物性质、组成和数量,充分考虑其经济性。适于热分解的固体废物有废塑料(含氯者除外)、废橡胶、废轮胎、废油及油泥、废有机污染物等。固体废物热分解一般采用竖炉、回转炉、高温熔化炉和流化床炉等。
岛津高效液相PEEK双球单向阀超声后分解了,求助岛津双球单向阀内部构造和如何安装。。
一复合物[url=https://insevent.instrument.com.cn/t/Mp][color=#3333ff]气相[/color][/url]自动进样,某一成分发生分解,会对剩余组分定量分析产生影响吗?二1.一定质量的纯物质A/B/C按一定浓度分别[url=https://insevent.instrument.com.cn/t/Mp][color=#3333ff]气相[/color][/url]进样;2.将一定质量的A/B/C混合在一起按一定浓度[url=https://insevent.instrument.com.cn/t/Mp][color=#3333ff]气相[/color][/url]进样;(1.2中相同物质称样质量相同,配制浓度相同)相同的方法下,混合物中A/B/C响应值与分别进样的A/B/C响应值为什么会有差异,而且差异很大?
哪一种马弗炉可以收集焙烧后的烟气的?我们实验需要焙烧一种废渣,收集废渣分解后的烟气进行实验,请问哪一种炉子可以?而且焙烧后的烟气中可能有二氧化硫,会有一定的腐蚀性。
热分解动力学软件问大家个问题,热分解动力学软件,能分析什么参数,最后能得到什么结果啊?谢谢大家
乌头碱标准品配制好后放在冰箱里过了2周左右就分解了,就不能用于薄层了。我用的溶剂是无水乙醇1mg配制成2ml。请问各位要怎么贮存才不容易分解。
标准品配制后,大家一般都用多长时间啊,怎么判断是否分解或者污染
衍生化试剂怕水的原理是什么?衍生化后遇水会分解吗?
晶圆表面[url=https://insevent.instrument.com.cn/t/Mp]气相[/url]分解后,收集液体所用的回收液,为什么要用到双氧水???,双氧水起到什么作用,为什么不用硝酸??? 请教各位大大!!!
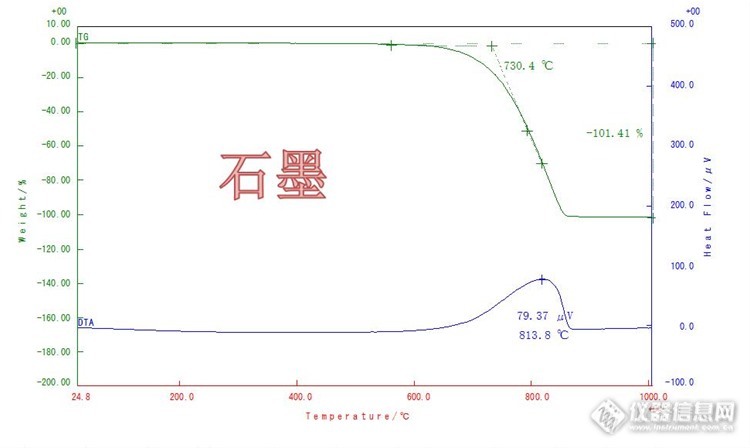
我这里使用的原材料有石墨粉,一直以来来料检查的时候都会用X线衍射确认成分,有一次因为供应商弄错了,给了我们焦炭粉。因为X线衍射是确认成分的,石墨和焦炭都是C,只能通过波峰高度来确认(但准确度不高)。因为我这刚好有TGA分析仪,能不能利用这个来做判断?我自己有做过几次,貌似焦炭的分解温度是700℃以下,石墨的是700℃以上(区别太小了)。我使用的条件是铂金坩埚、空气、10℃/min、烧1000℃。http://ng1.17img.cn/bbsfiles/images/2016/08/201608191842_605576_3080393_3.jpghttp://ng1.17img.cn/bbsfiles/images/2016/08/201608191842_605577_3080393_3.jpg
饮料是指以水为基本原料,由不同的配方和制造工艺生产出来,供人们直接饮用的液体食品。一般可分为含酒精饮料和无酒精饮料。 走进超市,你会发现饮料的品种非常多,果汁类、茶类、汽水类,还有营养类,而产品成分表里标注的添加剂数目更是繁多。不管什么饮料,几乎所有品种都无可避免地含有一种添加剂——防腐剂。一些饮料有不同的口味,橙子味、苹果味、葡萄味等,这就涉及到香精和甜味剂。不同口味的饮料有不同的颜色,这就涉及到人工色素。有营养类饮料,说能补充身体所需维生素,这涉及到维生素添加剂;有功能类,称其成分与人体体液成分极为相似,这就涉及到矿物元素等更多添加剂……
氘代氯仿久置后是否会分解?最多能放多久(不避光)不分解?分解后会生成盐酸吗?
今天不经意在网上看到一个叫做“水分解化合燃料用分解燃烧器”的发明专利,觉着很新鲜,在网上查了一下也有好多有关这个发明的新闻 发明者说:“水分解化合燃料用分解燃烧器”是以成本低廉的水为主要燃料,通过分解产生氢和氧并发生燃烧,从而减少了一次能源的消耗,可替代一次能源20%——80%。同时,由于氢和氧燃烧后产生的是水,明显降低了温室气体及污染物的排放,也避免了传统水煤气反应所带来的影响燃料燃烧等缺点。这种新兴产品具有工艺周期短、市场前景广阔、利润高等特点。这项发明可应用于热力电厂、供暖锅炉、化工热力等一切消耗能源的产业单位,是节能减排创新能源项目。“水分解化合燃料用分解燃烧器”无论燃烧多长时间,只需一次预热,可以采用自然状态下的河、湖等水源做燃料,可谓“取之不尽,用之不竭”。 眨眼一看,这个发明确实很不错,环保且污染小,尤其是“取之不尽,用之不竭”,看着就特别炫,但是这种东西真的可以吗,真的可以做出来吗? 看到这个发明的时候我又想起了去年听一个朋友介绍的“空气发动机”的项目,据说项目做的很大, 看着也确实很吸引人,但是按照常理来看,总是不能理解,或许是我们知识浅薄吧, 今天发这个帖子就想知道一下这个发明是不是真的可行?有相关只是经验的朋友可以解释一下
除少数分析手段如X-荧光、中子活化、火花源质谱可直接分析固体样品外,大多数分析方法如[url=https://insevent.instrument.com.cn/t/Wp][color=#3333ff]原子吸收光谱[/color][/url]法、电化学法、发射光谱法以及比色分析法等湿法分析,均要求把分析试样首先转变成均匀的溶液。在化妆品检验中质地均匀的液体试样(如香水、洗发液),有时样品可以不经预处理直接进行测定,但在绝大多数情况下,必须经过预处理,先制备成样液,然后再进行定量。待测元素在样品中含量一般是很低的,而样品基体成分及试样中含有的大量水分会对测试带来困难。消解除去试样中有机成分或从试样中浸提出待测成分的方法很多。有干法、湿法;有在密闭系统中也有在开放系统中;有高压,也有的在低压下;有用无机的酸碱试剂,也有用有机溶剂等等。这些方法各有其特点,应根据试样的待测元素以及实验设备等选用。在选用分析方法进行元素分析时,应结合试样性质、待测元素和定量方法等对以下几个问题加以权衡:如样品预处理过程是否安全?是否对所用的器皿有影响?所用方法对样品的分解效果如何?所用试剂是否会对定量产生干扰?是否造成了不能忽略的沾污?预处理方法能否导致待测元素的损失或产生该元素的不溶性化合物等等。1 干灰化法干灰化是在供给能量的前提下直接利用氧以氧化分解样品中有机物的方法。它包括在高温下利用空气中氧的高温炉干灰化法100~300℃下利用激化了的氧原子的等离子氧低温灰化法;在高压氧气氛中燃烧灰化的氧弹法;在常压氧气中燃烧的氧瓶法等。1.1高温炉干灰化法装有样品的器皿放在高温炉内,利用高温(450~850℃)分解有机物,这是最古老也是最简单的方法。利用高温下空气中氧将有机物碳化和氧化,挥发掉易挥发性组分;与此同时,试样中不挥发性组分也多转变为单体、氧化物或耐高温盐类。高温炉干灰化是很复杂的反应过程,经干燥碳化的样品变成多孔的含有无机成分的有孔焦炭,其氧化动力学决定于物质的性质,即所含的无机成分、多孔性及颗粒大小。由氧化纯石墨得到的资料表明,当温度大于800℃,反应的实际机制可以认为:在最初比较缓慢
我这里有个有机小分子,大约300°分解,我想知道它分解后的产物是什么,请问该怎样做呢?我曾经送过热重-质谱联用,不过那里必须是首先自己推测可能的产物,然后对这些目标产物进行检测,我想能不能用类似EI的仪器直接检测分解后产物的分子量呢?请各位老师同学指点!谢谢!
要放假了,以为最后两天可以闲一下的,但是公司有个品种要注册,突然要求检测必须在年前做完,老总发话了,只能做了。由于我公司[url=https://insevent.instrument.com.cn/t/Mp]气相[/url]人员不足,没有时间摸方法和做方法验证,就委托一公司代做。拿到对方提供的方法后,就开始按方法做了:安捷伦6890-7694E,DB-624 30Mx0.53mmx3.0um 1N氢氧化钠溶液做溶剂,检甲醇、A、B、DMF四种溶剂。顶空瓶温度95度,流速1.5ML/MIN,其它这里不细讲了。 按照这个方法了.从走出的图谱上看到[u][b]甲醇保留时间2.6MIN(峰高300PA),[/b][/u]A在3.1MIN出峰,B在12.6MIN出峰,DMF限量很小,峰面积也很小,从五针标样上都看到的一个在15.7MIN的小峰,貌似是DMF,但是又发现在空白里也有一个这样的峰面积差不的峰,为了给它验明正身,紧接着做的是DMF定位了。在顶空瓶里装了点1N氢氧化钠,滴了几滴DMF放顶空里运行了。 [color=#d40a00] [u]定位图谱出来了,吓倒我了!出了三个峰保留时间分别是:[b]2.6MIN[/b],7.0MIN、15.3MIN,其中2.6MIN峰相当大峰高有10000PA,7.0MIN峰高300PA,15.3MIN峰高700PA[/u][/color]。首先我想到的是要放假了,做事浮躁了,把试剂污染了,没办法打起十二分精神再做一次定位。就直接开了一瓶4L、TEDIA公司的DMF试剂直接倒了点到顶空瓶中,再加了适量1N氢氧化钠溶液在同一顶空瓶中,再次运行,结果耐人寻味。居然和定位图谱在峰个数和保留时间上惊人相同,纠结啊! 倒底是哪里出问题了?坐在电脑前,看着我的图谱,口中念着N,N-二甲基甲酰胺。突然一个大胆的想法闪过(因为几个同事都在心里觉得是我搞错了试剂根本不相信是我的灵光一闪,只是我个人觉得这想法大胆),会不会是DMF分解了?毕竟我是做检测的,对化学反应不是很敏感,我需要再做几个样品试试。 [u] 试验1 将之前配制的标样加适量到顶空瓶中,再滴几滴刚开的那瓶DMF,仍按此方法运行。结果出峰如下:2.6MIN,3.1MIN,7.0MIN,12.6MIN, 15.3MIN几个峰,其中甲醇即2.6MIN峰峰面积远远超过之前正常标样中甲醇应该的峰面积,峰高大约有5000PA[/u] 试验2 我选择了更换溶剂,[color=#fe2419]用纯化水替代1N氢氧化钠[/color]。在顶空瓶中加入一定量纯化水,加一点前面刚开的那瓶DMF,仍按前面的方法运行。[u]结果只在15.3MIN时出了一个大峰.[/u] 试验3 网上查询 结果[color=#fe2419]DMF在碱性、高温条件下易分解[/color] 相信看到这里,各位应该各有想法了 我们的结果是:注册计划被打乱了!
作植物灰分的分析时,用硝酸,高氯酸分解样品 用盐酸(1+50)把样品稀释到合适范围内。同时取适量的水用与样品相同的方法制成空白溶液。用空白结果去校正测定值。校准曲线:取5至10ml的Zn标准溶液(10ppm)以逐渐增加的体积到100ml容量瓶中,然后加与样品相同量的酸,用水定容到刻度。不知道它是如何用“空白结果去校正测定值”? 具体步骤如何操作(比如测得的空白结果为5ppm,而样品测定结果为20ppm,则实际结果为多少? )?另外它那个校准曲线也不理解是怎么回事标准曲线是基准物质用去离子稀释还是用盐酸稀释好?比如测得的空白结果为5ppm,而样品测定结果为20ppm,则实际结果为多少?
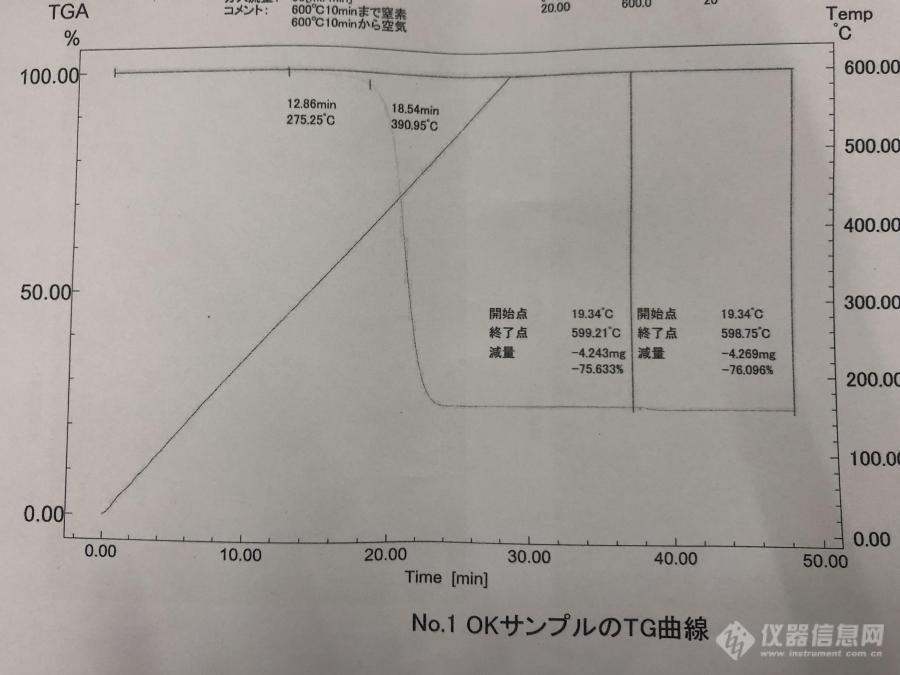
[img=样品1,690,517]https://ng1.17img.cn/bbsfiles/images/2020/04/202004221549107499_3936_1612965_3.jpg!w690x517.jpg[/img][img=样品2,690,387]https://ng1.17img.cn/bbsfiles/images/2020/04/202004221549123300_7297_1612965_3.jpg!w690x387.jpg[/img]上面2个测试图是ABS材料的,从图中可以看到写着NG的和上面OK的在开始分解时的温度是有差异的,前面的曲线也有差异,这个可以说明这2个样品的成分不一致吗?可以推测得出较早开始分解掉的是什么物质吗?
现在真的很疑惑啊,ddt分解的厉害,虽然洗了衬管,也硅烷化了,怎么还是分解呢,又换上新的衬管试了试也还是分解,难道是新衬管硅烷化的不好?难道是硅烷化试剂失效了?想请教一下大家,硅烷化试剂能保存多长时间?我处理衬管的时候是先用铬酸洗液泡24小时,再用蒸馏水洗干净,用甲醇超声,烘干后泡在5%的二甲基二氯硅烷/正己烷中24小时,然后在甲醇中泡一小时后取出烘干备用,这个过程中同时也把玻璃毛处理了,想请教一下大家这个过程存在什么问题嘛?怎么ddt还是分解的50%多呢?
最近在做比对测试,新配好的标液上机测试发现峰面积很小,经过一翻折腾最后发现还是在冰箱里保存的50ppm的十溴醚标液分解掉了。同样的问题已经在今年出现了两次,四月份时发现新配的标液一溴到九溴峰面积很正常(相对于以往的测试记录),但是十溴的峰就很小几乎看不到了,当时也有怀疑就将一瓶新买没有开封的50ppm的十溴醚重新配标液发现峰面积正常!这次又是跟四月份的情况一样。而且配制好做工作曲线的低浓度的(1,2.5,5ppm)标液的浓度又很正常,没有被分解掉。现在这个问题真的是头痛,所有的标液都是放在一个冰箱的相同位置,为什么会发生这个情况?可以肯定的是50ppm的母液十溴醚是被分解了,其他的1-9溴未被分解。而且低浓度的未被分解!今年以前也是在同样的情况下50ppm的标液并母液出现过分解的情况!希望各位大侠帮我分析下原因以及应对的办法
各位老师大虾帮帮忙,请问:8.423 16.818 21.210 21.447 26.406 27.935 28.039 32.796 36.689 37.213 各是啥成分啊?或是那些原料分解出来的?
根据国标GB/T 23496进行检定碱性橙,发现最后结果碱性橙21,碱性橙22,回收良好,碱性橙2没有回收。后面寻找原因时,采用标液采用旋蒸近干,碱性橙2没有回收了,还采用标液装进进样小瓶,再50℃水浴中,20分钟,直接上机,碱性橙2也没有回收。对于碱性橙2是否在加热中易分解呢,有没有更好的提取方案
除少数分析手段如X-荧光、中子活化、火花源质谱可直接分析固体样品外,大多数分析方法如[url=https://insevent.instrument.com.cn/t/Wp][color=#3333ff]原子吸收光谱[/color][/url]法、电化学法、发射光谱法以及比色分析法等湿法分析,均要求把分析试样首先转变成均匀的溶液。在化妆品检验中质地均匀的液体试样(如香水、洗发液),有时样品可以不经预处理直接进行测定,但在绝大多数情况下,必须经过预处理,先制备成样液,然后再进行定量。待测元素在样品中含量一般是很低的,而样品基体成分及试样中含有的大量水分会对测试带来困难。消解除去试样中有机成分或从试样中浸提出待测成分的方法很多。有干法、湿法;有在密闭系统中也有在开放系统中;有高压,也有的在低压下;有用无机的酸碱试剂,也有用有机溶剂等等。这些方法各有其特点,应根据试样的待测元素以及实验设备等选用。在选用分析方法进行元素分析时,应结合试样性质、待测元素和定量方法等对以下几个问题加以权衡:如样品预处理过程是否安全?是否对所用的器皿有影响?所用方法对样品的分解效果如何?所用试剂是否会对定量产生干扰?是否造成了不能忽略的沾污?预处理方法能否导致待测元素的损失或产生该元素的不溶性化合物等等。
根据分解试样时所用的试剂不同,分解方法可分别为湿法和干法。湿法是用酸、碱或盐的溶液来分解试样,干法则用固体的盐、碱来熔融或烧结分解试样。 1. 酸法分解 由于酸较易提纯,过量的酸,除磷酸外,也较易除去,分解时,不引进除氢离子以外的阳离子,操作简单,使用温度低,对容器腐蚀性小等优点,应用较广。酸分解法的缺点是对某些矿物的分解能力较差,某些元素可能挥发损失。⒈盐酸浓盐酸的沸点为108℃,故溶解温度最好低于80℃,否则,因盐酸蒸发太快,试样分解不完全。⑴ 易溶于盐酸的元素或化合物是:Fe,Co,Ni,Cr,Zn;普通钢铁、高铬铁,多数金属氧化物(如MnO2、2PbOPbO2、Fe2O3等),过氧化物,氢氧化物,硫化物、碳酸盐、磷酸盐、硼酸盐等。⑵ 不溶于盐酸的物质包括灼烧过的Al,Be,Cr,Fe,Ti,Zr和Th的氧化物SnO2,Sb2O5,Nb2O5,Ta2O5,磷酸锆,独居石,磷钇矿,锶、钡和铅的硫酸盐,尖晶石,黄铁矿;汞和某些金属的硫化物,铬铁矿,铌和钽矿石和各种钍和铀的矿石。⑶ As (III),Sb (III),Ge (IV) 和Se (IV),Hg (II),Sn (IV),Re (VIII) 容易从盐酸溶液中(特别是加热时)挥发失去。在加热溶液时,试样中的其他挥发性酸,诸如HBr,HI,HNO3,H3BO3和SO3当然也会失去。⒉硝酸⑴ 易溶于硝酸的元素和化合物是除金和铂系金属及易被硝酸钝化以外的金属、晶质铀矿(UO2)和钍石(ThO2)、铅矿,几乎所有铀的原生矿物及其碳酸盐、磷酸盐、钒酸盐、硫酸盐。⑵ 硝酸不宜分解氧化物以及元素Se,Te,As。很多金属浸入硝酸时形成不溶的氧化物保护层,因而不被溶解,这些金属包括Al,Be,Cr,Ga,In,Nb,Ta,Th,Ti,Zr和Hf。Ca,Mg,Fe能溶于较稀的硝酸。⒊硫酸⑴ 浓硫酸可分解硫化物、砷化物、氟化物、磷酸盐、锑矿物、铀矿物、独居石、萤石等。还广泛用于氧化金属Sb,As,Sn和Pb的合金及各种冶金产品,但铅沉淀为PbSO4。溶解完全后,能方便地借加热至冒烟的方法除去部分剩余的酸,但这样做将失去部分砷。硫酸还经常用于溶解氧化物、氢氧化物、碳酸盐。由于硫酸钙的溶解度低,所以硫酸不适于溶解钙为主要组分的那些物质。⑵ 硫酸的一个重要应用是除去挥发性酸,但Hg (II),Se (IV)和Re (VII)在某种程度上可能失去。磷酸、硼酸也能失去。⒋磷酸磷酸可用来分解许多硅酸盐矿物、多数硫化物矿物、天然的稀土元素磷酸盐、四价铀和六价铀的混合氧化物。磷酸最重要的分析应用是测定铬铁矿,铁氧体和各种不溶于氢氟酸的硅酸盐中的二价铁。尽管磷酸有很强的分解能力,但通常仅用于一些单项测定,而不用于系统分析。磷酸与许多金属,甚至在较强的酸性溶液中,亦能形成难溶的盐,给分析带来许多不便。⒌高氯酸温热或冷的稀高氯酸水溶液不具有氧化性。较浓的酸(60%~72%)虽然冷时没有氧化能力,热时却是强氧化剂。纯高氯酸是极其危险的氧化剂,放置时它将爆炸,因而决不能使用。操作高氯酸、水和诸如乙酸酐或浓硫酸等脱水剂的混合物应格外小心,每当高氯酸与性质不明的化合物混合时,也应极为小心,这是严格的规则。热的浓高氯酸几乎与所有的金属(除金和一些铂系金属外)起反应,并将金属氧化为最高价态,只有铅和锰呈较低氧化态,即Pb (II)和Mn (II)。但在此条件下,Cr不被完全氧化为Cr (VI)。若在溶液中加入氯化物可保证所有的铱都呈四价。高氯酸还可溶解硫化物矿、铬铁矿、磷灰石、三氧化二铬以及钢中夹杂碳化物。⒍氢氟酸氢氟酸分解极其广泛地应用于分析天然或工业生产的硅酸盐,同时也适用于许多其他物质,如Nb,Ta,Ti和Zr的氧化物、Nb和Ta的矿石或含硅量低的矿石。另外,含钨铌钢、硅钢、稀土、铀等矿物也均易用氢氟酸分解。许多矿物,包括石英、绿柱石、锆石、铬铁矿、黄玉、锡石、刚玉、黄铁矿、蓝晶石、十字石、黄铜矿、磁黄铁矿、红柱石、尖晶石、石墨、金红石、硅线石和某些电气石,用氢氟酸分解将遇到困难。⒎混合酸混合酸常能起到取长补短的作用,有时还会得到新的,更强的溶解能力。王水(HNO3︰HCl = 1︰3):可分解贵金属和辰砂、镉、汞、钙等多种硫化矿物,亦可分解铀的天然氧化物、沥青铀矿及许多其他的含稀土元素、钍、锆的衍生物,某些硅酸盐、矾矿物、彩钼铅矿、钼钙矿、大多数天然硫酸盐类矿物。磷酸 — 硝酸:可分解铜和锌的硫化物和氧化物。磷酸 — 硫酸:可分解许多氧化矿物,如铁矿石和一些对其他无机酸稳定的硅酸盐。高氯酸 — 硫酸:适于分解铬尖石等很稳定的矿物。高氯酸 — 盐酸 — 硫酸:可分解铁矿、镍矿、锰矿石。氢氟酸 — 硝酸:可分解硅铁、硅酸盐及含钨、铌、钛等试样。
根据分解试样时所用的试剂不同,分解方法可分别为湿法和干法。湿法是用酸、碱或盐的溶液来分解试样,干法则用固体的盐、碱来熔融或烧结分解试样。 6.2.1 酸法分解 由于酸较易提纯,过量的酸,除磷酸外,也较易除去,分解时,不引进除氢离子以外的阳离子,操作简单,使用温度低,对容器腐蚀性小等优点,应用较广。酸分解法的缺点是对某些矿物的分解能力较差,某些元素可能挥发损失。⒈盐酸浓盐酸的沸点为108℃,故溶解温度最好低于80℃,否则,因盐酸蒸发太快,试样分解不完全。⑴ 易溶于盐酸的元素或化合物是:Fe,Co,Ni,Cr,Zn;普通钢铁、高铬铁,多数金属氧化物(如MnO2、2PbOPbO2、Fe2O3等),过氧化物,氢氧化物,硫化物、碳酸盐、磷酸盐、硼酸盐等。⑵ 不溶于盐酸的物质包括灼烧过的Al,Be,Cr,Fe,Ti,Zr和Th的氧化物SnO2,Sb2O5,Nb2O5,Ta2O5,磷酸锆,独居石,磷钇矿,锶、钡和铅的硫酸盐,尖晶石,黄铁矿;汞和某些金属的硫化物,铬铁矿,铌和钽矿石和各种钍和铀的矿石。⑶ As (III),Sb (III),Ge (IV) 和Se (IV),Hg (II),Sn (IV),Re (VIII) 容易从盐酸溶液中(特别是加热时)挥发失去。在加热溶液时,试样中的其他挥发性酸,诸如HBr,HI,HNO3,H3BO3和SO3当然也会失去。⒉硝酸⑴ 易溶于硝酸的元素和化合物是除金和铂系金属及易被硝酸钝化以外的金属、晶质铀矿(UO2)和钍石(ThO2)、铅矿,几乎所有铀的原生矿物及其碳酸盐、磷酸盐、钒酸盐、硫酸盐。⑵ 硝酸不宜分解氧化物以及元素Se,Te,As。很多金属浸入硝酸时形成不溶的氧化物保护层,因而不被溶解,这些金属包括Al,Be,Cr,Ga,In,Nb,Ta,Th,Ti,Zr和Hf。Ca,Mg,Fe能溶于较稀的硝酸。⒊硫酸⑴ 浓硫酸可分解硫化物、砷化物、氟化物、磷酸盐、锑矿物、铀矿物、独居石、萤石等。还广泛用于氧化金属Sb,As,Sn和Pb的合金及各种冶金产品,但铅沉淀为PbSO4。溶解完全后,能方便地借加热至冒烟的方法除去部分剩余的酸,但这样做将失去部分砷。硫酸还经常用于溶解氧化物、氢氧化物、碳酸盐。由于硫酸钙的溶解度低,所以硫酸不适于溶解钙为主要组分的那些物质。⑵ 硫酸的一个重要应用是除去挥发性酸,但Hg (II),Se (IV)和Re (VII)在某种程度上可能失去。磷酸、硼酸也能失去。⒋磷酸磷酸可用来分解许多硅酸盐矿物、多数硫化物矿物、天然的稀土元素磷酸盐、四价铀和六价铀的混合氧化物。磷酸最重要的分析应用是测定铬铁矿,铁氧体和各种不溶于氢氟酸的硅酸盐中的二价铁。尽管磷酸有很强的分解能力,但通常仅用于一些单项测定,而不用于系统分析。磷酸与许多金属,甚至在较强的酸性溶液中,亦能形成难溶的盐,给分析带来许多不便。⒌高氯酸温热或冷的稀高氯酸水溶液不具有氧化性。较浓的酸(60%~72%)虽然冷时没有氧化能力,热时却是强氧化剂。纯高氯酸是极其危险的氧化剂,放置时它将爆炸,因而决不能使用。操作高氯酸、水和诸如乙酸酐或浓硫酸等脱水剂的混合物应格外小心,每当高氯酸与性质不明的化合物混合时,也应极为小心,这是严格的规则。热的浓高氯酸几乎与所有的金属(除金和一些铂系金属外)起反应,并将金属氧化为最高价态,只有铅和锰呈较低氧化态,即Pb (II)和Mn (II)。但在此条件下,Cr不被完全氧化为Cr (VI)。若在溶液中加入氯化物可保证所有的铱都呈四价。高氯酸还可溶解硫化物矿、铬铁矿、磷灰石、三氧化二铬以及钢中夹杂碳化物。⒍氢氟酸氢氟酸分解极其广泛地应用于分析天然或工业生产的硅酸盐,同时也适用于许多其他物质,如Nb,Ta,Ti和Zr的氧化物、Nb和Ta的矿石或含硅量低的矿石。另外,含钨铌钢、硅钢、稀土、铀等矿物也均易用氢氟酸分解。许多矿物,包括石英、绿柱石、锆石、铬铁矿、黄玉、锡石、刚玉、黄铁矿、蓝晶石、十字石、黄铜矿、磁黄铁矿、红柱石、尖晶石、石墨、金红石、硅线石和某些电气石,用氢氟酸分解将遇到困难。⒎混合酸混合酸常能起到取长补短的作用,有时还会得到新的,更强的溶解能力。王水(HNO3︰HCl = 1︰3):可分解贵金属和辰砂、镉、汞、钙等多种硫化矿物,亦可分解铀的天然氧化物、沥青铀矿及许多其他的含稀土元素、钍、锆的衍生物,某些硅酸盐、矾矿物、彩钼铅矿、钼钙矿、大多数天然硫酸盐类矿物。磷酸 — 硝酸:可分解铜和锌的硫化物和氧化物。磷酸 — 硫酸:可分解许多氧化矿物,如铁矿石和一些对其他无机酸稳定的硅酸盐。
[em09511]为什么臭豆腐"闻着臭吃着香"? 这是因为豆腐在发酵淹制和后发酵的过程中,其中所含蛋白质在蛋白酶的作用下分解,所含的硫氨基酸也充分水解,产生一种叫硫化氢(H2S)的化合物,这种化合物具有刺鼻的臭味。这就是臭豆腐闻着臭的原因。 在蛋白质分解后,即产生氨基酸,而氨基酸又具有鲜美的滋味,故"吃着香"。 另外,臭豆腐营养丰富。据测定,每两块臭豆腐中所含蛋白质就相当于一个鸡蛋中蛋白质的含量,再加上它又是经过微生物发酵制成,故营养成分更容易被人体消化和吸收。