各位大佬,请问测试两个物质的反应热,使用DSC,谱图中的峰的面积的焓值即为反应热吗?过程中物质状态变化产生的焓值应如何归属?或者哪位大佬可通俗指点下DSC测试反应热和物质其他变化(比如熔化等)的关系,不胜感激
想用DSC测定两个物质的反应热,应该用什么物质校准仪器呢?测量溶解热时一般选用铟,锡,铅等标准物质,测反应热用这些就不准确了吧。
柠檬酸与碳酸氢钠反应热效应的研究[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=65994]感受物质变化中的能量转换[/url]
水热反应釜一般怎么加热呢将反应混合体系装入了不锈钢反应釜中,做水热反应,一般用什么设备加热呢?1477748976778815.jpg一般可以放烘箱中进行加热,另外为保证实验安全,实验之前一定要了解化学反应热力学、动力学,了解试验过程中是否会有小分子分解,释放大量能量,是否有毒有害的物质生成,避免实验压力过大,超过反应釜的极限压力值,导致釜体变形。同时,毕竟也是高温高压的实验,实验人员也要做好安全防护措施,如:戴好眼罩、面罩或在通风柜内操作等。
想请问前辈们如何用Dsc测定样品的固化反应曲线,一直找不到合适的方法。谢谢!
已知:2H2(g)+O2(g)=2H2O(g) 反应热为-484KJ | MOL 2H2(g)+O2(g)=2H2O(l)反应热为--572KJ | MOL 在25c 101kpa时,一定量的氢气。氧气的混合气体点燃爆炸后再恢复至原来状态时,气体体积比原来减少了3.36L(折合成标准状况下的体积),则反应时放出的热量是? 再问一下原来状态什么状态
仪器介绍 美国Omnical公司SuperCRC 反应量热仪的设计,使专门针对工艺控制早期的研究、反应特征、动力学研究、化学品危害相容性筛选等应用领域。该系统使用15ml的玻璃瓶或哈斯特洛合金(HastelloyC)反应容器,科学家/化工工业工程师可以使用最小的物料和时间获得高质量的化工级别的化学反应量热数据。 此款量热仪可提供化工工业放大过程中所需的热流实验数据,包括:总放热量、最大放热速率、反应动力学、热力学、热容和化工热转化系数。此外,SuperCRC采用了受专利保护的“快速补充”的单元来消除测试体系的敏感的热变化。此款独特的量热平台包含了三个量热操作系统:反应量热、压力补偿“大型”DSC、传统的微量热仪。客户一致反应该仪器操作简单;SuperCRC能在60分钟之内“运输”简单的混合热。该仪器有几种不同的配置。技术参数1、 温度范围:-100℃—+200℃ 2、 灵敏度:10微瓦(不搅拌) 3、 压力:0 – 1000psi(HastelloyC反应容器) 4、 搅拌速率:1400rpm(磁力搅拌);1000rpm(扭矩机械搅拌) 5、 可视化窗口:通过管道镜 6、 加样:注射器自动加样(选配) 7、 加热:预加热/可通过积分消除error from sensible heats.主要特点1、体积小、操作简单;易于快速了解反应初始条件 2、工艺早期的快速筛选,表征和动力学研究 3、热量和热流数据放大,适用于安全评价和有效工艺放大 4、工作范围:-100C ~ 200C, VAC ~ 1000psi **********************************************Omnical应用领域*********************************************A:反应热危害评价: 1、 快速热危害筛选 2、 研究“期望”化学工艺 3、 量化热失控反应 4、 测定分解反应 5、 Cp测定 B:工艺研发与优化 1、 聚合反应动力学研究 2、 Polymerization induction time measurement 3、 溶解度筛选 4、 自催化反应研究 5、 快速、安全的工艺放大研究 C:其他热化学应用: 1、水泥固化研究 2、沥青键和聚合研究 3、电池热稳定研究 4、单体/药物稳定性研究
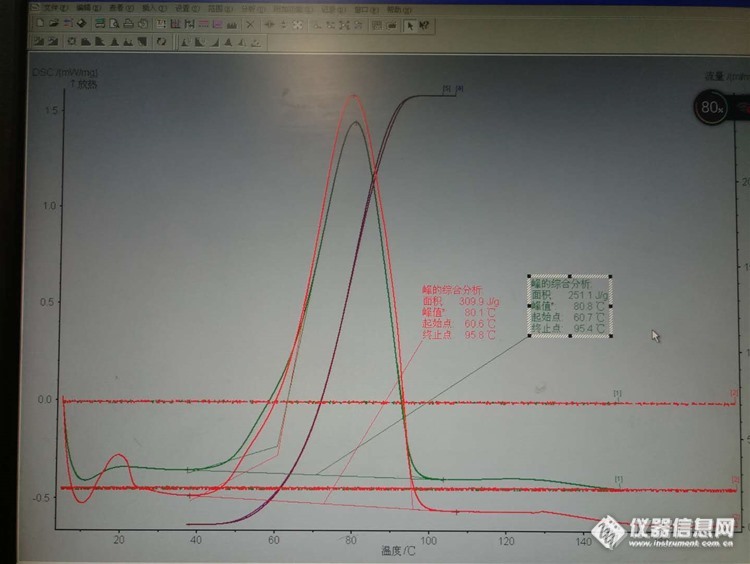
我使用耐驰DSC204 测量不饱和树脂固化反应热焓,前段时间换了一批坩埚,测出的热焓变小了很多,再用原来的坩埚去测,结果跟之前的一致,想请教下大家坩埚对热焓有影响没[img=,750,564]http://ng1.17img.cn/bbsfiles/images/2017/10/201710091447_01_3240555_3.jpg[/img]
量热仪、量热器或者卡计,是一种测量突袭发生物理的或化学的过程效应的仪器,例如,用于测定物质的热容及各种反应热(如中和热,燃料与食物的燃烧值、有机化合物的燃烧热)等 量热仪适用于测量电力、煤炭、冶金、石化、质检、环保、水泥、造纸、地勘、科研院等行业部门测量煤炭、焦炭、石油、水泥生料,砖坯及其它固体或液体等可燃物的发热量 量热计结构主要可以分为外筒、内筒、温度计和搅拌器。 外筒主要起到保温作用。内筒直接充当反应容器。 温度计用来测量反应的温度变化。搅拌器用来使得反应物混合均匀,提高温度测量的准确性和反应的完全性。
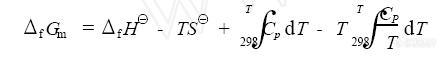
如题,最近想计算化学反应的热力学,想搞个软件算算,哪位仁兄有,帮忙给传一下,多谢多谢~~~~还是用excel就能搞定,可以积分啥的?可能我没把这个问题叙述清楚,我想算化学反应的吉布思自由能,如下的方程式中[img]http://ng1.17img.cn/bbsfiles/images/2008/09/200809011811_106701_1607171_3.jpg[/img]如上述的式子中的方程式中的吉布思自由能
差示扫描量热法(DSC)是在程序控温条件下,测量在升温、降温或恒温过程中输入到试样和参比物的热流量差或功率差与温度或时间的关系。提供物理、化学变化过程中有关的吸热、放热、热容变化等定量或定性的信息。 动态零位平衡原理:样品与参比物温度,不论样品是吸热还是放热,两者的温度差都趋向零。DSC测定的是维持样品与参比物处于相同温度所需要的能量差,反映了样品热焓的变化。 差示扫描量热法(DSC)广泛应用于塑料、橡胶、涂料、胶粘剂、医药、石油化工等不同领域,主要用于高分子材料的定性、定量分析,包括测试熔点、玻璃化转变温度、结晶度、熔融热、结晶热、纯度、反应动力学参数、比热、相转变温度、不同材料的相容性等。 根据DSC曲线,可以测定多种热力学和动力学参数,例如比热容、反应热、转变热、相图、反应速率、结晶速率、结晶度以及样品纯度等。 各种介绍差示扫描量热法(DSC)原理的文章有很多,大家可以通过各种方法轻易获取。本文主要罗列一下差示扫描量热法(DSC)在胶粘剂和涂料行业的实际应用: 测量固化时间(固化速度):利用等温固化曲线,在特定温度下测定反应放热结束时间。选定固化温度:在程序升温条件下,确定最佳固化温度及固化条件。测量固化反应放热:测定固化反应放热量,可以指导配方设计。了解特定温度下固化反应速率:在ΔH-T曲线上,某点的的斜率可以清晰反映特定温度下的固化反应速率,可以指导配方设计。固化度(固化转化率)的测量:根据某个特定条件下的放热量和总放热量来计算固化度,对于固化体系及固化条件的选择有参考作用。产品质量一致性检验:将相同配方不同批次的产品DSC指纹图谱对比,容易发现产品质量的波动,有利于监控产品的质量。玻璃化转变温度(Tg)的测定:Tg是固化物从玻璃态转变为高弹态的温度。在Tg时,固化物的比热容、热膨胀系数、折光率、自由体积、弹性模量等物理参数都要发生突变,所以在配方设计时要考虑固化物的Tg。差示扫描量热法(DSC)可以根据比热容的变化来测定固化物的Tg点。固化物分解温度的测定:不同配方体现固化物的分解温度不同,差示扫描量热法(DSC)可以方便测试固化物的分解温度,体现固化物的热稳定性。原材料的质量监控:很多原材料的质量问题都能在差示扫描量热法DSC的图谱上反应出来,例如熔点、软化点、结晶度、水分含量、相容性、热分解温度、氧化分解温度等。可以根据材料的特性,利用差示扫描量热法DSC的高分辨率和高灵敏度,设计出多种监控原材料质量的测试方法和内控标准。特别是对于潜伏性固化剂质量的监控,大多数厂家生产的潜伏性固化剂在化学组成和结构上不会提供明确的信息,所以质量监控比较麻烦,我们就可以差示扫描量热法(DSC)在程序升温的条件下观察DSC图谱,根据DSC图谱反应出来的相变、自反应热以及热分解温度等信息来监控潜伏性固化剂的质量。
在使用水热反应釜做完实验后,清洁是很重要的,及时的清洗能够保证它的使用效率,能够使它使用的寿命更长。在化学实验室里,我们通常能见到一种很小型的反应容器,那就是水热反应釜。对于在实验室里面使用的设备,通常都会在操作过后进行清洁,下面我们就以水热反应釜具有哪些保养来进行介绍。http://www.shuirefanyingfu.com/upload/201702/1487813101801792.jpg1、在要使用水热反应釜的时候,要先检查,看看是否有损坏,各个部件是否正确摆放,在使用或是不适用的时候,对其都要轻放轻拿,避免碰到坚硬的物体导致损坏。2、在水热反应釜出现故障的时候,要应对其做修理或是检查的时候,让专业的维修人员来进行修理。3、使用水热反应釜做实验之前要把不锈钢釜盖拧紧,这样才不很容易损坏。4、在使用或是停止工作的时候,用软布或是餐巾来将接口擦干净,保护螺纹不受损伤。5、市场上有很多水热反应釜劣质品,会影响实验进度浪费成本,请认准正规厂家、勿贪便宜,6、在水热反应釜使用后对其螺纹圈进行清洁,先把外盖取下来,然后在看看是否残留污垢,用软布或毛巾来对其内部进行擦拭干净,然后在擦拭干净过后涂上一层的润滑剂,这样可以保持接触的润滑,不会产生摩擦力阻碍。通过上述对水热反应釜的保养的介绍,相信新大家对保养水热反应釜都有了新的认识。
放热反应如果 ΔH 计算为负值,则反应能量通常会释放出来形成热,即为放热反应。放热反应会自发性产生。比如我们日常所知的燃烧反应就是在空气中燃烧瓦斯形成热。吸热反应也有反应是正值的 ΔH 。如果 ΔH 是正值,完成反应须吸收能量。即所谓的吸热反应。
(1)由于反应器中微通道宽度和深度比较小,一般为几十到几百微米,使反应物间的扩散距离大大缩短,传质速度快,反应物在流动的过程中短时间内即可充分混合(2)微通道的比表面积一般为5000—50000m2m-3,而在常规反应容器内,比表面积约为100m2m-3,少数为1000m2m-3。微通道的比表面积大,具有很大的热交换效率,即使是激烈的放热反应,瞬间释放出大量反应热也能及时移出,维持反应温度在安全范围内。由于反应物总量少,传热快,特别适用于研究异常激烈的合成反应而避免爆炸的危险。(3)在微通道反应器中进行合成反应时,需要反应物用量甚微,不但能减少昂贵、有毒、有害反应物的用量,反应过程中产生的环境污染物也极少,实验室基本无污染,是一种环境友好、合成研究新物质的技术平台。(4)在微通道反应器中得到产物的量与近代分析仪器,如GC、GC2MS、HPLC及NMR的进样量相匹配,使近代分析仪器可用于直接在线监测反应进行的程度,大大提高了研究合成路线的速度。(5)可以将各种催化剂固定在芯片微通道中得到高比表面积的微催化床,提高催化效率。(6)在微通道反应器中进行合成反应时,反应物配比、温度、压力、反应时间和流速等反应条件容易控制。反应物在流动过程中发生反应,浓度不断降低,生成物浓度不断提高,副反应较少。(7)在微通道反应器中采用连续流动的方式进行反应,对于反应速度很快的化学反应,可以通过调节反应物流速和微通道的长度,精确控制它们在微通道反应器中的反应时间。(8)随着微加工技术的发展,由微传感器、微热交换器、微混合器、微分离器、微反应单元、微流动装置等组成的集成系统,在合成反应研究中受到越来越多的关注。(9)微流控芯片高通量、大规模、平行性等特点使多个或大量微反应器的集成化与平行操作成为可能,从而提高了合成新物质、筛选新药物的效率,大幅度地降低了研究成本。文章来源:http://www.micromeritics.com.cn/news_view.aspx?id=819
水热反应釜用途说明水热反应釜是为在一定温度、一定压力条件下合成化学物质提供的反应容器。它广泛应用于新材料、能源、环境工程等领域的科研试验中,是高校、科研单位进行科学研究的常用反应设备。http://www.shuirefanyingfu.com/upload/201612/1482388143413679.jpg水热反应釜作为实验室常用的设备,可用于原子吸收光谱及等离子发射等分析中的溶样预处理,也可用于小剂量的合成反应;如利用罐体内强酸或强碱且高温高压密闭的环境来达到快速消解难溶物质的目的。在气相、液相、等离子光谱质谱、原子吸收和原子荧光等化学分析方法中做样品前处理。是测定微量元素及痕量元素时消解样品的得力助手。水热反应釜可在铅、铜、镉、锌、钙、锰、铁、汞等重金属测定中应用,还可作为一种耐高温耐高压防腐高纯的反应容器,以及有机合成、水热合成、晶体生长或样品消解萃取等方面。在样品前处理消解重金属、农残、食品、淤泥、稀土、水产品、有机物等。因此,在石油化工、生物医学、材料科学、地质化学、环境科学、食品科学、商品检验等部门的研究和生产中被广泛使用。水热法是指将反应物放置在水热反应釜中,用水作溶剂,对反应物进行高温加热和加压,使得在正常情况下难溶或者不溶于水的物质溶解并参与反应的方法。水热反应釜制备纳米材料是近年来的研究热点之一。其中水热合成法制备纳米颗粒的方法由于其独特的优良性能被广泛应用。
请问各位大侠: 什么物质水解是吸热或放热反应,而且热量很大,如硝酸铵吸热,等等.[em0910]
之前没用过现在想买个反应釜用于生产中请教一下各位反应釜有隔热层吗?
反应釜控温机组,反应釜冷热一体机,反应釜温度控制机反应釜控温机组综合本公司多年的冷热温控经验,引进国外先进技术,提供全方位的工业温度控制技术和解决方案,在反应釜行业可根据客户要求量身定控制调节反应釜的温度,提高产品的质量产量,环保安全,不需要专人操作.我们有着最专业的团队和最优的产品可供大家选择,反应釜控温机组,反应釜温度控制机的介绍:根据您反应釜的大小,所需要的温度来设计不同功率的油加热器,加热方式为循环加热,所以介质无损耗,多点温度控制机组可订做,温控范围大,温度精确均匀稳定,导热速度快,升降温速度快.能自动精确控温,可快速达到设定温度,设定值和实际值分别显示,进口微电脑双组PID温度控制机,触摸式内储自动演算,精确可靠省电35%以上.反应釜冷热一体机特点如下:1.换热面积大,升温和降温的速率很快,导热油的需求量也比较小.可实现连续升降温,制冷换热器采用高力板式换热器,换热效率高,占地面积小.整个循环是密闭的,高温时没有油雾挥发,导热油不会被氧化和褐化,低温时不会吸收空气中的水汽,延长了导热油的寿命.2.具有自我诊断功能,冷冻机过载保护,高压压力开关,过载继电器,热保护装置等多种安全保障机能,充分保证使用安全.3.温度自适应控制,适应控制系统在控制工艺(如化学反应工艺)的过程中,持续不断的调节PID参数来给予工艺最好的控制温度和响应时间,这种过程是通过有效的多方位的测定温度,温度变化和温度变化的速率来实现的.带有矫正外循环和内循环温度探头PT100的功能.4.精确控制化学反应的速度(选配:一体化机组,实现高温冷凝回流,根据温度控制加料速率,防止反应过快,同时精确控制加料量).5.程序功能系列,非线性和线性的温度跳跃功能,所有程序的每步选项包括控制外循环程序,都由PLC控制器电脑来控制.6.自动诊断和系统的监控功能系列,通过PLC触摸屏控制器,电脑实行监控和显示详细系统信息,可以监控和显示升温速率等所有信息.7.触摸屏控制器;可以选择显示信息,实时图表显示实时的夹套温度和反应釜体内温度,显示实时的变化曲线以及安全信息等.彩色屏幕,详细菜单以及详细自我诊断系统都是可用的,设备可以用触摸屏热键,选码器或者程序号来控制.反应釜控温机组根据反应釜行业的应用特点设计,反应釜温度控制机根据客户要求选择水或者油作为传热介质,水最高温度可达180度,最高温度可达350度.我公司是专业生产反应釜温度控制设备,反应釜加热器,反应釜加热设备,反应釜精密温控设备的厂家.主要产品;反应釜夹套油加热器,反应釜温控机,反应釜恒温机,反应釜冷却机等反应釜行业专用温度控制设备。
水热反应釜内衬可以装满溶液吗?网上说的是60-80%,文献里基本都是填充的80%,多少比较合适?http://www.shuirefanyingfu.com/upload/201611/1478141785154231.jpg这里要提到的是水热反应釜的填充度,水热反应釜的填充度就是指液体的体积占釜的总容积的百分数。水热反应釜的填充量度,一般要求是2/3左右,这是对的水热反应釜本身的密闭性好坏的综合性考虑,还有如果你的水热反应产生气体量大且温度较高条件下,建议2/3左右,如果温度不太高,可以适当增加填充量,最高至80%左右,但不宜超过。注意的是你填充度几次试验要保持一致最好,气压大小相对稳定最好。不同的东西,溶剂的种类和量也不同。首次接触的话,如果没有特殊要求,一般溶剂的量可以考虑控制在50%以下,大于30%。后期可以慢慢摸条件。如果对压力计算,所用溶剂和整个反应比较了解的话,可以算一下溶剂的量与压力、温度等的关系来推导出你做试验需要多少的量。因为一般反应的温度是高于溶液沸点的,所以80%是过高的,因此水热反应釜内衬不能装满溶液做加热实验。
用水热反应釜做过实验后,内衬上面会残留物质,那么这些物质怎么清洗呢?水热反应釜的催化剂不同,清洗方法也不同,要是硅体系的话,可以加点氢氟酸或者碱加热洗涤在用完后;要是硅金属体系的话,那得看它溶解于什么酸,盐酸需要用王水:浓硝酸和浓盐酸三比一比列)。http://www.shuirefanyingfu.com/upload/201612/1482388143413679.jpg实验室常用的水热反应釜清洗方法王水:浓http://www.shuirefanyingfu.com/news/95-cn.html硝酸和浓盐酸三比一比例,用王水清洗如:用高锰酸钾溶于水中,然后加入3-5mL的浓盐酸,放到反应釜中密封好,180度水热反应5-10个小时,洗的非常干净其他水热反应釜的清洗方式1、在实验反应结束后,在水热反应釜内加入 大约 1:5 的 硝酸和水的混合溶液,然后加热到180摄氏度大约 12个小时,这些数据都不是固定的,需要根据你实验反应的具体情况而定,混合溶液的比例不一定是1:5,温度也不一定到180才行,但这个方法有个缺陷,就是使得实验的重复性变差。2、用草酸溶液煮6个小时,160度左右的温度具体看实验情况而定。3、使用氢氟酸或乙醇加热反应清洗,或是其他的强酸!如做磷酸亚铁锂正极材料的,用水热反应釜,反应完后,反应釜内壁程微黄色,怎么洗都洗不掉,用浓硝酸加热洗也洗不掉,怎么办?解决方式:用高锰酸钾溶于水中,然后加入3-5mL的浓盐酸,放到反应釜中密封好,180度水热反应5-10个小时,洗的非常干净~水热反应釜弄黑了怎么清洗用二乙醇胺和水体积比1:1做溶剂,溶质是NiCl2 ,180° 反映12小时,反应釜全黑了,估计是二乙醇胺碳化导致,请问改如何清洗。解决方法:用王水反复泡 可以洗的很干净。
一些更接触实验的学生用水热法做纳米材料,但是对于水热反应釜的安全性充满了怀疑。西安仪贝尔厂家生产的水热反应釜一般有聚四氟乙烯的内衬,或是PPL(对位聚苯)内衬。聚四氟内衬的可以耐温到200℃,而ppl内衬的可以达到300℃。 安全疑问水热反应釜一般厂家只说耐压3MPa,照这么说的话,水热反应釜不可能达到200℃啊,更不可能达到300℃。这是怎么回事呢?对于刚接触这类实验的学生难免会担心压强问题,我们做过在线监测压力变化的水热反应实验,采用的内衬为聚四氟乙烯,如果是纯水的话,在200°大概是1.5到2MPa的压强,若水中还有其他溶质或者溶剂的话就要具体请具体分析了,通常来说压强还会增大,若体系中有氨水过氧化氢的易产生气体的溶剂则更应该小心,压强可能会大过3MPa,此时要考虑降低填充比了,控制在40%到50%吧。没有人担心爆炸问题的,就是因为他们规范操作,实验前要考察好反应体系变化,做到心中有底,不打无准备之仗嘛~总而言之,做什么实验不都是这样嘛,做足准备就不用怕了参考清华李院士的文献,一半乙醇的时候温度100多度都没问题,更别说水了,只要聚四氟没问题,不超过180度,日常使用不用担心安全问题。文章来源: http://www.shuirefanyingfu.com/news/92-cn.html
1.温度滴定理论温度滴定是基于滴定剂(浓度已知)和被滴定物(浓度未知)之间化学反应的温度变化速率而确定滴定过程中被滴定物的终点。因为其理论根据是溶液的温度变化,所以无需知道溶液的绝对温度。用一个简单的含有热敏电阻的探头监测溶液温度,根据曲线上的拐点或弯曲确定终点。1.反应热常压下,在特定系统中所有化学反应的热量变化可以表示为:△H°=△G° + T△S° (1)其中:△H° ——焓变;△G° ——自由能变;△S° ——熵变;T ——开氏温度,K。aA + bB + cC=pP + bB+Q (2)当反应(2)反应完,产生△H的系统焓变,就会表现为系统温度△T的变化,总热量Q与△H、△T的关系分别为:Q =-np×△H (3)Q = Cs×△T (4)其中:np——产物的摩尔数(物质的量);Cs——系统的热容。结合(3)和(4),得到:△T=-△H×np / Cs (5)一般温度变化范围不大时,△H是不随温度变化的值。从方程式(5)可以看出,在绝热系统中,△T就不仅与总的摩尔反应热有关,而且与参加反应的物质的量有关。对式(2),将滴定剂C加入到被滴定物(A和B)中,只要生成产物P分子,就会有温度的变化。加入c mol的滴定剂C,只要系统中存在A分子,就会生成p mol的产物P。反应动力学和自由能变将会使反应立即进行并完成。因此如果以溶液的温度变化对以恒定速率加入的滴定剂体积作图,那么曲线斜率的变化就会显示在哪个点没有产物分子生成,也就是滴定终点。这种滴定方法就是温度滴定。2.终点处平衡常数的重要性反应的自由能也可以和其它反应参数进行关联:△G=-RTlnK (6)其中:R——气体常数,8.3145J/(mol• K);T——开氏温度,K;K——反应平衡常数,可以将式(2)定义为: 在温度滴定中,某反应的K值越大,其温度曲线的二阶导数曲线峰形将会越尖锐、峰高也越高,也就是说终点变化就会越敏锐;如果K值越小,其其温度曲线的二阶导数曲线峰形将会越平滑、峰高也越低,终点变化也越不明显。但是尽管曲线圆滑,还是可以通过近似的数学处理确定终点。3.影响滴定曲线的其它参数在理想条件下,温度的升高或降低都应该有很好的线性关系,但是因为某些原因会偏离线性关系。1)系统热容的变化这主要是因为滴定剂的加入导致液体体积增加,使用高浓度的滴定剂(约是样品溶液中分析物浓度的20-100倍)可以使这种影响最小。如果滴定弱解离物质,就需要减缓滴定速率,以免越过终点。过长的滴定时间可能会使系统的热损失增大。过高的滴定剂浓度可能会使滴定度降低,相对误差增大。因此在所有情况下都应该注意滴定剂的加入速率是一个很重要的参数。2)滴定剂和被滴定物的温差尽管在某些环境下可以通过实验分析确定终点,但是在繁忙的生产过程和品质控制情况下并不常用。在分析实验中滴定剂和被滴定物的温度应该是和当时的环境温度平衡的。3)稀释热滴定剂的稀释通常是滴定剂和样品溶液混合产生稀释热的最大的单一贡献者。4)混合热当滴定剂和被滴定物的溶剂不同时,就会发生这种情况。5)搅拌热部分的搅拌机械作会可转化为热焓,但是这不足以影响终点的确定。6)温度探头的焦耳效应作为温度感应器的热敏电阻是半导体电阻材料,其电阻是温度变化的函数。对通过的小而有效的电流就会产生高电阻,产生的能量转化为热能。但是相对于温度滴定中使用的液体体积,其对体系的温度变化影响可以忽略。4.多组分滴定系统温度滴定提供了许多分析多组分体系中物质的例子,主要有两个标准:首先,在滴定下一组分之前,前一组分必须全部滴定完;第二,反应热必须有足够的差别以产生一个清晰的拐点。电位滴定要求两个平衡常数比(K1/K2)不小于103,也就是说(pK2-pK1)不小于3,但是用温度滴定成功的分析了pKa差值为2甚至更低的多组分物质(Vaughan,1973)。用电位滴定分析工业铝酸盐溶液中的OH-和碳酸盐可能会出现问题,其中使用配体如葡萄糖酸盐络合铝酸盐,1996年Connop认为有必要使用Gran的方法分别分析这两种物质,但是温度滴定没有这个问题(H+和OH-的反应热约为-56.2kJ/mol,H+与碳酸盐的反应热为-14.8 kJ/mol)。用温度滴定分析不同物质不限于酸碱滴定,例如用EDTA做滴定剂可以分析混合物中的钙和镁。用EDTA络合钙是一个放热反应,反应热约为-24kJ/mol,相反EDTA和镁是一个吸热反应(约为+21 kJ/mol)。滴定分析钙的精度为0.003mL,分析镁的精度为0.005mL。
温度滴定理论温度滴定是基于滴定剂(浓度已知)和被滴定物(浓度未知)之间化学反应的温度变化速率而确定滴定过程中被滴定物的终点。因为其理论根据是溶液的温度变化,所以无需知道溶液的绝对温度。用一个简单的含有热敏电阻的探头监测溶液温度,根据曲线上的拐点或弯曲确定终点。1.反应热常压下,在特定系统中所有化学反应的热量变化可以表示为:△H°=△G° + T△S° (1)其中:△H° ——焓变;△G° ——自由能变;△S° ——熵变;T ——开氏温度,K。aA + bB + cC=pP + bB+Q (2)当反应(2)反应完,产生△H的系统焓变,就会表现为系统温度△T的变化,总热量Q与△H、△T的关系分别为:Q =-np×△H (3)Q = Cs×△T (4)其中:np——产物的摩尔数(物质的量);Cs——系统的热容。结合(3)和(4),得到:△T=-△H×np / Cs (5)一般温度变化范围不大时,△H是不随温度变化的值。从方程式(5)可以看出,在绝热系统中,△T就不仅与总的摩尔反应热有关,而且与参加反应的物质的量有关。对式(2),将滴定剂C加入到被滴定物(A和B)中,只要生成产物P分子,就会有温度的变化。加入c mol的滴定剂C,只要系统中存在A分子,就会生成p mol的产物P。反应动力学和自由能变将会使反应立即进行并完成。因此如果以溶液的温度变化对以恒定速率加入的滴定剂体积作图,那么曲线斜率的变化就会显示在哪个点没有产物分子生成,也就是滴定终点。这种滴定方法就是温度滴定。2.终点处平衡常数的重要性反应的自由能也可以和其它反应参数进行关联:△G=-RTlnK (6)其中:R——气体常数,8.3145J/(mol• K);T——开氏温度,K;K——反应平衡常数,可以将式(2)定义为:在温度滴定中,某反应的K值越大,其温度曲线的二阶导数曲线峰形将会越尖锐、峰高也越高,也就是说终点变化就会越敏锐;如果K值越小,其其温度曲线的二阶导数曲线峰形将会越平滑、峰高也越低,终点变化也越不明显。但是尽管曲线圆滑,还是可以通过近似的数学处理确定终点。3. 影响滴定曲线的其它参数在理想条件下,温度的升高或降低都应该有很好的线性关系,但是因为某些原因会偏离线性关系。1)系统热容的变化这主要是因为滴定剂的加入导致液体体积增加,使用高浓度的滴定剂(约是样品溶液中分析物浓度的20-100倍)可以使这种影响最小。如果滴定弱解离物质,就需要减缓滴定速率,以免越过终点。过长的滴定时间可能会使系统的热损失增大。过高的滴定剂浓度可能会使滴定度降低,相对误差增大。因此在所有情况下都应该注意滴定剂的加入速率是一个很重要的参数。2)滴定剂和被滴定物的温差尽管在某些环境下可以通过实验分析确定终点,但是在繁忙的生产过程和品质控制情况下并不常用。在分析实验中滴定剂和被滴定物的温度应该是和当时的环境温度平衡的。3)稀释热滴定剂的稀释通常是滴定剂和样品溶液混合产生稀释热的最大的单一贡献者。4)混合热当滴定剂和被滴定物的溶剂不同时,就会发生这种情况。5)搅拌热部分的搅拌机械作会可转化为热焓,但是这不足以影响终点的确定。6)温度探头的焦耳效应作为温度感应器的热敏电阻是半导体电阻材料,其电阻是温度变化的函数。对通过的小而有效的电流就会产生高电阻,产生的能量转化为热能。但是相对于温度滴定中使用的液体体积,其对体系的温度变化影响可以忽略。4.多组分滴定系统温度滴定提供了许多分析多组分体系中物质的例子,主要有两个标准:首先,在滴定下一组分之前,前一组分必须全部滴定完;第二,反应热必须有足够的差别以产生一个清晰的拐点。电位滴定要求两个平衡常数比(K1/K2)不小于103,也就是说(pK2-pK1)不小于3,但是用温度滴定成功的分析了pKa差值为2甚至更低的多组分物质(Vaughan,1973)。用电位滴定分析工业铝酸盐溶液中的OH-和碳酸盐可能会出现问题,其中使用配体如葡萄糖酸盐络合铝酸盐,1996年Connop认为有必要使用Gran的方法分别分析这两种物质,但是温度滴定没有这个问题(H+和OH-的反应热约为-56.2kJ/mol,H+与碳酸盐的反应热为-14.8 kJ/mol)。用温度滴定分析不同物质不限于酸碱滴定,例如用EDTA做滴定剂可以分析混合物中的钙和镁。用EDTA络合钙是一个放热反应,反应热约为-24kJ/mol,相反EDTA和镁是一个吸热反应(约为+21 kJ/mol)。滴定分析钙的精度为0.003mL,分析镁的精度为0.005mL。
温度滴定理论温度滴定是基于滴定剂(浓度已知)和被滴定物(浓度未知)之间化学反应的温度变化速率而确定滴定过程中被滴定物的终点。因为其理论根据是溶液的温度变化,所以无需知道溶液的绝对温度。用一个简单的含有热敏电阻的探头监测溶液温度,根据曲线上的拐点或弯曲确定终点。1.反应热常压下,在特定系统中所有化学反应的热量变化可以表示为:△H°=△G° + T△S° (1)其中:△H° ——焓变;△G° ——自由能变;△S° ——熵变;T ——开氏温度,K。aA + bB + cC=pP + bB+Q (2)当反应(2)反应完,产生△H的系统焓变,就会表现为系统温度△T的变化,总热量Q与△H、△T的关系分别为:Q =-np×△H (3)Q = Cs×△T (4)其中:np——产物的摩尔数(物质的量);Cs——系统的热容。结合(3)和(4),得到:△T=-△H×np / Cs (5)一般温度变化范围不大时,△H是不随温度变化的值。从方程式(5)可以看出,在绝热系统中,△T就不仅与总的摩尔反应热有关,而且与参加反应的物质的量有关。对式(2),将滴定剂C加入到被滴定物(A和B)中,只要生成产物P分子,就会有温度的变化。加入c mol的滴定剂C,只要系统中存在A分子,就会生成p mol的产物P。反应动力学和自由能变将会使反应立即进行并完成。因此如果以溶液的温度变化对以恒定速率加入的滴定剂体积作图,那么曲线斜率的变化就会显示在哪个点没有产物分子生成,也就是滴定终点。这种滴定方法就是温度滴定。2.终点处平衡常数的重要性反应的自由能也可以和其它反应参数进行关联:△G=-RTlnK (6)其中:R——气体常数,8.3145J/(mol• K);T——开氏温度,K;K——反应平衡常数,可以将式(2)定义为:在温度滴定中,某反应的K值越大,其温度曲线的二阶导数曲线峰形将会越尖锐、峰高也越高,也就是说终点变化就会越敏锐;如果K值越小,其其温度曲线的二阶导数曲线峰形将会越平滑、峰高也越低,终点变化也越不明显。但是尽管曲线圆滑,还是可以通过近似的数学处理确定终点。3. 影响滴定曲线的其它参数在理想条件下,温度的升高或降低都应该有很好的线性关系,但是因为某些原因会偏离线性关系。1)系统热容的变化这主要是因为滴定剂的加入导致液体体积增加,使用高浓度的滴定剂(约是样品溶液中分析物浓度的20-100倍)可以使这种影响最小。如果滴定弱解离物质,就需要减缓滴定速率,以免越过终点。过长的滴定时间可能会使系统的热损失增大。过高的滴定剂浓度可能会使滴定度降低,相对误差增大。因此在所有情况下都应该注意滴定剂的加入速率是一个很重要的参数。2)滴定剂和被滴定物的温差尽管在某些环境下可以通过实验分析确定终点,但是在繁忙的生产过程和品质控制情况下并不常用。在分析实验中滴定剂和被滴定物的温度应该是和当时的环境温度平衡的。3)稀释热滴定剂的稀释通常是滴定剂和样品溶液混合产生稀释热的最大的单一贡献者。4)混合热当滴定剂和被滴定物的溶剂不同时,就会发生这种情况。5)搅拌热部分的搅拌机械作会可转化为热焓,但是这不足以影响终点的确定。6)温度探头的焦耳效应作为温度感应器的热敏电阻是半导体电阻材料,其电阻是温度变化的函数。对通过的小而有效的电流就会产生高电阻,产生的能量转化为热能。但是相对于温度滴定中使用的液体体积,其对体系的温度变化影响可以忽略。4.多组分滴定系统温度滴定提供了许多分析多组分体系中物质的例子,主要有两个标准:首先,在滴定下一组分之前,前一组分必须全部滴定完;第二,反应热必须有足够的差别以产生一个清晰的拐点。电位滴定要求两个平衡常数比(K1/K2)不小于103,也就是说(pK2-pK1)不小于3,但是用温度滴定成功的分析了pKa差值为2甚至更低的多组分物质(Vaughan,1973)。用电位滴定分析工业铝酸盐溶液中的OH-和碳酸盐可能会出现问题,其中使用配体如葡萄糖酸盐络合铝酸盐,1996年Connop认为有必要使用Gran的方法分别分析这两种物质,但是温度滴定没有这个问题(H+和OH-的反应热约为-56.2kJ/mol,H+与碳酸盐的反应热为-14.8 kJ/mol)。用温度滴定分析不同物质不限于酸碱滴定,例如用EDTA做滴定剂可以分析混合物中的钙和镁。用EDTA络合钙是一个放热反应,反应热约为-24kJ/mol,相反EDTA和镁是一个吸热反应(约为+21 kJ/mol)。滴定分析钙的精度为0.003mL,分析镁的精度为0.005mL。
水热反应釜加热完成后,如果从烘箱中取出后让它自然冷却,那会非常缓慢,为什么不可以用凉水降温呢?如果反应釜温度很高的话,一般要是200oC左右的话,水冷是没问题的,但是小编建议最好不要这么做,否则你的内胆很难打开,而且对仪器本身寿命有影响。这样做虽然没有任何危险。但会对不钢釜有影响,一般自然降温俩个小时即可。http://www.shuirefanyingfu.com/upload/201703/1489024816964842.jpg水热反应釜,又名微型反应器,与其它反应釜相比其造价低,结构简单,采用不锈钢做承压元件,内部衬有聚四氟乙烯内胆喝PPL内衬,适用于做各种强酸、强碱等介质的反应,高洁净无任何腐蚀污染。可用于相同组分的介质在不同条件下的反应情况进行测试或用于不同组分的介质在相同条件下的反应情况进行测试,常见容积分为:25ML 、50ML 、100ML 、200ML、500ML等规格,
如题。比如说 用DSC测反应热, 同一样品需要做3个重复试验然后取平均值吗?大家都是怎么判定两个样品有显著差异的? 谢谢!
请教一下各位:铝热反应实验中氯酸钾的作用是什么?为什么要加入氯酸钾?而反应方程式中又没有体现出来。
1.温度滴定理论温度滴定是基于滴定剂(浓度已知)和被滴定物(浓度未知)之间化学反应的温度变化速率而确定滴定过程中被滴定物的终点。因为其理论根据是溶液的温度变化,所以无需知道溶液的绝对温度。用一个简单的含有热敏电阻的探头监测溶液温度,根据曲线上的拐点或弯曲确定终点。1.反应热常压下,在特定系统中所有化学反应的热量变化可以表示为:△H°=△G° + T△S° (1)其中:△H° ——焓变;△G° ——自由能变;△S° ——熵变;T ——开氏温度,K。aA + bB + cC=pP + bB+Q (2)当反应(2)反应完,产生△H的系统焓变,就会表现为系统温度△T的变化,总热量Q与△H、△T的关系分别为:Q =-np×△H (3)Q = Cs×△T (4)其中:np——产物的摩尔数(物质的量);Cs——系统的热容。结合(3)和(4),得到:△T=-△H×np / Cs (5)一般温度变化范围不大时,△H是不随温度变化的值。从方程式(5)可以看出,在绝热系统中,△T就不仅与总的摩尔反应热有关,而且与参加反应的物质的量有关。对式(2),将滴定剂C加入到被滴定物(A和B)中,只要生成产物P分子,就会有温度的变化。加入c mol的滴定剂C,只要系统中存在A分子,就会生成p mol的产物P。反应动力学和自由能变将会使反应立即进行并完成。因此如果以溶液的温度变化对以恒定速率加入的滴定剂体积作图,那么曲线斜率的变化就会显示在哪个点没有产物分子生成,也就是滴定终点。这种滴定方法就是温度滴定。2.终点处平衡常数的重要性反应的自由能也可以和其它反应参数进行关联:△G=-RTlnK (6)其中:R——气体常数,8.3145J/(mol• K);T——开氏温度,K;K——反应平衡常数,可以将式(2)定义为: 在温度滴定中,某反应的K值越大,其温度曲线的二阶导数曲线峰形将会越尖锐、峰高也越高,也就是说终点变化就会越敏锐;如果K值越小,其其温度曲线的二阶导数曲线峰形将会越平滑、峰高也越低,终点变化也越不明显。但是尽管曲线圆滑,还是可以通过近似的数学处理确定终点。3.影响滴定曲线的其它参数在理想条件下,温度的升高或降低都应该有很好的线性关系,但是因为某些原因会偏离线性关系。1)系统热容的变化这主要是因为滴定剂的加入导致液体体积增加,使用高浓度的滴定剂(约是样品溶液中分析物浓度的20-100倍)可以使这种影响最小。如果滴定弱解离物质,就需要减缓滴定速率,以免越过终点。过长的滴定时间可能会使系统的热损失增大。过高的滴定剂浓度可能会使滴定度降低,相对误差增大。因此在所有情况下都应该注意滴定剂的加入速率是一个很重要的参数。2)滴定剂和被滴定物的温差尽管在某些环境下可以通过实验分析确定终点,但是在繁忙的生产过程和品质控制情况下并不常用。在分析实验中滴定剂和被滴定物的温度应该是和当时的环境温度平衡的。3)稀释热滴定剂的稀释通常是滴定剂和样品溶液混合产生稀释热的最大的单一贡献者。4)混合热当滴定剂和被滴定物的溶剂不同时,就会发生这种情况。5)搅拌热部分的搅拌机械作会可转化为热焓,但是这不足以影响终点的确定。6)温度探头的焦耳效应作为温度感应器的热敏电阻是半导体电阻材料,其电阻是温度变化的函数。对通过的小而有效的电流就会产生高电阻,产生的能量转化为热能。但是相对于温度滴定中使用的液体体积,其对体系的温度变化影响可以忽略。4.多组分滴定系统温度滴定提供了许多分析多组分体系中物质的例子,主要有两个标准:首先,在滴定下一组分之前,前一组分必须全部滴定完;第二,反应热必须有足够的差别以产生一个清晰的拐点。电位滴定要求两个平衡常数比(K1/K2)不小于103,也就是说(pK2-pK1)不小于3,但是用温度滴定成功的分析了pKa差值为2甚至更低的多组分物质(Vaughan,1973)。用电位滴定分析工业铝酸盐溶液中的OH-和碳酸盐可能会出现问题,其中使用配体如葡萄糖酸盐络合铝酸盐,1996年Connop认为有必要使用Gran的方法分别分析这两种物质,但是温度滴定没有这个问题(H+和OH-的反应热约为-56.2kJ/mol,H+与碳酸盐的反应热为-14.8 kJ/mol)。用温度滴定分析不同物质不限于酸碱滴定,例如用EDTA做滴定剂可以分析混合物中的钙和镁。用EDTA络合钙是一个放热反应,反应热约为-24kJ/mol,相反EDTA和镁是一个吸热反应(约为+21 kJ/mol)。滴定分析钙的精度为0.003mL,分析镁的精度为0.005mL。
垃圾热值:是单位量(克或千克)生活垃圾完全氧化时的反应热。
可以用甘油做为溶剂热反应的溶剂吗?我想用甘油作为溶剂,在水热釜中进行溶剂热反应,温度高于300度,是不是很危险,哪位虫虫做过相关的实验,给点意见啊,谢谢!! [em0802]