本人最近测定枸杞多糖含量时,所用测定方法均为2005年版药典枸杞项下,结果出现如下问题:测定枸杞提取物(注:厂家未提供提取方法)枸杞多糖含量时,直接称样水溶解然后测定,结果所测提取物含量高达95%;按药典方法进行前处理,测出值也高达70%;而厂家提供的是50%。另外,我们公司有一种产品,45度白酒,其中添加了葛根黄酮提取物和这种枸杞提取物,结果所测枸杞多糖含量也与理论添加量有很大差别。请问:像我这种情况,在测定枸杞多糖时,需要像药典中那样前处理吗?有哪些更好的方法?多糖测定时葛根黄酮会不会影响?测定提取物和测定白酒中多糖含量时方法是否可以一致?不行的话又分别该怎样测定? 恳请问各位专家朋友指点迷津!谢谢![/color][/color][/color]
本人最近测定枸杞多糖含量时,所用测定方法均为2005年版药典枸杞项下,结果出现如下问题:测定枸杞提取物(注:厂家未提供提取方法)枸杞多糖含量时,直接称样水溶解然后测定,结果所测提取物含量高达95%;按药典方法进行前处理,测出值也高达70%;而厂家提供的是50%。另外,我们公司有一种产品,45度白酒,其中添加了葛根黄酮提取物和这种枸杞提取物,结果所测枸杞多糖含量也与理论添加量有很大差别。请问:像我这种情况,在测定枸杞多糖时,需要像药典中那样前处理吗?有哪些更好的方法?多糖测定时葛根黄酮会不会影响?测定提取物和测定白酒中多糖含量时方法是否可以一致?不行的话又分别该怎样测定? 恳请问各位专家朋友指点迷津!谢谢!
采用回流提取的方法,并结合大孔树脂吸附分离,富集并浓缩得到总黄酮和总多糖,用分光光度法测定总黄酮和总多糖含量,通过大孔吸附树脂分别得到含量为105.2%的总多糖及含量为5.3%的总黄酮,则大枣中总黄酮含量为0.11%,总多糖含量为16.43%。运用大孔吸附树脂可以同步提取大枣中的总多糖和总黄酮,对总多糖提取率高,有利于大枣的综合利用,为其质量控制提供参考。
本人最近测定枸杞多糖含量时,所用测定方法均为2005年版药典枸杞项下,结果出现如下问题:测定枸杞提取物(注:厂家未提供提取方法)枸杞多糖含量时,直接称样水溶解然后测定,结果所测提取物含量高达95%;按药典方法进行前处理,测出值也高达70%;而厂家提供的是50%。另外,我们公司有一种产品,45度白酒,其中添加了葛根黄酮提取物和这种枸杞提取物,结果所测枸杞多糖含量也与理论添加量有很大差别。请问:像我这种情况,在测定枸杞多糖时,需要像药典中那样前处理吗?有哪些更好的方法?多糖测定时葛根黄酮会不会影响?测定提取物和测定白酒中多糖含量时方法是否可以一致?不行的话又分别该怎样测定? 恳请问各位专家朋友指点迷津!谢谢!
苯酚-硫酸法是一种常用的检测粗多糖含量的方法,其原理是苯酚-硫酸试剂可与游离的寡糖、多糖中的己糖、糖醛酸起显色反应,在480-490 nm处有最大吸收值,吸收值与糖含量呈线性关系。此法是先用标准品多糖制作标准曲线后,再通过多糖的显色反应测定吸光度,然后根据其在曲线上的位置推算出多糖的浓度从而推算其含量。此法操作简单、快速、灵敏、重复性好,对每种多糖仅需制作一条标准曲线[1]。目前大家研究较多的、生物活性较高的一些真菌多糖,如香菇多糖、灵芝多糖、姬松茸多糖、猴头菇多糖、灰树花多糖等[2],在结构上大多是以β-(1→3)、β-(1→4)或β-(1→6)糖苷键连接的葡聚糖,另外,分子量也一般分布在十几万到几十万之间。因此,由北京卫生防疫站建立,经中国预防科学院营养与食品卫生研究所验证的《粗多糖含量的测定方法》中建议使用50万分子量的葡聚糖作为标准品[3]。为行业内粗多糖含量的测定统一了标准,使各企业之间多糖类产品更具有可比性。燕麦β-葡聚糖是一种β-(1→3)-(1→4)键接的线性葡聚糖,在结构、粘度等其他物理性质上与常见的植物和真菌多糖很相似,适合作为植物、真菌来源多糖含量测定的标准品。但由于多糖纯化困难,市面上不少葡聚糖纯度较低,不适合作为标准品。下面,我们来比较两种不同纯度的燕麦β-葡聚糖产品作为多糖标准品的区别。1 材料与方法1.1 实验材料高纯度燕麦β-葡聚糖PS-Con-Ⅰ由武汉百特纯大分子科技有限公司提供,纯度大于97%(其中,另外3%主要是结合水),低纯度燕麦β-葡聚糖由某食品研究所提供,纯度约50%,苯酚、浓硫酸均为化学纯。1.2 实验方法样品溶解:高纯度燕麦β-葡聚糖经70℃水浴,15min后完全溶解。低纯度燕麦β-葡聚糖70℃水浴,30min后仍有不溶物,升高溶解温度至90℃后继续溶解30min,仍有少量不溶物,过滤。溶液配制:配制0.1mg/ml葡聚糖标准溶液,50mg/ml苯酚溶液备用。标准曲线的制作:精密吸取葡聚糖标准液0.10,0.40, 0.80,1.20,1.60,2.00ml(分别相当于葡聚糖0.01,0.04,0.08,0.12,0.16,0.20mg),补充水至2.0mL,加入苯酚溶液1.0ml,混匀,再加入浓硫酸5ml,混匀,沸水浴2分钟,混匀,冷却后用分光光度计在485nm波长处以试剂空白溶液为参比,测定吸光度值(A),以A为横坐标,葡聚糖含量C为纵坐标绘制标准曲线。2 结果与分析2.1 样品溶解高纯度燕麦β-葡聚糖溶解速度较快,溶液澄清透明,说明此产品溶解性良好。低纯度燕麦β-葡聚糖难以溶解,且溶解1h后仍有不溶物存在,说明此产品溶解性差,杂质较多。 2.2 标准曲线下表为两种标准品分别配制不同葡聚糖浓度(含量)反应后得到的吸光值:葡聚糖含量(mg)0.010.040.080.120.162.00高纯度标样吸光值0.0530.0800.2000.2620.3530.450低纯度标样吸光值0.0010.0550.1130.1730.2400.320通过数据处理,得到标准曲线如下:高纯度燕麦β-葡聚糖 C=0.4657A-0.0068 (R=0.9955)低纯度燕麦β-葡聚糖 C=0.609A+0.0101(R=0.9985)比较这两个标准曲线发现,当待测样品吸光值一定,使用低纯度葡聚糖作为标准品得到的标准曲线计算葡聚糖含量值时,明显高于高纯度标准品。究其原因,低纯度葡聚糖所含杂质较多,在作为标准品时,部分杂质不能溶解,却计入了标准品葡聚糖总量,因此,使得结果偏高。另外,即使溶解的物质中,也有可能存在部分不能参加反应的蛋白等杂质,同样会造成结果偏高。由以上数据和分析可以得出,测定粗多糖含量不能使用低纯度葡聚糖作为标准品,应尽量选用高纯度葡聚糖标准品,按照国家建议方法和行业标准进行检测,这样才能保证各企业多糖系列产品在含量和纯度上的可比性,有利于规范企业行为和保健品市场。参考文献[1] 胡居吾,范青生,肖小年. 粗多糖测定方法的研究. 江西食品工业. 2005, 1[2] 李明元. 真菌粗多糖测定方法的研究. 食品研究与开发. 2007, 5[3] 粗多糖的测定方法. 北京卫生防疫站建立,经中国预防科学院营养与食品卫生研究所验证. 食品伙伴网[em0805]
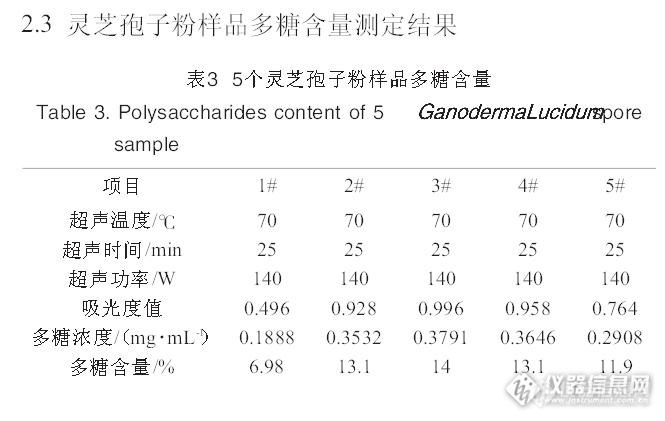
中国药典2010年版一部关于灵芝药材的多糖含量测定问题偶然的机会,有个样品是灵芝药材,做全检,其中含量测定是做灵芝的多糖含量.多糖含量做的多了,但都是保健食品的检验项目,还有做枸杞子的多糖.这个灵芝的多糖没做过.按常理这个灵芝多糖该很顺利就做出来的.可是事与愿违.按药典方法做出来的结果大跌眼镜,多糖含量结果是0.之后就是找原因,先找个人操作问题,步骤没错,顺序也没错,试剂也没加错.那操作排除了.又去药店买了整个的灵芝回来作参照,结果也是大跌眼镜,一样测出来的结果是0。问题来了。细细观察过程,原来在醇沉的那步骤里有异常,送检的灵芝和买回来的灵芝都没有沉淀产生,溶液还是透明的。难道是多糖量少的原因,于是又按药典的量称了1mg葡聚糖对照品用2ml水溶解后,再醇沉,是阳性反应啊,有乳白色的浑浊产生(沉淀)。http://ng1.17img.cn/bbsfiles/images/2013/10/201310171824_471607_1621232_3.jpg后来又拿了黄芪药材作参照(黄芪含有大量的黄芪多糖),在醇沉的那步骤里也是有乳白色的浑浊产生啊(沉淀)。到这里,该推断出问题该出在样品上了。后来又查了一下文献,有文献说到灵芝饱子粉含有的多糖含量大约为10%左右。http://ng1.17img.cn/bbsfiles/images/2013/10/201310171826_471610_1621232_3.jpg最后,我又把送检灵芝和买来的灵芝做了薄层鉴别,薄层是与对照药材一样有荧光斑点的哦。到这里,想到一个原因,现在灵芝饱子粉热销,很值钱,很多的种植户都是待灵芝开了后收集了饱子粉才会采摘整个的灵芝子实体,图经济效应最大化。所以以前我们还可以买到子实体(带有泥灰一样的),现在的买到子实体都是非常的干净,干净到发亮反光(哈哈,有点夸张吧)。我是这样想的,为什么这次送检的灵芝和药店买回来的灵芝做不出多糖呢,问题在于饱子粉上,饱子粉含多糖达到10%,而子实体基本是木头(纤维),子实体的多糖该很低的,子实体开过收集了饱子粉以后,剩下的没有孢子的子实体的多糖数值肯定没多少了。做不出来也难怪了。所以,在修定药材标准时,特别是整株植物药材,由几个不同的部位组成的,有花有果有茎有叶有根的,就更复杂了。一定要弄清楚目标物的来源,现有的商人都是追逐利润最大化的。
苯酚-硫酸法是一种常用的检测粗多糖含量的方法,其原理是苯酚-硫酸试剂可与游离的寡糖、多糖中的己糖、糖醛酸起显色反应,在480-490 nm处有最大吸收值,吸收值与糖含量呈线性关系。此法是先用标准品多糖制作标准曲线后,再通过多糖的显色反应测定吸光度,然后根据其在曲线上的位置推算出多糖的浓度从而推算其含量。此法操作简单、快速、灵敏、重复性好,对每种多糖仅需制作一条标准曲线[1]。目前大家研究较多的、生物活性较高的一些真菌多糖,如香菇多糖、灵芝多糖、姬松茸多糖、猴头菇多糖、灰树花多糖等[2],在结构上大多是以β-(1→3)、β-(1→4)或β-(1→6)糖苷键连接的葡聚糖,另外,分子量也一般分布在十几万到几十万之间。因此,由北京卫生防疫站建立,经中国预防科学院营养与食品卫生研究所验证的《粗多糖含量的测定方法》中建议使用50万分子量的葡聚糖作为标准品[3]。为行业内粗多糖含量的测定统一了标准,使各企业之间多糖类产品更具有可比性。燕麦β-葡聚糖是一种β-(1→3)-(1→4)键接的线性葡聚糖,在结构、粘度等其他物理性质上与常见的植物和真菌多糖很相似,适合作为植物、真菌来源多糖含量测定的标准品。但由于多糖纯化困难,市面上不少葡聚糖纯度较低,不适合作为标准品。下面,我们来比较两种不同纯度的燕麦β-葡聚糖产品作为多糖标准品的区别。1 材料与方法1.1 实验材料高纯度燕麦β-葡聚糖PS-Con-Ⅰ由武汉百特纯大分子科技有限公司提供,纯度大于97%(其中,另外3%主要是结合水),低纯度燕麦β-葡聚糖由某食品研究所提供,纯度约50%,苯酚、浓硫酸均为化学纯。1.2 实验方法样品溶解:高纯度燕麦β-葡聚糖经70℃水浴,15min后完全溶解。低纯度燕麦β-葡聚糖70℃水浴,30min后仍有不溶物,升高溶解温度至90℃后继续溶解30min,仍有少量不溶物,过滤。溶液配制:配制0.1mg/ml葡聚糖标准溶液,50mg/ml苯酚溶液备用。标准曲线的制作:精密吸取葡聚糖标准液0.10,0.40, 0.80,1.20,1.60,2.00ml(分别相当于葡聚糖0.01,0.04,0.08,0.12,0.16,0.20mg),补充水至2.0mL,加入苯酚溶液1.0ml,混匀,再加入浓硫酸5ml,混匀,沸水浴2分钟,混匀,冷却后用分光光度计在485nm波长处以试剂空白溶液为参比,测定吸光度值(A),以A为横坐标,葡聚糖含量C为纵坐标绘制标准曲线。2 结果与分析2.1 样品溶解高纯度燕麦β-葡聚糖溶解速度较快,溶液澄清透明,说明此产品溶解性良好。低纯度燕麦β-葡聚糖难以溶解,且溶解1h后仍有不溶物存在,说明此产品溶解性差,杂质较多。 2.2 标准曲线下表为两种标准品分别配制不同葡聚糖浓度(含量)反应后得到的吸光值:葡聚糖含量(mg)0.010.040.080.120.162.00高纯度标样吸光值0.0530.0800.2000.2620.3530.450低纯度标样吸光值0.0010.0550.1130.1730.2400.320通过数据处理,得到标准曲线如下:高纯度燕麦β-葡聚糖 C=0.4657A-0.0068 (R=0.9955)低纯度燕麦β-葡聚糖 C=0.609A+0.0101(R=0.9985)比较这两个标准曲线发现,当待测样品吸光值一定,使用低纯度葡聚糖作为标准品得到的标准曲线计算葡聚糖含量值时,明显高于高纯度标准品。究其原因,低纯度葡聚糖所含杂质较多,在作为标准品时,部分杂质不能溶解,却计入了标准品葡聚糖总量,因此,使得结果偏高。另外,即使溶解的物质中,也有可能存在部分不能参加反应的蛋白等杂质,同样会造成结果偏高。由以上数据和分析可以得出,测定粗多糖含量不能使用低纯度葡聚糖作为标准品,应尽量选用高纯度葡聚糖标准品,按照国家建议方法和行业标准进行检测,这样才能保证各企业多糖系列产品在含量和纯度上的可比性,有利于规范企业行为和保健品市场。参考文献[1] 胡居吾,范青生,肖小年. 粗多糖测定方法的研究. 江西食品工业. 2005, 1[2] 李明元. 真菌粗多糖测定方法的研究. 食品研究与开发. 2007, 5[3] 粗多糖的测定方法. 北京卫生防疫站建立,经中国预防科学院营养与食品卫生研究所验证. 食品伙伴网

[align=center]保健品中粗多糖含量的测定[/align]本文研究了苯酚-硫酸法检测不同基质的保健品中粗多糖的含量,论述了不同基质的前处理方法和经验。1 前言市场上常见的保健品多种多样,胶囊、口服液、药片等等。多糖含量作为保健品中的有效成分之一,越来越引起人们的关注。从药理学上讲,多糖具有抗肿瘤、抗病毒、增强免疫力、抗氧化、抗心血管疾病等。因为具有诸多功效,许多保健品生产公司也开发越来越多的含多糖保健品,通过在保健品中添加含有多糖的中药材或者海洋生物,从而使该保健品具有较高的多糖含量,增强其功效。不仅在胶囊、口服液等常规的保健品中添加含有多糖的成分,甚至在一些咖啡、饮料、食品中也添加含有多糖的组分,使其成为功能性的产品。多糖的含量对其功效的发挥至关重要,那么怎么准确、有效地检测出保健品中多糖的含量是一个重要的环节。保健品由于种类繁多,基质复杂,找到一种简单、有效的检测方法,能够检测出各种基质的保健品中多糖的含量具有重要的意义。本实验中采用了常见的苯酚-硫酸法检测保健品中粗多糖含量,选用乙醇提取以除去单糖、低聚糖、甙类及生物碱等干扰成分,然后用去离子水提取其中所含的多糖类成分。多糖在硫酸作用下,水解成单糖,并迅速生成糖醛衍生物与苯酚综合成有色化合物,用分光光度法测定其多糖含量。2 实验部分2.1 试剂95%乙醇 葡萄糖:优级纯;葡萄糖标准液:精确称取105℃干燥恒重的葡萄糖100 mg,置100 ml容量瓶中,加蒸馏水溶液解并稀释至刻度(可加几滴甲苯或几粒苯甲酸防腐)。此标准溶液1.00 ml含葡萄糖1.00 mg,储存于冰箱冷藏;苯酚;苯酚液:称取优级纯苯酚10.0 g,加水150 g ,置棕色瓶中备用,储存于冰箱;浓硫酸。2.2 仪器分光光度计。2.3 分析步骤2.3.1 样品预处理(1) 口服液等液体样品准确移取2.00~10.00 mL液体口服液试样,置于250 mL圆底烧瓶中,加入9倍体积的95%乙醇,混匀,静置1 h,回流提取1 h,趁热过滤,残渣用95%乙醇5 ml洗涤三次。将残渣连同滤纸置于烧瓶中,加蒸馏水50 mL,在60℃水浴中加热提取30 min,趁热过滤,残渣用5 mL热水洗涤三次,洗液并入滤液,放冷后移至100 mL容量瓶中,稀释至刻度,备用。(2)内容物为膏状的胶囊样品或者膏状类样品准确称取0.50~1.00 g膏状内容物或膏状样品,倘若其中含有油脂类辅料,加入乙醚或者石油醚脱脂,离心,弃去乙醚或者石油醚层。再用一定体积的水溶解,转移至250 mL圆底烧瓶中,加入9倍体积的95%乙醇,混匀,静置1 h,回流提取1 h,趁热过滤,残渣用95%乙醇5 ml洗涤三次。将残渣连同滤纸置于烧瓶中,加蒸馏水50 mL,在60℃水浴中加热提取30 min,趁热过滤,残渣用5 mL热水洗涤三次,洗液并入滤液,放冷后移至100 mL容量瓶中,稀释至刻度,备用。(3)内容物为粉状的胶囊样品或者粉状片剂、咖啡等准确称取0.10~0.50 g均质后的粉状样品,倘若其中含有脂肪类辅料,先加入一定体积的水,溶解粉状样品,再加入乙醚或者石油醚脱脂,离心,弃去乙醚或者石油醚层。将水层转移至250 mL圆底烧瓶中,加入9倍体积的95%乙醇,混匀,静置1 h,回流提取1 h,趁热过滤,残渣用95%乙醇5 ml洗涤三次。将残渣连同滤纸置于烧瓶中,加蒸馏水50 mL,在60℃水浴中加热提取30 min,趁热过滤,残渣用5 mL热水洗涤三次,洗液并入滤液,放冷后移至100 mL容量瓶中,稀释至刻度,备用。2.3.2 标准曲线的制备吸取葡萄糖标准液0.25 mL、0.50 mL、1.00 mL、1.50 mL、2.00 mL、2.50 mL,分别置于50 mL容量瓶中,加水定容。吸取上述溶液各2.00 mL,再加苯酚液1.00 mL,涡旋混合均匀,迅速沿管壁加入浓硫酸5.00 mL,摇晃后涡旋混合,放置5 min,置沸水浴中加热15 min,取出后冷却至室温,于490 nm处以水代替样品作参比测吸光度,绘制标准曲线。2.3.3 样品中多糖含量测定吸取2.00 mL样品液,置于10 ml容量瓶中,加水定容。吸取2.00 mL上述溶液,按标准曲线制备项下方法测定吸光度。另以2.00 mL水,同上操作做空白。查标准曲线得样品液中葡萄糖含量。2.3.4 液体样品分析结果的计算计算液体样品中酸性多糖的含量按式(1)或者(2)计算,分别以mg/mL或者mg/g表示。[img=,503,114]https://ng1.17img.cn/bbsfiles/images/2024/03/202403181709449978_4859_3246897_3.png[/img][sub] [/sub] 式中: X—保健品中酸性多糖含量(以葡萄糖计), mg/g或者mg/mL表示;A—从浓度-吸光度曲线上查得样品溶液的葡萄糖浓度,μg;B—从浓度-吸光度曲线上查得空白溶液的葡萄糖浓度,μg;V[sub]1[/sub]—多糖溶液总体积,mL,如按本方法为100 mL;V[sub]2[/sub]—移取多糖溶液的初始体积,mL,如按本方法为2 mL V[sub]3[/sub]—待测多糖浓度溶液的总体积,mL,如按本方法为10 mL;V[sub]4[/sub]—待测多糖溶液的移取体积,mL,如按本方法为2 mL m—保健品的称取质量,g;V[sub]0[/sub]—保健品的测试体积,mL;如两次测定符合允许差时,取两次测定结果的算术平均值作为结果,报告结果取三位有效数字。2.3.5 允许差同一样品的两次测定值之差不得超过两次测定平均值的10%。2.3.6 结果与分析(1)含油脂类样品脱脂与否的影响含有油脂类的保健品,脱脂前后采用上述方法进行酸性多糖含量测定时,多糖含量有一定的差别,未脱脂的样品进行多糖含量测定时,过滤过程十分缓慢,耗时长,多糖含量数据经常不平行,而且数值偏高。[align=center][img=,300,307]http://ng1.17img.cn/bbsfiles/images/2017/08/201708230846_01_3246897_3.jpg[/img][/align][align=center]图1 乙醚脱脂[/align]样品经过乙醚脱脂后有明显的油脂层。[align=center][img=,300,296]http://ng1.17img.cn/bbsfiles/images/2017/08/201708230846_02_3246897_3.jpg[/img][/align][align=center]图2 回流后的未脱脂样品[/align][align=center][img=,300,302]http://ng1.17img.cn/bbsfiles/images/2017/08/201708230847_01_3246897_3.jpg[/img][/align][align=center]图3 回流后的脱脂样品[/align]通过比较图2和图3,脱脂后的样品溶液更加澄清,无论是过滤还是洗涤,反应更快速,洗涤效果也更好。相反,未脱脂的样品,整个容器壁上都黏附着脂肪、油脂层,即使离心后过滤,过滤速率也很差,滤液也很浑浊,如下图4所示。[align=center][img=,300,268]http://ng1.17img.cn/bbsfiles/images/2017/08/201708230847_02_3246897_3.jpg[/img][/align][align=center]图4 脱脂前后滤液的比较[/align][align=left]没有脱脂的样品,油脂层包裹着含有单糖或者寡糖的乙醇溶液,不容易被乙醇洗涤干净,这部分残留的单糖或者寡糖导致结果偏高。因此,对相应的含油脂保健品提前进行脱脂后再检测多糖,不仅能减少操作的时间,还能获得更为准确的结果。 [/align][align=left](2)醇沉时间的影响[/align][align=left]对以含有大豆油辅料的胶囊内容物进行脱脂后沉淀粗多糖,对比了加入9倍95%乙醇后立即回流提取多糖和加入9倍95%乙醇后室温下静置1 h再回流提取多糖,结果显示,加入乙醇后立即回流提取多糖与静置1h后再回流检测出的多糖含量分别为41.69 mg/g、48.08mg/g。可以看出,室温下醇沉时间的增加可以使更多的粗多糖醇沉完全,检测含量增高。[/align][align=left](3) 苯酚硫酸法操作方法的影响[/align][align=left]苯酚硫酸法检测粗多糖含量最为常见,操作简单,适用于常规检测。在实验过程中发现,无论苯酚和浓硫酸的加入比例是1:5还是1:10,苯酚的体积分数是5%还是6%,在进行加入时最好是一个样品加完苯酚,混匀后,立即沿管壁加入浓硫酸,混匀后,再加另一个样品的苯酚和浓硫酸,这样显色更稳定。实验中发现,倘若对所有样品全加完苯酚混匀后,再统一加浓硫酸,显色及不稳定,标准曲线甚至不成线性。苯酚易挥发,长时间与空气接触也容易被氧化,造成结果不稳定。[/align][align=center][img=,300,287]http://ng1.17img.cn/bbsfiles/images/2017/08/201708230848_01_3246897_3.jpg[/img][/align][align=center]图 5 苯酚-硫酸法检测多糖含量[/align][align=left]图5为苯酚硫酸法侧多糖含量的标准曲线和样品,采用了单个样品加完苯酚和浓硫酸后再加另一个样品的苯酚好浓硫酸,显色稳定有规律,经过分光光度计检测,线性良好,样品数据平行,能够有效避免苯酚-硫酸法重现性差这一缺点。[/align]3. 结论采用苯酚-硫酸法检测保健品中粗多糖含量时,针对各种基质进行相应的脱脂操作、增加回流前的醇沉时间、进行显色反应时加入苯酚后混匀立即加入浓硫酸,能够使检测的数据更可靠、稳定。
HPGPC法测多糖含量时,其分离机理是什么?
哪位有NY/T 1676—2008《食用菌中粗多糖含量的测定》标准?能发上来吗?谢了!
[size=5][b]简介[/b][/size] 苯酚-硫酸法是利用多糖在硫酸的作用下先水解成单糖,并迅速脱水生成糖醛衍生物,然后与苯酚生成橙黄色化合物。再以比色法测定。[size=5][b]原理[/b][/size] 多糖在硫酸的作用下先水解成单糖,并迅速脱水生成糖醛衍生物,然后与苯酚生成橙黄色化合物。再以比色法测定。[size=5][b]试剂[/b][/size] 1. 浓硫酸:分析纯,95.5% 2. 80%苯酚:80克苯酚(分析纯重蒸馏试剂)加20克水使之溶解,可置冰箱中避光长期储存。 3. 6%苯酚:临用前以80%苯酚配制。([b]每次测定均需现配[/b]) 4. 标准葡聚糖(Dextran,瑞典Pharmacia),或分析纯葡萄糖。 5. 15%三氯乙酸(15%TCA):15克TCA加85克水使之溶解,可置冰箱中长期储存。 6. 5%三氯乙酸(5%TCA):25克TCA加475克水使之溶解,可置冰箱中长期储存。 7. 6mol/L 氢氧化钠:120克分析纯氢氧化钠溶于500ml水。 8. 6mol/L 盐酸[size=5][b]操作[/b][/size] 1.制作标准曲线:准确称取标准葡聚糖(或葡萄糖)20mg于500ml容量瓶中,加水至刻度,分别吸取0.4、0.6、0.8、1.0、1.2、1.4、1.6及1.8ml,各以蒸馏水补至2.0ml,然后加入6%苯酚1.0ml及浓硫酸5.0ml,摇匀冷却,室温放置20分钟以后于490nm测光密度,以2.0ml水按同样显色操作为空白,横坐标为多糖微克数,纵坐标为光密度值,得标准曲线。 2.样品含量测定: ①取样品1克(湿样)加1ml 15%TCA溶液研磨,再加少许5%TCA溶液研磨,倒上清液于10毫升离心管中,再加少许5%TCA溶液研磨,倒上清液,重复3次。最后一次将残渣一起到入离心管。[b]注意:总的溶液不要超出10毫升。[/b](既不要超出离心管的容量)。 ②离心,转速3000转/分钟,共三次。第一次15分钟,取上清液。后两次各5分钟取上清液到25毫升锥形比色管中。最后滤液保持18毫升左右。([b]测肝胰腺样品时,每次取上清液时应过滤。因为其脂肪含量大容易夹带残渣。[/b]) ③水浴,在向比色管中加入2毫升6mol/L 盐酸之后摇匀,在96℃水浴锅中水浴2小时。 ④定容取样。水浴后,用流水冷却后加入2毫升6mol/L氢氧化钠摇匀。定容至25毫升的容量瓶中。吸取0.2ml的样品液,以蒸馏补至2.0ml,然后加入6%苯酚1.0ml及浓硫酸5.0ml,摇匀冷却室温放置20分钟以后于490nm测光密度。每次测定取双样对照。以标准曲线计算多糖含量。[size=5][b]注意[/b][/size][b][b](1)此法简单、快速、灵敏、重复性好,对每种糖仅制作一条标准曲线,颜色持久。 (2)制作标准线宜用相应的标准多糖,如用葡萄糖,应以校正系数0.9校正μg数。 (3)对杂多糖,分析结果可根据各单糖的组成比及主要组分单糖的标准曲线的校正系数加以校正计算。 (4)测定时根据光密度值确定取样的量。光密度值最好在0.1——0.3之间。比如:小于0.1之下可以考虑取样品时取2克,仍取0.2ml样品液,如大于0.3可以减半取0.1ml的样品液测定。[/b] [/b]

问题来源:实验室用10版《中国药典》“玉竹”的多糖含量方法测苦荞麦中的多糖,由于前后两人测得结果差距比较大,A同学结果低、B同学结果高。然后对一系列可能影响结果的因素做了对照试验。http://ng1.17img.cn/bbsfiles/images/2015/09/201509151229_566071_3028242_3.png分析原因:两人在实验过程中“测定法”下离心时间分别为A同学:5min和B同学:25min,所以怀疑是离心时间导致结果的不一致。查找资料: 多糖的单糖基越多 所带的羟基也就越多 多糖的极性也就增大 根据相似相溶 就是 极性的有机物易容于极性的溶剂,极性小的易溶于极性小或非极性溶剂 多糖极性较大 在水中的溶解性很好不过 在醇的溶解性 很低 所以 将 醇 加到含有多糖的水溶液中 可以改变的水溶液的极性 极性大的多糖最先溶出来 极性下的最后溶出来 做到了分级纯化 其实这也是浓缩多糖的好方法。糖在浓硫酸作用下,脱水生成的糠醛或羟甲基糠醛能与苯酚缩合成一种橙红色化合物,在10-100mg范围内其颜色深浅与糖的含量成正比。对照试验:分别对两人的样品做了5min和25min的离心处理,测试结果A同学的样品离心5min的显色很低,离心25min显色深。B同学离心5min和25min显色差距不大都很深。请问这 能说明问题么?
大家好 我现在用药典方法 提取多糖 测黄精中多糖含量 即取60度干燥恒重的生黄精粉末0.25g,精密称定,置圆底烧瓶中,加80%乙醇150ml回流提取1h,趁热滤过,残渣用80%乙醇洗涤3次,每次10ml,将残渣及滤纸置烧瓶中,加水150ml,加热回流1h,趁热滤过,残渣及烧瓶用水洗涤4次,每次10ml,合并滤液与洗液,放冷,转移至250ml容量瓶中,加水至刻度,摇匀 精密吸取1ml至10ml具塞干燥试管中,加水至2ml,摇匀,在冰水浴中缓慢滴加0.2%蒽酮-硫酸溶液,至刻度,混匀,放冷后至水浴用保温10min,取出,立即置冰水浴中冷却10min,取出,以相应试剂为空白,照紫外可见分光光度计在582nm波长处测定吸光度。 我分别按上述方法提了6次样品,测得多糖含量 68% 左右。 实在搞不懂到底哪里出了问题,使测出的多糖含量这么高。。。 在做含量测定时,分别吸取1ml多糖液、1ml水和8ml0.2%蒽酮硫酸溶液时 都是用吸量管吸取的 这样重复性比较好 但是就是含量出奇的高 求高人指点 是我哪个地方需要注意下么?
采用超声波辅助提取金花茶叶多糖(PCCT),在单因素试验的基础上,采用响应面分析法对PCCT 提取工艺进行优化研究,以多糖提取率为考察指标,使用苯酚- 硫酸法测定PCCT 含量。结果表明,最佳提取工艺条件为水料比46:1(mL/g)、温度87℃、提取时间54min、共提3 次,测得PCCT 的提取率4.39%,鲜叶PCCT 含量66.8mg/g。
黄芪静脉输液中黄芪甲苷和黄芪多糖的含量测定摘要:建立黄芪静脉输液中黄芪甲苷和黄芪多糖的含量测定方法。方法:用高效液相色谱法测定黄芪甲苷的含量,用碘量法测定黄芪多糖的含量。结果:黄芪甲苷和黄芪多糖的平均回收率分别为9751%、9918%,相对标准差分别为248%、191%。结论:本文建立的方法准确可靠、灵敏度高、重现性好,可作为黄芪静脉输[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]液质[/color][/url]量控制的有效方法。关键词:黄芪甲苷;黄芪多糖;高效液相色谱法;碘量法; 英文摘要:ToestablishthemethodfordeterminationofastragalosideIVandastragaluspolysaccharidesinRadixAstragaliinjectionMETHODS:AstragalosidewasdeterminedbyHPLCandastragaluspolysaccharidesbyiodometryRESULTS:Therecoveriesofastragalosideandastragaluspolysaccharideswere9751%RSD=248%and9918%(RSD=191%)respectivelyCONCLUSION:Thismethodisaccurate,sensitiveandrepeatable,andcanbeusedforqualitycontrolofthepreparation英文关键词:astragaloside;astragaluspolysaccharide;HPLC;iodometry;contentdetermination黄芪为补气药,性甘温,归肺、脾经,具有补气固表、利尿托毒、排脓、敛疮生肌之功效。医疗实践证明,黄芪注射液对心气虚损、血脉瘀阻、病毒性心肌炎、心功能不全、脾虚困湿之肝炎有较好的疗效,也是肿瘤、免疫功能低下等较理想的辅助治疗药物。目前临床所使用的黄芪注射液为小容量针剂,需稀释后滴注,且不含黄芪多糖,所以疗效不够理想。为此,武警四川总队乐山医院和四川省乐山市三民药物研究所共同研制了含黄芪多糖、黄酮、苷类等有效成分的黄芪静脉输液。黄芪注射液的含量检测尽管WS3-β-3335-98执行标准仅要求采用薄层色谱法,但因高效液相色谱法操作更简便,精密度更高,故笔者参照文献以蒸发光散色高效液相色谱法[1]测定黄芪静脉输液中的黄芪甲苷含量;至于黄芪多糖含量的检测则选择采用碘量法。1仪器与试药11仪器美国奥泰公司高效液相色谱仪,包括蒸发光散射(ELSD)500检测器、Alltech426主机泵;电动离心机(江苏金坛公司);TP-150超声波清洗机(北京天鹏公司)。12试药黄芪甲苷对照品(中国药品生物制品检定所,批号:0781-9908);甲醇、乙醇、正丁醇、氢氧化钠、硫酸、葡萄糖均为分析纯;乙腈为色谱纯;水为重蒸馏水。2方法和结果21黄芪甲苷含量的测定211色谱条件:色谱柱为ODS柱(250mm×40mm),柱温为40℃,流动相为乙腈-水(36∶64),流速为06ml/min,进样量为20μl。212漂移管温度选择:根据ELDS检测使用手册推荐,设置气体流速为300slpm,漂移管温度为75℃,观察流动相(不进样)进入检测器的基线噪音,不断改变漂移管温度(步长为5℃),根据基线随温度的变化情况,选择95℃为试验最优温度。213载气流速选择:设定漂移管温度为95℃,取黄芪甲苷对照液恒量,得相应峰面积,不断改变气体流速(步长为025slpm)观察峰面积和基线的变化情况,最终选择270slpm为试验最优载气流速。214最低检测限试验:精密称取黄芪甲苷对照品适量,加甲醇溶解并稀释成浓度为1mg/ml的溶液作为贮备液,精密量取适量,逐步稀释测定,直到黄芪甲苷主峰信号为检测器噪声水平的3倍为止。得黄芪甲苷最低检测限为153ng。215线性试验:取“214”项黄芪甲苷对照品贮备液适量,精密量取10、20、30、40、50、60分别置于10ml容量瓶中,加甲醇稀释至刻度(约相当于黄芪甲苷01、02、03、04、05、06mg)。以对照品峰面积的常用对数值为横坐标(X),以进样量的常用对数值(Y)为纵坐标进行线性回归,得回归方程为Y=06001X—34896(r=09991),黄芪甲苷进样量在20μg~120μg范围内线性关系良好。216精密度试验:精密称取黄芪甲苷对照品适量,加甲醇溶解并稀释至浓度为025mg/ml的溶液作为对照溶液,注入液相色谱仪,连续重复进样6次,测得黄芪甲苷的相对标准差为179%,精密度符合规定。217重现性试验:精密量取黄芪注射液适量(相当于黄芪甲苷约20mg)5份,按“2110”项下方法制备,测定黄芪甲苷含量。结果黄芪注射液中黄芪甲苷为2390mg,RSD=201%,表明方法重现性良好。218稳定性试验:取“217”项下样品溶液,分别于0、1、2、3、5、8h取样测定峰面积,结果RSD=107%,表明黄芪甲苷溶液在8h内基本稳定。219回收率试验:分别精密量取黄芪注射液适量(约相当于黄芪甲苷10、12、14mg)共3份,每份各精密加入对照溶液(0404mg/ml)25、30、35ml,按“2110”项下方法制备,测定黄芪甲苷含量,结果详见表1。由表1可见,平均回收率为9751%,RSD=248%,符合规定,说明方法具有可行性。2110样品中黄芪甲苷的含量测定:精密量取黄芪注射液100ml,置于烧杯中浓缩至10ml,加无水乙醇40ml沉淀,放置20min,离心,沉淀用80%的乙醇溶液洗涤2次,每次10ml,合并离心液与洗涤液,置水浴上蒸干。残渣加1%NaOH溶液10ml溶解,用饱和的正丁醇水溶液提取3次,每次20ml,合并正丁醇的水溶液,蒸干,残渣再加1%NaOH溶液5ml溶解,通过已处理的D101大孔吸附树脂柱(Φ15×20cm,内装树脂高约10cm)吸附,以1%NaOH溶液50ml洗脱,弃去,用蒸馏水洗至中性,再用30%乙醇溶液50ml洗脱,弃去洗脱液,继续用70%乙醇液50ml洗脱,收集洗脱液并蒸干,残渣加甲醇溶解并定容至10ml,得供试品溶液。精密称取黄芪甲苷对照品适量,加甲醇溶解并稀释成浓度为01、03mg/ml的溶液作为对照溶液。分别精密量取上述溶液各20μl注入液相色谱仪,记录色谱图,并以峰面积和进样量的对数值按二点法计算,详见图1;3批样品按上述方法制备测定,结果详见表2。22黄芪多糖含量的测定[2,3]221线性试验:精密称取105℃干燥至恒重的葡萄糖适量,加水溶解并稀释成浓度为10mg/ml的标准溶液,分别精密量取此标准溶液100、90、80、70、60ml,置于250ml碘量瓶中,分别加水0、10、20、30、40ml,然后精密加入01mol/L碘滴定液25ml,在不断振摇的情况下缓缓滴加01mol/LNaOH40ml,密塞,在暗处放置10min,然后加入05mol/LH2SO4液6ml,摇匀,立即用01mol/LNa2S2O3滴定液滴定,近终点时,加淀粉指示液2ml,继续滴定至蓝色消失,并同时作空白试验校正。以取样量(X)与Na2S2O3的消耗量(Y)进行线性回归,得回归方程为Y=009766X—000244,(r=09999),表明葡萄糖在60mg~100mg的范围内线性关系良好。222重现性试验:精密量取黄芪注射液100ml,按“224”项下方法制备5份,测定黄芪多糖含量,结果为10423mg,RSD=099%,表明方法重现性良好。223回收率试验:分别精密量取黄芪注射液(多糖含量为10423mg/100ml)120、150、180ml,每份各加入葡萄糖标准液(25002mg/ml)50、60、70ml制成80%、100%、120%浓度的溶液。分别浓缩至10ml,加无水乙醇40ml,放置20min,离心。沉淀用80%乙醇洗涤2次,每次10ml,弃去离心液与洗涤液,沉淀加热蒸馏水10ml溶解,并转移至25ml容量瓶中,定容,摇匀。分别精密量取3种不同浓度的溶液80、70、60ml置于250ml碘量瓶中,分别精密加水2、3、4ml,按“224”项方法测定,每个浓度测定3次,共9次,计算得到回收率为9918%,RSD=191%,详见表3。224样品中黄芪多糖的含量测定:精密量取黄芪注射液100ml,浓缩至10ml,加无水乙醇40ml,放置20min,离心。沉淀用80%乙醇洗涤2次,每次10ml,加热蒸馏水3ml使沉淀溶解并定容至10ml,摇匀。移置于250ml碘量瓶中,加入1mol/LH2SO420ml,置于水浴中水解2h,取出,放冷,加入2mol/LNaOH溶液调节pH值=7,冷却至室温。精密加入碘滴定液(01mol/L)25ml,在不断振摇的情况下缓缓滴加01mol/LNaOH40ml,密塞,置暗处放置10min。然后加入05mol/LH2SO46ml,摇匀,立即用Na2S2O3滴定液(01mol/L)滴定,至近终点时,加淀粉指示液2ml,继续滴定至蓝色消失,并同时作空白试验校正,计算即得(每1ml上述碘滴定液相当于9008mg的C6H12O6)。3批黄芪注射液样品,按上述方法测定多糖含量均符合规定,结果详见表4。3讨论测定黄芪甲苷含量时,如将精密量取的黄芪注射液浓缩后仅采用正丁醇的水饱合液提取制得供试品溶液,则所得的样品杂质峰多,基线略有漂移,因此不宜采用。黄芪多糖主要为葡萄糖,因此,可采用以葡萄糖或葡聚糖作对照品的苯酚-浓硫酸法[4]、蒽酮-浓硫酸法[5]或水解后用碘量法等测定其含量,但一般多采用后两种方法。采用蒽酮-浓硫酸法时,由于其线性试验回归方程为C=98481A+08314(r=09663),浓度线性范围为35~165μg/ml,线性关系不好,故不宜采用。
[b]1.[font=宋体]黄芪多糖的精制[/font][/b][font=宋体]取黄芪药材粉末约[/font]30.0 g[font=宋体],精密称定,加入石油醚([/font]60[font=宋体]~[/font]90 [font=宋体]℃[/font][font=宋体])[/font]100 mL[font=宋体]回流提取[/font]3[font=宋体]次,每次[/font]1 h[font=宋体],弃去提取液(除去脂溶性成分),药渣烘干,用[/font]70 %[font=宋体]乙醇[/font]150 mL[font=宋体]回流提取[/font]3[font=宋体]次,每次[/font]2 h[font=宋体]。弃去提取液(除单糖、低聚糖和苷类等小分子物质),药渣烘干,加蒸馏水[/font]200 mL[font=宋体]回流提取[/font]3[font=宋体]次,每次[/font]2 h[font=宋体]。合并提取液,减压浓缩至[/font]100 mL[font=宋体],即得粗多糖的水溶液。在粗多糖水溶液中加入[/font]Sevage[font=宋体]试剂(氯仿[/font][font=宋体]:[/font][font=宋体]正丁醇[/font] = 4[font=宋体]:[/font]l[font=宋体])[/font]10 mL[font=宋体],剧烈震荡[/font]20 min[font=宋体],使其充分混合,在[/font]4000 rpm[font=宋体]转速下离心[/font]5 min[font=宋体],弃去中间变性蛋白层和下层有机层,水相继续重复上述操作[/font]10[font=宋体]次,直至水相与有机相中间无变性蛋白出现为止,即得脱蛋白多糖水溶液。[/font][font=宋体]向脱蛋白多糖水溶液中加入[/font]5[font=宋体]倍量无水乙醇[/font]80mL[font=宋体](使溶液含醇量达[/font]80 %[font=宋体]以上),充分搅拌,静置过夜。在[/font]4000rpm[font=宋体]转速下离心[/font]5 min[font=宋体],弃去上清液,所得沉淀依次用无水乙醇、丙酮、无水乙醚[/font]20mL[font=宋体]各洗涤[/font]3[font=宋体]次,弃去有机溶剂后挥干沉淀,并用真空干燥机抽真空,[/font]60 [font=宋体]℃[/font][font=宋体]干燥[/font]12h[font=宋体],得到灰白色颗粒状多糖样品。[/font] [font=宋体]黄芪多糖精制的工艺流程图见图[/font]1[font=宋体]。[/font][align=center][img=,627,567]https://ng1.17img.cn/bbsfiles/images/2021/11/202111161201593536_221_3528941_3.gif!w627x567.jpg[/img][/align][align=center][b]Fig.1 The isolationprocedure of the polysaccharide in [i]Radix Astragali.[/i][/b][/align][b]2.[font=宋体]黄芪多糖的纯度检查[/font]2.1 Molish [font=宋体]试验[/font][/b][font=宋体]([/font]1[font=宋体])供试品溶液:取黄芪多糖[/font]2mg[font=宋体],加[/font]10mL [font=宋体]蒸馏水,微热使溶解,再加入[/font]α-[font=宋体]萘酚;[/font][font=宋体]([/font]2[font=宋体])[/font][font=宋体]阳性对照品溶液:取淀粉[/font]2 mg[font=宋体],加[/font]10 mL [font=宋体]蒸馏水,加热溶解,再加入[/font]α-[font=宋体]萘酚;[/font][font=宋体]([/font]3[font=宋体])[/font][font=宋体]阴性对照品溶液:[/font]10 mL [font=宋体]蒸馏水,加[/font]α-[font=宋体]萘酚。[/font][font=宋体]分别摇匀,将试管倾斜,沿试管壁慢慢加入浓硫酸,竖直试管观察。供试品溶液与阳性对照品溶液试管中呈紫堇色环,阴性对照品溶液试管界面无变化。结果表明供试品溶液为糖类。[/font][b]2.2 Fehling [font=宋体]试验[/font][/b] Fehling[font=宋体]试剂的配置:称取[/font]CuSO[sub]4[/sub][sup].[/sup]5H[sub]2[/sub]O7.28 g[font=宋体],[/font][font=宋体]加水至[/font]40 mL[font=宋体],[/font]0.1 mL [font=宋体]浓硫酸酸化,再加水至[/font]100 mL[font=宋体]作为甲液;称取酒石酸钾钠[/font]34.6 g[font=宋体],氢氧化钠[/font]14.2 g[font=宋体],加水至[/font]100mL [font=宋体]作为乙液。临用时将甲、乙液按[/font]1:1[font=宋体]混匀即可。[/font][font=宋体]([/font]1[font=宋体])[/font][font=宋体]供试品溶液:取黄芪多糖[/font]2 mg[font=宋体],加[/font]10 mL [font=宋体]蒸馏水,微热使溶解;[/font][font=宋体]([/font]2[font=宋体])[/font][font=宋体]阳性对照品溶液:取葡萄糖[/font]2mg[font=宋体],加[/font]10mL [font=宋体]蒸馏水,微热使溶解;[/font][font=宋体]([/font]3[font=宋体])[/font][font=宋体]阴性对照品溶液:[/font]10 mL [font=宋体]蒸馏水。[/font][font=宋体]分别加入[/font]Fehling[font=宋体]试剂,在[/font]70℃[font=宋体]水浴中加热[/font]10 min[font=宋体]。供试品溶液与阳性对照品溶液为蓝色,阴性对照品溶液变为砖红色。单糖与[/font]Fehling[font=宋体]试剂反应变为砖红色,而多糖为非还原性糖,不与[/font]Fehling[font=宋体]试剂反应,结果表明供试品中不含单糖。[/font][b]2.3[font=宋体]显色条件[/font][/b][font=宋体]总多糖的测定:精密量取对照品溶液或供试品溶液[/font]0.5mL[font=宋体]于具刻度试管中,加水补至[/font]1.0mL[font=宋体],再加入[/font]8%[font=宋体]苯酚溶液[/font]1.0mL[font=宋体],充分混匀后,加入浓硫酸[/font]5.0mL[font=宋体],[/font]60 ℃[font=宋体]水浴加热[/font]15 min[font=宋体],取出,冷却至室温后,于[/font]487nm[font=宋体]下测定吸光度,外标一点法测定多糖含量。[/font]
黄芪多糖的含量测定用苯酚硫酸法测定要注意哪些事项?我是把无水葡糖配成0.1 mg/ml的标准溶液,取2ml到10ml加5%苯酚1ml,滴加5ml浓硫酸,放置5分钟,用沸水浴15分,放冷后定容,做了很多次,发现同一个对照品,同一个样品,同一种稀释方法,结果不一样,样品结果还是平行,是什么原因。需要控制哪些环节。
各位大神,请问总多糖比色法的测定国标以及含量计算公式!谢谢
[color=#444444]我想用[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]液质联用[/color][/url]做一个中药的成分分析,它含有多糖和苷以及黄酮这些物质,根据我所知道的质谱的检测仪如果是TOF的话,可以测大分子,如果[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]液质联用[/color][/url]中质谱采用TOF检测器,请问样品需要如何前处理?直接做这个[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]液质联用[/color][/url]可以定性和定量检测吗?[/color]
我提取的多糖中有葡聚糖和甘露聚糖,我想检测甘露聚糖的含量,现在我首先想先把样品水解检测葡萄糖的含量,我想用试剂盒检测葡萄糖的含量,我想问下葡萄糖试剂盒检测葡萄糖时,甘露糖会对它产生干扰吗??
各位,有没有人测过多糖的糖含量?我测了,空白每次显色都不一样,有过淡紫红色,有过淡蓝色,但老师说应该是无色,怎么回事呢?[em09] 有谁遇到过同样的情况,可以不吝赐教吗?多谢
请问多糖的含量可以用高效液相色谱来测定吗?现在的方法大多用紫外可见分光光度法来检测的。
西洋参中含有丰富的多糖、肽类、黄酮、核酸可调节免疫,降血糖血脂,清除自由基还有17种人体必须氨基酸及15种微量元素其中钾、钴、锌、硒等含量西洋参均高于人参是大自然赐予文登人最完美的配方所以,在西洋参的庇護下文登有许多年过八十的健康老人有的老人比年轻人还要强壮性格开朗,生活也丰富多彩文登也因此被认定为全国“长寿之乡”!
除了NY/T 1676-2008 食用菌中粗多糖含量的测定还有哪些标准方法呢?
亚甲基蓝比色法测定海参不同组织酸性黏多糖含量http://www.cnki.com.cn/Article/CJFDTotal-HYKX201103014.htm不知道有没有版友做过海参中的多糖呀?看到这样一篇文章不知道有没有版友手里有呀?是否能分享一下如果有做过的版友也可以分享一下你的经验,谢谢!!
各位好,最近检测需要测紫甘薯中总糖、粗多糖和还原糖的含量,但我查了检测方法,都比较繁琐,方法复杂,而且容易产生干扰,不知那位高手测过,求易于操作、有效的检测方法。
您好: 我现在用强碱性阴离子交换树脂分离Vc的单糖衍生物,在254nm下经过HPLC检测发现只有一个峰,但用冷冻干燥后,样品就黏糊的,我怀疑是样品中含有多糖,因为我测得植物中多糖含量很高,所以我想请教一下这样除去多糖(重复上柱效果不好)。还有这两者用什么来检测区分呢!若用硅胶薄层板的话应该用什么显色剂?
有关多糖换算因素的计算问题,求助高手,如下面的换算因素怎么计算:其中W是用哪个数据,还有稀释因素是多少?至于具体的换算因素结果,不需要 精密称取干燥的多糖约25.00mg,置100ml容量瓶中,用蒸馏水稀释至刻度,摇匀,作为贮备液。精密吸取贮备液 5.0ml,稀释至 50ml,取其中的2.0ml置试管中,照标准曲线的制备项下的方法测定吸收度,从回归方程中求出多糖液中的果糖含量,按下式计算,换算因素f=W/(C×D),其W 为多糖的重;C为多糖液中果糖浓度;D为多糖稀释因数. 计算 f值。结果,测得A=0.360,算出f=。
多糖的分析是一个大问题啊!和大家讨论一下吧,经综合各种文献我认为多糖结构分析内容:要搞清1. 多糖的单糖组成(种类、比例)2. 每个单糖残基的D-、L-构型,吡喃环式或呋喃环式3. 羟基被取代情况(糖苷键的位置)4. 糖苷键及构型(α、β异头异构体)5. 重复单元方法:1、单糖组成:(对照品:葡萄糖、岩藻糖、半乳糖、甘露糖、木糖、阿拉伯糖、鼠李糖)a:水解: 纸层析薄层层析气相色谱(糖氰乙酸酯衍生物、糖醇乙酸酯)液相色谱(ZORBAX-NH2、HRC-NH2、RID)首选气相,灵敏度高,液相RSD、ELSD灵敏度低b:TFA酸解:气相色谱(乙酰化物)c:甲醇解:气相色谱(三甲基硅醚)2:高碘酸钠氧化和Smith降解a:每摩尔己糖基的高碘酸消耗量、甲酸释放量。(目的:判断可氧化糖基与不可氧化糖基之比例)b:Smith降解完全水解,气相分析,如有葡萄糖(表示有1-3键糖基)、甘油(有1-6或1-2糖基)、甲酸(有1-6糖基)Smith降解部分水解,说明主干糖苷键类型。3:甲基化分析(Hakrmor法)-支链分布多糖—甲基化—水解—还原得甲基化单糖醇—乙酰化得糖醇衍生物—GC-MS检测。 对照品 2,3,4,6-四甲基葡萄糖 糖苷键类型 1—2,4,6- 三甲基葡萄糖 1—32,3,4-三甲基葡萄糖 1—62,4-二甲基葡萄糖 1—3,6 4:IR图谱解析a:吡喃环式或呋喃环式α、β异头异构体5:1HNMR及13CNMR解析(构型)6:纯度检查:a: 紫外吸收光谱(280、260)b:电泳(琼脂糖电泳、聚丙烯酰胺凝胶、醋酸纤维素薄膜)c:薄层色谱(多糖不水解)7:X射线衍射,立体构型。好多啊!想和大家讨论讨论多糖的HPLC分析,我们试验室用的液相是C18柱,紫外检测器,做多糖含量及纯度检测,这样的装备够不够用呀?是不是做前必须衍生化或有其它方法,如用示差折射仪作检测器,是不是不需衍生化?多糖的HPLC分析,用得较多用HPGPC测分子量及分子量分布。一般纯多糖紫外吸收较弱,多用RID或ELSD。至于含量测定多用硫酸蒽酮比色或苯酚硫酸法。http://img.dxycdn.com/images_new/smiles/smile_angry.gif
目的 从虎眼万年青中提取、分离水溶性多糖,初步研究其特征和抗肿瘤活性。 方法 采用热水提取,乙醇沉淀,Sevag法脱蛋白,DEAE-Sepharose Fast Flow离子交换柱色谱和Sephadex G-75凝胶过滤柱色谱分离纯化,得到虎眼万年青均一多糖OCAP-2-2。毛细管区带电泳法(CZE)分析单糖组成;采用高效凝胶渗透色谱法(HPGPC)测定多糖纯度和相对分子质量;动物移植性实体瘤的瘤重实验法研究对小鼠S180肉瘤的抑瘤作用,采用细胞体外培养技术,MTT法检测对人白血病细胞株K562细胞的增殖抑制作用。 结果 经过分离纯化得到的均一多糖组分OCAP-2-2主要由葡萄糖、木糖、甘露糖、半乳糖等4种单糖组成,其相对分子质量之比为2.16∶1.26:0.88∶1.00,平均相对分子质量9.84×104,总糖含量为92.3%,总糖醛酸含量为6.21%,蛋白质含量为3.68%;在0.1~100 μgmL-1内与荷瘤对照组相比,OCAP-2-2对小鼠S180肉瘤有显著的抑制活性,其中多糖浓度为100 μgmL-1时抑瘤率达(53.16±4.23)% ([i]P<[/i]0.001);OCAP-2-2对K562细胞有明显的增殖抑制作用([i]P<[/i]0.01),在多糖浓度为0.10 μgmL-1时,增殖抑制率最高为(39.83±7.31)% ([i]P<[/i]0.01)。 结论 OCAP-2-2具有很高的抗肿瘤活性,可以探索作为一种潜在的天然抗肿瘤药物。