用氯仿做溶剂,碘分子,碘离子,三碘离子,五碘离子的紫外吸收各在什么位置呢?好心人帮帮忙~~
如题,在水和废水监测分析方法第四版中,干扰及消除第2条里指出“碘离子及溴离子对测定有干扰。”可是没讲怎么排除,请问有碘离子及溴离子干扰时,该怎么消除
用常规柱子分析过碘离子的友友们,请指导下。推荐分析柱,谢谢。
没有查找到相关方法,采用食盐中碘离子测定方法,但由于颜色等干扰因素,测定结果远大于实际添加食盐的碘离子含量理论值,因此该方法不适用于对酱油中碘离子的测定
请问 用碘离子选择电极测定碘离子时,为什么要使空白电位在去离子水中洗至+80mv左右,还有溴的是-180mv?谢谢各位
电位滴定法测定氯离子和碘离子 1.实验目的 (1)用电位滴定法测定氯离子和碘离子的含量。 (2)掌握电位滴定法终点的确定方法和实验技术。2.实验原理电位滴定法利用电极电位的“突跃”指示滴定终点。电位滴定终点的确定,不必知道终点电位的确定值。只要测得电位值的变化,就可通过作图法或二阶微商法确定滴定终点。氯化银、碘化银的溶度积分别为AgCl: Ksp = 1×10-10 mol2.L-2 AgI: Ksp = 1×10-16 mol2.L-2用硝酸银进行滴定含氯离子和碘离子的试液时,先生成碘化银沉淀,当碘化银沉淀完全后,开始生成氯化银沉淀。本实验以硝酸银为滴定剂,基于银离子与碘离子和银离子分步沉淀原理进行测定。以银-氯化银电极为指示电极,玻璃电极为参比电极,通过测量滴定过程中电位的变化,测定待测溶液中碘离子和银离子的浓度。滴定过程中,溶液pH不发生变化,pH玻璃电极可作为参比电极。滴定过程中,有两个电位“突跃”。每次滴定下1.0 mL;在终点附近的量,电位值变化较大时,每次可滴下0.10 mL,以便于微商法的计算和获得准确的测定结果。3.仪器与试剂高输入阻抗电位计(或pH记,或离子计,或ZD-2型自动电位滴定仪),银-氯化银电极;pH玻璃电极。200 mL烧杯;10 mL移液管。0.10 mol.L-1AgNO3标准溶液:准确称取110℃干燥的AgNO3(GR)8.6 g于500 mL烧杯中,用约200 mL不含Cl-的蒸馏水溶解,转入500 mL容量瓶中,再用不含Cl-的蒸馏水定容。计算其浓度。配制的溶液装入棕色瓶中暗处保存。电位滴定时,稀释成0.050 mol.L-1 AgNO3标准溶液。含氯离子和碘离子的试液(各含约0.01 mol.L-1)。4.实验步骤移取10.00 mL含氯离子和碘离子的试液于200 mL烧杯中,放入搅拌子,加入80 mL蒸馏水,将电极浸入试液中,以银-氯化银电极为指示电极,pH玻璃电极为参比电极①,用0.050 mol.L-1 AgNO3标准溶液进行滴定,大概估计滴定终点。记录消耗AgNO3标准溶液的体积和电位测定值。平行测定三次。5.数据处理(1)以消耗AgNO3标准溶液的体积(V)为横坐标,以测得的电位(E)为纵坐标,绘制E-V曲线,再绘制一次微分 曲线和 曲线,确定终点体积。(2)计算试液中氯离子和碘离子的浓度和测定结果的相对平均偏差。注释①参比电极也可使用双盐桥电极(外套管内装1 mol.L-1 KNO3溶液)或用内含1 mol.L-1 KNO3溶液的盐桥连接的饱和甘汞电极。思考题1.银电极、银离子选择电极或氯离子选择电极可否用作指示电极?为什么?2.pH玻璃电极为什么可用作参比电极?3.用本实验的方法可否连续测定氯离子、溴离子和碘离子? 陕西师范大学分析化学研究所
求教各位大神Dionex IonPac AS22能检测碘离子,拖尾很严重怎么处理,条件是4.5mm的碳酸钠、1mm的碳酸氢钠。柱温30℃
事情是这样的: 公司才买了雷磁公司的碘离子选择电极和配套使用的217型双盐桥参比电极,第二盐桥我们填充的是饱和KNO3溶液(照说明书),碘电极使用前在0.001mol/L的KI溶液活化了3小时,并在蒸馏水中洗至+80mv,但是测定绘制曲线用的标准却是负值,请问这样合理吗? 另外,我们拿到的这个参比电极下面的晶体比较多,是不是会堵塞毛细孔,对测定结果有影响吗? 请问有谁遇到过这种情况?麻烦告知,谢谢了!
最近公司要扩项,涉及到水质碘离子的测定,求各位大神告知一下,需要哪些硬件(备注:已有一台瑞士万通883离子色谱)?色谱柱、抑制器、检测器这些直接在883基础上加装还是得重新买一台离子色谱?另外做工业循环冷却水中钠、铵、钾、镁和钙离子的测定离子色谱法GB/T15454-2009这个标准时需要哪些设备!!!
紧急求救:有谁知道在[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]测定碘做标线的时候碘的出峰时间是多少啊?我们公司才买的[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱仪[/color][/url],现在不知道这个啊。
请问各位有没有测试卤素的碘离子的标准溶液是向哪家公司购买的我找了很多厂商都说没有
碘离子选择电极电极测定碘时,电位是正的还是负的?谢谢各位
[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=103305][url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]法测定饱和卤水中痕量碘离子[/url]
现在用[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]测碘的最好前处理方法是什么啊??电导检测器可以测吗?是带阴抑制器的。有哪位大侠测过或正在做这方面检测的,请发表一下高见啊
Thermo 戴安2100可以测碘溶液中的氯离子浓度吗
尊敬的老师,您好,我想咨询是否有用[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]检测高纯醋酸里碘离子的分析方法或者标准(碘离子的浓度为10ppb左右),谢谢!.
[color=#00008B] 碘量法测铜是铜矿化验及铜湿法冶金生产中中控分析的常用方法,但碘量法测铜在资料及教科书中从未提到亚铁离子对碘量法的影响。因为从中学教材、大学教材到《重要无机化学反应》,都只讲三价铁可以氧化溶解金属铜: 2Fe[sup]3+[/sup] Cu = 2Fe[sup]2+[/sup] + Cu[sup]2+[/sup] 却没有人说这是一个可以向左进行的可逆反应。事实上,这个反应的平衡常数是可以通过二电对的标准电极电位计算出来的:lgK=14.71,即K=1014.71,任何反应都有可逆性,只是程度和条件不同而已,下面的案例就是其逆向进行,影响测定结果的情况: 某硫酸铜厂(低品位氧化矿经硫酸浸出,铁屑置换,焙烧,硫酸再溶解,除杂,结晶。是一种较简单的生产流程)告知:他们的生产一直正常,用最近一批氧化铜矿石生产时,浸出率较低,化验结果波动很大,氧化铜测定结果严重偏低,请帮助分析原因。 我到该厂后,用快速碘量法化验有问题的矿粉中的氧化铜(用稀硫酸溶矿为氧化铜部分,属于物相分析,见我上传的《化学物相分析》),过程中发现:稀硫酸溶解液为黄绿色,当加碱调整到有大量氢氧化铁生成(此时PH值在3左右),加入NH4HF2,清液中慢慢析出红色沉淀,溶液变浅蓝色。按正常化验,结果较低。据此现象,我初步断定:溶液中有铜被还原了,还原可能是亚铁离子,亚铁离子是否会还原铜离子呢,我取了适量硫酸亚铁溶液与硫酸铜溶液混合,没有变化,又往其中加入氟氢酸铵,慢慢地生成了红色沉淀,再加入稀硫酸,沉淀溶解,毫无疑问,是亚铁在氟离子存在下还原了铜,我又配制较浓的硫酸亚铁溶液和硫酸铜溶液,并混合,不加氟氢酸铵,同样生成红色沉淀。无论何种情况下生成红色的铜沉淀,只要往悬浊液中加硫酸,沉淀重新溶解。同样的方法,我将氟氢酸铵改成氨水,较高浓度的亚铁离子照样还原铜离子至红色。由此看来问题出在他们的矿石中含亚铁矿较高。 理论分析:上面的平衡虽然强烈偏向右边,一般含亚铁较少的溶液不受影响,但亚铁较高时,当加入较多的氟离子,由于左边的高铁离子生成铁氟络离子,反应便向左边移动,从而出现还原铜的情况,加氨水时,也由于高铁的完全沉淀,导致平衡向左移动(还未到铜氨离子的PH值,亚铁已经还原了部分铜),不加沉淀剂和络合剂,在PH2左右(生产上浸矿时的终结PH),只要加热,也促进高铁水解,高浓度的亚铁就能还原部分铜。当加酸时,由于氢氧化铁溶解,或酸效应作用使铁氟络离子完全分解,又使得上述反应向右进行,铜复溶。 处理方法: 分析方法:用稀硫酸溶解后的试液,分离矿渣,洗涤液合并,溶液中加双氧水,加热氧化亚铁,并加热至湿盐状(分解双氧水),加水稀释,高PH值,以后操作按资料。除亚铁的方法,也可以将矿浸液适当加硫酸和磷酸,用重铬酸钾滴定至二苯胺磺酸钠变紫(还可以计算亚铁浓度),除去亚铁离子,再调PH到3左右,加氟氢酸铵,操作同上。后一方法可以免去加热分解双氧水的漫长过程,缩短时间, 生产流程:将原来的加热浸矿改成冷浸矿,防止了加热浸矿时铜被还原留存于渣中的可能,提高了铜的回收率。 至此,化验和生产的问题得到了妥善的解决。[/color]
样品中的硫酸根含量较高,干扰了碘的出峰。请问,我可以直接向样品中加入氯化钡来沉淀硫酸根吗?参余的高浓度的钡离子对色谱柱有影响吗?我用的是戴安1500,AS22柱,电导检测器,碳酸根体系。
[color=#444444]做了一个化合物是有N正离子和碘负离子,打了氢谱感觉是对的,想做个高分辨,打出来有1点多的差别,不知道是不是选的方式不对,是该用加氢呢还是减氢呢?还是要特别注意什么?我看部分类似化合物文献中都是没有碘的分子量,难道碘会被完全打掉?我的为什么还有呢?[/color]
我的样品中含有高浓度的碘离子,或者其与金属的络合物,试样呈血红色。测试完后,进样管壁呈黄色。请问我能不能用乙醇清洗,如果能的话,怎么洗?是不是在熄火之后,开泵,润洗。
[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]法测盐酸胺碘酮原料药 其不易溶解 如何前处理比较好
【题名】:离子选择性电极法氯溴碘的同时测定【全文链接】: https://www.cnki.com.cn/Article/CJFDTOTAL-LHJH198202010.htm
采用电感耦合等离子体分析土壤中碘,前处理方法有哪些?
地下水中碘离子的含量与碘化物的含量有什么关系?
[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]0.1mg/l的点老做不好,不过原点0.15,过了曲线圈点0.078,曲线的各点是0.1,0.5,1,2,5,求指教
我们公司生产LED和LCD,组装线上面现在有很大的静电,给生产带来了很大的不变,听说东莞顺冠防静电的离子风机和离子风枪效果非常好,哪里有卖他们的离子风机和离子风枪!谁知道请告知一下!
请教各位大侠,怎样用分光光度计测量碘、碘化钾混合溶液中的碘离子和碘分子浓度。我现在手上有一台紫外-可见光区分光光度计,恳请各位指教小生。感激不尽。[em24]
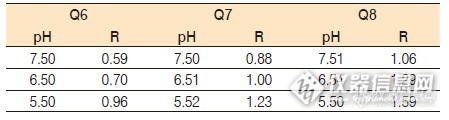
做液相分析的版友们,相信对离子对试剂都不陌生。离子对试剂最大的优点就是:当样品在反相色谱柱上的保留时间很短或者根本不保留,这时要加入相应的离子对试剂,将分析物上的离子进行结合,形成在柱子上有保留的分子;另外,还有就是改善峰形以及使分析结果的重现性更好…………可是,凡事都有两面,离子对试剂最大滴缺点就是:对色谱柱造成不可逆的伤害,离子对试剂和固定相结合产生不可逆吸附,进而影响固定相活性位点。而且离子对试剂很难从色谱柱上冲洗干净,会大大缩短色谱柱的使用寿命。另外,离子对试剂对pH值比较敏感,配制流动相时要求精确度较高。否则直接影响实验的重复性和重现性当然鉴于离子对试剂的一些优点,还是大有人在使用离子对试剂达到较好的分离效果,只要不考虑米米。下面讲讲离子对试剂的选择:怎样选择离子对试剂在选择离子对试剂时,烷基链的长度是必须考虑的因素,因为碳链的长度决定了对样品的分离。碳链越长,对离子的疏水性越强,如表1 和图1 中所示,Q12 的保留时间是Q5 的20 倍。表1 和图1 同时也表明,Q 系列试剂的链长明显影响了苯甲酸的保留时间,而对苯甲醇的保留时间没有影响。S 系列试剂也具有同样的保留特性。表1. 碳链长度对保留值的影响http://ng1.17img.cn/bbsfiles/images/2015/03/201503191558_538861_2452211_3.png表2. pH 值对保留值的影响苯甲酸/ 苯甲醇的保留比,流动相:水/ 甲醇(60/40)http://ng1.17img.cn/bbsfiles/images/2015/03/201503191559_538862_2452211_3.png下面是选择离子对试剂的步骤• 选择一支柱子,通常是端基封尾的C18 柱(Diamonsil、Spursil、Inspire等色谱柱均可)• 使用色谱纯的水和试剂• 选择获得最佳分离效果的流动相的配比• 如果样品中含有非离子组分,在进样前需最优化样品溶液• 选择合适的对离子,酸性化合物选用Q 系列试剂,碱性化合物选用S 系列试剂• 选择合适的碳链长度,使分离度达到最大• 一旦选定离子对试剂,可以通过调整pH 值来获得最佳分离。由于pH 值能够显著影响保留时间,所以在调整时,应该微调,不可调整幅度太大。离子对试剂在流动相中的理想浓度通常是0.005 M,但是也可以通过调整其浓度的大小来优化分离效果
我用碘量法测定巯基,但有一些干扰。主要是硫离子,请问有什么方法能掩蔽硫离子又不干扰测试?谢谢!
[font=&]【题名】: 733型碘离子选择电极的制备、分析性能与应用[font=微软雅黑, &][color=#333333][/color][/font][/font][font=&]【全文链接】: https://www.cnki.com.cn/Article/CJFDTOTAL-FXHX197801001.htm[/font]