加热蛋白溶菌酶能杀灭诺如病毒日本东京海洋大学的一个研究小组日前宣布,在实验中发现,加热处理鸡蛋蛋白含有的溶菌酶,能灭活诺如病毒。这是由于溶菌酶能破坏包裹诺如病毒基因的外壳。诺如病毒会引发急性肠胃炎和食物中毒。这种病毒具有强大的感染力,只要有10至100个病毒体进入人体,就会导致感染,目前还没有有效的抗病毒剂。研究小组利用实验鼠的诺如病毒替代人类诺如病毒进行了实验。他们将蛋白中含有的溶菌酶在100摄氏度下加热40分钟,使其变性。接下来,将含有1%加热处理过的溶菌酶的溶液与实验鼠诺如病毒混合在一起,并观察了1分钟之后的变化。溶菌酶是蛋白等含有的一种能水解致病菌中黏多糖的碱性酶。研究人员发现,诺如病毒基因量大幅减少,以致无法检出,并观察到病毒体出现膨胀。他们认为这是由于包裹病毒基因的外壳被破坏导致的。研究人员指出,实验鼠诺如病毒和人类诺如病毒从遗传学上来看非常类似,所以这种加热变性处理的蛋白溶菌酶对人类诺如病毒应该也有效果。他们希望将其制成消毒喷雾剂,在下一年度达到实用化。
如果靶基因亚克隆在含有T7启动子的表达载体(如质粒载体pET-22b和pET-15b等)上,那么重组质粒应转化入λDE3溶源菌菌株 中,以进行靶基因的表达。 (一) 溶菌酶-DNase I-反复冻融裂解菌体法1. 单菌落接入4ml LB培养液中,过夜培养。再以1:20转接至2管4 ml LB培养液中,当OD600为0.6-0.8时,一管加IPTG诱导,另一管不加IPTG作对照。2. 离心收集菌体,每管加Binding buffer 100 μl,DNase I (2,000 u/ml) 10 μl,溶菌酶 (2 mg/ml) 5 μl。菌体充分悬浮后,在-20℃放置20分钟,室温融化,如此反复冻融8-10次。3. 吸取20 μl加入一洁净的EP管中,12,000 rpm离心10分钟,上清和沉淀分别进行SDS-PAGE电泳,以判断靶蛋白质主要以溶解形式还是以包涵体形式存在。 (二) 超声波裂解菌体法1. 单菌落接入4 ml LB培养液中,过夜培养。其中2 ml过夜培养物用于菌种保存和DNA测序,另
蛋白质纯化及复性 重组蛋白在大肠杆菌(E. coli)高效表达时,往往以不溶的、无活性的蛋白聚集体,即包涵体(inclusion body)的形式存在于细胞内。必须从细胞内分离出包涵体,采用高浓度变性剂(如7.0mol/L盐酸胍、8.0mol/L脲)溶解包涵体,然后除去变性剂或降低变性剂的浓度,使包涵体蛋白得以复性,最后再用色谱法使目标蛋白质得到纯化。其中包涵体蛋白的复性和纯化是整个过程中的核心。 目前重组蛋白生产中普遍存在的问题是:(1)复性效率低。传统的复性方法稀释法和透析法。稀释复性法对样品几十倍,甚至上百倍的稀释会使样品的体积急剧增大,给后续的分离纯化带来很大的困难,而且复性过程中需要较大的复性容器。透析法耗时较长,而且要多次更换透析溶液。这两种方法的共同缺点是蛋白质在复性过程中会发生聚集而产生大量沉淀,复性效率低,通常蛋白质的活性回收率只有5~20%,而且复性后的蛋白质溶液中含有大量的杂蛋白,需要进行进一步的分离纯化。(2)工艺路线烦琐,生产周期长。在传统的重组蛋白质分离纯化工艺中,大多采用经典的软凝胶分离介质,由于这种介质的颗粒较大,分离效率较差,因此常常需要采用多种不同模式的色谱操作联用对目标蛋白质进行纯化,才能得到纯度符合一定标准的目标蛋白质。另外,这种色谱介质的耐压性很差,只能在流速较低的情况下进行操作,分离纯化时间较长。分离纯化步骤多和分离时间长使得蛋白质的质量回收率和活性回收率很低。而且在传统的重组蛋白质生产工艺中,蛋白质的复性和纯化是生产过程中两个独立的单元操作,也在很大程度上制约着生产效率。(3)生产成本高,设备投资大。由于复性和分离纯化分别单独进行,而且分离纯化步骤多,每一步都需要有与之配套的设备,致使设备投资大,生产成本高。随着生产规模的增加,这种弊端会愈来愈严重。 1991年耿信笃教授首先将高效疏水相互作用色谱(HPHIC)用于变性蛋白的复性,很好的解决了上述问题,现已成功用于重组人干扰素-g(rhIFN-g)、重组人干扰素-a(rhIFN-a)、人粒细胞集落刺激因子(rhG-CSF)、重组人胰岛素原(proinsulin)、重组牛朊病毒(prion)等重组蛋白以及溶菌酶和核搪核酸酶等标准模型蛋白的复性与同时纯化中。目前,排阻色谱法、离子交换色谱法和亲合色谱法也已用于蛋白质的复性和同时纯化中。与传统的稀释法及透析法比较,用色谱法进行蛋白复性的优点是:①在进样后可很快除去变性剂;②由于色谱固定相对变性蛋白质的吸附,可明显地减少、甚至完全消除复性过程中蛋白质聚集体和沉淀的产生,从而提高蛋白质复性的质量和活性回收率;③在蛋白质复性的同时可使目标蛋白质与杂蛋白分离以达到纯化的目的,使复性和纯化同时进行;④便于回收变性剂,以降低废水处理成本。简言之,色谱法复性可以提高蛋白质的活性和质量回收率,将蛋白复性和纯化集成在一步操作完成,缩短了操作步骤和生产时间,减少了设备投资,使生产成本大大降低,已经引起了全世界范围内许多生化研究者和重组蛋白药物生产厂家的关注。由于高效液相色谱(HPLC)分离效率高,往往在一步操作中便可得到纯度符合要求的蛋白质,而且分离速度快,在应用方面具有更大的优势。
色谱CHINESE JOURNAL OF CHROMATOGRAPHY2005 Vol.23 No.1 P.12-17 高速逆流色谱双水相体系分离蛋白质Separation of Proteins in Aqueous Two-Phase Systems with High-Speed Counter-Current Chromatography郅文波 邓秋云 宋江楠 顾铭 欧阳藩 摘 要:利用多分离柱高速逆流色谱仪,研究了聚乙二醇1000(PEG1000)-磷酸盐双水相体系的固定相保留率及该体系对蛋白质混合物和鸡蛋清样品的分离.以14.0%PEG1000-16.0%磷酸盐体系的上相为固定相,在流速0.6mL/min和转速900 r/min的条件下,固定相的保留率达到33.3%.在pH 9.2的PEG1000-磷酸盐双水相体系中,细胞色素C、溶菌酶和血红蛋白的分配系数差异最大,采用该pH值的14.0%PEG1000-16.0%磷酸钾盐双水相体系,在流速1.0 mL/min和转速850 r/min的条件下,成功地分离了这3种蛋白质的混合物.鸡蛋清中的主要蛋白质成分--卵转铁蛋白、卵白蛋白和溶菌酶在pH 9.2的15.0%PEG1000-17.0%磷酸钾盐体系中也具有最大的分配系数差异.采用该体系,在流速1.0 mL/min和转速850 r/min的条件下,成功地分离了鸡蛋清样品,得到的卵白蛋白、溶菌酶和卵转铁蛋白的电泳纯度分别为100%,100%和60%,收率均大于90%.关键词:高速逆流色谱 双水相体系 蛋白质 分离纯化分类号:O658 文献标识码:A文章编号:1000-8713(2005)01-0012-06 作者简介:郅文波,男,博士研究生,E-mail:zhiwenbo@163.com.通讯联系人:欧阳藩,男,教授,Tel:(010)82627061,Fax:(010)62561822,E-mail:fouyang@home.ipe.ac.cn. 作者单位:郅文波(中国科学院过程工程研究所生化工程国家重点实验室,北京,100080) 邓秋云(上海同田生化技术有限公司,上海,200122) 宋江楠(中国科学院过程工程研究所生化工程国家重点实验室,北京,100080) 顾铭(中国科学院过程工程研究所生化工程国家重点实验室,北京,100080) 欧阳藩(中国科学院过程工程研究所生化工程国家重点实验室,北京,100080) [img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=23113]高速逆流色谱双水相体系分离蛋白质[/url]
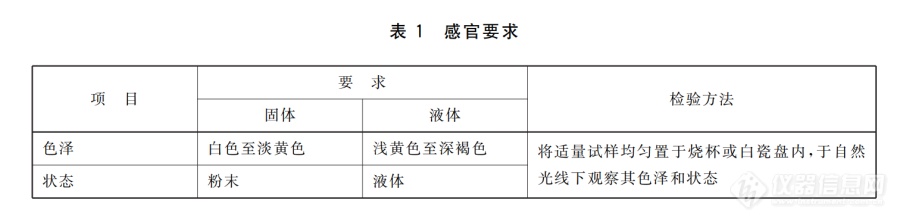
[align=center][font='宋体'][size=29px]溶菌酶[/size][/font][/align][size=24px]赵浩博[/size][size=12px]溶菌酶又称细胞壁质酶或[/size][size=12px] N- 乙酰胞壁质聚糖水解酶。1922 年英国细菌学家 A. Fleming 发现人的唾液、 眼泪中存[/size][size=12px]在有溶解细菌细胞壁的酶,[/size][size=12px] 因其具有溶菌作用, 故命名为溶[/size][size=12px]菌酶。[/size][size=12px] 此后在人和动物的多种组织、 分泌液, 及某些植物、[/size][size=12px]微生物中也发现了溶菌酶的存在。[/size][size=12px] 随着研究的不断深入, 发[/size][size=12px]现不仅有溶解细菌细胞壁的溶菌酶,[/size][size=12px] 还有作用于真菌细胞壁[/size][size=12px]的种类,[/size][size=12px] 同时对其作用机制也有了更进一步的了解。 近几[/size][size=12px]年,[/size][size=12px] 人们根据溶菌酶的溶菌特性, 将其应用于医疗、 食品、[/size][size=12px]畜牧及生物工程中。[/size][size=12px]溶菌酶来源不同,其分子大小不一样,其氨基酸排列顺序也有所不同,如:[/size][size=12px] T4 噬菌体溶菌酶由 164 个[/size][size=12px]氨基酸组成,分子量为[/size][size=12px] 19 ku;鸡蛋溶菌酶只有 129 个[/size][size=12px]氨基酸,其分子量约为[/size][size=12px] 14.3 ku;人溶菌酶由 130 个氨[/size][size=12px]基酸残基组成,分子量为[/size][size=12px] 14.6 ku;植物中分离出的溶[/size][size=12px]菌酶,其分子量较大,约为[/size][size=12px] 24 ku~29 ku。各种溶菌酶[/size][size=12px]的等电点在[/size][size=12px] 10.7~11.5 之间,化学性质十分稳定, pH 在1.2~11.3 范围内剧烈变化时,其结构几乎不变,活性不[/size][size=12px]受影响,此外,溶菌酶对热也极为稳定,在[/size][size=12px] pH3.0 条件[/size][size=12px]下,沸水浴中加热[/size][size=12px] 60 min 其活力仍保持 90 %以上。[/size][size=12px]目前鸡蛋清溶菌酶是研究最清楚的一种溶菌酶并已投入商业化生产。它是由[/size][size=12px] 18 种 129 个氨基酸残基[/size][size=12px]构成的单一肽链,有[/size][size=12px] 4 个 S-S 键的氨基酸 Cys,等电点[/size][size=12px]约为[/size][size=12px] 11.1,最适溶菌温度为 45 ℃~50 ℃, pH 为 6.0~7.0。在酸性环境中,溶菌酶对热的稳定性很强, pH4~7[/size][size=12px]范围内,[/size][size=12px] 100 ℃处理 1 min 仍有近 100 的活力, 210 ℃加[/size][size=12px]热[/size][size=12px] 1.5 h 仍具有活性;在中性水溶液中,溶菌酶可维持[/size][size=12px]数天而不失去活性;在碱性条件下,其稳定性较差[/size][size=12px]。[/size][font='宋体'][size=14px]1. [/size][/font][font='宋体'][size=12px]溶菌酶的理化性质[/size][/font][size=12px]溶菌酶纯品呈白色、微黄或黄色的结晶体或无定形粉末,无异味,微甜,易溶于水,不溶于丙酮、乙醚。溶菌酶遇碱易被破坏,但在酸性环境下,溶菌酶对热的稳定性很强,在[/size][size=12px]pH值为4-7时,100℃处理1min,仍能较好地保持活力:pH值为3时,能耐100℃加热处理45min。 [/size][size=12px]溶菌酶化学性质非常稳定,当[/size][size=12px]pH值在一定范围内剧烈变化时,其结构几乎不变。溶菌酶不可逆变性的临界点是77℃,随溶剂的变化,不可逆变性临界点也发生变化,当溶菌酶所处溶液pH值小于1时,不可逆变性临界点降低到43℃。[/size][size=12px]溶菌酶最适[/size][size=12px]pH为5.3~6.4,可用于低酸性食品防腐;溶菌酶作为防腐剂安全性高,可被冷冻或干燥处理,且活力稳定。 [/size][size=12px]溶菌酶对几种变性剂的敏感程度为[/size][size=12px]:二恶烷二甲基乙酰胺二甲基甲酰胺丙酮,并且随溶剂用量的增加而直线下降。[/size][font='宋体'][size=14px]2. [/size][/font][font='宋体'][size=12px]溶菌酶的制备[/size][/font][size=12px]目前溶菌酶可以以鸡蛋清和蛋壳膜为材料提取制得,常用的方法有亲和层析法、离子交换树脂法、直接结晶法和聚丙烯酸沉淀法等。[/size][size=12px]亲和层析法是利用蛋白质和酶的生物学特异性,即蛋白质或酶与其配体之间所具有的专一性亲和力而设计的色谱技术。酶一底物复合物形成之后,在一定的条件下分离复合物便得到纯净的酶。常常使用的吸附剂为几丁质及其衍生物,如:几丁质粉、羧甲基几丁质、几丁质包埋纤维素、脱氨几丁质粉、[/size][size=12px]N-酰化壳聚糖、脱氨再生几丁质凝胶。[/size][size=12px]离子交换法是利用离子交换剂与溶液中的离子之间所生的交换反应来进行分离的,分离的效果较好,广泛用于微量组分的富集。一般流程为:鲜蛋一预处理一搅拌吸附一上柱洗脱一等电点沉淀一透析一喷雾干燥一成品。[/size][size=12px]溶菌酶在等电点以下较广泛的[/size][size=12px]pH值范围内,分子带正电荷,可吸附于弱酸性阳离子交换树脂上,洗脱后盐析,可得溶菌酶沉淀,再进行精制可得成品。蛋清吸附724树脂,洗涤缓冲液洗脱,硫酸铵溶液盐析透析,用NaOH去碱性蛋白,冻干溶菌酶,冻干粉沉淀干燥得到溶菌酶。在5—10℃下,将新鲜蛋清540kg加入到已处理好的80kg 724树脂中,搅拌吸附6h,在0—5℃静置过夜。倾出上层蛋清,树脂离心甩干,用蒸馏水反复洗去黏附的卵蛋白,然后将树脂装入柱内,用0.15mol/L、pH=6.5磷酸缓冲溶液约150L洗涤树脂,再用约600L的10%硫酸铵溶液洗脱,收集洗脱液。洗脱液中加硫酸铵,使最终含硫酸铵量为40%,有白色沉淀生成,冷处放置过夜。虹吸上层清液,沉淀吸滤抽干,再用1倍蒸馏水溶解沉淀呈稀糊状,然后装入透析袋,在约5℃的条件下,对蒸馏水透析24h左右,中间换水2—3次。离心去除沉淀,沉淀再用少量水洗一次,洗液与离心液合并。再往透析清液中慢慢加入1mol/L氢氧化钠溶液,同时不断搅拌,使pH值上升到8.0—9.0,如有白色沉淀,即离心除去。然后用3mol/L盐酸调pH=5.0,冷冻干燥,即得白色片状溶菌酶。也可将离心液用3mol/L盐酸调pH=3.5,在搅拌下缓慢加入5%的固体氯化钠,在约5℃的温度下静置48h,离心,沉淀用0℃丙酮洗涤,干燥,即得溶菌酶。[/size][size=12px]在蛋清中加入一定量的碘化物或碳酸盐等盐类,并调[/size][size=12px]pH值至9.5—10.0,溶菌酶会以结晶形式慢慢析出,而大多数蛋白质仍然在溶液。在超滤浓缩脱盐后,为获得较纯产品,采用结晶纯化酶液经超滤处理后,用NaOH调整pH 9.5,离心去除。上清液在缓缓搅拌下,加NaCl至5%,静置一周,得粗结晶。结晶溶于pH 4.6醋酸水中,分去不溶物后,进行重结晶,结晶的最终得率为60%左右。即每公斤蛋清中可得重结晶品近1.3 g,活力测定为8000U/mg。 [/size][size=12px]聚丙烯酸沉淀法为将提取过滤后含酶洗脱液,首先经过吸附步骤,即将过滤后的澄清溶液用[/size][size=12px]20%的NaOH溶液调pH至6.0,在调pH值的过程中不停的搅拌。有少量的乳白色沉淀析出,然后加入15%聚丙烯酸,立即有白色沉淀析出,加至pH值为3.0为止,静置17个小时进行静析,得到粘附于底部的乳白色胶状物。第二步解离,将前步得到的溶菌酶聚丙烯酸凝聚物。加入少量蒸馏水并用0.5 mol/L的碳酸钠,将其溶解,转移后,将pH值调到9.5。加入5%CaCl2溶液将溶菌酶聚丙烯酸解离,至无沉淀析出,然后过滤,得到澄清溶液。第三步盐[/size][size=12px]析,将所得澄清溶液加入[/size][size=12px]5%的NaCI溶液搅拌均匀。放入冰箱调温度为0℃。待有晶体析出后,用无水乙醇洗涤数次,置恒温培养箱中40℃条件下干燥称重。[/size][font='宋体'][size=14px]3. [/size][/font][font='宋体'][size=12px]溶菌酶的应用[/size][/font][font='宋体'][size=12px]本文主要从溶菌酶在食品添加剂中的应用展开进行论述。[/size][/font][size=12px]3[/size][size=12px].1 用于水产、肉类的防腐[/size][size=12px]将溶菌酶应用于水产品、肉类的保鲜防腐,目前已做了大量的研究。如早在[/size][size=12px] 2001 年前陈舜胜等就研[/size][size=12px]究了溶菌酶复合保鲜剂在冷藏([/size][size=12px]5 ℃)与冰藏(0 ℃~1 ℃)[/size][size=12px]条件下对虾、带鱼段、扇贝柱和柔鱼的保鲜效果,结果表明,使用溶菌酶([/size][size=12px]0.05 %)复合保鲜液浸泡后冷藏或[/size][size=12px]用溶菌酶([/size][size=12px]0.05 %~0.08 %)复合保鲜液制备保鲜冰冰[/size][size=12px]藏,与常规保鲜方法相比,可将上述水产品的保鲜期延长约一倍的时间。[/size][size=12px]2012 年张观科又报道:采用溶[/size][size=12px]菌酶、[/size][size=12px]Nisin、甘氨酸、VC、山梨酸钾、NaCl 等不同的配比[/size][size=12px]的复合生物保鲜剂在不同温度对牡蛎进行保鲜贮藏研究。结果表明,采用[/size][size=12px] Nisin 和溶菌酶配合的生物保鲜[/size][size=12px]剂的保鲜效果最佳(在[/size][size=12px]-3 ℃微冻条件下,保藏 30 天后[/size][size=12px]感官性状仍然良好)[/size][size=12px] 。而钱曦利用海藻糖、蜂胶、茶多[/size][size=12px]酚、魔芋葡甘露聚糖、[/size][size=12px]Nisin、溶菌酶、壳聚糖和姜汁 8种[/size][size=12px]天然保鲜剂对鹿肉保鲜进行研究,结果表明:单独使用时,溶菌酶对鹿肉样品就有较明显的抑菌作用(最佳抑菌浓度为[/size][size=12px] 0.5 %);而采用复合天然保鲜剂(茶多[/size][size=12px]酚、溶菌酶、海藻糖、[/size][size=12px]Nisin 复合)效果更好,可以有效的[/size][size=12px]提高鹿肉的货架期至[/size][size=12px] 36 d。从以上研究结果来看,溶菌[/size][size=12px]酶尤其是它在与其他保鲜剂按一定比例复合使用时,对水产及肉类能起到较好的防腐保鲜效果。[/size][size=12px]3[/size][size=12px].2 在低度酒类、饮料中的应用[/size][size=12px]日本已成功的使用鸡蛋清溶菌酶代替水杨酸作防腐剂用于清酒的防腐[/size][size=12px]。在国内,倪瑛和钟立人研[/size][size=12px]究了溶菌酶在葡萄酒生产中的应用。因为在葡萄酒生产中乳酸菌会将苹果酸转变为乳酸,但如果在酒精发[/size][size=12px]酵的前期就完成了这种反应,会对葡萄酒的感官产生不良影响,而控制乳酸菌生长的传统方法是使用[/size][size=12px] SO2,[/size][size=12px]但[/size][size=12px] SO2 的使用不仅对人体产生毒性,同样影响葡萄酒[/size][size=12px]的品质。因此,倪瑛等尝试将溶菌酶替代或补充[/size][size=12px] SO2 调[/size][size=12px]控乳酸菌的生长,结果显示,在葡萄原汁中加入[/size][size=12px] 0.1 %~0.15 %的溶菌酶,乳酸菌生长被抑制;在白葡萄酒中溶[/size][size=12px]菌酶剂量加至[/size][size=12px] 0.5 %时,可完全抑制苹果酸向乳酸的转[/size][size=12px]变。此外,将溶菌酶用于饮料防腐也有报道,如常凯等将溶菌酶([/size][size=12px]0.05 %) 、甘氨酸和 NaCl 进行复配用于生[/size][size=12px]产脱脂山核桃乳,其抑菌效果较显著,降低了山核桃乳的杀菌强度,延长了产品货架期。从以上结果看,在葡萄酒的生产中溶菌酶可作为[/size][size=12px]SO2 天然的、安全的替代或补充品来抑制乳酸菌的生[/size][size=12px]长,在其他低度果酒中也可做类似的尝试;同样将溶菌酶用饮料的防腐也有较显著的效果。[/size][size=12px]3[/size][size=12px].3 在乳制品中的应用[/size][size=12px]由于溶菌酶对肠道中腐败性微生物有特殊的杀灭作用,同时可直接或间接地促进肠道中双歧杆菌的增殖[/size][size=12px]。因此,有大量有关溶菌酶应用于婴幼儿奶粉的[/size][size=12px]专题论述[/size][size=12px] 冯棋琴,等:溶菌酶在食品工业中的研究进展[/size][size=12px]35研究报道,如刘浩强等研究了鸡蛋溶菌酶对婴幼儿[/size][size=12px]配方奶粉的抑菌效果,结果表明,婴幼儿配方奶粉在喷雾干燥后添加[/size][size=12px] 10 mg/100 mL~50 mg/100 mL 的鸡蛋[/size][size=12px]溶菌酶效果最好。张明江[/size][size=12px]等关于婴幼儿配方奶粉中[/size][size=12px]溶菌酶的添加工艺的研究也得出了相似的结论,既奶粉喷雾干燥后添加[/size][size=12px] 500 mg/L 的溶菌酶抑菌效果最好。[/size][size=12px]3[/size][size=12px].4 在水果保鲜上的应用[/size][size=12px]水果经过溶菌酶处理,其表面的细菌被有效的抑制或杀灭,从而延长水果的保鲜期。胡晓亮等[/size][size=12px]采用溶[/size][size=12px]菌酶与溶菌酶复合保鲜剂对马陆葡萄进行涂膜保鲜,结果表明:溶菌酶单独使用有一定的保鲜效果,但将溶菌酶([/size][size=12px]0.1 %)和海藻酸钠(1 %)复合使用对抑制马陆[/size][size=12px]葡萄的感官品质下降效果更为显著,在([/size][size=12px]4±1) ℃条件下[/size][size=12px]贮藏[/size][size=12px] 25 d 后,仍保持果实的硬度和组织形态,质量损[/size][size=12px]失率仅为[/size][size=12px] 9.34 %。[/size][size=12px]溶菌酶本身作为一种天然蛋白质,能在胃肠内作为营养物质被消化和吸收,对机体无毒性,也不会在体内残留,安全性很高,加之有效的防腐特性,溶菌酶已受到了食品行业的青睐。但目前实际应用的且已商品化的是鸡蛋清溶菌酶,它的抗菌谱较窄,只对[/size][size=12px] G+细菌起作用,底物特异性[/size][size=12px]强,且投入[/size][size=12px]/效率低,这限制了它们的广泛使用。为了扩[/size][size=12px]大溶菌酶使用领域及防腐效果,可以将鸡蛋清溶菌酶与其他天然保鲜剂(如海藻糖、茶多酚、[/size][size=12px]Nisin、溶菌酶、[/size][size=12px]壳聚糖等)配合使用。[/size][size=12px]此外,随着科学技术的发展,人们还可以采用一些高科技手段(如采用微生物发酵法生产溶菌酶,采用酶修饰法合成溶菌酶复合物如溶菌酶[/size][size=12px]-环糊精、溶菌酶-半乳甘露聚糖等)生产并改良溶[/size][size=12px]菌酶。经过改良的溶菌酶不仅抗菌活性稳定,而且具有良好的乳化性能。当这些杀菌谱广、成本低、安全性高溶菌酶复合剂以及人工合成溶菌酶商品化时,溶菌酶的使用范围定会越来越广,将会在各行业发挥不可估量的作用。[/size][font='宋体'][size=14px]4. [/size][/font][font='宋体'][size=12px]溶菌酶的限量,检测与标准[/size][/font][size=12px]溶菌酶可水解细菌的细胞壁[/size][size=12px], 造成藤黄微球菌的溶解而引起溶液吸光度值的降低。[/size][size=12px]一个溶菌酶活力单位定义为[/size][size=12px]25 ℃ ,pH 6.2 条件下, 使用藤黄微球菌悬浊液在450 nm 处每分钟引[/size][size=12px]起吸光度变化为[/size][size=12px]0.001 所需溶菌酶的量。[/size][size=12px]试剂和材料[/size][size=12px]藤黄微球菌:ATCC4698 或 CICC10680。[/size][size=12px]0.1 mol/L 磷酸盐缓冲液:pH 6.2。[/size][size=12px]称取[/size][size=12px]11.70 g 磷酸二氢钠(NaH[/size][font='宋体'][size=12px]2[/size][/font][size=12px]PO[/size][font='宋体'][size=12px]4[/size][/font][size=12px] 2H[/size][font='宋体'][size=12px]2[/size][/font][size=12px]O) 、7.86 g 磷酸氢二钠(Na[/size][font='宋体'][size=12px]2[/size][/font][size=12px]HPO[/size][font='宋体'][size=12px]4[/size][/font][size=12px]12H[/size][font='宋体'][size=12px]2[/size][/font][size=12px]O) 及0.372 g[/size][size=12px]乙二[/size][size=12px]胺四乙酸二钠 (EDTA-[/size][font='宋体'][size=12px]2[/size][/font][size=12px]Na)于无菌水中并稀释定容至1000mL。调整缓溶液pH至6.2±0.1。[/size][size=12px]注[/size][size=12px]: 用小份缓冲溶液检查pH, 以避免缓冲溶液被污染。如果需要, 通过加入更多的磷酸二氢钠溶液或磷酸氢二钠[/size][size=12px]溶液调整[/size][size=12px]pH。[/size][size=12px]溶菌酶标准品: 蛋清溶菌酶。[/size][size=12px]底物溶液: 用磷酸盐缓冲液制备50 mL 藤黄微球菌悬浊液。 使用前, 底物于37 ℃ 培养30 min。[/size][size=12px]该底物溶液室温下可稳定[/size][size=12px]2 h。 以磷酸盐缓冲液调分光光度计零点, 然后测定底物溶液的吸光度,450 nm 下读数应为0.70±0.1。[/size][size=12px]仪器和设备[/size][size=12px]分光光度计: 精度±0.001。pH 计。[/size][size=12px]注[/size][size=12px]: 所用的器皿应保持无菌, 保证工作环境的清洁。[/size][size=12px]分析步骤[/size][size=12px]试样溶液的制备[/size][size=12px]准确称取[/size][size=12px]100 mg±0.1 mg 试样, 置于50 mL 容量瓶中, 用约25 mL 磷酸盐缓冲液搅拌溶解并稀释[/size][size=12px]定容[/size][size=12px], 充分混匀。 再转移3 mL 上述试样制备溶液至100 mL 容量瓶中, 用磷酸盐缓冲液搅拌溶解并稀[/size][size=12px]释定容。[/size][size=12px]标准溶液的制备[/size][size=12px]精确称取[/size][size=12px]50 mg 蛋清溶菌酶标准品于50 mL 容量瓶中, 用约25 mL 磷酸盐缓冲液搅拌溶解并稀释[/size][size=12px]定容[/size][size=12px], 充分混匀(如果需要, 冷冻该溶液以备后续测定)。转移3 mL 上述标准制备溶液至100 mL容量[/size][size=12px]瓶中[/size][size=12px], 用磷酸盐缓冲液搅拌溶解并稀释定容。测定[/size][size=12px]取[/size][size=12px]3 份标准溶液和3 份试样溶液进行测定。[/size][size=12px]25 ℃ 室温下, 将1 cm 比色皿放入分光光度计, 用磷酸盐缓冲液调整吸光度零点。 吸2.9 mL 底物[/size][size=12px]溶液于比色皿[/size][size=12px], 最初450 nm 处吸光度应为0.70±0.10,3 min 之内初始吸光度值变化应小于或等于0.003 时, 方可开始测定。 吸取0.1 mL 标准溶液加入底物溶液, 充分混合。 记录3 min 吸光度值的变[/size][size=12px]化[/size][size=12px], 每15s 记录一次吸光度值。 每分钟吸光度值变化应在0.03~0.08, 若不在要求范围需调整试样溶液[/size][size=12px]的浓度。[/size][size=12px] 重复操作测定试样溶液。[/size][size=12px]反应[/size][size=12px]1 min 后稳定, 计算时忽略最初1 min 的读数。[/size][size=12px]结果计算[/size][size=12px]酶活力[/size][size=12px] X , 按式计算:[/size][align=center][size=12px]X =(A[/size][font='宋体'][size=12px]1[/size][/font][size=12px] -A[/size][font='宋体'][size=12px]2[/size][/font][size=12px])[/size][size=12px]/([/size][size=12px]2 × m ×0.001[/size][size=12px])[/size][/align][size=12px]式中[/size][size=12px]:[/size][size=12px]A1 ———[/size][size=12px]试样在[/size][size=12px]450 nm [/size][size=12px]处反应[/size][size=12px]1 min [/size][size=12px]时的吸光度[/size][size=12px] [/size][size=12px]A2 ———[/size][size=12px]试样在[/size][size=12px]450 nm [/size][size=12px]处反应[/size][size=12px]3 min [/size][size=12px]时的吸光度[/size][size=12px] [/size][size=12px]m ———用于分析的试样制备溶液中的溶菌酶质量, 单位为毫克(mg) [/size][size=12px]2 ———获得1 min 和3 min 吸光度读数所用的时间, 单位为分钟(min) [/size][size=12px]0.001———由单位溶菌酶每分钟引起的吸光度降低的值。[/size][size=12px]试验结果以平行测定结果的算术平均值为准。[/size][size=12px] 在重复性条件下获得的两次独立测定结果的绝对差[/size][size=12px]值不大于算术平均值的[/size][size=12px]10%。[/size][size=12px]最终对于溶菌酶的检测要求罗列如下:[/size][img]https://ng1.17img.cn/bbsfiles/images/2021/08/202108081546089787_7027_1608728_3.png[/img][align=center][img]https://ng1.17img.cn/bbsfiles/images/2021/08/202108081546090379_7253_1608728_3.png[/img][/align][align=center][img]https://ng1.17img.cn/bbsfiles/images/2021/08/202108081546091326_4621_1608728_3.png[/img][/align][size=12px]注:本标准适用于以鸡蛋清为原料[/size][size=12px], 经提取、精制等工艺制得的食品添加剂溶菌酶。[/size][size=12px]溶菌酶作为一种天然球状蛋白质,[/size][size=12px] 能促进营养物质被人[/size][size=12px]体消化吸收,[/size][size=12px] 对人体无毒性, 也不会在体内残留, 是一种安[/size][size=12px]全性很高的食品保鲜剂、[/size][size=12px] 营养保健品和药品。 由于每一类型[/size][size=12px]的溶菌酶都有其最适的作用条件,[/size][size=12px] 而且底物特异性强, 因[/size][size=12px]此,[/size][size=12px] 在应用溶菌酶时, 必需注意以下几个事项: ①充分掌握[/size][size=12px]溶菌酶的酶学特性,[/size][size=12px] 掌握食品中的营养成分、 pH 值、 食盐[/size][size=12px]浓度等影响溶菌酶效果的因素以及造成某种食品腐败的主要微生物群体,[/size][size=12px] 采用适当的添加量和添加方法才能收到应有的[/size][size=12px]防腐效果。[/size][size=12px] ②为了有效的发挥溶菌酶作用效力, 可以考虑与[/size][size=12px]其它物质配伍使用。[/size][size=12px] 如将溶菌酶与甘氨酸混合使用, 其防腐[/size][size=12px]效果则远远高于单独使用溶菌酶。[/size][size=12px] 因为甘氨酸含量达到一定[/size][size=12px]程度时,[/size][size=12px] 能抑制微生物细胞壁的合成, 这种作用对革兰氏阳[/size][size=12px]性菌和阴性菌均有效,[/size][size=12px] 从而增了溶菌酶效力的发挥。 也可[/size][size=12px]以考虑与植酸、[/size][size=12px] 聚合磷酸盐等配伍使用, 以增强溶菌酶革兰[/size][size=12px]氏阴性细菌的抑菌作用。[/size][size=12px] 不管与哪种物质配伍使用, 使用之[/size][size=12px]前都要进行小试。[/size][size=12px]参考文献:[/size][font='宋体'][size=14px][1] [/size][/font][font='宋体'][size=12px]GB 1886.257-2016,食品安全国家标准 食品添加剂 溶菌酶[s].[/s][/size][/font][font='宋体'][size=14px][2] [/size][/font][font='宋体'][size=12px]范林林[/size][/font][font='宋体'][size=12px], 林楠, 冯叙桥,等. 溶菌酶及其在食品工业中的应用[J]. 食品与发酵工业, 2015, 41(003):248-253.[/size][/font][font='宋体'][size=14px][3] [/size][/font][font='宋体'][size=12px]冯棋琴[/size][/font][font='宋体'][size=12px], 周立梅, 高文功,等. 溶菌酶在食品工业中的研究进展[J]. 食品研究与开发, 2015, 000(005):134-136[/size][/font][font='宋体'][size=14px][4] [/size][/font][font='宋体'][size=12px]张新宝[/size][/font][font='宋体'][size=12px], 陈红兵. 溶菌酶的性质及其在食品防腐中的应用[J]. 江西食品工业, 2008(4):42-45[/size][/font]
[color=#444444]实验需要定量牛血清白蛋白(BSA)和溶菌酶(LYZ)混合溶液中各自的含量是多少,用的是安捷伦1260高效液相,色谱柱C-18,25cm,300A,流动相A 0.1%三氟乙酸水溶液。流动相B 0.1%三氟乙酸乙腈溶液,但是怎么走梯度都分不开啊,总是在间隔不到1分中出峰。求大神指点[/color]
我将需要浓缩的蛋白质溶液在-20℃下冷冻20h后在室温下冷却,结果蛋白质形成絮状析出,而且析出的蛋白质能用砂芯过滤器过滤得到比较干的滤饼。这样等到的蛋白质变性了吗?低温可使蛋白质浓缩凝胶析出,这样的蛋白质与之前没处理的蛋白质溶液相比变性了吗?
[font=宋体]蛋白质的分离纯化是生物科学领域中的一项关键技术,它涉及到从复杂的混合物中分离并纯化出特定的蛋白质。这个过程通常包括多个步骤,每个步骤都需要精确的操作和优化,以确保最终得到的蛋白质具有高纯度和活性。下面我们将详细介绍蛋白质的分离纯化步骤。[/font][font=宋体] [/font][font=宋体][b]分离纯化某一特定蛋白质的一般程序可以分为前处理、粗分离、精细分离三个步骤。[/b][/font][font=宋体] [/font][font=宋体][b]①前处理[/b][/font][font=宋体] [/font][font=宋体]分离纯化某种蛋白质,首先要把蛋白质从原来的组织或细胞中以溶解的状态释放出来并保持原来的天然状态,不丢失生物活性。[/font][font=宋体] [/font][font=宋体]为此,动物材料应先剔除结缔组织和脂肪组织,种子材料应先去壳甚至去种皮以免受单宁等物质的污染,油料种子最好先用低沸点的有机溶剂如乙醚等脱脂。然后根据不同的情况,选择适当的方法,将组织和细胞破碎。[/font][font=宋体] [/font][font=宋体]动物组织和细胞可用电动捣碎机或匀浆机破碎或用超声波处理破碎。植物组织和细胞一般需要用石英砂或玻璃粉和适当的提取液一起研磨的方法或用纤维素酶处理也能达到目的。细菌细胞的破碎比较麻烦,破碎细菌细胞壁的常用方法有超声波破碎,与砂研磨、高压挤压或溶菌酶处理等。[/font][font=宋体] [/font][font=宋体]组织和细胞破碎后,选择适当的缓冲液把所要的蛋白提取出来。细胞碎片等不溶物用离心或过滤的方法除去。[/font][font=宋体] [/font][font=宋体]如果所要的蛋白主要集中在某一细胞组分,如细胞核、染色体、核糖体或可溶性细胞质等,则可利用差速离心的方法将它们分开,收集该细胞组分作为下步纯化的材料。如果碰上所要蛋白是与细胞膜或膜质细胞器结合的,则必须利用超声波或去污剂使膜结构解聚,然后用适当介质提取。[/font][font=宋体] [/font][font=宋体][b]②粗分离[/b][/font][font=宋体] [/font][font=宋体]当蛋白质提取液(有时还杂有核酸、多糖之类)获得后,选用一套适当的方法,将所要的蛋白与其他杂蛋白分离开来。一般这一步的分离用超滤、盐析、等电点沉淀和有机溶剂分级分离等方法。这些方法的特点是简便、处理量大,既能除去大量杂质,又能浓缩蛋白溶液。[/font][font=宋体] [/font][font=宋体][b]③精细分离[/b][/font][font=宋体] [/font][font=宋体]样品经粗分级分离以后,一般体积较小,杂蛋白大部分已被除去。进一步纯化,一般使用层析法包括离子交换层析、亲和层析、疏水层析以及分子筛等。必要时还可选择电泳法,包括区带电泳、等电点聚焦等作为最后的纯化步骤。用于细分级分离的方法一般规模较小,但分辨率很高。[/font][font=宋体] [/font][font=宋体]结晶是[url=https://cn.sinobiological.com/resource/protein-review/protein-purification][b]蛋白质分离纯化[/b][/url]的最后步骤。尽管结晶过程并不能保证蛋白一定是均一的,但是只有某种蛋白在溶液中数量上占有优势时才能形成结晶。结晶过程本身也伴随着一定程度的纯化,而重结晶又可除去少量夹杂的蛋白。由于结晶过程中从未发现过变性蛋白,因此蛋白的结晶不仅是纯度的一个标志,也是断定制品处于天然状态的有力指标。[/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州提供[url=https://cn.sinobiological.com/services/recombinant-protein-expression-service][b]重组蛋白表达服务[/b][/url][/font][font=宋体],可以根据客户需求,选用不同表达[/font][font=Calibri]/[/font][font=宋体]纯化标签、表达宿主等,真正为客户实现深度私人定制。[/font][/font][font=宋体][font=宋体]蛋白纯化详情:[/font][font=Calibri]https://cn.sinobiological.com/resource/protein-review/protein-purification[/font][/font]
[color=#444444]在用蛋白质进液相和凝胶色谱的时候是怎样让蛋白质溶解的啊?我看到用碱液可以让蛋白质溶解,那一般多少ph的碱液或者说多少浓度的碱液可以让蛋白质溶解呢,谢谢[/color]
[size=3]选择材料及预处理 以蛋白质和结构与功能为基础,从分子水平上认识生命现象,已经成为现代生物学发展的主要方向,研究蛋白质,首先要得到高度纯化并具有生物活性的目的物质。蛋白质的制备工作涉及物理、化学和生物等各方面知识,但基本原理不外乎两方面。一是得用混合物中几个组分分配率的差别,把它们分配到可用机械方法分离的两个或几个物相中,如盐析,有机溶剂提取,层析和结晶等;二是将混合物置于单一物相中,通过物理力场的作用使各组分分配于来同区域而达到分离目的,如电泳,超速离心,超滤等。在所有这些方法的应用中必须注意保存生物大分子的完整性,防止酸、硷、高温,剧烈机械作用而导致所提物质生物活性的丧失。蛋白质的制备一般分为以下四个阶段:选择材料和预处理,细胞的破碎及细胞器的分离,提取和纯化,浓细、干燥和保存。 微生物、植物和动物都可做为制备蛋白质的原材料,所选用的材料主要依据实验目的来确定。对于微生物,应注意它的生长期,在微生物的对数生长期,酶和核酸的含量较高,可以获得高产量,以微生物为材料时有两种情况:(1)得用微生物菌体分泌到培养基中的代谢产物和胞外酶等;(2)利用菌体含有的生化物质,如蛋白质、核酸和胞内酶等。植物材料必须经过去壳,脱脂并注意植物品种和生长发育状况不同,其中所含生物大分子的量变化很大,另外与季节性关系密切。对动物组织,必须选择有效成份含量丰富的脏器组织为原材料,先进行绞碎、脱脂等处理。另外,对预处理好的材料,若不立即进行实验,应冷冻保存,对于易分解的生物大分子应选用新鲜材料制备。 蛋白质的分离纯化 一,蛋白质(包括酶)的提取 大部分蛋白质都可溶于水、稀盐、稀酸或碱溶液,少数与脂类结合的蛋白质则溶于乙醇、丙酮、丁醇等有机溶剂中,因些,可采用不同溶剂提取分离和纯化蛋白质及酶。 (一)水溶液提取法 稀盐和缓冲系统的水溶液对蛋白质稳定性好、溶解度大、是提取蛋白质最常用的溶剂,通常用量是原材料体积的1-5倍,提取时需要均匀的搅拌,以利于蛋白质的溶解。提取的温度要视有效成份性质而定。一方面,多数蛋白质的溶解度随着温度的升高而增大,因此,温度高利于溶解,缩短提取时间。但另一方面,温度升高会使蛋白质变性失活,因此,基于这一点考虑提取蛋白质和酶时一般采用低温(5度以下)操作。为了避免蛋白质提以过程中的降解,可加入蛋白水解酶抑制剂(如二异丙基氟磷酸,碘乙酸等)。下面着重讨论提取液的pH值和盐浓度的选择。[/size]
基因组(genome)包含的遗传信息经转录产生mRNA,一个细胞在特定生理或病理状态下表达的所有种类的mRNA称为转录子组(transcriptome)。很显然,不同细胞在不同生理或病理状态下转录子组包含的mRNA的种类不尽相同。mRNA经翻译产生蛋白质,一个细胞在特定生理或病理状态下表达的所有种类的蛋白质称为蛋白质组(proteome)。同理,不同细胞在不同生理或病理状态下所表达的蛋白质的种类也不尽相同。蛋白质是基因功能的实施者,因此对蛋白质结构,定位和蛋白质-蛋白质相互作用的研究将为阐明生命现象的本质提供直接的基础。生命科学是实验科学,因此生命科学的发展极大地依赖于实验技术的发展。以DNA序列分析技术为核心的基因组研究技术推动了基因组研究的日新月异,而以基因芯片技术为代表的基因表达研究技术为科学家了解基因表达规律立下汗马功劳。在蛋白质组研究中,二维电泳和质谱技术的黄金组合又为科学家掌握蛋白质表达规律再铸辉煌。蛋白质组学(proteomics)就是指研究蛋白质组的技术及这些研究得到的结果。蛋白质组学的研究试图比较细胞在不同生理或病理条件下蛋白质表达的异同,对相关蛋白质进行分类和鉴定。更重要的是蛋白质组学的研究要分析蛋白质间相互作用和蛋白质的功能。蛋白质组学的研究内容包括:1.蛋白质鉴定:可以利用一维电泳和二维电泳并结合Western等技术,利用蛋白质芯片和抗体芯片及免疫共沉淀等技术对蛋白质进行鉴定研究。2.翻译后修饰:很多mRNA表达产生的蛋白质要经历翻译后修饰如磷酸化,糖基化,酶原激活等。翻译后修饰是蛋白质调节功能的重要方式,因此对蛋白质翻译后修饰的研究对阐明蛋白质的功能具有重要作用。3.蛋白质功能确定:如分析酶活性和确定酶底物,细胞因子的生物分析/配基-受体结合分析。可以利用基因敲除和反义技术分析基因表达产物-蛋白质的功能。另外对蛋白质表达出来后在细胞内的定位研究也在一定程度上有助于蛋白质功能的了解。Clontech的荧光蛋白表达系统就是研究蛋白质在细胞内定位的一个很好的工具。4.对人类而言,蛋白质组学的研究最终要服务于人类的健康,主要指促进分子医学的发展。如寻找药物的靶分子。很多药物本身就是蛋白质,而很多药物的靶分子也是蛋白质。药物也可以干预蛋白质-蛋白质相互作用。在基础医学和疾病机理研究中,了解人不同发育、生长期和不同生理、病理条件下及不同细胞类型的基因表达的特点具有特别重要的意义。这些研究可能找到直接与特定生理或病理状态相关的分子,进一步为设计作用于特定靶分子的药物奠定基础。不同发育、生长期和不同生理、病理条件下不同的细胞类型的基因表达是不一致的,因此对蛋白质表达的研究应该精确到细胞甚至亚细胞水平。可以利用免疫组织化学技术达到这个目的,但该技术的致命缺点是通量低。LCM技术可以精确地从组织切片中取出研究者感兴趣的细胞类型,因此LCM技术实际上是一种原位技术。取出的细胞用于蛋白质样品的制备,结合抗体芯片或二维电泳-质谱的技术路线,可以对蛋白质的表达进行原位的高通量的研究。很多研究采用匀浆组织制备蛋白质样品的技术路线,其研究结论值得怀疑,因为组织匀浆后不同细胞类型的蛋白质混杂在一起,最后得到的研究数据根本无法解释蛋白质在每类细胞中的表达情况。虽然培养细胞可以得到单一类型细胞,但体外培养的细胞很难模拟体内细胞的环境,因此这样研究得出的结论也很难用于解释在体实际情况。因此在研究中首先应该将不同细胞类型分离,分离出来的不同类型细胞可以用于基因表达研究,包括mRNA和蛋白质的表达。LCM技术获得的细胞可以用于蛋白质样品的制备。可以根据需要制备总蛋白,或膜蛋白,或核蛋白等,也可以富集糖蛋白,或通过去除白蛋白来减少蛋白质类型的复杂程度。相关试剂盒均有厂商提供。蛋白质样品中的不同类型的蛋白质可以通过二维电泳进行分离。二维电泳可以将不同种类的蛋白质按照等电点和分子量差异进行高分辨率的分离。成功的二维电泳可以将2000到3000种蛋白质进行分离。电泳后对胶进行高灵敏度的染色如银染和荧光染色。如果是比较两种样品之间蛋白质表达的异同,可以在同样条件下分别制备二者的蛋白质样品,然后在同样条件下进行二维电泳,染色后比较两块胶。也可以将二者的蛋白质样品分别用不同的荧光染料标记,然后两种蛋白质样品在一块胶上进行二维电泳的分离,最后通过荧光扫描技术分析结果。胶染色后可以利用凝胶图象分析系统成像,然后通过分析软件对蛋白质点进行定量分析,并且对感兴趣的蛋白质点进行定位。通过专门的蛋白质点切割系统,可以将蛋白质点所在的胶区域进行精确切割。接着对胶中蛋白质进行酶切消化,酶切后的消化物经脱盐/浓缩处理后就可以通过点样系统将蛋白质点样到特定的材料的表面(MALDI-TOF)。最后这些蛋白质就可以在质谱系统中进行分析,从而得到蛋白质的定性数据;这些数据可以用于构建数据库或和已有的数据库进行比较分析。实际上像人类的血浆,尿液,脑脊液,乳腺,心脏,膀胱癌和磷状细胞癌及多种病原微生物的蛋白质样品的二维电泳数据库已经建立起来,研究者可以登录www.expasy.ch/www/tools.html等网站进行查询,并和自己的同类研究进行对比分析。Genomic Solution可以为研究者提供除质谱外的所有蛋白质组学研究工具,包括二维电泳系统,成像系统及分析软件,胶切割系统,蛋白质消化浓缩工作站,点样工作站等;同时还可以提供相关试剂和消耗品。LCM-二维电泳-质谱的技术路线是典型的一条蛋白质组学研究的技术路线,除此以外,LCM-抗体芯片也是一条重要的蛋白质组学研究的技术路线。即通过LCM技术获得感兴趣的细胞类型,制备细胞蛋白质样品,蛋白质经荧光染料标记后和抗体芯片杂交,从而可以比较两种样品蛋白质表达的异同。Clontech最近开发了一张抗体芯片,可以对378种膜蛋白和胞浆蛋白进行分析。该芯片同时配合了抗体芯片的全部操作过程的重要试剂,包括蛋白质制备试剂,蛋白质的荧光染料标记试剂,标记体系的纯化试剂,杂交试剂等。对于蛋白质相互作用的研究,酵母双杂交和噬菌体展示技术无疑是很好的研究方法。Clontech开发的酵母双杂交系统和NEB公司开发的噬菌体展示技术可供研究者选用。关于蛋白质组的研究,也可以将蛋白质组的部分或全部种类的蛋白质制作成蛋白质芯片,这样的蛋白质芯片可以用于蛋白质相互作用研究,蛋白表达研究和小分子蛋白结合研究。Science,Vol.293,Issue 5537,2101-2105,September 14,2001发表了一篇关于酵母蛋白质组芯片的论文。该文主要研究内容为:将酵母的5800个ORF表达成蛋白质并进行纯化点样制作芯片,然后用该芯片筛选钙调素和磷脂分子的相互作用分子。最后有必要指出的是,传统的蛋白质研究注重研究单一蛋白质,而蛋白质组学注重研究参与特定生理或病理状态的所有的蛋白质种类及其与周围环境(分子)的关系。因此蛋白质组学的研究通常是高通量的。适应这个要求,蛋白质组学相关研究工具通常都是高度自动化的系统,通量高而速度快,配合相应分析软件和数据库,研究者可以在最短的时间内处理最多的数据。
一、实验目的1. 了解凝胶层析的原理及其应用。2. 通过测定蛋白质分子量的训练,初步掌握凝胶层析技术。二、实验原理凝胶层析又称排阻层析,凝胶过滤,渗透层析或分子筛层析等。它广泛地应用于分离、提纯、浓缩生物大分子及脱盐、去热源等,而测定蛋白质的分子量也是它的重要应用之一。凝胶是一种具有立体网状结构且呈多孔的不溶性珠状颗粒物质。用它来分离物质,主要是根据多孔凝胶对不同半径的蛋白质分子(近于球形)具有不同的排阻效应实现的。亦即它是根据分子大小这一物理性质进行分离纯化的。分离原理参见“理论部分的凝胶层析一节”。对于某种型号的凝胶,一些大分子不能进入凝胶颗粒内部而完全被排阻在外,只能沿着颗粒间的缝隙流出柱外;而一些小分子不被排阻,可自由扩散,渗透进入凝胶内部的筛孔,尔后又被流出的洗脱液带走。分子越小,进入凝胶内部越深,所走的路程越多,故小分子最后流出柱外,而大分子先从柱中流出。一些中等大小的分子介于大分子与小分子之间,只能进入一部分凝胶较大的孔隙,亦即部分排阻,因此这些分子从柱中流出的顺序也介于大、小分子之间。这样样品经过凝胶层析后,分子便按照从大到小的顺序依次流出,达到分离的目的。凝胶层析分离原理示意动画。对于任何一种被分离的化合物在凝胶层析柱中被排阻的范围均在0~100%之间,其被排阻的程度可以用有效分配系数Kav(分离化合物在内水和外水体积中的比例关系)表示,Kav值的大小和凝胶柱床的总体积(Vt)、外水体积(V0)以及分离物本身的洗脱体积(Ve)有关:Kav = (Ve-V0)/(Vt-V0) ----------- (1)在限定的层析条件下,Vt和V0都是恒定值,而Ve是随着分离物分子量的变化而改变。分子量大,Ve值小,Kav值也小。反之,分子量小Ve值大,Kav值大。有关凝胶层析柱中凝胶自身(基质)体积(Vg)、外水体积(V0)、内水体积(Vi)及柱床总体积(Vt)的参见示意图。凝胶层析柱中的几种层析峰。有效分配系数Kav是判断分离效果的一个重要参数,同时也是测定蛋白质分子量的一个依据。在相同层析条件下,被分离物质Kav值差异越大,分离效果越好。反之,分离效果差或根本不能分开。在实际的实验中,我们可以实测出Vt、V0及Ve的值,从而计算出Kav的大小。对于某一特定型号的凝胶,在一定的分子量范围内,Kav与logMw (Mw表示物质的分子量) 成线性关系:Kav =-b logMw + C --------- (2)其中 b,C为常数。同样可以得到:Ve =-b'logMw + C' --------- (3)其中 b', C'为常数。即 Ve 与 logMw 也成线性关系。我们可以通过在一凝胶柱上分离多种已知分子量的蛋白质后,并根据上述的线性关系绘出标准曲线,然后用同一凝胶柱测出其它未知蛋白的分子量。三、器材与试剂(一)器材1. 玻璃层析柱((20mm×60cm)2. 恒流泵(或下口恒压贮液瓶)3. 自动部分收集器4. 紫外分光光度计5. 100ml试剂瓶6. 1000ml量筒7. 250ml烧杯8. 50ml、100ml烧杯9. 10ml(或5ml)刻度试管(二)试剂1. 标准蛋白(1)牛血清白蛋白:Mw=67,000(上海生化所)(2)鸡卵清清蛋白:Mw=45,000(美国SIGMA公司)(3)胰凝乳蛋白酶原A:Mw=24,000(美国SIGMA公司)(4)溶菌酶:Mw =14,3002. 未知蛋白质样品:由实验室准备3. 0.025M KCl-0.1M HAC(乙酸)(洗脱液1000ml)4. 蓝色葡聚糖-2000
蛋白质与多肽蛋白质粉 人类的营养物质有许多种类,最为重要的为蛋白质,碳水化合物和脂肪,其它则是微量营养物质,如维生素、电解质和微量元素等。虽然每一种营养物质对人体来说都是不可或缺的,但绝大多数的营养学家都会有充分的理由认为,真正最重要的营养物质是蛋白质。一、蛋白质是构成人体的基本物质。 蛋白质是由氨基酸通过肽链相连而构成的,它是人体包括骨骼、肌肉、皮肤和脑的重要物质基础,同时氨基酸也是生成核酸的基本物质。我们知道,核酸既形成遗传密码,也是体内储存能量的基本物质。因而从根本上说,人体是由蛋白质组成的。构成人体蛋白质的生理功能概括有如下三个方面:1)人体组织的主要构成成份:如肌肉、骨骼、血液、皮肤、神经、肝、心等等。2)具有特殊生理功能:可以这样说,人类的一切生理活动都与蛋白质有关。如酶蛋白能催化机体的一切化学反应,包括蛋白质、脂肪、碳水化合物的消化等;载脂蛋白运送脂肪;血红蛋白运送氧;激素蛋白调节代谢与生理活动包括情感;血浆白蛋白调节渗透压、运输金属离子、胆红素和抗生素等。3)供给机体能量:成年人每日约需要更新400g蛋白质,每克蛋白质彻底分解能释放出约4 Kcal的热量。4)为机体提供氮原料:人体内所必需的嘧啶、嘌呤、肌酸、胆碱、肾上腺素、肉碱、牛磺酸等,都是以多肽、氨基酸为原料的。表1. 世界粮食组织(FAD)和世界卫生组织(WHO)根据中国人的体质和膳食结构推荐的中国人蛋白质的摄入量(RNLs)。年 龄蛋白质RNL(g/d) 初生—6个月 1.5-3 1岁 35 3岁 45 5岁 55 7岁 60 9岁 65 10-16岁 75-85 成年女性 65 成年男性 75 妊娠 +15 乳母 +20 根据统计资料:由于贫困、工作紧张、精神压力、减肥节食、以及肠胃疾病、癌症、贫血、肾病、各种结核病、肝硬化、腹水、烧伤、失血等,以及老龄人均不同程度地存在着蛋白质的摄入不足。 上世纪80年代以来,我国营养学家对7个省18个贫困地区,1万名学龄前儿童进行了为期4年的连续调查,发现营养不良现象非常严重,其中蛋白质的摄入量不足WHO规定的60%。近年社会医学工作调查,在发达地区由于生活节奏加快,精神压力异常增加,以及办公室白领阶层的减肥节食,也导致蛋白质摄入不足,代谢异常的人群增加。二、蛋白质缺乏的体征和临床症状 单纯的蛋白质营养不良又叫加西长病,这或许是来源于非洲的单词,单纯的能量不足时叫消瘦;临床上通常把这两种现象叫单纯性蛋白质能量营养不良症或PEM。单纯的PEM症在临床上较少见到,但在慢性消耗性疾病患者中则常见,尤其是在癌症患者和艾滋病的患者中几乎占到90%以上。 现代都市和贫困地区存在着相当数量的蛋白质营养不良族群,他们的临床表现主要是能量损失或不足,如体力不支、睡眠不安、怕冷、怕热、性冷淡、无法进行正常的体力劳动和运动,其次为肌肉组织萎缩、皮肤松驰;腿部、脸部易水肿、脂肪肝、无名皮疹、伤口愈合不良、记忆力下降、视力减弱等。再者免疫力低下易感冒、感染。在做血检时通常会发现这些族群的血浆蛋白处于正常值的下限,其中白蛋白、转铁蛋白、甲状腺素结合前体蛋白和视轴蛋白(retinol-binding protein)均处于低水平时,患者易于感染各种疾病并且出现早衰症状,如果是儿童则感染后死亡率增加30%-40%,对于这类人群WHO的专家最好的建议就是迅速补充优质(或全价)的蛋白质。三、优质蛋白质和劣质蛋白质的区别。 要弄清楚何为优质蛋白质?何为劣质蛋白质?我们要引入什么是必需氨基酸的概念。营养生理学家、生化学家发现构成人体蛋白质的氨基酸共有21种,而这些氨基酸中其中有4种是可以由体内含碳和含氮底物自己合成的,被称为非必需氨基酸,还有10个必需的氨基酸,是人类机体无法制造需要从饮食中摄取的,另有7个是介于这两者之间的被称为条件必需氨基酸。表2. 必需、条件必需和非必需氨基酸 必需氨基酸条件必需氨基酸 非必需氨基酸 亮氨酸牛黄酸 丙氨酸 异亮氨酸酪氨酸 谷氨酸 缬氨酸甘氨酸 天冬氨酸 赖氨酸丝氨酸 天冬酰胺 苯丙氨酸(酪氨酸)脯氨酸 蛋氨酸(半胱氨酸)谷氨酰酸 苏氨酸 胱氨酸 色氨酸 组氨酸 精氨酸 虽然蛋白质广泛存在于许多动物性和植物性食物中,但是必需氨基酸的构成异差很大,WHO把“蛋白质其组成恰好符合人体需要”的蛋白质称为理想蛋白质,在自然界这种理想的蛋白质普遍认为是鸡蛋蛋白,因此就把鸡蛋蛋白作为衡量蛋白质优劣的参照蛋白,科学家把它作为一把尺子来衡量各种蛋白质,并制定出标准,以4种必需氨基酸为最低限来决定其优劣,即色氨酸、苏氨酸、赖氨酸或者蛋氨酸(半胱氨酸)。 通过比较科学发现,肉、鱼、蛋、牛奶、乳酪含有优质蛋白,大豆、花生、豌豆也含有较多的高质量蛋白。进一步研究发现它们都不够完美,因而要求大家对优质的动物性蛋白和植物性蛋白进行了科学搭配才是最完美的全价蛋白质(complete protein)。表3. 部分高质量蛋白
一,蛋白质(包括酶)的提取 大部分蛋白质都可溶于水、稀盐、稀酸或碱溶液,少数与脂类结合的蛋白质则溶于乙醇、丙酮、丁醇等有机溶剂中,因些,可采用不同溶剂提取分离和纯化蛋白质及酶。(一)水溶液提取法 稀盐和缓冲系统的水溶液对蛋白质稳定性好、溶解度大、是提取蛋白质最常用的溶剂,通常用量是原材料体积的1-5倍,提取时需要均匀的搅拌,以利于蛋白质的溶解。提取的温度要视有效成份性质而定。一方面,多数蛋白质的溶解度随着温度的升高而增大,因此,温度高利于溶解,缩短提取时间。但另一方面,温度升高会使蛋白质变性失活,因此,基于这一点考虑提取蛋白质和酶时一般采用低温(5度以下)操作。为了避免蛋白质提以过程中的降解,可加入蛋白水解酶抑制剂(如二异丙基氟磷酸,碘乙酸等)。下面着重讨论提取液的pH值和盐浓度的选择。1、pH值 蛋白质,酶是具有等电点的两性电解质,提取液的pH值应选择在偏离等电点两侧的pH范围内。用稀酸或稀碱提取时,应防止过酸或过碱而引起蛋白质可解离基团发生变化,从而导致蛋白质构象的不可逆变化,一般来说,碱性蛋白质用偏酸性的提取液提取,而酸性蛋白质用偏碱性的提取液。2、盐浓度 稀浓度可促进蛋白质的溶,称为盐溶作用。同时稀盐溶液因盐离子与蛋白质部分结合,具有保护蛋白质不易变性的优点,因此在提取液中加入少量NaCl等中性盐,一般以0.15摩尔。升浓度为宜。缓冲液常采用0.02-0.05M磷酸盐和碳酸盐等渗盐溶液。(二)有机溶剂提取法 一些和脂质结合比较牢固或分子中非极性侧链较多的蛋白质和酶,不溶于水、稀盐溶液、稀酸或稀碱中,可用乙醇、丙酮和丁醇等有机溶剂,它们具的一定的亲水性,还有较强的亲脂性、是理想的提脂蛋白的提取液。但必须在低温下操作。丁醇提取法对提取一些与脂质结合紧密的蛋白质和酶特别优越,一是因为丁醇亲脂性强,特别是溶解磷脂的能力强;二是丁醇兼具亲水性,在溶解度范围内(度为10%,40度为6.6%)不会引起酶的变性失活。另外,丁醇提取法的pH及温度选择范围较广,也适用于动植物及微生物材料。
[align=center]蛋白质热稳定性的研究机理[/align][align=center]西安国联质量检测技术股份有限公司[/align][align=center]食品事业部:魏娜[/align] 疏水作用被认为是决定蛋白质结构的主要作用力。蛋白质的天然结构是由以下类型的共同作用力维持其结构的热稳定性(例如,H键,离子键和范德华力)。德国专家Dil回顾了支持这一理论的证据:(一)非极性溶剂使蛋白质变性 (二)疏水残基可以很典型的把核心部位分开,在其核心部位他们在很大程度上避免了与接触水 (三)在蛋白质核心部位的残基和疏水基团比任何其他一种残基具有更坚固的保守区和结构(核心部位疏水残基的取代物一般比任何一种代替物更具有破坏性)。(四)蛋白质展开涉及大量增加的热容量。给定的疏水作用的中心对在蛋白质折叠也有一定的影响,很容易以为疏水作用还是负责蛋白稳定性的主要动力。在过去20年里,序列、结构和诱变等信息的积累证实了疏水作用,事实上,更是蛋白质稳定性的主要动力。两个观察报告指出常温的和极端嗜热的微生物的同源体具有相同的最基本的稳定性,这种稳定性由保守的蛋白质核心提供:(1)疏水相互作用以及中心残基所影响的二级结构比特征区域表面更保守。(2)在有溶解能力的被暴露的区域发现了大量稳定的代替物(可以在常温及极端嗜热蛋白质结构的比较以及在蛋白质定向突变的实验中观察到)。常温以及嗜热蛋白质同源体的核心具有高度的相似性,这些性质表明常温蛋白质尽可能高效的与那些在核心外部的没有太多空间稳定性的蛋白质进行折叠。极端嗜热蛋白质稳定的相互作用经常在蛋白质的不保守区被发现。如下所示,如表面离子对减少了溶剂暴露疏水面,和与之稳定结合(即N和C末端以及氨基酸循环)的蛋白质表面似乎有助于极端嗜热蛋白质的热稳定性。 在近年来足够的实验证据(如序列,诱变,结构,和热力学)被积累,但没有一个单一的机理可以解释极端嗜热蛋白质的显著的稳定性。增加的热稳定性可以在数量很少的精确突变中找到,这样的突变常常不遵循任何一种固定的法则。[b] 氨基酸组成和内在倾向[/b]蛋白质的氨基酸组成长期以来被认为与其热稳定性有关。第一个数据分析对比了常温和极端嗜热蛋白质的氨基酸组成,发现趋向于Gly→Ala,Lys→Arg的替换,嗜温蛋白质的组成中含有大量Ala,主要是由于Ala最易于螺旋结构的形成。随着更多实验数据的积累(尤其是,全基因组序列的测序 ),通常的嗜热适应规则不能依据显著性差异来定义蛋白质中氨基酸的组成已经变得越来越明显了。通过对8个常温和7个极端嗜热微生物的基因组序列的对比得出常温和极端嗜热蛋白质的残基存在这种趋势的差异(如表4所示)。另外发现,极端嗜热蛋白质比常温蛋白质带有更多的带电残基(多3.24%),以及较少的极性未荷电残基(-4.98% 特别是谷氨酰胺,-2.21%)。嗜热蛋白质比常温蛋白质还含有更多的疏水残基和芳香残基。从基因组测序中获得的这些数据不能普遍化,在极端嗜热的微生物基因组中自身存在着很多的突变。敏捷气热菌实际上比在表4中列出的嗜温菌含有有更少的带电残基(23.64%),更少的大体积的疏水残基(27.29%),以及更少的芳香性残基(7.42%)。相反,敏捷气热菌含有较多的Ala,Gly,Pro,Ser,和Thr残基。因此,极端嗜热蛋白质的氨基酸组成可能经常和突变性有关,而不是与其适应高温的指标有关。蛋白质中氨基酸残基的分布与其相互作用比氨基酸残基的组成对蛋白质的热稳定性更相关。这两种同源蛋白酶解淀粉芽孢杆菌枯草杆菌蛋白酶BPN9和普通高温放线菌嗜热蛋白酶包含数量相同的带电残基,但嗜常温酶的嗜热蛋白酶包含比八个更多的离子对。有关的想法,蛋白质的稳定性取决于稳定的紧密包裹的疏水内核,个别残基的固有倾向是参与螺旋或链结构,这作为一个潜在的稳定机制被研究。比较嗜温和嗜热蛋白结构,Facchiano等人观察到嗜热蛋白质的螺旋结构通常比的嗜温蛋白质更稳定。他们检测到的唯一的趋势是在嗜热蛋白质的螺旋(二支链残基没有得到很好的耐受性螺旋线性残留有)中C[sub]β[/sub]分支残基的减少(Val,Ile,和Thr)。许多实例存在于未遵循这一趋势。该P.球菌和T. litoralisGDHs包含更多数量的Ile。如果将Leu和Ile残基进行比较,这两个残基具有最高的(和等同的)部分特定卷。在蛋白质中,Leu侧链最常发现两种旋转异构体的构象(180°和300°×1),但不是在一个与X1 =60°。在Ile侧链频繁采用四种不同的旋转异构体的构象,以及三个X1值被发现。随着这种构象的柔性,Ile可能能够更好地填补在蛋白质内核折叠时出现的空缺。Dil还指出,环境的影响(例如,盐桥的形成,芳烃相互作用,疏水表面的包埋,以及填充膜腔)可以作为重要内在的螺旋倾向。在许多情况下,二级结构在蛋白质结构不对应于所找到的二级结构预测的内在倾向,表明该固有倾向不足以解释蛋白质中α-螺旋的稳定性。Arg残基的几个特性表明,他们将比Lys残基更好地适应高温:该Argδ-胍基部分由于其高的pKa和共振稳定而降低的化学反应活性。δ-胍基部分比Lys氨基为带电的相互作用提供了更多的表面积。Arg参与多种非共价相互作用的能力。因为在Arg侧链比Lys少一个亚甲基,它具有开发较少不利触点的电位与溶剂。最后,因为它的pKa值(约12)是Lys的1倍以上(11.1),在温度升高的时候,精氨酸更容易保持离子对和净正电荷(因为温度的增加,pKa值下降)(252,354)。在嗜温菌的蛋白质池和在表中列出超嗜4(0.73+ - 0.37和0.87+ - 0.60,分别)平均精氨酸/赖氨酸的比率与大标准偏差相关。(其中超嗜热,精氨酸/赖氨酸的比率范围从Aquifex0.52超嗜热菌蛋白到2.19敏捷气热菌。)这些结果表明,如果增加精氨酸确实会变得稳定,这种机制是不能够普遍使用于极端嗜热菌中。[b] 二硫键 [/b]二硫键被认为主要是通过降低蛋白质裂解状态的熵维持蛋白质的稳定。当两个半胱氨酸键断裂时,二硫键的熵效应成比例地以对数方式增加残基的数量。 因为在高温下,半胱氨酸和二硫键的敏感性遭到破坏,,100℃被认为是蛋白质维持二硫键稳定性的上限。这一概念是基于这样一个事实,早期的研究描述蛋白质活性的研究机理,在那个时期仅形成了一种可利用的酶:常温酶。这些研究确定了所有蛋白质研究,研究包括的二硫键在100℃时β-消除有相同的速率。这个速率不依赖于蛋白质的结构并且在pH=8.0(半衰为1小时)比在pH =6.0(半衰期为12.4小时)时速度快。这些研究的限制是在100℃时所有蛋白质是在展开状态时进行研究的。在最近包括二硫键的蛋白质的描述中,在100℃时这些蛋白质具有最大的活性和稳定性,表明在100℃时二硫键维持了这些蛋白质的稳定性并且构象环境和溶剂可被决定因素保护,防止破坏二硫键。当描述大肠杆菌时,S.solfataricus 5’-甲硫腺苷磷酸化酶形成了不正确,不稳定的二硫键。这一观察间接反映了,二硫键在天然酶中表现出的稳定性。嗜火液丝氨酸蛋白酶被描述为包含8半胱氨酸(无存在于枯草杆菌蛋白酶BPN')。处理二硫苏糖醇从半衰期为90 小时 85℃,减少到少于2小时。在高温下二硫苏糖醇不稳定进一步表明这种酶的确含有二硫键并且它们是高度不稳定的。这种酶在半衰期为6小时 温度为105℃ pH=9.0时,要比它在蛋白质展开中pH=8.0 半衰期为1小时二硫键计算的长,表明这种酶的二硫键通过蛋白质中二硫键的无法靠近以保护二硫键不被破坏。因此,不是所有的二硫键对热稳定破坏具有相同的易感性。[align=center][b]疏水作用[/b][/align] 在极端嗜热蛋白质中,疏水作用是蛋白质热稳定性的一个机理。平均增加1.3千卡/摩尔(±0.5)的稳定性对于增加甲基埋在蛋白质折叠(取决于腔产生突变,这种突变中,大的脂族残基被替换为一个较小的脂族残基)。当突变产生了往往需要局部重排的不利的范德华力作用时,突变试图填充凹处往往是更不稳定的。疏水性相互作用在蛋白质结晶中的热稳定作用的,实验证据是可用于确认所述极端嗜热蛋白质中疏水作用的区域。存在于沃氏甲烷球菌和M.jannaschiladenylate激酶中的这种酶嵌合体的结构的稳定部分表明,更大和更具极端嗜热酶疏水酶核心(这是由于增加的脂肪族残基含量和脂族侧链体积)可能是负责分枝詹氏甲烷球菌的腺苷酸激酶的热稳定性。该从嗜热栖热菌3-异丙基苹果酸脱氢酶热包含亚基间的疏水相互作用的没有在大肠杆菌中酶存在。嗜三异丙基脱氢酶Leu246Glu/ Val249Met和大肠杆菌Glu256Leu/Met259Val突变衍生物构建了动摇并稳定在栖热和大肠杆菌酶,分别的突变体和野生型的聚丙烯酰胺凝胶电泳在尿素的存在下酶表明,疏水性相互作用使二聚体解离更有抵抗力。[b]氢键[/b]由于氢键的作用使得核糖核酸酶T1趋于稳定。核糖核酸酶T1平均长度86 H键。他们的核糖核酸酶T1稳定(约贡献110千卡/摩尔,如通过诱变和展开实验确定),H键贡献(307)1.3千卡/摩尔能力。因为识别H键的高度依赖于距离截止和因为一批超嗜热蛋白质结构没有被细化到足够高的分辨率,通过结构研究的热稳定性H键的作用分析没有提供明确的答案。一项研究由唐纳等人完成的。H键使得蛋白质的热力学稳定:(i)关联的去溶剂化罚与掩埋诸如H键小于去溶剂化罚掩埋离子对的(即包括两个电荷的残基),和(ii)一个充电中立H键的焓奖励是大于由于中性中性H键的电荷 - 偶极相互作用。chargedneutral之间的这种相关性H键和GAPDH稳定性表明的作用在稳定蛋白质电荷的残基可以不限于形成离子对。带电中性h的人数增加债券还发现了T. maritima的铁氧还蛋白(表5)。这些H键或者稳定转弯或锚的结构变为另一个。[b]离子对[/b]因为离子对通常存在于在少量蛋白质和因为它们不是高度保守的,它们是不驱动在蛋白质折叠的力。去溶剂化作用8筒体螺旋A8和A1)还通过测试SDM。在85.5°C,突变Arg241Ala增加酶变性率几乎3.酶的EA的一个因素展开在85℃下降3.2千焦耳/摩尔,这表明Arg241-Glu73对参与的动力学稳定这种酶。在P.球菌确定的离子对网络,P. kodakaraensis,和T. litoralis的GDH的结构进行了研究由SDM。这三种酶是83至87%相同,但它们的thermostabilities减小的方向P.球菌GDH。P. kodakaraensis GDH。T. litoralis的GDH。它们都含有相同的18离子对网络在它们的六聚体界面。突变Glu158Gln,其中去掉2离子对的该网络的中心,显著不稳定P. kodakaraensisGDH的。一个离子,包括六对网络被控残留物只存在于P.球菌GDH。相同的离子对网络在P.kodakaraensis GDH和T. litoralis的创建GDH由SDM。这两种酶是由新稳定的介绍离子对网络(280,348)。这些研究证实离子对网络在巴斯德球菌,P的作用kodakaraensis和T. litoralis的GDH thermostabilities。 Lebbink等。 (203)介绍了16个残基的离子对网络的在T. maritima的GDH亚基界面来创建一个界面类似于在体育球菌的GDH在18离子对网络。该三不稳定的突变组合产生了三重突变酶(Ser128Arg-Thr158Glu-Asn117Arg),这是稍微更稳定和嗜热比野生型酶。这个结果示出合作的高级别存在这种离子对网络的不同成员之间。该结果还支持18个残基的离子对的作用网络中的P.球菌GDH稳定。在早先的研究中,Tomschy等。(337)已拆除2位于两个α-螺旋在T. maritima的表面上的离子对GAPDH。由于这些突变不影响所述酶稳定性,作者得出结论认为,表面离子对不能被认为是热适应的总体战略。选择在本研究Bothion对分别螺旋内的离子对。这些2双可能已经位于蛋白质领域的人过约束,而不是蛋白质的地区之一最容易展开。与此相反,在其它实施例上述说明的热稳定效果非本地离子对和离子对网络,连接不相邻的残基(和二级结构)的序列中。离子配对中的作用的附加的,间接的证据热稳定性是来自基因组测序。与嗜热蛋白质带电残基相比,常温蛋白,主要是在不带电荷的极性为代价残留物。[b]脯氨酸及脯氨酸展开过程中的熵的减少[/b]Matthews等人提出已知的蛋白质三维结构可以通过展开时他们的熵的减少维持稳定。在展开状态下,甘氨酸是带有最高构象熵的残基,没有C[sub]β[/sub]。脯氨酸,可以采用只有几个配置并限制允许前述残余物的配置(313),具有最低的构象熵。因此,该突变Gly3Xaa或Xaa3Pro应该减少熵及的蛋白质的展开状态稳定的蛋白质,只要作为改造的残留不引入不利菌株中的蛋白质的结构。这一技术已被用来工程师酶是热力学更稳定。例如,杆状stearothermophilus中性蛋白酶失活通过自溶,其中针对特定柔性表面环(残基63到69)(93)。脯氨酸在循环中引入使其不易展开。只有定位65至69是适合脯氨酸替换。在其他位置,一脯氨酸将消除非共价相互作用,产生构象株,或有不恰当的扭转角度。许多嗜热和嗜热蛋白也利用这个稳定机构(255)。Pro177和Pro316在两个N个末端螺旋和Pro24中的B-转弯位置2被证明是稳定(215)。(脯氨酸分别在相应的引入地点在拜氏梭菌的酶。)至少有其中仅发生在嗜热芽孢杆菌脯氨酸22位置寡聚1,6-葡糖苷酶。其中大多数脯氨酸是在位置2的溶剂暴露B-圈(七个脯氨酸的),在循环内的线圈(9人),或在N帽一个螺旋在桶结构(其中四个)。脯氨酸是在嗜温的相应位置引入蜡状芽孢杆菌寡-1,6-葡糖苷酶。热稳定性一般随着引入脯氨酸的数量。稳定性增长最为显著时添加的脯氨酸位置两个B-转弯或在一个螺旋瓶盖ñ 。少稳定的突变可能引入不利范德范德华相互作用或删除稳定H键(361)。在那不勒斯栖热袍木糖异构酶包含两个脯氨酸在参与亚基间的相互作用是一个循环。这些脯氨酸缺席在不太稳定的Thermoanaerobacteriumthermosulfurigenes酶。动力学稳定性两个T的性能thermosulfurigenes木糖异构酶突变体Gln58Pro和Ala62Pro说明如何重要突变位置为SDM(313)的结果。两Gln58和Ala62有骨干二面角这使得为脯氨酸,既不参与非共价稳定相互作用,以及Asp57和Lys61不得不二面角那允许前面的脯氨酸残留。的构象在Gln58侧链非常接近的脯氨酸吡咯烷酮环,并且因此没有构象菌株由临介绍 突变Gln58Pro稳定的蛋白质主要是通过降低展开的熵。相反,突变Ala62Pro之间创建一个卷的干扰脯氨酸吡咯烷酮环(镉原子)和Ly61侧链(CB原子),这可能导致不稳定的构象变化。突变Ala62Pro降低了酶的T1 /2为85℃下的10倍。[b] 构象应变作用力的作用[/b]左手螺旋构象的残基(Φ=40至60°,Ψ=20〜 80°)有着末端构象稳定性除非它们通过分子内的非共价相互作用来稳定。(左旋螺旋构象非甘氨酸残基被认为比右旋结构少0.52.0千卡/摩尔而不太稳定)。在左手螺旋构象的残基中,β- 碳和羰基氧的紧密相连在蛋白质结构中产生了一个局部的构象张力。左手螺旋构象的两个残基,谷氨酸15在枯草芽胞杆菌的DNA结合蛋白HU和赖氨酸95大肠杆菌核糖核酸酶H1,在旋转区域,是通过在嗜热酶的相应部分甘氨酸残基取代。突变体谷氨酸15甘氨酸和赖氨酸95甘氨酸分别在枯草杆菌DNA结合蛋白HU和大肠杆菌RNA酶H1,消除在左旋螺旋构象中由残基产生的构象张力,以及两种蛋白质的热力学稳定性的显著增加。在这两个例子中,由于构象张力的释放增加的蛋白质的稳定,通过它的稳定性影响二级结构的相互作用被加强。大肠杆菌核糖核酸酶H1包含两个额外左旋螺旋构象的非甘氨酸残基。残基色氨酸90和天冬酰胺100,而相比之下,赖氨酸95,酶内部的点,并且它们弥补了极性或疏水的相互作用。左旋螺旋构象中,常温的铁氧还蛋白含有三个残基在他们簇结合区域。在海栖热袍菌和T. litoralis的同系物中,簇结合区域的空间位阻通过具有三个甘氨酸残基的左旋螺旋构象的残基取代物被释放。这三个甘氨酸残基都涉及了拥有硫原子簇的H键。其他类型的构象张力释放作为稳定机制已经被提及。例如在α-螺旋中,具有低螺旋倾向的残基可以通过具有高螺旋倾向的残基被替换。这样的替代物通常发生在残基的侧链没有得到很好的安置的α-螺旋时。位于α-螺旋的一个特殊取代物是C末端(或C帽)。因为它缺乏了的支链以允许它采用没有张力的左手螺旋构象,并且由于主链羰基氧可以与溶剂分子形成氢键,所以在C帽甘氨酸是最有利的残基。该P.furiosus柠檬酸合成酶至少包含了7个具有C-帽的甘氨酸螺旋。他们的对稳定性的影响仍是未知的。虽然,在一般情况下,这些构象张力释放的类型不被期望提供显著的稳定性,并且它们在极端嗜热蛋白结构中没有扮演细致的角色。他们还与其他稳定机制相竞争(如倾向疏水相互作用,H键,或离子对)。[b] 螺旋偶极作用力对结构稳定的作用[/b]螺旋偶极可以通过邻近N-末端带负电荷的残基,以及邻近C-末端带正电荷的残基维持稳定。在S.solfataricus吲哚-3-甘油磷酸合成酶中,螺旋的偶极。也被稳定在杆状stearothermophilus和海栖热袍菌PGKs中:常温酶只有9 N帽和12 C帽(猪PGK)和10 N帽9 C帽(酵母PGK)通过相反的电荷被稳定。嗜热脂肪芽孢PGK数量稳定的N和C帽提高到16 N帽和13 C和在海栖热袍菌的PGK的提高到17 N帽和14C帽。尼克尔森等人展示N帽可通过约0.8千卡/摩尔增加酶的△Gstab。虽然,在一般情况下,N和C帽子和其他稳定的以及不稳定机制相竞争(例如,倾向H键或离子对)。[b]金属键对稳定性的影响[/b]长久以来,金属键以稳定和激活酶而众所周知。木糖异构酶连接两个金属离子(选自Co[sup]2+[/sup],Mg[sup]2+[/sup]和Mn[sup]2[/sup][sup]+[/sup])。一种阳离子是直接参与催化 第二种主要是结构。两种金属结合位点具有不同的特异性,并且一种阳离子与另一种阳离子的替换经常显著的改变酶的活性,底物特异性,热稳定性。存在和不存在于地衣芽孢杆菌木糖异构酶的金属键其酶稳定性的研究稳定结果表明的演变动力学稳定性遵循的热力学稳定性以及这两种类型的稳定性是金属呈现出的固有的功能。这些观察表明,主要稳定力与呈现在全酶中的金属相连。 对于金属在极端嗜热蛋白质中的稳定性起的作用的间接证据是在酶中除去金属遇到困难。α-淀粉酶特殊结合Ca[sup]2[/sup][sup]+[/sup]。α-淀粉酶催化位点位于两个领域的分裂结构之间(具有8管和一个回路)。属于这两个领域的配体相调整,Ca[sup]2[/sup][sup]+[/sup]配体对酶的催化活性和热稳定性是必不可少。巴斯德球菌胞外α-淀粉酶最初描述为Ca[sup]2[/sup][sup]+[/sup]无关的酶,因为室温下EDTA处理对其活性没有任何影响。进一步鉴定表明,这种酶包含至少两个Ca[sup]2[/sup][sup]+[/sup]阳离子,这种阳离子在70℃以下不能被EDTA去除。在90℃下处理EDTA30分钟除去大约60%至70%的结合的Ca[sup]2[/sup][sup]+[/sup]。Thermococcus profundusα-淀粉酶做出类似的观察结果(约80%相同的P.furiosua,胞外α-淀粉酶)。这种酶被激活并通过Ca[sup]2[/sup][sup]+[/sup]使其稳定,但室温处理EDTA对活性没有任何影响。 一些嗜热和极端嗜热酶曾被描述为含有金属原子,这些原子不出现在它们同源的常温酶中。来自于Sulfolobus sp.de 铁氧化还原蛋白张力7包含一个额外的40残基的N-末端延伸,这个延伸通过Zn结合位点被连接到核心蛋白上。锌原子通过N-末端结构域的三个组氨酸残基与核心结构域的1个天冬氨酸残基相连接。这种结构(N-末端延伸加锌结合位点)是不存在于真细菌同源微生物中的但是被保存在所有其他的嗜热嗜酸菌中 。逐行N末端缺失和两三个定向突变的配体表明,N端延伸和这两个锌原子对热力学稳定性很重要。虽然,它们的存在或缺失没有任何影响,但是影响着铁氧还蛋白功能。锌原子是负责9°C增加Tm值。它是如此的紧密结合在蛋白质内,在没有移除这两个FeS时锌原子不能被移除。普通嗜热放线菌枯草杆菌蛋白酶型丝氨酸蛋白酶的嗜热蛋白酶包含了三个Ca[sup]2[/sup][sup]+[/sup]结合位点 它们中的一个不出现在其常温酶同系物中(331)。嗜热酶的嗜热同系物,芽孢杆菌AK1蛋白酶比嗜热酶包含更多的Ca[sup]2[/sup][sup]+[/sup],并且它比在嗜热酶中出现的Ca[sup]2[/sup][sup]+[/sup]具有更显著的动力学稳定(半衰期为15小时80℃下与19分钟为嗜热酶)。因为Ca[sup]2[/sup][sup]+[/sup]优先与羧酸盐以及其他含氧等配体结合(它是最有可能被位于蛋白质表面上的金属配位体),这种金属比其他金属在蛋白质稳定性可能扮演更显著的稳定作用。[b] 蛋白质翻译后的修饰作用[/b] 蛋白质糖基化广泛存在于真核生物的酶上,以及一些细菌的胞外酶被糖基化。只有几个例子是公知的被糖基化的极端嗜热蛋白,并且它们的碳水化合物部分还没有被广泛表征。虽然,大多数的酶被糖基化(细菌,古细菌和真核微生物),但在细菌中仍然保留了其催化作用和稳定性。一些研究使用天然糖基化的真核生物蛋白质表明,糖基化可能在不影响蛋白质折叠的方式或它们的构象下造成显著地热稳定作用。较高倾向去糖基化的酶在热失活下聚集,表明糖基化也可以防止部分折叠或来自于聚合蛋白质的展开。牛科胰核糖核酸酶A和核糖核酸酶B区别仅在于连接核糖核酸酶B的Asn34部分的碳水化合物不同。这碳水化合物解释说明了核糖核酸酶B更高的动力学以及热力学稳定性。先进的碳水化合物部分的假说表明,稳定性的不同是由于在第一个糖单元连接到Asn34。 糖基化对热稳定性的影响两个杆菌β-葡聚糖酶在大肠杆菌和酿酒酵母的表达。这两个之一酶在70℃时,通过糖基化有强烈的动力学稳定性,其最佳动力学稳定活性温度更高。对热稳定水平比对糖基化的程度更依赖于碳水化合物部分在蛋白质中的位置。虽然在自然界中糖基化可能不是大众的热稳定方法,上述被引用的几个例子表明,对于酶的热稳定或是溶解,糖基化可能代表了一种替代方法。 翻译后赖氨酸甲基化(形成于 N-ε-单甲基赖氨酸)已经描述为许多硫化的蛋白。天然的小的来自的 S.嗜酸热的DNA结合蛋白Sac7d(单甲基化赖氨酸 Lys5和Lys7)在100℃下发生可逆地变性(pH为7.0)。该重组Sac7d在92.7℃下变性。天然和重组的Sac7d之间的Tm 7°C的区别已被归因于赖氨酸的甲基化,赖氨酸的甲基化不存在于重组蛋白之中。由于Sso7d的稳定性(在S.Sulfolobus中是Sac7d的同系物)是不依赖于甲基化的,赖氨酸的甲基化在Sulfolobales是否是一般的热稳定机制。[b]盐离子的稳定性[/b]无机盐稳定蛋白有两种方式:(ⅰ)通过特定的影响,其中,金属离子于一个构象方式的蛋白质相互作用(参见“金属键”),(ii)通过一般盐的影响,主要影响水活性。 Thauer以及他的同事研究了盐对热稳定性的影响以及5种如甲烷噬热菌产甲烷的酶的活性(36,37,181,224,225)。然而这5种酶通过盐被激活以及机械的被稳定,盐影响的程度是酶的依赖性。 K[sup]+[/sup]和NH[sup]4[/sup][sup]+[/sup]通常比其他阳离子更有效地稳定酶。所有的阴离子,SO4[sup]2[/sup][sup]-[/sup]和HPO4[sup]2[/sup][sup]-[/sup]有最强的激活效应。酶盐的要求并不总是由细胞内盐浓度满足。分枝如甲烷噬热菌细胞内的盐浓度(大于1M钾加1M的环状2,3-二磷酸甘油酸)似乎对MkCH活性有利(最大浓度为1.5M盐)在其稳定(最佳浓度低于0.1M盐)。盐对来自于如甲烷噬热菌,M.thermoautotrophicum, Archaeoglobus fulgidus以及Methanosarcinabarkeri的CHOtetrahydrormethanopterin(H4MPT)甲酰基转移酶的影响进行比较。通过盐在甲酰基转移酶活性的不同是与在不同的生物体细胞内cDPG浓度直接相关。通过盐按照MkFT的活性分析了MkFT的结构。两种功能被提出相关的性质:(一)在疏水性表面MkFT呈现出下降的趋势,以及亚基间的界面在很大程度上是疏水的 和(ii)四聚体表面呈现与24个基本过量的负电荷残基(48个残基)。酸性残基可以形成较强的氢键和多H键的水分子,确保这些残基与无机阳离子或水竞争。所有的残基中,谷氨酸具有结合水分子的最高容量。48个表面带负电荷的,33个是谷氨酸和15是天冬氨酸。高易溶的盐浓度被认为由于在负电荷残基表面增加的无机阳离子增加了表面离子作用,并且间由于盐析的影响提高了亚基疏水相互作用效果。MkFT寡聚物构象显示出了需要比磷酸钾更高的NaCl浓度(更强易溶的盐),表明在MkFT热稳定中盐析的影响起主导作用。这种蛋白质可能有演变为最佳地稳定性表现在高的胞内盐浓度中。 当在98℃时,如甲烷噬热菌细胞中含有约的1M cDPG。cDPG中的钾盐,2,3-DPG以及磷酸盐在激活如甲烷嗜热酶环化酶中同样有效。然而,在同等离子浓度cDPG比在稳定的MkFT中更有效。在如甲烷噬热菌中,cDPG浓度对MkCH和MkFT的活性以及稳定性是最佳的。合成CDPG需要4 分子ATP。在这个合成的最后反应是唯一一个能够放出足够的能量来驱使合成cDPG而非其前体2,3-DPG。此外,在pH=7.0,cDPG是三阴离子,而2,3-DPG是五阴离子 因此cDPG比2,3-DPG在离子强度方面有更小的影响。[color=#ff0000] [/color]M. fervidus[color=#ff0000] [/color]磷酸甘油醛脱氢酶(GAPDH)本质上动力学稳定仅达到75℃。通过盐来研究这种酶的热稳定性表明,相对于盐的效果—K[sub] 3[/sub] PO[sub] 4[/sub]Na[sub]3[/sub]PO[sub]4[/sub][sub] [/sub]K[sub]2[/sub]SO[sub]4[/sub]Na[sub]2[/sub]SO[sub]4[/sub]KCLNaCL—都与他们保持一致各自的能力以减少酶在水溶液中的溶解度。它们的盐析影响了他们活性的分布。 M. fervidus GAPDH可能由cDPG被稳定在体内,它以约为0.2〜 0.3M出现在生物体中。有趣的是,其他的M.fervidus酶是唯一依赖于低于生物体的最佳生长温度的以维持稳定,这表明在该生物体中通过盐的稳定性是共同的机制。 [b]压力的影响[/b] 因为许多高温环境同样也是高压环境并且因为微生物无法逃避压力和温度,所有的大分子细胞成分必须能适应高的压力。因此,并不奇怪的是找到极端嗜生物体也是嗜压微生物(如嗜热barophilus),并发现通过高压使这种酶被稳定以及被激活(例如,M。詹氏甲烷球菌的蛋白酶和氢化酶)。通过压力这种稳定性背后的理论说明压力有利于体积最小的结构。蛋白质主要通过疏水被稳定因此,预计在高呀下被稳定,而通过离子相互作用被稳定的蛋白质应该是不稳定的。例如,P.furiosus 红素氧还蛋白主要是由静电相互作用稳定。这种酶在高压力不稳定。由于许多化学反应在高温高压进行的,在高压下酶的稳定性可能很大程度上对生物催化作用有利。
本人初来乍到,老板让查下蛋白质酶解的资料,什么方法?条件?试剂?哪位大虾知道?能否简单介绍一下?着急呀
纤维素),当被分离的蛋白质溶液流经离子交换层析柱时,带有与离子交换剂相反电荷的蛋白质被吸附在离子交换剂上,随后用改变pH或离子强度办法将吸附的蛋白质洗脱下来。(详见层析技术章)(四)根据配体特异性的分离方法-亲和色谱法 亲和层析法(aflinity chromatography)是分离蛋白质的一种极为有效的方法,它经常只需经过一步处理即可使某种待提纯的蛋白质从很复杂的蛋白质混合物中分离出来,而且纯度很高。这种方法是根据某些蛋白质与另一种称为配体(Ligand)的分子能特异而非共价地结合。其基本原理:蛋白质在组织或细胞中是以复杂的混合物形式存在,每种类型的细胞都含有上千种不同的蛋白质,因此蛋白质的分离(Separation),提纯(Purification)和鉴定(Characterization)是生物化学中的重要的一部分,至今还没的单独或一套现成的方法能移把任何一种蛋白质从复杂的混合蛋白质中提取出来,因此往往采取几种方法联合使用。细胞的破碎1、高速组织捣碎:将材料配成稀糊状液,放置于筒内约1/3体积,盖紧筒盖,将调速器先拨至最慢处,开动开关后,逐步加速至所需速度。此法适用于动物内脏组织、植物肉质种子等。2、玻璃匀浆器匀浆:先将剪碎的组织置于管中,再套入研杆来回研磨,上下移动,即可将细胞研碎,此法细胞破碎程度比高速组织捣碎机为高,适用于量少和动物脏器组织。3、超声波处理法:用一定功率的超声波处理细胞悬液,使细胞急剧震荡破裂,此法多适用于微生物材料,用大肠杆菌制备各种酶,常选用50-100毫克菌体/毫升浓度,在1KG至10KG频率下处理10-15分钟,此法的缺点是在处理过程会产生大量的热,应采取相应降温措施。对超声波敏感和核酸应慎用。4、反复冻融法:将细胞在-20度以下冰冻,室温融解,反复几次,由于细胞内冰粒形成和剩余细胞液的盐浓度增高引起溶胀,使细胞结构破碎。5、化学处理法:有些动物细胞,例如肿瘤细胞可采用十二烷基磺酸钠(SDS
请教:双缩脲反应测定蛋白质含量时,绘制标准曲线时需要标准蛋白溶液,标准蛋白溶液要用什么蛋白质?我见有用酪蛋白的,可以用胶原蛋白吗?谢谢……
双缩脲试剂(biuret reagent)是由双缩脲试剂A(NaOH)和双缩脲试剂B(CuSO4)两种试剂组成.双缩脲试剂A的成分是氢氧化钠的质量分数为0.1 g/mL的水溶液;双缩脲试剂B的成分是硫酸铜的质量分数为0.01 g/mL的水溶液。双缩脲试剂可以验证蛋白质的存在。具体方法是:先将双缩脲试剂A加入组织样液,振荡均匀(必须营造碱性环境),再加入双缩脲试剂B,摇荡均匀。如果组织里含有蛋白质,那么会看到溶液变成紫色。具有两个或两个以上肽键的化合物皆可与双缩脲试剂产生紫色反应。蛋白质的肽键在碱性溶液中能与Cu2+络合成紫红色的化合物。颜色深浅与蛋白质浓度成正比。双缩脲(NH2CONHCONH2)是两个分子脲经180℃左右加热,放出一个分子氨后得到的产物。双缩脲试剂本是用来检测双缩脲,因蛋白质中也有-CONH-基也可用于检验蛋白质,与蛋白质接触后的颜色呈紫色
人类的营养物质有许多种类,最为重要的为蛋白质,碳水化合物和脂肪,其它则是微量营养物质,如维生素、电解质和微量元素等。虽然每一种营养物质对人体来说都是不可或缺的,但绝大多数的营养学家都会有充分的理由认为,真正最重要的营养物质是蛋白质。一、蛋白质是构成人体的基本物质。蛋白质是由氨基酸通过肽链相连而构成的,它是人体包括骨骼、肌肉、皮肤和脑的重要物质基础,同时氨基酸也是生成核酸的基本物质。我们知道,核酸既形成遗传密码,也是体内储存能量的基本物质。因而从根本上说,人体是由蛋白质组成的。构成人体蛋白质的生理功能概括有如下三个方面:1)人体组织的主要构成成份:如肌肉、骨骼、血液、皮肤、神经、肝、心等等。2)具有特殊生理功能:可以这样说,人类的一切生理活动都与蛋白质有关。如酶蛋白能催化机体的一切化学反应,包括蛋白质、脂肪、碳水化合物的消化等;载脂蛋白运送脂肪;血红蛋白运送氧;激素蛋白调节代谢与生理活动包括情感;血浆白蛋白调节渗透压、运输金属离子、胆红素和抗生素等。3)供给机体能量:成年人每日约需要更新400g蛋白质,每克蛋白质彻底分解能释放出约4 Kcal的热量。4)为机体提供氮原料:人体内所必需的嘧啶、嘌呤、肌酸、胆碱、肾上腺素、肉碱、牛磺酸等,都是以多肽、氨基酸为原料的。表1. 世界粮食组织(FAD)和世界卫生组织(WHO)根据中国人的体质和膳食结构推荐的中国人蛋白质的摄入量(RNLs)。年 龄 蛋白质RNL(g/d)初生—6个月 1.5-31岁 353岁 455岁 557岁 609岁 6510-16岁 75-85成年女性 65成年男性 75妊娠 +15乳母 +20根据统计资料:由于贫困、工作紧张、精神压力、减肥节食、以及肠胃疾病、癌症、贫血、肾病、各种结核病、肝硬化、腹水、烧伤、失血等,以及老龄人均不同程度地存在着蛋白质的摄入不足。上世纪80年代以来,我国营养学家对7个省18个贫困地区,1万名学龄前儿童进行了为期4年的连续调查,发现营养不良现象非常严重,其中蛋白质的摄入量不足WHO规定的60%。近年社会医学工作调查,在发达地区由于生活节奏加快,精神压力异常增加,以及办公室白领阶层的减肥节食,也导致蛋白质摄入不足,代谢异常的人群增加。二、蛋白质缺乏的体征和临床症状单纯的蛋白质营养不良又叫加西长病,这或许是来源于非洲的单词,单纯的能量不足时叫消瘦;临床上通常把这两种现象叫单纯性蛋白质能量营养不良症或PEM。单纯的PEM症在临床上较少见到,但在慢性消耗性疾病患者中则常见,尤其是在癌症患者和艾滋病的患者中几乎占到90%以上。现代都市和贫困地区存在着相当数量的蛋白质营养不良族群,他们的临床表现主要是能量损失或不足,如体力不支、睡眠不安、怕冷、怕热、性冷淡、无法进行正常的体力劳动和运动,其次为肌肉组织萎缩、皮肤松驰;腿部、脸部易水肿、脂肪肝、无名皮疹、伤口愈合不良、记忆力下降、视力减弱等。再者免疫力低下易感冒、感染。在做血检时通常会发现这些族群的血浆蛋白处于正常值的下限,其中白蛋白、转铁蛋白、甲状腺素结合前体蛋白和视轴蛋白(retinol-binding protein)均处于低水平时,患者易于感染各种疾病并且出现早衰症状,如果是儿童则感染后死亡率增加30%-40%,对于这类人群WHO的专家最好的建议就是迅速补充优质(或全价)的蛋白质。
有奖问答:当调节溶液pH值,使蛋白质分子的正、负离子数目相等,此时溶液的pH值即为该蛋白质的?
请问,我在做蛋白质谱的过程中,酶切膜蛋白时,总有一些序列cover不到(哪怕胶内酶解PSM很高时,也没有改善)。请教有没有大佬传授一些经验,谢谢
蛋白质组学研究的一般工具与方法随着人类基因组计划取得巨大的成功和许多物种基因组测序的完成,仅仅靠基因组的序列来试图阐明生命现象是远远不够的,因此,研究重心已经开始从揭示生命的所有遗传信息转移到在分子整体水平对功能的研究上,生命科学已实质性地跨入了后基因组时代。 尽管现在已经有多个物种的基因组被测序,但这些基因组中通常有一半以上基因的功能是未知的。目前功能基因组研究中所采用的策略,如微阵列法(microarray)(Wodicka et al., 1997)、基因芯片(gene chips)(Ramsay et al., 1998)、基因表达序列分析(SAGE)(Velculescu et al., 1995)等,都是从细胞中mRNA的角度来考虑的。但事实上,从DNA、mRNA到蛋白质存在三个层次的调控,mRNA自身也存在着贮存、转运和降解等问题,从mRNA角度考虑,实际上仅包括了转录水平调控,并不能全面代表蛋白质表达水平。实验也证明,组织中mRNA丰度与蛋白质丰度的相关性并不好,尤其对于低丰度蛋白质来说,相关性更差。蛋白质复杂的翻译后修饰,蛋白质的亚细胞定位或迁移,蛋白质-蛋白质相互作用则几乎无法从mRNA水平来判断(曾嵘,夏其昌,2002)。新生肽链合成后存在多种加工、修饰过程,蛋白质间也存在类似于mRNA分子内的剪切、拼接,研究证明基本元件“intein”广泛存在于蛋白质中(Perler et al., 1997)。基因与其编码产物蛋白的线性对应关系只存在于新生肽链而不是最终的功能蛋白质中。 蛋白质是生理功能的执行者和生命现象的直接体现者,对蛋白质结构和功能的研究将直接阐明生命在生理或病理条件下的变化机制;蛋白质本身的存在形式和活动规律,如翻译后修饰、蛋白质间相互作用及蛋白质构象等问题,仍依赖于直接对蛋白质的研究来解决。因此要对生命的复杂活动有全面和深入的认识,必然要在整体、动态、网络的水平上对蛋白质进行研究(钱小红,贺福初,2003)。 蛋白质组学研究中常用的技术体系 方法学上,二维凝胶电泳-质谱仍然是目前最流行和可靠的技术平台(Rabilloud et al., 2000)。其一般过程是:细胞或组织样品——样品制备——二维凝胶电泳(2D-PAGE)分离蛋白质——计算机辅助分析2D-PAGE图象——对感兴趣的蛋白质进行酶解——质谱分析——数据库检索——蛋白质鉴定——分析蛋白质在细胞与组织中的表达情况。 2-D PAGE 样品制备 2D-PAGE 的操作流程基本上实现了程序化。但是,样品制备是一个非常关键与复杂的过程。成功的2D-PAGE取决于对样品中蛋白质有效的抽提和它的溶解性。与核酸不同,目前没有一种通用的方法适用于所有的蛋白质,来源不同的蛋白质都受到自身蛋白质制备方法的挑战。 正确的样品制备方法从收集样品开始时就要防止样品的裂解和被蛋白水解酶降解(Rabilloud et al., 2000)。要尽可能溶解更多的蛋白,并且在2D-PAGE过程中保持它的溶解性,阻止蛋白质的人为修饰。在样品制备过程中,各个实验室也通过实验建立了更为可行的方法。目前通过建立分步提取方法可以有效地提取出更多的蛋白质(兰彦等,2001)。另一种对蛋白质采用预分离的方法称为“多间隔电解法(multi-compartment-electrolyser)”,采用这种方法后,分辨率和胶的质量均明显改善(Herbert et al., 2000)。 但是,由于生物样品的多样性和复杂性,目前所采用的样品制备方法具有局限性。其它物质对蛋白质样品制备存在干扰。核酸通过与蛋白质结合,增加样品黏度而干扰等点聚焦(IEF)分离的效果。当然,通过实验探索,采取一些措施可以减轻它的干扰。例如,在样品制备过程中加入非特异性的核酸酶或RNase与DNase的混合物,在等电聚焦时将每个胶条的电流限制在50mA以内通常可以消除其影响。脂类物质的影响可以通过利用有机溶剂的方法将其去除,但是这常常会导致蛋白质的不可逆沉淀。除了蛋白质的降解之外,糖基化是蛋白质的最重要的人工修饰,样品中的尿素在这一过程中起着非常重要的作用。样品中的尿素在降解的过程中会形成能够与蛋白质的氨基反应的氰酸盐,这种结果会导致蛋白质带有更多的正电荷。所以,在2D-PAGE中要用新鲜的尿素溶液,在等电聚焦过程中要控制温度不能太高(Beranova-Giorgianni, 2003)。但是,目前还没有一种简单有效的方法来去除样品中的多糖。 样品分离和分析 样品制备完成后运用IEF和SDS-PAGE电泳对它进行分离,常采用银染和考马斯亮兰染色即可观察到具有许多蛋白质斑点的凝胶图像。等电聚焦电泳与SDS-PAGE的具体操作步骤已经实现了程序化,均有详细操作流程参考,但是由于样品的不同,不同样品的具体条件还需要试验探索。第二相SDS-PAGE运行结束,染色完毕后,利用计算机软件对凝胶图像进行分析,如PD-QUEST软件,LIPS,HERMES,GEMINI等,对凝胶图像上的蛋白质斑点进行匹配,对图像进行数字化处理等分析(贾宇峰等,2001),对感兴趣的蛋白质采用质谱分析。 低丰度蛋白质的检测 低丰度蛋白在蛋白质组学研究中常常是人们非常感兴趣的,因为细胞或组织中的一些生物活性物质,如细胞分泌的一些活性物质,受体等表达量都非常低。按照一般电泳的上样量,这些小分子是根本看不到的,但如果单纯地增加上样量,细胞或组织中的大量表达的蛋白就会将其覆盖,而且上样量过大也会影响电泳结果。所以对这些低丰度的样品可以进行富集,富集的方法可以通过层析,如亲和层析,离子交换层析等方法,还可以通过利用样品等电点性质等方法将pH范围相近的蛋白质富集(Santoni et al., 2000; Beranova-Giorgianni, 2003)。
一、样品的浓缩生物大分子在制备过程中由于过柱纯化而样品变得很稀,为了保存和鉴定的目的,往往需要进行浓缩。常用的浓缩方法的:1. 减压加温蒸发浓缩通过降低液面压力使液体沸点降低,减压的真空度愈高,液体沸点降得愈低,蒸发愈快,此法适用于一些不耐热的生物大分子的浓缩。2. 空气流动蒸发浓缩 空气的流动可使液体加速蒸发,铺成薄层的溶液,表面不断通过空气流;或将生物大分子溶液装入透析袋 内置于冷室,用电扇对准吹风,使透过膜外的溶剂不沁蒸发,而达到浓缩目的,此法浓缩速度慢,不适于大量溶液的浓缩。3. 冰冻法 生物大分子在低温结成冰,盐类及生物大分子不进入冰内而留在液相中,操作时先将待浓缩的溶液冷却使之变成固体,然后缓慢地融解,利用溶剂与溶质融点介点的差别而达到除去大部分溶剂的目的。如蛋白质和酶的盐溶液 用此法浓缩时,不含蛋白质和酶的纯冰结晶浮于液面,蛋白质和酶则集中于下层溶液中,移去上层冰块,可得蛋白质和酶的浓缩液。4. 吸收法 通过吸收剂直接收除去溶液中溶液分子使之浓缩。所用的吸收剂必需与溶液不起化学反应,对生物大分子不吸附,易与溶液分开。常用的吸收剂有聚乙二醇,聚乙稀吡咯酮、蔗糖和凝胶等,使用聚乙二醇吸收剂时,先将生物大分子溶液装入半透膜的袋里,外加聚乙二醇复盖置于4度下,袋内溶剂渗出即被聚乙二醇迅速吸去,聚乙二醇被水饱和后要更换新的直至达到所需要的体积。5. 超滤法 超滤法是使用一种特别的薄膜对溶液中各种溶质分子进行选择性过滤的方法,不液体在一定压力下(氮气压或真空泵 压)通过膜时,溶剂和小分子透过,大分子受阻保留,这是近年来发展起来的新方法,最适于生物大分子尤其是蛋白质和酶的浓缩或脱盐,并具有成本低,操作方便,条件温和,能较好地保持生物大分子的活性,回收率高等优点。应用超滤法关键在于膜的选择,不同类型和规格的膜,水的流速,分子量截止值(即大体上能被膜保留分子最小分子量值)等参数均不同,必须根据工作需要来选用。另外,超滤装置形式,溶质成份及性质、溶液浓度等都对超滤效果的一定影响。Diaflo 超滤膜的分子量截留值http://img.dxycdn.com/trademd/upload/userfiles/image/2013/10/A1381571714_small.jpg 用上面的超滤膜制成空心的纤维管,将很多根这样的管拢成一束,管的两端与低离子强度的缓冲液相连,使缓冲液不断地在管中流动。然后将纤维管浸入待透析的蛋白质溶液中。当缓冲液流过纤维管时,则小分子很易透过膜而扩散,大分子则不能。这就是纤维过滤秀析法,由于透析面积增大,因而使透析时间缩短10倍。二、干燥生物大分子制备得到产品,为防止变质,易于保存,常需要干燥处理,最常用的方法是冷冻干燥和真空干燥。真空干燥适用于不耐高温,易于氧化物质的干燥和保存,整个装置包括干燥器、冷凝器及真空干燥原理外,同时增加了温度因素。在相同压力下,水蒸汽压随温度下降而下降,故在低温低压下,冰很易升华为气体。操作时一般先将待干燥的液体冷冻到冰点以下使之变成固体,然后在低温低压下将溶剂变成气体而除去。此法干后的产品具有疏松、溶解度好、保持天然结构等优点,适用于各类生物大分子的干燥保存。三、贮存生物大分子的稳定性与保存方法的很大关系。干燥的制品一般比较稳定,在低温情况下其活性可在数日甚至数年无明显变化,贮藏要求简单,只要将干燥的样品置于干燥器内(内装有干燥剂)密封,保持0-4度冰箱即可,液态贮藏时应注意以下几点。样品不能太稀,必须浓缩到一定浓度才能封装贮藏,样品太稀易使生物大分子变性。一般需加入防腐剂和稳定剂,常用的防腐剂有甲苯、苯甲酸、氯仿、百里酚等。蛋白质和酶常用的稳定剂有硫酸铵糊、蔗糖、甘油等,如酶也可加入底物和辅酶以提高其稳定性。此外,钙、锌、硼酸等溶液对某些酶也有一定保护作用。核酸大分子一般保存在氯化钠或柠檬酸钠的标准缓冲液中。贮藏温度要求低,大多数在0度左右冰箱保存,有的则要求更低,应视不同物质而定。
(一)蛋白质的盐析 取1.5mL蛋白质溶液,加入等体积饱和硫酸铵溶液(浓度为50%饱和),微微摇动试管,使溶液混合均匀后,静置数分钟,球蛋白即析出呈絮状沉淀(如无沉淀可再加少许饱和硫酸铵),用滤纸滤取上清液,滤液中再加入固体硫酸铵粉末至不再溶解,析出的即为清蛋白,再加水稀释,观察沉淀是否溶解。 (二)蛋白质的沉淀 1.用重金属盐沉淀蛋白质 取三支试管,各加1mL蛋白质溶液,分别各加3滴6%醋酸铅溶液、3滴2%硫酸铜溶液和3滴1%硝酸银溶液,观察蛋白质沉淀的析出。 2.用有机酸沉淀蛋白质 取二支试管,各加1mL蛋白质溶液,并加5%醋酸溶液使之呈酸性(该沉淀反应最好在弱酸中进行)。然后分别滴加饱和苦味酸、饱鞣酸溶液,直至沉淀产生为止。 用10%三氯醋酸溶液、3%磺柳酸溶液进行类似实验(用量同前),观察现象。
蛋白质纯化 蛋白质分离纯化是用生物工程下游技术从混合物之当中分离纯化出所需要得目的蛋白质的方法。 是当代生物产业当中的核心技术。该技术难度、成本均高;例如一个生物药品的成本75%都花在下游蛋白质分离纯化当中。常用技术有: 1、沉淀, 2、电泳:蛋白质在高于或低于其等电点的溶液中是带电的,在电场中能向电场的正极或负极移动。根据支撑物不同,有薄膜电泳、凝胶电泳等。 3、透析:利用透析袋把大分子蛋白质与小分子化合物分开的方法。 4、层析: a.离子交换层析,利用蛋白质的两性游离性质,在某一特定PH时,各蛋白质的电荷量及性质不同,故可以通过离子交换层析得以分离。如阴离子交换层析,含负电量小的蛋白质首先被洗脱下来。 b.分子筛,又称凝胶过滤。小分子蛋白质进入孔内,滞留时间长,大分子蛋白质不能时入孔内而径直流出。 5、超速离心:既可以用来分离纯化蛋白质也可以用作测定蛋白质的分子量。不同蛋白质其密度与形态各不相同而分开。
蛋白质数据库1.PIR和PSDPIR国际蛋白质序列数据库(PSD)是由蛋白质信息资源(PIR)、慕尼黑蛋白质序列信息中心(MIPS)和日本国际蛋白质序列数据库(JIPID)共同维护的国际上最大的公共蛋白质序列数据库。这是一个全面的、经过注释的、非冗余的蛋白质序列数据库,包含超过142,000条蛋白质序列(至99年9月),其中包括来自几十个完整基因组的蛋白质序列。所有序列数据都经过整理,超过99%的序列已按蛋白质家族分类,一半以上还按蛋白质超家族进行了分类。PSD的注释中还包括对许多序列、结构、基因组和文献数据库的交叉索引,以及数据库内部条目之间的索引,这些内部索引帮助用户在包括复合物、酶-底物相互作用、活化和调控级联和具有共同特征的条目之间方便的检索。每季度都发行一次完整的数据库,每周可以得到更新部分。PSD数据库有几个辅助数据库,如基于超家族的非冗余库等。PIR提供三类序列搜索服务:基于文本的交互式检索;标准的序列相似性搜索,包括BLAST、FASTA等;结合序列相似性、注释信息和蛋白质家族信息的高级搜索,包括按注释分类的相似性搜索、结构域搜索GeneFIND等。PIR和PSD的网址是:http://pir.georgetown.edu/。数据库下载地址是:ftp://nbrfa.georgetown.edu/pir/。2. SWISS-PROT SWISS-PROT是经过注释的蛋白质序列数据库,由欧洲生物信息学研究所(EBI)维护。数据库由蛋白质序列条目构成,每个条目包含蛋白质序列、引用文献信息、分类学信息、注释等,注释中包括蛋白质的功能、转录后修饰、特殊位点和区域、二级结构、四级结构、与其它序列的相似性、序列残缺与疾病的关系、序列变异体和冲突等信息。SWISS-PROT中尽可能减少了冗余序列,并与其它30多个数据建立了交叉引用,其中包括核酸序列库、蛋白质序列库和蛋白质结构库等。利用序列提取系统(SRS)可以方便地检索SWISS-PROT和其它EBI的数据库。SWISS-PROT只接受直接测序获得的蛋白质序列,序列提交可以在其Web页面上完成。SWISS-PROT的网址是:http://www.ebi.ac.uk/swissprot/。3. PROSITEPROSITE数据库收集了生物学有显著意义的蛋白质位点和序列模式,并能根据这些位点和模式快速和可靠地鉴别一个未知功能的蛋白质序列应该属于哪一个蛋白质家族。有的情况下,某个蛋白质与已知功能蛋白质的整体序列相似性很低,但由于功能的需要保留了与功能密切相关的序列模式,这样就可能通过PROSITE的搜索找到隐含的功能motif,因此是序列分析的有效工具。PROSITE中涉及的序列模式包括酶的催化位点、配体结合位点、与金属离子结合的残基、二硫键的半胱氨酸、与小分子或其它蛋白质结合的区域等;除了序列模式之外,PROSITE还包括由多序列比对构建的profile,能更敏感地发现序列与profile的相似性。PROSITE的主页上提供各种相关检索服务。PROSITE的网址是:http://www.expasy.ch/prosite/。4. PDB蛋白质数据仓库(PDB)是国际上唯一的生物大分子结构数据档案库,由美国Brookhaven国家实验室建立。PDB收集的数据来源于X光晶体衍射和核磁共振(NMR)的数据,经过整理和确认后存档而成。目前PDB数据库的维护由结构生物信息学研究合作组织(RCSB)负责。RCSB的主服务器和世界各地的镜像服务器提供数据库的检索和下载服务,以及关于PDB数据文件格式和其它文档的说明,PDB数据还可以从发行的光盘获得。使用Rasmol等软件可以在计算机上按PDB文件显示生物大分子的三维结构。RCSB的PDB数据库网址是:http://www.rcsb.org/pdb/。5. SCOP蛋白质结构分类(SCOP)数据库详细描述了已知的蛋白质结构之间的关系。分类基于若干层次:家族,描述相近的进化关系;超家族,描述远源的进化关系;折叠子(fold),描述空间几何结构的关系;折叠类,所有折叠子被归于全α、全β、α/β、α+β和多结构域等几个大类。SCOP还提供一个非冗余的ASTRAIL序列库,这个库通常被用来评估各种序列比对算法。此外,SCOP还提供一个PDB-ISL中介序列库,通过与这个库中序列的两两比对,可以找到与未知结构序列远缘的已知结构序列。SCOP的网址是:http://scop.mrc-lmb.cam.ac.uk/scop/。6. COG蛋白质直系同源簇(COGs)数据库是对细菌、藻类和真核生物的21个完整基因组的编码蛋白,根据系统进化关系分类构建而成。COG库对于预测单个蛋白质的功能和整个新基因组中蛋白质的功能都很有用。利用COGNITOR程序,可以把某个蛋白质与所有COGs中的蛋白质进行比对,并把它归入适当的COG簇。COG库提供了对COG分类数据的检索和查询,基于Web的COGNITOR服务,系统进化模式的查询服务等。蛋白质直系同源簇(COGs)数据库是对细菌、藻类和真核生物的21个完整基因组的编码蛋白,根据系统进化关系分类构建而成。COG库对于预测单个蛋白质的功能和整个新基因组中蛋白质的功能都很有用。利用COGNITOR程序,可以把某个蛋白质与所有COGs中的蛋白质进行比对,并把它归入适当的COG簇。COG库提供了对COG分类数据的检索和查询,基于Web的COGNITOR服务,系统进化模式的查询服务等。COG库的网址是:http://www.ncbi.nlm.nih.gov/COG。下载COG库和COGNITOR程序在:ftp://ncbi.nlm.nih.gov/pub/COG
蛋白质化学与蛋白质组学夏其昌 曾嵘 等编著2004年4月出版ISBN 7-03-012401-4/Q.133116开,平装,580页定价: 75.00元 本书系统论述了蛋白质化学基础理论和实验技巧,也反映了蛋白质组学研究的最新成果。内容包括:蛋白质的表征,蛋白质的组成分析和序列测定,与此相关的实验方法,包括各种色谱、电泳、质谱技术等,以及应用在蛋白质表征研究和基因工程产品的质检方面的实际范例。在蛋白质组学领域介绍了基本概念、样品制备、双向凝胶电泳的图像分析和定量分析、质谱等常规方法,并介绍了国际上最新的多维技术在研究中的应用;同时充分体现了生物信息学在蛋白质组研究中的重要性。 本书可作为生物学、医学、化学专业大学生,研究生和教学人员的参考书,也是从事生物化学、分子生物学、医学等领域中分离分析工作人员的参考书。
有个问题一直想不通,请各位帮帮我啊!就是在连续几天测定胁迫下SOD酶的比活力后,发现比活性一直平稳,但后来急剧上升之后下降。但是下降时测得的蛋白质含量与上升时差不多。 为什么酶的比活性下降了(或者说),但是蛋白质含量还是如此高?SOD比活性上升了,是因为酶量增加了还是酶结构的变化?还是说,SOD比活性降低,只是酶的活性部分被抑制,其酶的蛋白质性质未发生改变? 向各位高手求救![em0715]
纤维素),当被分离的蛋白质溶液流经离子交换层析柱时,带有与离子交换剂相反电荷的蛋白质被吸附在离子交换剂上,随后用改变pH或离子强度办法将吸附的蛋白质洗脱下来。(详见层析技术章)(四)根据配体特异性的分离方法-亲和色谱法亲和层析法(aflinity chromatography)是分离蛋白质的一种极为有效的方法,它经常只需经过一步处理即可使某种待提纯的蛋白质从很复杂的蛋白质混合物中分离出来,而且纯度很高。这种方法是根据某些蛋白质与另一种称为配体(Ligand)的分子能特异而非共价地结合。其基本原理:蛋白质在组织或细胞中是以复杂的混合物形式存在,每种类型的细胞都含有上千种不同的蛋白质,因此蛋白质的分离(Separation),提纯(Purification)和鉴定(Characterization)是生物化学中的重要的一部分,至今还没的单独或一套现成的方法能移把任何一种蛋白质从复杂的混合蛋白质中提取出来,因此往往采取几种方法联合使用。浓缩、干燥及保存一、样品的浓缩生物大分子在制备过程中由于过柱纯化而样品变得很稀,为了保存和鉴定的目的,往往需要进行浓缩。常用的浓缩方法的:1. 减压加温蒸发浓缩通过降低液面压力使液体沸点降低,减压的真空度愈高,液体沸点降得愈低,蒸发愈快,此法适用于一些不耐热的生物大分子的浓缩。2. 空气流动蒸发浓缩 空气的流动可使液体加速蒸发,铺成薄层的溶液,表面不断通过空气流;或将生物大分子溶液装入透析袋内置于冷室,用电扇对准吹风,使透过膜外的溶剂不沁蒸发,而达到浓缩目的,此法浓缩速度慢,不适于大量溶液的浓缩。3. 冰冻法 生物大分子在低温结成冰,盐类及生物大分子不进入冰内而留在液相中,操作时先将待浓缩的溶液冷却使之变成固体,然后缓慢地融解,利用溶剂与溶质融点介点的差别而达到除去大部分溶剂的目的。如蛋白质和酶的盐溶液用此法浓缩时,不含蛋白质和酶的纯冰结晶浮于液面,蛋白质和酶则集中于下层溶液中,移去上层冰块,可得蛋白质和酶的浓缩液。4. 吸收法 通过吸收剂直接收除去溶液中溶液分子使之浓缩。所用的吸收剂必需与溶液不起化学反应,对生物大分子不吸附,易与溶液分开。常用的吸收剂有聚乙二醇,聚乙稀吡咯酮、蔗糖和凝胶等,使用聚乙二醇吸收剂时,先将生物大分子溶液装入半透膜的袋里,外加聚乙二醇复盖置于4度下,袋内溶剂渗出即被聚乙二醇迅速吸去,聚乙二醇被水饱和后要更换新的直至达到所需要的体积。5. 超滤法 超滤法是使用一种特别的薄膜对溶液中各种溶质分子进行选择性过滤的方法,不液体在一定压力下(氮气压或真空泵压)通过膜时,溶剂和小分子透过,大分子受阻保留,这是近年来发展起来的新方法,最适于生物大分子尤其是蛋白质和酶的浓缩或脱盐,并具有成本低,操作方便,条件温和,能较好地保持生物大分子的活性,回收率高等优点。应用超滤法关键在于膜的选择,不同类型和规格的膜,水的流速,分子量截止值(即大体上能被膜保留分子最小分子量值)等参数均不同,必须根据工作需要来选用。另外,超滤装置形式,溶质成份及性质、溶液浓度等都对超滤效果的一定影响。用上面的超滤膜制成空心的纤维管,将很多根这样的管拢成一束,管的两端与低离子强度的缓冲液相连,使缓冲液不断地在管中流动。然后将纤维管浸入待透析的蛋白质溶液中。当缓冲液流过纤维管时,则小分子很易透过膜而扩散,大分子则不能。这就是纤维过滤秀析法,由于透析面积增大,因而使透析时间缩短10倍。二、干燥生物大分子制备得到产品,为防止变质,易于保存,常需要干燥处理,最常用的方法是冷冻干燥和真空干燥。真空干燥适用于不耐高温,易于氧化物质的干燥和保存,整个装置包括干燥器、冷凝器及真空干燥原理外,同时增加了温度因素。在相同压力下,水蒸汽压随温度下降而下降,故在低温低压下,冰很易升华为气体。操作时一般先将待干燥的液体冷冻到冰点以下使之变成固体,然后在低温低压下将溶剂变成气体而除去。此法干后的产品具有疏松、溶解度好、保持天然结构等优点,适用于各类生物大分子的干燥保存。三、贮存生物大分子的稳定性与保存方法的很大关系。干燥的制品一般比较稳定,在低温情况下其活性可在数日甚至数年无明显变化,贮藏要求简单,只要将干燥的样品置于干燥器内(内装有干燥剂)密封,保持0-4度冰箱即可,液态贮藏时应注意以下几点。1. 样品不能太稀,必须浓缩到一定浓度才能封装贮藏,样品太稀易使生物大分子变性。2. 一般需加入防腐剂和稳定剂,常用的防腐剂有甲苯、苯甲酸、氯仿、百里酚等。蛋白质和酶常用的稳定剂有硫酸铵糊、蔗糖、甘油等,如酶也可加入底物和辅酶以提高其稳定性。此外,钙、锌、硼酸等溶液对某些酶也有一定保护作用。核酸大分子一般保存在氯化钠或柠檬酸钠的标准缓冲液中。3. 贮藏温度要求低,大多数在0度左右冰箱保存,有的则要求更低,应视不同物质而定。