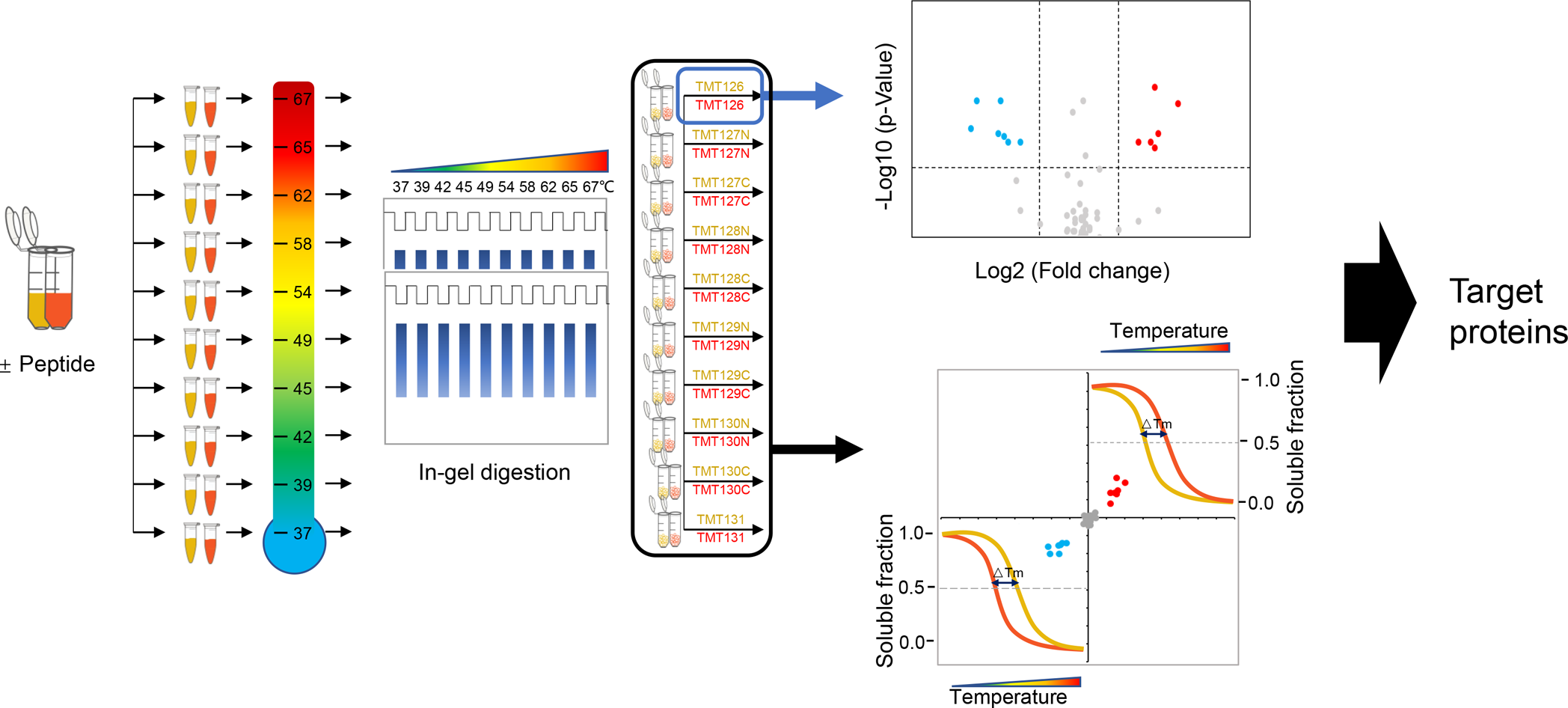
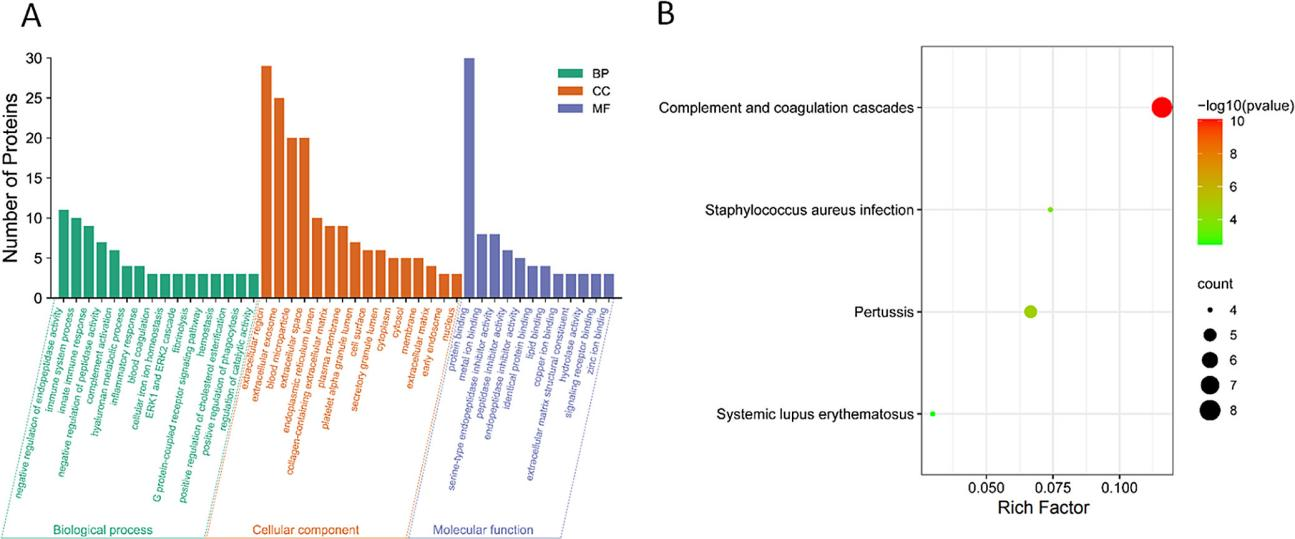
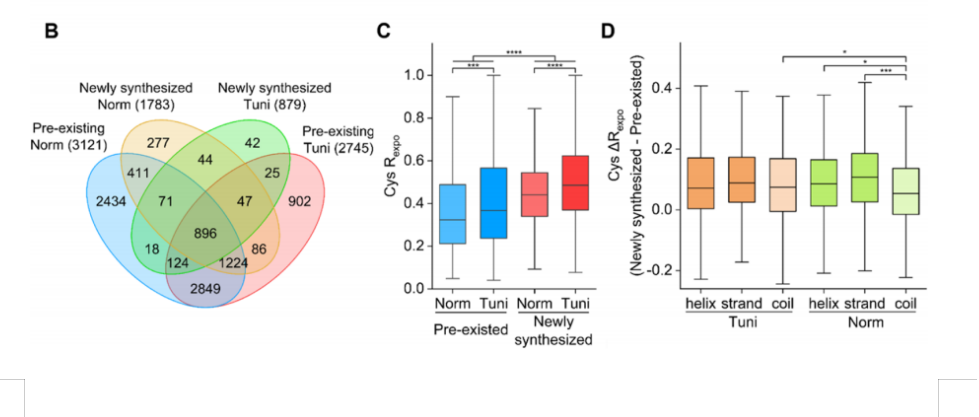
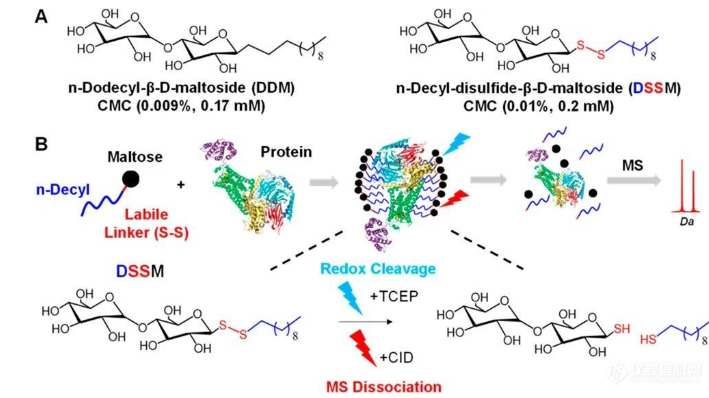
蛋白质组学的前世今生与未来: 蛋白质存在形式 -- 记中南大学湘雅医院詹显全教授
p style=" text-align: justify line-height: 1.75em " 詹显全,中南大学教授、博士研究生导师、博士后合作导师,英国皇家医学会会士(FRSM)、美国科学促进会(AAAS)会员、欧洲预测预防个体化医学协会(EPMA)的会士和国家代表、美国肿瘤学会(ASCO会士、欧洲科技合作组织(e-COST)的海外评审专家,中国抗癌药物国家地方联合工程实验室技术委员会委员、技术带头人和副主任,临床蛋白质组学与结构生物学学科学术带头人和学科负责人,国家临床重点专科建设项目重点实验室建设项目学科带头人,湖南省百人计划专家、湖南省高层次卫生人才“225”工程医学学的学科带头人、中南大学“531”人才工程专家。目前正致力于从多参数系统策略角度阐述肿瘤的分子机理、发现肿瘤分子标志物,研究并整合基因组、转录组、蛋白质组和代谢组的变异来实现肿瘤的预测、预防与个体化治疗及精准医学。已发表学术论文130 余篇,主编国际学术专著3 本,参编国际学术专著16 本,获得美国发明专利2 个。受邀在中科院1 区影响因子9.068 MassSpectrometry Reviews 和中科院2 区影响因子3.65 Frontiers in Endocrinology 的国际期刊上客座主编了3 个专刊。 /p p style=" text-align: justify line-height: 1.75em text-indent: 2em " 本篇文章仪器信息网获得授权转载,来源中国科技成果杂志。 /p p style=" text-align: center line-height: 1.75em " span style=" color: rgb(0, 112, 192) " strong 深入剖析蛋白质组学技术最新进展与应用 /strong /span /p p style=" text-align: justify line-height: 1.75em " 詹显全:人类结构基因组测序接近尾声,人们就从结构基因组学研究转向功能基因组学研究,即对转录组和蛋白质组进行研究。1995 年正式提出了”蛋白质组”和”蛋白质组学”的概念,距今已有25 年历史了。 /p p style=" text-align: justify line-height: 1.75em text-indent: 2em " 蛋白质组学的主要技术包括蛋白质组的分离技术、鉴定技术和蛋白质组信息学技术。 span style=" text-indent: 2em " 蛋白质组的分离技术主要有双向凝胶电泳(2DE)和多维液相色谱(2DLC)。蛋白质组的鉴定技术主要是基于质谱(MS)的技术,主要分为肽质指纹(PMF)和串联质谱(MS/MS)分析技术,其用于蛋白质大分子分析的两大离子源主要有MALDI 和ESI。质谱技术发展很快,主要朝向高灵敏度、高通量和高精度方向发展。 /span /p p style=" text-align: justify line-height: 1.75em " 蛋白质组信息学技术主要是用来构建蛋白质相互用网络的相关技术。蛋白质组的分离技术和质谱技术的不同联合就形成了各种类型的蛋白质组学分析技术:如2DE-MS和2DLC-MS。2DE-MS 又有2DE-MALDI-PMF 和2DE-ESI-LC-MS/MS, 该技术在蛋白质组学研究的头10-15 年是其主要技术,然而常规概念认为2DE 的通量不高,即一个2D 胶点中一般仅含有1 ~ 2 个蛋白质,通常一次实验其通量仅能鉴定几十到一千个蛋白质,这样其在蛋白质组学中的地位逐渐被淡化。 /p p style=" text-align: justify line-height: 1.75em text-indent: 2em " 2DLC-MS 主要有iTRAQ or TMT-based SCX-LC-MS/MS and labelfree LC-LC-MS/MS, 这就是人们通常说的“Bottomup”蛋白质组学,该技术在最近10 ~ 15 年在蛋白质组学中起着核心技术的作用,因为其通量明显增加,一次实验其通量可达到几千到一万的蛋白质能被鉴定,但该法鉴定的结果是一个protein group, 实质上鉴定的是编码蛋白质的基因, 而并没有鉴定到真正意义上的蛋白质,即蛋白质存在形式(Proteoforms 或Protein species)。蛋白质存在形式(Proteoforms)是蛋白质组的基本单元。人类基因大约2 万个,人类转录本至少10 万个,每个转录本指导核糖体按三联密码子决定一个氨基酸残基来合成氨基酸序列,刚合成出来的蛋白质氨基酸序列是没有功能的,它必须到达其指定的位置如胞内、胞外,和不同的亚细胞器等,形成特定的三位空间结构,并与其周围的相关分子相互作用,形成一个复合物(complex)才能发挥其功能作用。从核糖体刚合成出来到其指定的位置过程中有很多的蛋白质翻译后修饰(PTMs 据估计人体有400 ~ 600 种PTMs)。我们最近对蛋白质存在形式的概念给出了最新最完整的定义:蛋白质的氨基酸序列+ 翻译后修饰+ 空间构型+ 辅助因子+ 结合伴侣分子+ 空间位置+ 特定的功能。而蛋白质的概念被定义为:由同一个基因编码的所有蛋白质存在形式的集合体。这样,人类蛋白质组中的蛋白质存在形式(Proteoforms)至少有100 万或甚至达10 亿 (图1)。 /p p style=" text-align: center" img style=" max-width: 100% max-height: 100% width: 600px height: 427px " src=" https://img1.17img.cn/17img/images/202008/uepic/1d18fad3-b010-4ea5-a812-432853ad4ec6.jpg" title=" 1111111.png" alt=" 1111111.png" width=" 600" height=" 427" border=" 0" vspace=" 0" / /p p style=" text-align: center line-height: 1.75em " 图1 :Proteoforms 的概念及形成模式 (Zhan et al,Med One, 2018 Zhan et al., Proteomes, 2019) /p p style=" text-align: justify line-height: 1.75em " 如此庞大数量的Proteoforms/Protein species, 如何对其进行大规模的探测、鉴定和定量,是一个至关重要的事情。目前关于Proteoforms 的研究有两套策略一是“Top-down”MS 技术, 二是“Top-down” 和“Bottom-up”相结合的技术即2DE-LC/MS 技术(图2)。 /p p style=" text-align: center" img style=" max-width: 100% max-height: 100% width: 600px height: 415px " src=" https://img1.17img.cn/17img/images/202008/uepic/94f48c94-fd0b-4959-90fb-dd399cebf074.jpg" title=" 2.png" alt=" 2.png" width=" 600" height=" 415" border=" 0" vspace=" 0" / /p p style=" text-align: center line-height: 1.75em " 图2 :Proteoforms 研究技术比较(Zhan et al., Med One, 2018 Zhan et al., Proteomes, 2019) /p p style=" text-align: justify line-height: 1.75em " “Top-down”MS 技术能探测、鉴定和定量Proteoforms,获得蛋白质的氨基酸序列和PTMs 信息,然而该技术的通量较低,目前最大通量鉴定到5700 个Proteoforms, 对应到860 蛋白质。 /p p style=" text-align: justify line-height: 1.75em " 最近,詹显全教授团队发现2DE-LC/MS 技术是一超高通量的技术平台,在探测、鉴定和定量Proteoforms方面, 可以鉴定达几十万至上100 万的Proteoforms。随着质谱灵敏度的显著提高,自2015 年以来,詹显全教授团队就发现每个2D 胶点包含了平均至少50 个甚至达几百个Proteoforms,并且大多数是低丰度的 并在近1 ~ 2 年来发表了相关论文来全面阐述2DE-LC/MS 的新理念和实践,完全打破了40 多年来人们对双向电泳的传统认识 (即一个2D 胶点中一般仅含有1 ~ 2 蛋白质),为大规模的Proteoforms 研究提供了技术基础。Proteoforms/Protein species 概念的发展极大的丰富了蛋白质组的内涵,是蛋白质组学研究的更高层次,是国际科学发展的前沿,必将影响着整个生命科学和医学科学的研究和实践,有助于发现可靠而有效的疾病标志物,用于深度理解疾病分子机制和决定药物靶点,或者用于有效的预测、诊断、预后评估。另外,蛋白质组是表型组的重要成分,是基因组功能的最终执行者,是基因组和转录组研究所不能替代的,要实现真正的个性化医学和精准医学,蛋白质组学研究是不能绕过去的。 /p p style=" text-align: center line-height: 1.75em " span style=" color: rgb(0, 112, 192) " strong 基于整合组学发现疾病标志物才是精准发展之重 /strong /span /p p style=" text-align: justify line-height: 1.75em " 1. 您一直专注于肿瘤蛋白质组学的研究,例如垂体瘤、卵巢癌等相关恶性肿瘤结合组学的研究,请谈谈在这方面的最新的研究成果,以及过程中的主要挑战和解决方案 /p p style=" text-align: justify line-height: 1.75em " 詹显全: 垂体瘤是颅内常见肿瘤,绝大多数是良性的,只有少数具有侵袭性和恶性,并能引起激素分泌紊乱和颅内压迫症状,出现严重的临床症状,危害人体健康。临床上分为功能性垂体瘤和非功能性垂体瘤,并且非功能性垂体瘤不表现血中激素水平增加,不易早期诊断,经常是当肿瘤体积增加到压迫周围组织器官产生压迫综合征时才被诊断,这时已经是中晚期了,且其分子 /p p style=" text-align: justify line-height: 1.75em " 机制并不清楚,缺乏早期诊断标志物和药物治疗靶标。因此,非功能性垂体瘤被选为主要研究对象。虽然垂体瘤是在颅内,但我们认为垂体瘤是一种多病因、多过程、多结果的全身性的慢性疾病,并且还具有肿瘤的异质性 它涉及到一系列的分子改变,包括发生在基因组、转录组、蛋白质组、代谢组和相互作用组水平上的改变,而这些不同水平改变的分子和信号通路又不是孤零零的起作用,而是相互间具有千丝万缕的联系。因此,我们很难用一种单一因素来解决其预测、预防、诊断、治疗和预后评估 而必须从单因素模式转向多参数系统思维模式。垂体瘤的多病因、多过程、多结果、全身性、慢性、分子网络系统性给其“同病同治”提出了严峻挑战,同时为实现其个性化的精准预测、精准预防、精准诊断和精准治疗提供了机遇和条件。多组学(基因组学、转录组学、蛋白质组学、代谢组学、影像组学)和系统生物学技术的发展驱动了这一多参数系统思维模式的转变、推进了其个性化医学和精准医学的研究和实践。因此,我们认为多参数系统策略观和多组学是进行垂体瘤个性化医学和精准医学的研究和实践的重要理念和技术方案。 /p p style=" text-align: justify line-height: 1.75em " 我们从2001 开始进行垂体瘤的蛋白质组学及其翻译后修饰组学研究,从2008 年开始进行多组学和分子网络研究,及预测预防个体化医学(PPPM)和精准医学(PM)研究。经过过去近20 年未间断的研究,我们在垂体瘤的蛋白质组学、翻译后修饰组学、多组学、分子网络和系统生物学研究方面在国际上处于了主导地位。 /p p style=" text-align: justify line-height: 1.75em " 在我们研究过程中,我深深体会到一个重大思转变就是从以前的单参数模式转向了多参数系统思维模式,这符合肿瘤的真实情况。另外,就是多组学技术促进了这一模式的转变,并是其主要的解决方案。 /p p style=" text-align: justify line-height: 1.75em " 2. 从您的研究方向及重点出发,您认为多组学研究在精准医学中接下来的研究应当侧重于哪些方面,以及如何才能比较好的实现从研究到临床的转化落地? /p p style=" text-align: justify line-height: 1.75em " 詹显全:我的研究对象是肿瘤(垂体瘤、卵巢癌、肺癌、胶质瘤),研究理念是肿瘤的多参数系统策略观,技术手段是多组学和系统生物学,研究的目标是要解决肿瘤的预测预防个体化医学(PPPM)和精准医学(PM)。 /p p style=" text-align: justify line-height: 1.75em " 我们认为多组学中的不同组学对PPPM/PM 的贡献是不平衡的,即个性化的表型组是基因组通向PPPM/PM 应用实践的桥梁,而蛋白质组和代谢组是表型组中两重要成分。蛋白质组的内涵包括蛋白质的拷贝数变化、剪切变化、翻译后修饰、转位、再分布、空间构型、与周围分子相互作用、及信号通路网络问题。代谢组的内涵涉及到体内所有物质(包括糖、脂、蛋白质、核酸)的代谢产物及其代谢网络问题。要真正实现PPPM 和PM,蛋白质组和代谢组的贡献是基因组所不能替代的是不能绕过去的。人们应从以基因组为中心的研究和实践转向以表型组为中心的研究和实践。其中蛋白质组的研究又应以翻译后修饰和蛋白质存在形式(Proteoforms)作为今后的研究方向。Proteoforms 的研究必将影响着整个生命科学和医学科学。从临床转化研究来看,基于多组学的整合生物标志物是发展方向。对于这里的生物标志物,我们将其分为两类:一类是解决疾病分子机制和药物靶点的生物标志物,这类生物标志物一定要有因果关系 一类是解决预测、诊断、预后评估的生物标志物,这类标志物不一定要求有因果关系,但必要要有量的变化。 /p p style=" text-align: justify line-height: 1.75em " 3. 作为EPMA(欧洲预测预防个体化医学协会)的中国代表,想请您分享下国际上对于组学研究在精准医疗中的应用现状、趋势以及发展规划 /p p style=" text-align: justify line-height: 1.75em " 詹显全:欧洲预测预防个体化医学协会(EPMA)是国际个体化医学领域领头的学术协会,由来自全球55 个国家和地区的专家学者组成,其创办的官方杂志EPMA Journal( 中科院2 区,ESI IF5.661) 涵盖了24 个专题内容,较全面地反映了预测预防个体化医学(PPPM)和精准医学(PM)的研究、实践与最新动态,还涉及到PPPM 和PM 的政策、伦理、卫生经济和社会保障等许多方面,为PPPM 和PM 的科研、实践提供了一个很好的交流平台。 /p p style=" text-align: justify line-height: 1.75em text-indent: 2em " 我本人作为EPMA 的中方代表(National Representative of EPMA in China) 和其官方杂志EPMA Journal 的副主编,参与了其经历的重要活动。我从2008 开始起在EPMA 中主要负责多组学和创新技术方面,在EPMA 白皮书中的“肿瘤预测预防个体化医学的多参数系统策略观”这部分最早就是我写的,之后我们写了一系列文章来论述基于多组学的多参数系统策略的研究和实践。因此,在EPMA,我们的基于多组学的多参数系统策略观还是比较早的,近五六年来多组学研究在EPMA 圈内(55 个国家和地区)发展得很快,已经深入到PPPM 的各个领域。 /p p style=" text-align: justify line-height: 1.75em " 另外,我认为,精准医学在理念上没错,严格意义上的精准医学是个理想化的概念,人们只能无限去逐步接近它。现阶段搞精准医学还是要回归到人类健康的保护过程,即预测、预防、诊断、治疗和预后评估,这里应该是针对个人来说而不是针对群体,严格说来应该是个性化的精准预测、精准预防、精准诊断、精准治疗和精准预后评估。对于人类健康保护过程来说,预测、预防还是上策,其次就是早诊断、早治疗。多组学研究已渗入到人类健康保护过程的每个环节,主要用来寻找基于多组学的生物标志物,当然这里的生物标志物应泛指前面说的两类:一类是解决疾病机制和治疗靶点的标志物,一类是解决预测、诊断、预后评估的标志物。 /p p style=" text-align: justify line-height: 1.75em text-indent: 2em " 因此,基于多组学的PPPM/PM 的研究和实践一定是今后发展的一个长远趋势。 /p p style=" text-align: center" img style=" max-width: 100% max-height: 100% width: 600px height: 802px " src=" https://img1.17img.cn/17img/images/202008/uepic/581ff7cf-5c3e-4fd6-8f5f-805989791ee5.jpg" title=" 詹.jpg" alt=" 詹.jpg" width=" 600" height=" 802" border=" 0" vspace=" 0" / /p p br/ /p