LC-ESI-MS研究蛋白质(多聚体)复合物的实验中,LC用水作流动相,蛋白质及复合物带太多水分子而使质谱图复杂,而不易看到蛋白质和小分子配体的结合,而用酸水作流动相,又常遇到蛋白复合物被破坏的问题,请问有没有好的分析策略?向各位请教啦,谢谢!从图上可以看出右方四聚体部分的多电荷质谱图复杂,带有较多水分子。http://ng1.17img.cn/bbsfiles/images/2017/01/201701191656_648498_1634433_3.png
关于国家十一五计划的 乳制品质量安全控制技术研究与产业化示范中青霉素降解产物-蛋白质复合物方面哪位大侠能介绍一下吗?介绍几篇文献也行不胜感激 因为我查了很多文献都没有这方面的知识 都没找到不清楚到底是与哪种蛋白形成了什么复合物
请问用SDS-PAGE测量蛋白质复合物分子量,在样品处理时是否一定要加热呢?加热会使蛋白质变性,改变复合物的性质,影响结果的。多谢!
在研究蛋白质和小分子配体复合物相互作用时,如何看它们的15N-1H HSQC图谱?
这篇文章的出处"国家生物医学分析中心军事医学科学院[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=15861]蛋白质非共价复合物的电喷雾质谱(ESI-MS)研究[/url]
有偿求助,[url=https://bbs.instrument.com.cn/topic/152724]处理[color=red]蛋白质[/color]和小分子配体复合物15N-1H [color=red]HSQC[/color]图谱的教程和软件[/url]。
蛋白质的聚丙烯酰胺凝胶电泳 最广泛使用的不连续缓冲系统最早是由Ornstein(1964) 和Davis(1964) 设计的, 样品和浓缩胶中含 Tris-HCl(pH 6.8), 上下槽缓冲液含Tris-甘氨酸(pH 8.3), 分离胶中含Tris-HCl(pH 8.8)。系统中所有组分都含有0.1% 的 SDS(Laemmli, 1970)。样品和浓缩胶中的氯离子形成移动界面的先导边界而甘氨酸分子则组成尾随边界,在移动界面的两边界之间是一电导较低而电位滴度较陡的区域, 它推动样品中的蛋白质前移并在分离胶前沿积聚。此处pH值较高, 有利于甘氨酸的离子化,所形成的甘氨酸离子穿过堆集的蛋白质并紧随氯离子之后,沿分离胶泳动。从移动界面中解脱后,SDS-蛋白质复合物成一电位和pH值均匀的区带泳动穿过分离胶,并被筛分而依各自的大小得到分离。SDS与蛋白质结合后引起蛋白质构象的改变。SDS-蛋白质复合物的流体力学和光学性质表明,它们在水溶液中的形状,近似于雪茄烟形状的长椭园棒,不同蛋白质的SDS复合物的短轴长度都一样(约为18Å,即1.8nm),而长轴则随蛋白质分子量成正比地变化。这样的SDS-蛋白质复合物,在凝胶电泳中的迁移率,不再受蛋白质原有电荷和形状的影响,而只是椭园棒的长度也就是蛋白质分子量的函数。由于SDS和巯基乙醇的作用,蛋白质完全变性和解聚,解离成亚基或单个肽链,因此测定的结果只是亚基或单条肽链的分子量。 SDS聚丙烯酰胺凝胶的有效分离笵围取决于用于灌胶的聚丙烯酰胺的浓度和交联度。在没有交联剂的情况下聚合的丙烯酰胺形成毫无价值的粘稠溶液,而经双丙烯酰胺交联后凝胶的刚性和抗张强度都有所增加,并形成SDS蛋白质复合物必须通过的小孔。这些小孔的孔径随 “双丙烯酰胺~丙烯酰胺” 比率的增加而变小,比率接近 1:20 时孔径达到最小值。SDS聚丙烯酰胺凝胶大多按“双丙烯酰胺~丙烯酰胺”为1:29 配制,试验表明它能分离大小相差只有3% 的蛋白质。 凝胶的筛分特性取决于它的孔径,而孔径又是灌胶时所用丙烯酰胺和双丙烯酰胺绝对浓度的函数。用5~15%的丙烯酰胺所灌制凝胶的线性分离范围如下表:
现在,在实验研究基础上,借助多方面的生物信息学方法,可以快速高通量的预测和进行蛋白质鉴定蛋白翻译后修饰。分泌蛋白和膜相关蛋白附着于细胞膜上的或将被排泄出去的蛋白质是由细胞内质网膜上附着的核糖体合成。附着有核糖体的内质网被称为糙面型内质网。这类蛋白质都含有一个N-末端(或氨基端),我们称之为信号序列或信号肽。这个信号肽通常情况下含有13-36个主要疏水性残基,同时它含有多蛋白复合物,我们称之为信号识别粒子(SRP)。这种信号肽在通过内质网膜之后会被去除。信号肽的去除过程是在信号肽酶催化作用下完成的。含有一个信号肽的蛋白质被称为前蛋白,有别于原蛋白。然而,某些用于分泌的蛋白在分泌之后会进一步被蛋白水解,因此包含有原蛋白的序列。这类蛋白质被称为前原蛋白。蛋白水解性裂解许多蛋白质在翻译之后会经历水解性裂解过程。其中最为简单的形式是去除起始蛋氨酸。许多蛋白质合成了不活跃的前体细胞,这些细胞只能在合适的生理条件下通过限制性蛋白水解过程产生活性。在凝血过程中使用到的胰腺酶和酶类就是后者的例证。多肽去除时产生活性的不活跃的前体蛋白,我们称之为原蛋白。前原蛋白的翻译后加工过程的一个复杂的例子就是脑垂体分泌合成的前阿黑皮素原的裂解过程(有关前阿黑皮素原的讨论,见肽类激素页)。这类前原蛋白经过复杂的裂解,根据合成的前阿黑皮素原的细胞定位而不同,其路径也有所不同。另一个前原蛋白的例子就是胰岛素。由于胰岛素是由胰腺分泌的,因此它有一个前肽。随着含24个氨基酸的信号肽的裂解,这类蛋白也折叠成了胰岛素原。胰岛素原进一步分裂,产生活跃的胰岛素,它包含两个肽链,由二硫键进行连接。但仍有其他的蛋白(酶类)被合成为非活跃的前体细胞,被称为酶原。酶原在蛋白水解性裂解时会产生活性,在凝血串联蛋白质链的若干蛋白质中都会发生这种现象。甲基化作用蛋白翻译后的甲基化过程主要发生在氮原子和氧原子上。活性甲基供体是活性腺苷甲硫胺酸(SAM)。最常见的甲基化作用发生在赖氨酸残基的ε-amine上。脱氧核糖核酸组蛋白中赖氨酸残基的甲基化作用可调节核染色质结构,因此可调节其转录活性。赖氨酸原本被认为是一种常设共价标记,可提供长期信号,甚至包括转录记忆时的组蛋白依赖机制。然而,最近的临床研究表明赖氨酸甲基化作用与其他共价修饰体相似,作用时间短,并能通过反脱甲基化活动进行动态调节。最近的组学研究发现表明,赖氨酸残基的甲基化作用不仅发生在核染色质层面,而且还通过修订转录因子影响基因表达。组氨酸的咪唑环,精氨酸的胍基部分以及谷氨酸盐和天冬氨酸盐的R组酰胺(R-group amides )上,都发现了额外的氮甲基化作用。谷氨酸盐和天冬氨酸盐的R组羧化物也会发生氧甲基化作用并形成甲基酯。蛋白可能在半胱氨酸的R[
为探究生物进程的分子机制,需要确定介导这个过程的蛋白质-蛋白质间的相互作用。研究蛋白质间相互作用的主要技术总结如下:一、酵母双杂交系统酵母双杂交系统是当前广泛用于蛋白质相互作用组学研究的一种重要方法。其原理是当靶蛋白和诱饵蛋白特异结合后,诱饵蛋白结合于报道基因的启动子,启动报道基因在酵母细胞内的表达,如果检测到报道基因的表达产物,则说明两者之间有相互作用,反之则两者之间没有相互作用。将这种技术微量化、阵列化后则可用于大规模蛋白质之间相互作用的研究。在实际工作中,人们根据需要发展了单杂交系统、三杂交系统和反向杂交系统等。Angermayr等设计了一个SOS蛋白介导的双杂交系统。可以研究膜蛋白的功能,丰富了酵母双杂交系统的功能。此外,酵母双杂交系统的作用也已扩展至对蛋白质的鉴定。二、噬茵体展示技术在编码噬菌体外壳蛋白基因上连接一单克隆抗体的DNA序列,当噬菌体生长时,表面就表达出相应的单抗,再将噬菌体过柱,柱上若含目的蛋白,就会与相应抗体特异性结合,这被称为噬菌体展示技术。此技术也主要用于研究蛋白质之间的相互作用,不仅有高通量及简便的特点,还具有直接得到基因、高选择性的筛选复杂混合物、在筛选过程中通过适当改变条件可以直接评价相互结合的特异性等优点。目前,用优化的噬菌体展示技术,已经展示了人和鼠的两种特殊细胞系的cDNA文库,并分离出了人上皮生长因子信号传导途径中的信号分子。三、等离子共振技术表面等离子共振技术(SurfacePlasmonResonance,SPR)已成为蛋白质相互作用研究中的新手段。它的原理是利用一种纳米级的薄膜吸附上“诱饵蛋白”,当待测蛋白与诱饵蛋白结合后,薄膜的共振性质会发生改变,通过检测便可知这两种蛋白的结合情况。SPR技术的优点是不需标记物或染料,反应过程可实时监控。测定快速且安全,还可用于检测蛋白一核酸及其它生物大分子之间的相互作用。四、荧光能量转移技术荧光共振能量转移(FRET)广泛用于研究分子间的距离及其相互作用;与荧光显微镜结合,可定量获取有关生物活体内蛋白质、脂类、DNA和RNA的时空信息。随着绿色荧光蛋白(GFP)的发展,FRET荧光显微镜有可能实时测量活体细胞内分子的动态性质。提出了一种定量测量FRET效率以及供体与受体间距离的简单方法,仅需使用一组滤光片和测量一个比值,利用供体和受体的发射谱消除光谱间的串扰。该方法简单快速,可实时定量测量FRET的效率和供体与受体间的距离,尤其适用于基于GFP的供体受体对。五、抗体与蛋白质阵列技术蛋白芯片技术的出现给蛋白质组学研究带来新的思路。蛋白质组学研究中一个主要的内容就是研究在不同生理状态下蛋白水平的量变,微型化,集成化,高通量化的抗体芯片就是一个非常好的研究工具,他也是芯片中发展最快的芯片,而且在技术上已经日益成熟。这些抗体芯片有的已经在向临床应用上发展,比如肿瘤标志物抗体芯片等,还有很多已经应用再眼就的各个领域里。六、免疫共沉淀技术免疫共沉淀主要是用来研究蛋白质与蛋白质相互作用的一种技术,其基本原理是,在细胞裂解液中加入抗兴趣蛋白的抗体,孵育后再加入与抗体特异结合的结合于Pansobin珠上的金黄色葡萄球菌蛋白A(SPA),若细胞中有正与兴趣蛋白结合的目的蛋白,就可以形成这样一种复合物:“目的蛋白—兴趣蛋白—抗兴趣蛋白抗体—SPA\|Pansobin”,因为SPA\|Pansobin比较大,这样复合物在离心时就被分离出来。经变性聚丙烯酰胺凝胶电泳,复合物四组分又被分开。然后经Westernblotting法,用抗体检测目的蛋白是什么,是否为预测蛋白。这种方法得到的目的蛋白是在细胞内天然与兴趣蛋白结合的,符合体内实际情况,得到的蛋白可信度高。但这种方法有两个缺陷:一是两种蛋白质的结合可能不是直接结合,而可能有第三者在中间起桥梁作用;二是必须在实验前预测目的蛋白是什么,以选择最后检测的抗体,所以,若预测不正确,实验就得不到结果,方法本身具有冒险性。七、pull-down技术蛋白质相互作用的类型有牢固型相互作用和暂时型相互作用两种。牢固型相互作用以多亚基蛋白复合体常见,最好通过免疫共沉淀(Co-IP)、Pull-down技术或Far-western法研究。Pull-down技术用固相化的、已标记的饵蛋白或标签蛋白(生物素-、PolyHis-或GST-),从细胞裂解液中钓出与之相互作用的蛋白。通过Pull-down技术可以确定已知的蛋白与钓出蛋白或已纯化的相关蛋白间的相互作用关系,从体外传路或翻译体系中检测出蛋白相互作用关系。
质谱与蛋白质组学蛋白质组学对一个细胞或组织所表达的蛋白质进行的系统分析,而质谱是它的关键性分析工具。在过去的两年中,标准蛋白质组技术中的进展增进了更高水平自动化和敏感性的蛋白质识别技术。另外,新的技术促成了鉴定蛋白质功能相关特性的里程碑性的进展,包括它们的定量和在蛋白质复合物中复杂情况。缩写2DE two-dimensional gel electrophoresis双向凝胶电泳CID collision-induced dissociation碰撞诱导的解离ESI electrospray ionization电喷雾离子化FT-ICR Fourier-transform ion cyclotron resonance傅里叶-变换离子回旋加速器共振ICAT isotope-coded affinity tagsIEF isoelectric focusing等电聚焦MALDI matrix-assisted laser desorption ionization基质辅助的激光解析离子化Q-TOF quadrupole-TOFRP reversed phase反向TOF time-of-flight飞行时间简介蛋白质组学的核心组成是系统识别一个细胞或组织中表达的每一个蛋白质,以及确定每个蛋白质的突出特征(比如,丰度、修饰状态以及在多蛋白质复合体中的复杂状态)。这些分析的技术包括分离蛋白质和肽的分离科学、识别和定量分析物的分析科学和数据管理和分析的生物信息学。它的初步工具包括使用IEF(等电点聚焦)/SDS-PAGE凝胶的高分辨率的双向凝胶电泳(2DE),结合质谱和数据库搜索来分离、识别和定量在一个复合样本中存在的个体蛋白质,最终识别被分离的蛋白质。一个常用的方法用在Fig1中用图解说明。此技术以及由此而来的变化(综述见[1])已经被用来识别和分类在复杂样本中存在的大量蛋白质,并在蛋白质组数据库中呈现它们,该过程我们这里称之为"描述蛋白质组学"比如,Shevchenko等[2]从2D凝胶上系统地鉴定了150个蛋白质。数目庞大的这样的数据库现在可以找到。同样的技术现在已经被作为普遍的发现工具来动态检测一个细胞或组织对外来或内部干扰反应而在蛋白质组中的改变。因为检测动态改变需要精确定量每个被检测成分,我们使用"定量蛋白质组学"来定义。在此报告中,我们总结了自1999年1月至2000年4月来报道的与蛋白质组学和质谱相关的最重要的进展。在核心质谱技术中的进展已经导致2DE为基础的蛋白质组学技术的进一步改进。它们同时又促进了传统凝胶为基础的方法的替代方法,诸如引入以同位素稀释理论为基础的精确蛋白质定量技术和蛋白质复合物的系统分析。蛋白质组分析的MS技术进展在此部分,我们总结了在MS设备、它们的控制和操作中的进展,以及比较质谱数据和序列数据库识别蛋白质所用的搜索工具的进展。随着新型质谱仪的引入,蛋白质组学研究现存类型的质谱仪性能已经显著改进了。在此综述期间最普遍使用的仪器是可以分为两类:单一阶段的质谱仪和串联质谱为基础的系统。单一阶段的质谱仪,最显著的是基质辅助的激光解吸电离(MALDI)飞行时间(TOF)仪器,被用于无数通过肽质谱图谱技术大规模蛋白质识别的项目中。此方法在鉴别表达自小一些的和完全测序的基因组的蛋白质特别成功[3,4]。串联质谱仪器诸如triple quadrpole、离子捕获(ion-trap)和近来引进的混合quadrupole飞行时间(Q-TOF)被常规应用于[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]/MS或用电喷雾电离(ESI)来生成肽片段离子谱,以便通过搜寻序列数据库进行蛋白质鉴定。使用仪器控制程序来自动选择肽离子进行碰撞诱导的解离(CID)(数据依赖CID)的不断增多是这些MS/MS仪器的一个明显的趋势。一些新的构造的具有高潜能的质谱仪被引入到蛋白质组学研究中产生深刻影响。两个研究组近来一个MALDI离子源和一个混合Q-TOF耦联了起来[5,6]。Q-TOF提供的质量准确性和敏感性提升了数据库搜寻结果并同时使它成为MS/MS从头测序的当然仪器选择。MALDI Q-TOF构造提供了激动人心的机会进行自动化和高通量应用以及在一个样品盘上存档样品进行日后研究的可能。Medzihradszky等[7]描述了一个不同的混合仪器称之为MALDI TOF TOF。此设备享有许多MALDI Q-TOF的优点,另外能够进行高能量CID和非常快速的扫描速率。傅里叶-变换离子回旋加速器共振(FT-ICR)质谱对于蛋白质组学来说相对陌生。这些设备具有非常高的敏感性和分辨率,质量精确性可以达到1ppm。这些特征被用来在一次分析中测量和定量几百种蛋白质的完整的分子质量[8]。Goodlett等[9]表明FT-MS测量的一个肽的准确质量以及可以容易获得的限制因素能够通过序列数据库搜索被用来识别蛋白质。蛋白质组学如果没有软件工具来进行质谱数据和序列数据库的关联将变得几无可能。现存的数据库搜索程序已经变得越来越成熟和可以(从网络)可获得。另外,引入了新的算法。主要相关程序是Sequest[10],MASCOT[11],PeptedeSearch[12],PROWL[13]和Protein Prospector[14]。在它们中间,Sequest使用CID谱设置了蛋白质识别的实验室标准(benchmark),因为它与边界MS/MS数据工作得最好,并高度可信,可以从整个[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]/MS实验中自动分析数据,并不需要任何使用者的破译工作。在所提的程序中,然而,只有Sequest不能在网络上搜索。MASCOT是一个新的、快速、网络可进入和多功能的程序,具有进行肽指纹分析、用部分破译或未破译的CID谱进行数据库搜索的功能。

[size=16px] 食品蛋白质检测仪通常使用一系列的化学、生物化学或物理方法来检测乳制品中的蛋白质含量。以下是一种可能的检测过程: 样品制备: 从乳制品中取得样品,通常需要将样品进行处理,以确保蛋白质在检测过程中能够充分释放和反应。 蛋白质提取: 样品中的蛋白质需要从其他成分中分离出来。这可能涉及到样品的离心、过滤和/或溶解等步骤,以获得含有蛋白质的提取物。 显色/反应: 蛋白质的浓度可以通过与特定试剂发生化学反应或形成复合物来测量。例如,比目鱼法(Bradford法)或比二巴脱酰基试剂(BCA法)都是常用于蛋白质浓度测定的方法。这些试剂与蛋白质反应后会产生颜色变化,颜色的强度可以与蛋白质的浓度成正比。 分光光度测量: 使用分光光度计来测量显色产物的吸光度,从而确定蛋白质的浓度。通常,会建立一个标准曲线,其中包含已知浓度的蛋白质标准样品,用于校准测量结果。 计算浓度: 通过比较待测样品的吸光度与标准曲线上的数据,可以计算出待测样品中蛋白质的浓度。 需要注意的是,不同类型的食品蛋白质检测仪可能会采用不同的方法和试剂,具体的步骤和操作可能会有所不同。此外,为了获得准确的结果,操作者需要在操作过程中遵循标准操作规程,并确保仪器的准确校准和维护。最终结果的准确性也可能会受到样品的处理、试剂的质量以及操作技术等因素的影响。[img=,690,690]https://ng1.17img.cn/bbsfiles/images/2023/08/202308291345517046_7349_6098850_3.png!w690x690.jpg[/img][/size]
Q:SDS-PAGE电泳的基本原理?A:SDS-聚丙烯酰胺凝胶电泳,是在聚丙烯酰胺凝胶系统中引进SDS(十二烷基硫酸钠),SDS会与变性的多肽,并使蛋白带负电荷,由于多肽结合SDS的量几乎总是与多肽的分子量成正比而与其序列无关,因此SDS多肽复合物在丙稀酰胺凝胶电泳中的迁移率只与多肽的大小有关,在达到饱和的状态下,每克多肽可与1.4g去污剂结合。当分子量在15KD到200KD之间时,蛋白质的迁移率和分子量的对数呈线性关系,符合下式:logMW=K-bX,式中:MW为分子量,X为迁移率,k、b均为常数,若将已知分子量的标准蛋白质的迁移率对分子量对数作图,可获得一条标准曲线,未知蛋白质在相同条件下进行电泳,根据它的电泳迁移率即可在标准曲线上求得分子量。
为什么多个相同的蛋白质分子形成复合物之后,信号会变宽,甚至连成一片,无法分辨。我做的是1H-15N谱
在前处理中,内脏组织大多杂质很多,需要沉淀蛋白质,沉淀后离心,提上清夜再萃取,但内源性物质中的待检物同时也会和蛋白质成结合状态,需要水解,再萃取。所以请问如果我先沉淀了蛋白,那么会不会把成结合状态的待检物一同沉淀,损失待检物。在运用中如何处理蛋白质杂质和蛋白质结合物的前处理问题?
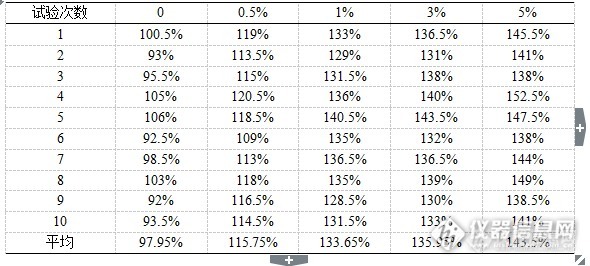
[b]中文摘要:目的[/b] 确立因子类血液制品中蛋白质含量对效价检测结果的影响,从而完善因子类血液制品效价检测的方法。[b]方法 [/b]选取不同蛋白质浓度梯度的稀释液对同一供试品进行稀释来确定蛋白质影响的规律。 [b]结果 [/b]建立起人凝血因子Ⅷ、人凝血酶原复合物的全自动血凝仪因子效价检测方法,根据效价检测反应体系中蛋白浓度对检测结果的影响,建立因子类血液制品效价全自动血凝仪检测的方法。[b]结论 [/b]建立的两种稀释方法均消除了样品中蛋白质含量的不同对检测结果的影响,提高了检测的准确性,不但可以适用于现在产品的效价检测,而且适用于随着生产工艺的提升生产的更高纯度、低蛋白含量的FⅧ和PCC,同时也是对中国药典标准的补充。[b]关键词[/b]:人凝血因子Ⅷ;人凝血酶原复合物;效价;蛋白含量 人凝血因子Ⅷ、人凝血酶原复合物、人凝血因子Ⅸ等因子类血液制品,是以健康人血浆为原料,经分离纯化和病毒灭活制成,在临床上主要用于各种凝血因子缺乏的治疗,这些因子类血液制品的凝血因子效价是药品有效性的指标,凝血因子效价的测定也是药品质量检测中的关键检测项目。血液制品生产企业及各级检测机构一般采用全自动血凝仪并按照仪器使用说明来进行因子效价的检测,然而在不同检测方法结果比对中,发现全自动血凝仪检测结果与中国药典中一期法的检测结果在部分因子效价检测中存在检测差异,差异可能是样品稀释中使用的稀释液的蛋白含量不同引起的,故本课题主要研究因子类血液制品中蛋白质含量对效价检测结果影响。通过蛋白含量对因子效价检测影响的研究建立起的全自动血凝仪因子效价检测方法,消除了产品本身性质的影响,可以准确进行因子效价的测定,方法的建立不但可以准确控制因子类血液制品的质量,保证生产企业持续稳定生产出质量均一的药品,而且可以减少因子类产品在临床使用中的风险。[b]1 实验仪器与试剂[b]1.1 仪器[/b][/b]Stago-compact全自动血凝仪(法国Diagnostica Stago公司),漩涡振荡器(美国Thermo Scientific公司)。[b][b]1.2 试剂[/b][/b]人凝血因子Ⅷ缺乏血浆(法国Diagnostica Stago公司),人凝血因子Ⅸ缺乏血浆(法国Diagnostica Stago公司),APTT试剂(法国Diagnostica Stago公司),Owren-Koller(稀释液)(法国Diagnostica Stago公司),0.025 mol/L氯化钙溶液(法国Diagnostica Stago公司),Desorb U(清洗液)(法国Diagnostica Stago公司),人凝血因子Ⅷ国家标准品(批号20100101),人凝血酶原复合物国家标准品(批号20130306),生理氯化钠溶液(石家庄四药有限公司),咪唑(天津市巴斯夫化工有限公司),氯化钠(天津市巴斯夫化工有限公司),枸橼酸钠(台山新宁制药有限公司),人血白蛋白(公司自产)。[b][b]2 方法2.1 人凝血因子Ⅷ不同蛋白质浓度梯度稀释效价测定[/b][/b] 人凝血因子Ⅷ国家标准品的定标:取1支人凝血因子Ⅷ国家标准品,加入1.0 ml纯化水复溶,轻轻混匀,用生理氯化钠溶液将其稀释成每1 ml含1.00 IU人凝血因子Ⅷ,将Desorb U(清洗液)、复溶后的人凝血因子Ⅷ缺乏血浆、0.025 mol/L氯化钙溶液、APTT以及每1 ml含1.00 IU的人凝血因子Ⅷ标准品溶液分别装入全自动血凝仪的试剂抽屉,将Owren-Koller(稀释液)装入全自动血凝仪的样本抽屉,按照《Stago-compact全自动血凝仪标准操作规程》选择人凝血因子Ⅷ效价测定定标程序进行定标,仪器自动将装入的人凝血因子Ⅷ标准品溶液再进行2倍、4倍、8倍稀释,建立人凝血因子Ⅷ标准品溶液效价(分别为1.00 IU/ml、0.50 IU/ml、0.25 IU/ml、0.13 IU/ml)的对数对其相应凝固时间对数的直线回归方程。 不同蛋白质浓度梯度稀释液制备:选取全自动血凝仪的稀释液Owren-Koller、生理氯化钠溶液、取1体积的3.8%枸橼酸钠加入5体积咪唑缓冲液混合液分别定义为稀释液1、稀释液2、稀释液3。向3种稀释液中分别加入人血白蛋白,使其中人血白蛋白的浓度分别为0、0.5%、1%、3%、5%。 人凝血因子Ⅷ供试品效价测定:取人凝血因子Ⅷ供试品,按其标示装量加入灭菌注射用水复溶,轻轻混匀,用生理氯化钠溶液将其稀释成每1 ml约含1.00 IU人凝血因子Ⅷ,再用含不同蛋白浓度的稀释液做2倍、4倍稀释,将稀释后的供试品溶液装入全自动血凝仪的样本抽屉,选择人凝血因子Ⅷ效价测定选项进行测定。[b][b]2.2 人凝血因子Ⅷ人凝血因子缺乏血浆稀释效价测定[/b] [/b]人凝血因子Ⅷ国家标准品的定标:取1支人凝血因子Ⅷ国家标准品,加入1.0 ml纯化水复溶,轻轻混匀,用人凝血因子Ⅷ缺乏血浆将其稀释成每1ml含1.00 IU人凝血因子Ⅷ,将Desorb U(清洗液)、复溶后的人凝血因子Ⅷ缺乏血浆、0.025 mol/L氯化钙溶液、APTT以及每1 ml含1.00 IU的人凝血因子Ⅷ标准品溶液分别装入全自动血凝仪的试剂抽屉,将Owren-Koller(稀释液)装入全自动血凝仪的样本抽屉,按照《Stago-compact全自动血凝仪标准操作规程》选择人凝血因子Ⅷ效价测定定标程序进行定标,仪器自动将装入的人凝血因子Ⅷ标准品溶液再进行2倍、4倍、8倍稀释,建立人凝血因子Ⅷ标准品溶液效价(分别为1.00 IU/ml、0.50 IU/ml、0.25 IU/ml、0.13 IU/ml)的对数对其相应凝固时间对数的直线回归方程。 人凝血因子Ⅷ供试品效价测定:取人凝血因子Ⅷ供试品,按其标示装量加入灭菌注射用水复溶,轻轻混匀,用人凝血因子Ⅷ缺乏血浆将其稀释成每1 ml约含1.00 IU人凝血因子Ⅷ,再用Owren-Koller(稀释液)做2倍、4倍稀释,将稀释后的供试品溶液装入全自动血凝仪的样本抽屉,选择人凝血因子Ⅷ效价测定选项进行测定。[b][b]2.3 人凝血酶原复合物人凝血因子Ⅸ不同蛋白质浓度梯度稀释效价测定[/b][/b] 人凝血因子Ⅸ国家标准品的定标:取1支人凝血酶原复合物国家标准品,加入1.0 ml纯化水复溶,轻轻混匀,用生理氯化钠溶液将其稀释成每1 ml含1.00 IU人凝血因子Ⅸ,将Desorb U(清洗液)、复溶后的人凝血因子Ⅸ缺乏血浆、0.025 mol/L氯化钙溶液、APTT以及每1 ml含1.00 IU的人凝血因子Ⅸ标准品溶液分别装入全自动血凝仪的试剂抽屉,将Owren-Koller(稀释液)装入全自动血凝仪的样本抽屉,按照《Stago-compact全自动血凝仪标准操作规程》选择人凝血因子Ⅸ效价测定定标程序进行定标,仪器自动将装入的人凝血因子Ⅸ标准品溶液再进行2倍、4倍、8倍稀释,建立人凝血因子Ⅸ标准品溶液效价(分别为1.00 IU/ml、0.50 IU/ml、0.25 IU/ml、0.13 IU/ml)的对数对其相应凝固时间对数的直线回归方程。 不同蛋白质浓度梯度稀释液制备同2.1。 人凝血酶原复合物供试品效价测定:取人凝血酶原复合物供试品,按其标示装量加入灭菌注射用水复溶,轻轻混匀,用生理氯化钠溶液将其稀释成每1 ml约含1.00 IU人凝血因子Ⅸ,再用含不同蛋白浓度的稀释液做2倍、4倍稀释,将稀释后的供试品溶液装入全自动血凝仪的样本抽屉,选择人凝血因子Ⅸ效价测定选项进行测定。[b][b]2.4 人凝血酶原复合物人凝血因子Ⅸ人凝血因子缺乏血浆稀释效价测定[/b][/b] 人凝血因子Ⅸ国家标准品的定标:取1支人凝血酶原复合物国家标准品,加入1.0 ml纯化水复溶,轻轻混匀,用人凝血因子Ⅸ缺乏血浆将其稀释成每1 ml含1.00 IU人凝血因子Ⅸ,将Desorb U(清洗液)、复溶后的人凝血因子Ⅸ缺乏血浆、0.025 mol/L氯化钙溶液、APTT以及每1 ml含1.00 IU的人凝血因子Ⅸ标准品溶液分别装入全自动血凝仪的试剂抽屉,将Owren-Koller(稀释液)装入全自动血凝仪的样本抽屉,按照《Stago-compact全自动血凝仪标准操作规程》选择人凝血因子Ⅸ效价测定定标程序进行定标,仪器自动将装入的人凝血因子Ⅸ标准品溶液再进行2倍、4倍、8倍稀释,建立人凝血因子Ⅸ标准品溶液效价(分别为1.00 IU/ml、0.50 IU/ml、0.25 IU/ml、0.13 IU/ml)的对数对其相应凝固时间对数的直线回归方程。 人凝血酶原复合物供试品效价测定:取人凝血酶原复合物供试品,按其标示装量加入灭菌注射用水复溶,轻轻混匀,用人凝血因子Ⅸ缺乏血浆将其稀释成每1 ml约含1.00 IU人凝血因子Ⅸ,再用Owren-Koller(稀释液)做2倍、4倍稀释,将稀释后的供试品溶液装入全自动血凝仪的样本抽屉,选择人凝血因子Ⅸ效价测定选项进行测定。[b][b]3 结果3.1 人凝血因子Ⅷ不同蛋白质浓度梯度稀释效价测定结果[/b][/b] 选取2015ZK0801批人凝血因子Ⅷ进行了不同蛋白质浓度梯度稀释效价测定,不同浓度稀释液分别测定10次。人血白蛋白的浓度分别为0、0.5%、1%、3%、5%的稀释液1、稀释液2、稀释液3的效价检测结果分别见表1、2、3,效价检测结果为效价标示量的百分比。[align=center]表1 FⅧ质控品不同蛋白浓度梯度稀释液1检测结果[/align][align=center][img=,590,266]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142017_01_1626619_3.png[/img][/align][align=center]表2 FⅧ质控品不同蛋白浓度梯度稀释液2检测结果 [/align][align=center][img=,586,260]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142019_01_1626619_3.png[/img][/align][align=center]表3 FⅧ质控品不同蛋白浓度梯度稀释液3检测结果 [/align][align=center][img=,585,261]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142019_02_1626619_3.png[/img][/align]人凝血因子Ⅷ质控品2015ZK0801批用不同蛋白质浓度梯度的稀释液1、稀释液2、稀释液3稀释效价检测结果平均值用折线图表示,如图1:[align=center]图1 FⅧ质控品不同蛋白质浓度检测结果对比[/align][align=center][img=,548,295]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142019_03_1626619_3.png[/img][/align] 选取2批国外产人凝血因子Ⅷ和VWF混合制剂进行了不同蛋白质浓度梯度稀释效价测定,人血白蛋白的浓度分别为0、0.5%、1%、3%、5%的稀释液1、稀释液2、稀释液3的效价检测结果见表4、5,效价检测结果为效价标示量的百分比。[align=center]表4 658668A批制剂FⅧ检测结果[/align][align=center][img=,585,99]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142020_01_1626619_3.png[/img][/align][align=center]表5 A3B1814批制剂FⅧ检测结果[/align][align=center][img=,577,97]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142021_01_1626619_3.png[/img][/align]FⅧ效价检测结果用折线图表示,如图2、3:[align=center][img=,563,299]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142029_01_1626619_3.png[/img][/align][align=center]图2 658668A批不同蛋白质浓度检测结果对比[/align][align=center][img=,567,287]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142030_01_1626619_3.png[/img][/align][align=center]图3 A3B1814批不同蛋白质浓度检测结果对比[/align][b][b]3.2 人凝血酶原复合物不同蛋白质浓度梯度稀释效价测定结果[/b][/b] 选取2015ZK0901批人凝血酶原复合物进行了不同蛋白质浓度梯度稀释人凝血因子Ⅸ效价测定,不同浓度稀释液分别测定10次。人血白蛋白的浓度分别为0、0.5%、1%、2%、3%、4%、5%的稀释液1、稀释液2、稀释液3的效价检测结果分别见表6、7、8,效价检测结果为效价标示量的百分比。[align=center]表6 PCC质控品不同蛋白浓度梯度稀释液1检测结果[/align][align=center][img=,583,269]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142031_01_1626619_3.png[/img][/align][align=center]表7 PCC质控品不同蛋白浓度梯度稀释液2检测结果[/align][align=center][img=,586,260]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142031_02_1626619_3.png[/img][/align][align=center]表8 PCC质控品不同蛋白浓度梯度稀释液3检测结果[/align][align=center][img=,593,263]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142043_01_1626619_3.png[/img][/align]人凝血酶原复合物质控品2015ZK0901批用不同蛋白质浓度梯度的稀释液1、稀释液2、稀释液3稀释FⅨ效价检测结果平均值用折线图表示,如图4:[align=center][img=,556,300]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142032_01_1626619_3.png[/img][/align][align=center]图4 PCC质控品不同蛋白质浓度FⅨ检测结果对比[/align][b][b]3.3 人凝血因子Ⅷ人凝血因子缺乏血浆稀释效价测定结果[/b][/b]选取2015ZK0801批人凝血因子Ⅷ进行了人凝血因子缺乏血浆稀释效价测定,共测定10次。效价检测结果见表9,效价检测结果为效价标示量的百分比。[align=center]表9 FⅧ质控品人凝血因子缺乏血浆稀释检测结果[/align][align=center][img=,579,74]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142032_02_1626619_3.png[/img][/align]选取2批国外产人凝血因子Ⅷ和VWF混合制剂进行了人凝血因子缺乏血浆稀释效价测定。效价检测结果见表10,效价检测结果为效价标示量的百分比。[align=center]表10 国外产品人凝血因子缺乏血浆稀释检测结果[/align][align=center][img=,578,77]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142036_01_1626619_3.png[/img][/align][b][b]3.4 人凝血酶原复合物人凝血因子Ⅸ人凝血因子缺乏血浆稀释效价测定结果[/b][/b]选取2015ZK0901批人凝血酶原复合物进行了人凝血因子缺乏血浆稀释人凝血因子Ⅸ效价测定,共测定10次。效价检测结果见表11,效价检测结果为效价标示量的百分比。[align=center]表11 PCC质控品人凝血因子缺乏血浆稀释检测结果[/align][align=center][img=,582,89]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142047_01_1626619_3.png[/img][/align][b][b]4 讨论[/b][/b] 本实验中对人凝血因子Ⅷ和人凝血酶原复合物分别用不同蛋白浓度梯度的稀释液进行了效价测定,另外用人凝血因子缺乏血浆稀释后进行了效价测定。因子效价测定中,稀释液1、稀释液2、稀释液3中加入相同浓度的人血白蛋白后,得到的因子效价检测结果没有差异,说明全自动血凝仪的稀释液Owren-Koller、生理氯化钠溶液、取1体积的3.8%枸橼酸钠加入5体积咪唑缓冲液混合液作为稀释液时没有区别。 人凝血因子Ⅷ、人凝血酶原复合物不同蛋白浓度梯度效价测定时,随着稀释液中蛋白质含量的增高,效价检测结果也不断升高,但在人凝血因子Ⅷ效价测定中,采用蛋白质含量为1%、3%的稀释液时,效价检测结果间均无显著差别,在人凝血酶原复合物人凝血因子Ⅸ效价测定中,采用蛋白质含量为0、0.5%、1%的稀释液时,效价检测结果间均无显著差别。另外,人凝血因子Ⅷ进行人凝血因子缺乏血浆稀释效价测定效价检测结果与采用蛋白质含量为1%、3%的稀释液得到的检测结果也无显著差异,人凝血酶原复合物人凝血因子缺乏血浆稀释人凝血因子Ⅸ效价检测结果与采用蛋白质含量为0、0.5%、1%的稀释液得到的检测结果也无显著差异。另外,国外生产的人凝血因子Ⅷ和VWF的混合制剂FⅧ效价的检测结果及血浆、稀释液的影响同泰邦公司产品一致。[b]参考文献[/b][align=left] 邬杨斌, 余蓉. 凝血因子Ⅸ复合物的研制 . 华西药学杂志, 2000, 15(3):177-179. Pabinger I, Brenner B, Kalina U, et al. Prothrombin complex concentrate(Beriplexw P/N)for emergency anticoagulation reversal: A prospective multinational clinical trial . J Thromb Haemost, 2008, 6(4):622-631. Kiman E, Elela AA, Ramsis N, et al. Evaluation of the coagulation factors activity of Cryosupernatant . Suez Canal Univ Med J, 2003, 6(2):247-258.Tullis JL, Melin M, Jurigian P. Clinical use of human Prothrombin complexes . N Engl J Med, 1965, 73(13):667-674.马莉, 孙盼, 李长清, 等. 去冷沉淀血浆的质量分析 . 中国生物制品学杂志, 2013, 26(1):81-83.魏舒, 时凯, 刘国荣, 等. 冻干人凝血酶原复合物的生产工艺研究 . 中国输血杂志, 2008, 21(10):282-284.Samama CM. Prothrombin complex concentrates: a brief review . Eur J Anaesthesiol, 2008, 25(10):784-789.焦丽华, 代旭兰, 刘文芳. 凝血酶原复合物的制备及其临床应用进展 .中国输血杂志, 2008, 21(9):737-741.[/align][b] [/b]
[font=宋体]蛋白质纯化系统是一种用于从混合物中纯化目标蛋白的设备和方法。它结合了多种技术和步骤,可以有效地分离和纯化蛋白质,提供高纯度和高活性的目标蛋白。蛋白质纯化系统是实现蛋白质纯化的关键装置,它结合了各种分离、富集和纯化方法,帮助科研工作者实现蛋白质的高纯度提取。[/font][font=宋体] [/font][font=宋体][b]蛋白质纯化系统的基本原理[/b][/font][font=宋体]蛋白质纯化系统主要依据蛋白质的特性利用不同的物理化学方法进行分离和纯化。下面将介绍几种常见的蛋白质纯化系统的基本原理。[/font][font=宋体] [/font][font=宋体][font=宋体]①[url=https://cn.sinobiological.com/resource/protein-review/protein-purification-by-ac][b]亲和层析[/b][/url][/font][/font][font=宋体]亲和层析是一种基于蛋白质的特异性与配体的亲和性相互作用来实现分离和纯化的方法。在亲和层析过程中,蛋白质溶液通过填充有配体的柱子,与配体结合形成复合物,而非特异性结合的其他组分被洗脱。最后,通过改变条件来破坏蛋白质与配体的结合,从而使得目标蛋白质得以纯化。[/font][font=宋体] [/font][font=宋体]②凝胶过滤层析[/font][font=宋体]凝胶过滤层析是一种基于蛋白质大小差异来进行分离的方法。在凝胶过滤层析中,待纯化的蛋白质溶液通过一系列的凝胶层析柱,大分子的蛋白质不能进入凝胶颗粒的内部,而小分子的蛋白质则可以进入凝胶颗粒内部。通过调整凝胶的孔径,可以实现对目标蛋白质的选择性分离和纯化。[/font][font=宋体] [/font][font=宋体][font=宋体]③[url=https://cn.sinobiological.com/resource/protein-review/protein-purification-by-iec][b]离子交换层析[/b][/url][/font][/font][font=宋体][font=宋体]离子交换层析是一种基于蛋白质与固定在柱子上的离子交换基的电荷相互作用来实现分离和纯化的方法。在离子交换层析中,蛋白质溶液通过带有离子交换基的柱子,与柱子上的离子交换基之间发生相互作用。通过改变溶液的离子浓度和[/font][font=Calibri]pH[/font][font=宋体]值,可以实现对蛋白质的选择性吸附和洗脱。[/font][/font][font=宋体] [/font][font=宋体]④逆流层析[/font][font=宋体]逆流层析是一种基于分子质量和电荷差异来实现蛋白质分离和纯化的方法。在逆流层析中,蛋白质溶液通过填充有逆流层析介质的柱子,溶液在反向流动的情况下通过层析柱。由于不同蛋白质之间的分子质量和电荷差异,它们在逆流层析介质中的移动速度不同,从而实现对蛋白质的分离和纯化。[/font][font=宋体] [/font][font=宋体][b]蛋白质纯化系统的应用[/b][/font][font=宋体]蛋白质纯化系统在生物医药领域有着广泛的应用,下面将介绍几个常见的应用场景。[/font][font=宋体] [/font][font=宋体]①药物研发[/font][font=宋体]蛋白质纯化系统在药物研发中起到了非常重要的作用。通过蛋白质纯化系统,科研人员可以从复杂的生物样品中高效纯化出目标蛋白质,为药物研发提供了可靠的原料和工具。蛋白质纯化系统不仅可以提高药物研发的效率,还可以确保药物的纯度和质量,从而提高药物的疗效和安全性。[/font][font=宋体] [/font][font=宋体]②生物学研究[/font][font=宋体]在生物学研究中,蛋白质纯化系统被广泛应用于蛋白质相互作用研究、蛋白质结构解析和功能分析等方面。通过蛋白质纯化系统,科研人员可以从不同的细胞和组织中提取目标蛋白质,进一步研究它们之间的相互关系和作用机制。蛋白质纯化系统还可以用于蛋白质结构解析,帮助科学家揭示蛋白质的三维结构以及其功能。[/font][font=宋体] [/font][font=宋体]③临床诊断[/font][font=宋体]蛋白质纯化系统在临床诊断中也起到了重要的作用。通过蛋白质纯化系统,医生可以从患者的生物样本中纯化出特定的蛋白质标志物,用于疾病早期诊断、病情监测和治疗评估等方面。蛋白质纯化系统在临床诊断中的应用可以帮助医生及早发现疾病,提高诊断的准确性和效率。[/font][font=宋体] [/font][font=宋体] [/font][font=宋体]蛋白质纯化系统是实现蛋白质纯化的重要装置,它结合了多种分离、富集和纯化方法,帮助科研人员高效地提取目标蛋白质。蛋白质纯化系统的应用广泛,不仅在药物研发、生物学研究和临床诊断等领域发挥重要作用,还为科学家揭开蛋白质的结构和功能提供了有力的支持。通过不断的技术创新和优化,蛋白质纯化系统将更好地满足科研和临床的需求,推动生物医药领域的发展。[/font][font=Calibri] [/font]
蛋白质与多肽蛋白质粉 人类的营养物质有许多种类,最为重要的为蛋白质,碳水化合物和脂肪,其它则是微量营养物质,如维生素、电解质和微量元素等。虽然每一种营养物质对人体来说都是不可或缺的,但绝大多数的营养学家都会有充分的理由认为,真正最重要的营养物质是蛋白质。一、蛋白质是构成人体的基本物质。 蛋白质是由氨基酸通过肽链相连而构成的,它是人体包括骨骼、肌肉、皮肤和脑的重要物质基础,同时氨基酸也是生成核酸的基本物质。我们知道,核酸既形成遗传密码,也是体内储存能量的基本物质。因而从根本上说,人体是由蛋白质组成的。构成人体蛋白质的生理功能概括有如下三个方面:1)人体组织的主要构成成份:如肌肉、骨骼、血液、皮肤、神经、肝、心等等。2)具有特殊生理功能:可以这样说,人类的一切生理活动都与蛋白质有关。如酶蛋白能催化机体的一切化学反应,包括蛋白质、脂肪、碳水化合物的消化等;载脂蛋白运送脂肪;血红蛋白运送氧;激素蛋白调节代谢与生理活动包括情感;血浆白蛋白调节渗透压、运输金属离子、胆红素和抗生素等。3)供给机体能量:成年人每日约需要更新400g蛋白质,每克蛋白质彻底分解能释放出约4 Kcal的热量。4)为机体提供氮原料:人体内所必需的嘧啶、嘌呤、肌酸、胆碱、肾上腺素、肉碱、牛磺酸等,都是以多肽、氨基酸为原料的。表1. 世界粮食组织(FAD)和世界卫生组织(WHO)根据中国人的体质和膳食结构推荐的中国人蛋白质的摄入量(RNLs)。年 龄蛋白质RNL(g/d) 初生—6个月 1.5-3 1岁 35 3岁 45 5岁 55 7岁 60 9岁 65 10-16岁 75-85 成年女性 65 成年男性 75 妊娠 +15 乳母 +20 根据统计资料:由于贫困、工作紧张、精神压力、减肥节食、以及肠胃疾病、癌症、贫血、肾病、各种结核病、肝硬化、腹水、烧伤、失血等,以及老龄人均不同程度地存在着蛋白质的摄入不足。 上世纪80年代以来,我国营养学家对7个省18个贫困地区,1万名学龄前儿童进行了为期4年的连续调查,发现营养不良现象非常严重,其中蛋白质的摄入量不足WHO规定的60%。近年社会医学工作调查,在发达地区由于生活节奏加快,精神压力异常增加,以及办公室白领阶层的减肥节食,也导致蛋白质摄入不足,代谢异常的人群增加。二、蛋白质缺乏的体征和临床症状 单纯的蛋白质营养不良又叫加西长病,这或许是来源于非洲的单词,单纯的能量不足时叫消瘦;临床上通常把这两种现象叫单纯性蛋白质能量营养不良症或PEM。单纯的PEM症在临床上较少见到,但在慢性消耗性疾病患者中则常见,尤其是在癌症患者和艾滋病的患者中几乎占到90%以上。 现代都市和贫困地区存在着相当数量的蛋白质营养不良族群,他们的临床表现主要是能量损失或不足,如体力不支、睡眠不安、怕冷、怕热、性冷淡、无法进行正常的体力劳动和运动,其次为肌肉组织萎缩、皮肤松驰;腿部、脸部易水肿、脂肪肝、无名皮疹、伤口愈合不良、记忆力下降、视力减弱等。再者免疫力低下易感冒、感染。在做血检时通常会发现这些族群的血浆蛋白处于正常值的下限,其中白蛋白、转铁蛋白、甲状腺素结合前体蛋白和视轴蛋白(retinol-binding protein)均处于低水平时,患者易于感染各种疾病并且出现早衰症状,如果是儿童则感染后死亡率增加30%-40%,对于这类人群WHO的专家最好的建议就是迅速补充优质(或全价)的蛋白质。三、优质蛋白质和劣质蛋白质的区别。 要弄清楚何为优质蛋白质?何为劣质蛋白质?我们要引入什么是必需氨基酸的概念。营养生理学家、生化学家发现构成人体蛋白质的氨基酸共有21种,而这些氨基酸中其中有4种是可以由体内含碳和含氮底物自己合成的,被称为非必需氨基酸,还有10个必需的氨基酸,是人类机体无法制造需要从饮食中摄取的,另有7个是介于这两者之间的被称为条件必需氨基酸。表2. 必需、条件必需和非必需氨基酸 必需氨基酸条件必需氨基酸 非必需氨基酸 亮氨酸牛黄酸 丙氨酸 异亮氨酸酪氨酸 谷氨酸 缬氨酸甘氨酸 天冬氨酸 赖氨酸丝氨酸 天冬酰胺 苯丙氨酸(酪氨酸)脯氨酸 蛋氨酸(半胱氨酸)谷氨酰酸 苏氨酸 胱氨酸 色氨酸 组氨酸 精氨酸 虽然蛋白质广泛存在于许多动物性和植物性食物中,但是必需氨基酸的构成异差很大,WHO把“蛋白质其组成恰好符合人体需要”的蛋白质称为理想蛋白质,在自然界这种理想的蛋白质普遍认为是鸡蛋蛋白,因此就把鸡蛋蛋白作为衡量蛋白质优劣的参照蛋白,科学家把它作为一把尺子来衡量各种蛋白质,并制定出标准,以4种必需氨基酸为最低限来决定其优劣,即色氨酸、苏氨酸、赖氨酸或者蛋氨酸(半胱氨酸)。 通过比较科学发现,肉、鱼、蛋、牛奶、乳酪含有优质蛋白,大豆、花生、豌豆也含有较多的高质量蛋白。进一步研究发现它们都不够完美,因而要求大家对优质的动物性蛋白和植物性蛋白进行了科学搭配才是最完美的全价蛋白质(complete protein)。表3. 部分高质量蛋白
[b]中文摘要:目的[/b] 确立因子类血液制品中蛋白质含量对效价检测结果的影响,从而完善因子类血液制品效价检测的方法。[b]方法 [/b]选取不同蛋白质浓度梯度的稀释液对同一供试品进行稀释来确定蛋白质影响的规律。 [b]结果 [/b]建立起人凝血因子Ⅷ、人凝血酶原复合物的全自动血凝仪因子效价检测方法,根据效价检测反应体系中蛋白浓度对检测结果的影响,建立因子类血液制品效价全自动血凝仪检测的方法。[b]结论 [/b]建立的两种稀释方法均消除了样品中蛋白质含量的不同对检测结果的影响,提高了检测的准确性,不但可以适用于现在产品的效价检测,而且适用于随着生产工艺的提升生产的更高纯度、低蛋白含量的FⅧ和PCC,同时也是对中国药典标准的补充。[b]关键词[/b]:人凝血因子Ⅷ;人凝血酶原复合物;效价;蛋白含量 人凝血因子Ⅷ、人凝血酶原复合物、人凝血因子Ⅸ等因子类血液制品,是以健康人血浆为原料,经分离纯化和病毒灭活制成,在临床上主要用于各种凝血因子缺乏的治疗,这些因子类血液制品的凝血因子效价是药品有效性的指标,凝血因子效价的测定也是药品质量检测中的关键检测项目。血液制品生产企业及各级检测机构一般采用全自动血凝仪并按照仪器使用说明来进行因子效价的检测,然而在不同检测方法结果比对中,发现全自动血凝仪检测结果与中国药典中一期法的检测结果在部分因子效价检测中存在检测差异,差异可能是样品稀释中使用的稀释液的蛋白含量不同引起的,故本课题主要研究因子类血液制品中蛋白质含量对效价检测结果影响。通过蛋白含量对因子效价检测影响的研究建立起的全自动血凝仪因子效价检测方法,消除了产品本身性质的影响,可以准确进行因子效价的测定,方法的建立不但可以准确控制因子类血液制品的质量,保证生产企业持续稳定生产出质量均一的药品,而且可以减少因子类产品在临床使用中的风险。[b]1 实验仪器与试剂[b]1.1 仪器[/b][/b]Stago-compact全自动血凝仪(法国Diagnostica Stago公司),漩涡振荡器(美国Thermo Scientific公司)。[b][b]1.2 试剂[/b][/b]人凝血因子Ⅷ缺乏血浆(法国Diagnostica Stago公司),人凝血因子Ⅸ缺乏血浆(法国Diagnostica Stago公司),APTT试剂(法国Diagnostica Stago公司),Owren-Koller(稀释液)(法国Diagnostica Stago公司),0.025 mol/L氯化钙溶液(法国Diagnostica Stago公司),Desorb U(清洗液)(法国Diagnostica Stago公司),人凝血因子Ⅷ国家标准品(批号20100101),人凝血酶原复合物国家标准品(批号20130306),生理氯化钠溶液(石家庄四药有限公司),咪唑(天津市巴斯夫化工有限公司),氯化钠(天津市巴斯夫化工有限公司),枸橼酸钠(台山新宁制药有限公司),人血白蛋白(公司自产)。[b][b]2 方法 2.1 人凝血因子Ⅷ不同蛋白质浓度梯度稀释效价测定[/b][/b] 人凝血因子Ⅷ国家标准品的定标:取1支人凝血因子Ⅷ国家标准品,加入1.0 ml纯化水复溶,轻轻混匀,用生理氯化钠溶液将其稀释成每1 ml含1.00 IU人凝血因子Ⅷ,将Desorb U(清洗液)、复溶后的人凝血因子Ⅷ缺乏血浆、0.025 mol/L氯化钙溶液、APTT以及每1 ml含1.00 IU的人凝血因子Ⅷ标准品溶液分别装入全自动血凝仪的试剂抽屉,将Owren-Koller(稀释液)装入全自动血凝仪的样本抽屉,按照《Stago-compact全自动血凝仪标准操作规程》选择人凝血因子Ⅷ效价测定定标程序进行定标,仪器自动将装入的人凝血因子Ⅷ标准品溶液再进行2倍、4倍、8倍稀释,建立人凝血因子Ⅷ标准品溶液效价(分别为1.00 IU/ml、0.50 IU/ml、0.25 IU/ml、0.13 IU/ml)的对数对其相应凝固时间对数的直线回归方程。 不同蛋白质浓度梯度稀释液制备:选取全自动血凝仪的稀释液Owren-Koller、生理氯化钠溶液、取1体积的3.8%枸橼酸钠加入5体积咪唑缓冲液混合液分别定义为稀释液1、稀释液2、稀释液3。向3种稀释液中分别加入人血白蛋白,使其中人血白蛋白的浓度分别为0、0.5%、1%、3%、5%。 人凝血因子Ⅷ供试品效价测定:取人凝血因子Ⅷ供试品,按其标示装量加入灭菌注射用水复溶,轻轻混匀,用生理氯化钠溶液将其稀释成每1 ml约含1.00 IU人凝血因子Ⅷ,再用含不同蛋白浓度的稀释液做2倍、4倍稀释,将稀释后的供试品溶液装入全自动血凝仪的样本抽屉,选择人凝血因子Ⅷ效价测定选项进行测定。[b][b]2.2 人凝血因子Ⅷ人凝血因子缺乏血浆稀释效价测定[/b] [/b]人凝血因子Ⅷ国家标准品的定标:取1支人凝血因子Ⅷ国家标准品,加入1.0 ml纯化水复溶,轻轻混匀,用人凝血因子Ⅷ缺乏血浆将其稀释成每1ml含1.00 IU人凝血因子Ⅷ,将Desorb U(清洗液)、复溶后的人凝血因子Ⅷ缺乏血浆、0.025 mol/L氯化钙溶液、APTT以及每1 ml含1.00 IU的人凝血因子Ⅷ标准品溶液分别装入全自动血凝仪的试剂抽屉,将Owren-Koller(稀释液)装入全自动血凝仪的样本抽屉,按照《Stago-compact全自动血凝仪标准操作规程》选择人凝血因子Ⅷ效价测定定标程序进行定标,仪器自动将装入的人凝血因子Ⅷ标准品溶液再进行2倍、4倍、8倍稀释,建立人凝血因子Ⅷ标准品溶液效价(分别为1.00 IU/ml、0.50 IU/ml、0.25 IU/ml、0.13 IU/ml)的对数对其相应凝固时间对数的直线回归方程。 人凝血因子Ⅷ供试品效价测定:取人凝血因子Ⅷ供试品,按其标示装量加入灭菌注射用水复溶,轻轻混匀,用人凝血因子Ⅷ缺乏血浆将其稀释成每1 ml约含1.00 IU人凝血因子Ⅷ,再用Owren-Koller(稀释液)做2倍、4倍稀释,将稀释后的供试品溶液装入全自动血凝仪的样本抽屉,选择人凝血因子Ⅷ效价测定选项进行测定。[b][b]2.3 人凝血酶原复合物人凝血因子Ⅸ不同蛋白质浓度梯度稀释效价测定[/b][/b] 人凝血因子Ⅸ国家标准品的定标:取1支人凝血酶原复合物国家标准品,加入1.0 ml纯化水复溶,轻轻混匀,用生理氯化钠溶液将其稀释成每1 ml含1.00 IU人凝血因子Ⅸ,将Desorb U(清洗液)、复溶后的人凝血因子Ⅸ缺乏血浆、0.025 mol/L氯化钙溶液、APTT以及每1 ml含1.00 IU的人凝血因子Ⅸ标准品溶液分别装入全自动血凝仪的试剂抽屉,将Owren-Koller(稀释液)装入全自动血凝仪的样本抽屉,按照《Stago-compact全自动血凝仪标准操作规程》选择人凝血因子Ⅸ效价测定定标程序进行定标,仪器自动将装入的人凝血因子Ⅸ标准品溶液再进行2倍、4倍、8倍稀释,建立人凝血因子Ⅸ标准品溶液效价(分别为1.00 IU/ml、0.50 IU/ml、0.25 IU/ml、0.13 IU/ml)的对数对其相应凝固时间对数的直线回归方程。 不同蛋白质浓度梯度稀释液制备同2.1。 人凝血酶原复合物供试品效价测定:取人凝血酶原复合物供试品,按其标示装量加入灭菌注射用水复溶,轻轻混匀,用生理氯化钠溶液将其稀释成每1 ml约含1.00 IU人凝血因子Ⅸ,再用含不同蛋白浓度的稀释液做2倍、4倍稀释,将稀释后的供试品溶液装入全自动血凝仪的样本抽屉,选择人凝血因子Ⅸ效价测定选项进行测定。[b][b]2.4 人凝血酶原复合物人凝血因子Ⅸ人凝血因子缺乏血浆稀释效价测定[/b][/b] 人凝血因子Ⅸ国家标准品的定标:取1支人凝血酶原复合物国家标准品,加入1.0 ml纯化水复溶,轻轻混匀,用人凝血因子Ⅸ缺乏血浆将其稀释成每1 ml含1.00 IU人凝血因子Ⅸ,将Desorb U(清洗液)、复溶后的人凝血因子Ⅸ缺乏血浆、0.025 mol/L氯化钙溶液、APTT以及每1 ml含1.00 IU的人凝血因子Ⅸ标准品溶液分别装入全自动血凝仪的试剂抽屉,将Owren-Koller(稀释液)装入全自动血凝仪的样本抽屉,按照《Stago-compact全自动血凝仪标准操作规程》选择人凝血因子Ⅸ效价测定定标程序进行定标,仪器自动将装入的人凝血因子Ⅸ标准品溶液再进行2倍、4倍、8倍稀释,建立人凝血因子Ⅸ标准品溶液效价(分别为1.00 IU/ml、0.50 IU/ml、0.25 IU/ml、0.13 IU/ml)的对数对其相应凝固时间对数的直线回归方程。 人凝血酶原复合物供试品效价测定:取人凝血酶原复合物供试品,按其标示装量加入灭菌注射用水复溶,轻轻混匀,用人凝血因子Ⅸ缺乏血浆将其稀释成每1 ml约含1.00 IU人凝血因子Ⅸ,再用Owren-Koller(稀释液)做2倍、4倍稀释,将稀释后的供试品溶液装入全自动血凝仪的样本抽屉,选择人凝血因子Ⅸ效价测定选项进行测定。[b][b]3 结果3.1 人凝血因子Ⅷ不同蛋白质浓度梯度稀释效价测定结果[/b][/b] 选取2015ZK0801批人凝血因子Ⅷ进行了不同蛋白质浓度梯度稀释效价测定,不同浓度稀释液分别测定10次。人血白蛋白的浓度分别为0、0.5%、1%、3%、5%的稀释液1、稀释液2、稀释液3的效价检测结果分别见表1、2、3,效价检测结果为效价标示量的百分比。[align=center]表1 FⅧ质控品不同蛋白浓度梯度稀释液1检测结果[/align][align=center][/align][align=center][img=,590,266]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142017_01_1626619_3.png[/img][/align][align=center]表2 FⅧ质控品不同蛋白浓度梯度稀释液2检测结果 [/align][align=center][img=,586,260]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142019_01_1626619_3.png[/img][/align][align=center]表3 FⅧ质控品不同蛋白浓度梯度稀释液3检测结果 [/align][align=center][img=,585,261]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142019_02_1626619_3.png[/img][/align]人凝血因子Ⅷ质控品2015ZK0801批用不同蛋白质浓度梯度的稀释液1、稀释液2、稀释液3稀释效价检测结果平均值用折线图表示,如图1:[align=center]图1 FⅧ质控品不同蛋白质浓度检测结果对比[/align][align=center][img=,548,295]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142019_03_1626619_3.png[/img][/align] 选取2批国外产人凝血因子Ⅷ和VWF混合制剂进行了不同蛋白质浓度梯度稀释效价测定,人血白蛋白的浓度分别为0、0.5%、1%、3%、5%的稀释液1、稀释液2、稀释液3的效价检测结果见表4、5,效价检测结果为效价标示量的百分比。[align=center]表4 658668A批制剂FⅧ检测结果[/align][align=center][img=,585,99]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142020_01_1626619_3.png[/img][/align][align=center]表5 A3B1814批制剂FⅧ检测结果[/align][align=center][img=,577,97]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142021_01_1626619_3.png[/img][/align]FⅧ效价检测结果用折线图表示,如图2、3:[align=center][img=,563,299]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142029_01_1626619_3.png[/img][/align][align=center]图2 658668A批不同蛋白质浓度检测结果对比[/align][align=center][img=,567,287]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142030_01_1626619_3.png[/img][/align][align=center][/align][align=center]图3 A3B1814批不同蛋白质浓度检测结果对比[/align][b][b]3.2 人凝血酶原复合物不同蛋白质浓度梯度稀释效价测定结果[/b][/b] 选取2015ZK0901批人凝血酶原复合物进行了不同蛋白质浓度梯度稀释人凝血因子Ⅸ效价测定,不同浓度稀释液分别测定10次。人血白蛋白的浓度分别为0、0.5%、1%、2%、3%、4%、5%的稀释液1、稀释液2、稀释液3的效价检测结果分别见表6、7、8,效价检测结果为效价标示量的百分比。[align=center]表6 PCC质控品不同蛋白浓度梯度稀释液1检测结果[/align][align=center][img=,583,269]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142031_01_1626619_3.png[/img][/align][align=center]表7 PCC质控品不同蛋白浓度梯度稀释液2检测结果[/align][align=center][img=,586,260]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142031_02_1626619_3.png[/img][/align][align=center]表8 PCC质控品不同蛋白浓度梯度稀释液3检测结果[/align][align=center][img=,593,263]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142043_01_1626619_3.png[/img][/align]人凝血酶原复合物质控品2015ZK0901批用不同蛋白质浓度梯度的稀释液1、稀释液2、稀释液3稀释FⅨ效价检测结果平均值用折线图表示,如图4:[align=center][img=,556,300]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142032_01_1626619_3.png[/img][/align][align=center]图4 PCC质控品不同蛋白质浓度FⅨ检测结果对比[/align][b][b]3.3 人凝血因子Ⅷ人凝血因子缺乏血浆稀释效价测定结果[/b][/b]选取2015ZK0801批人凝血因子Ⅷ进行了人凝血因子缺乏血浆稀释效价测定,共测定10次。效价检测结果见表9,效价检测结果为效价标示量的百分比。[align=center]表9 FⅧ质控品人凝血因子缺乏血浆稀释检测结果[/align][align=center][img=,579,74]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142032_02_1626619_3.png[/img][/align]选取2批国外产人凝血因子Ⅷ和VWF混合制剂进行了人凝血因子缺乏血浆稀释效价测定。效价检测结果见表10,效价检测结果为效价标示量的百分比。[align=center]表10 国外产品人凝血因子缺乏血浆稀释检测结果[/align][align=center][img=,578,77]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142036_01_1626619_3.png[/img][/align][b][b]3.4 人凝血酶原复合物人凝血因子Ⅸ人凝血因子缺乏血浆稀释效价测定结果[/b][/b]选取2015ZK0901批人凝血酶原复合物进行了人凝血因子缺乏血浆稀释人凝血因子Ⅸ效价测定,共测定10次。效价检测结果见表11,效价检测结果为效价标示量的百分比。[align=center]表11 PCC质控品人凝血因子缺乏血浆稀释检测结果[/align][align=center][img=,582,89]http://ng1.17img.cn/bbsfiles/images/2017/09/201709142047_01_1626619_3.png[/img][/align][b][b]4 讨论[/b][/b] 本实验中对人凝血因子Ⅷ和人凝血酶原复合物分别用不同蛋白浓度梯度的稀释液进行了效价测定,另外用人凝血因子缺乏血浆稀释后进行了效价测定。因子效价测定中,稀释液1、稀释液2、稀释液3中加入相同浓度的人血白蛋白后,得到的因子效价检测结果没有差异,说明全自动血凝仪的稀释液Owren-Koller、生理氯化钠溶液、取1体积的3.8%枸橼酸钠加入5体积咪唑缓冲液混合液作为稀释液时没有区别。 人凝血因子Ⅷ、人凝血酶原复合物不同蛋白浓度梯度效价测定时,随着稀释液中蛋白质含量的增高,效价检测结果也不断升高,但在人凝血因子Ⅷ效价测定中,采用蛋白质含量为1%、3%的稀释液时,效价检测结果间均无显著差别,在人凝血酶原复合物人凝血因子Ⅸ效价测定中,采用蛋白质含量为0、0.5%、1%的稀释液时,效价检测结果间均无显著差别。另外,人凝血因子Ⅷ进行人凝血因子缺乏血浆稀释效价测定效价检测结果与采用蛋白质含量为1%、3%的稀释液得到的检测结果也无显著差异,人凝血酶原复合物人凝血因子缺乏血浆稀释人凝血因子Ⅸ效价检测结果与采用蛋白质含量为0、0.5%、1%的稀释液得到的检测结果也无显著差异。另外,国外生产的人凝血因子Ⅷ和VWF的混合制剂FⅧ效价的检测结果及血浆、稀释液的影响同泰邦公司产品一致。[b]参考文献[/b][align=left] 邬杨斌, 余蓉. 凝血因子Ⅸ复合物的研制 . 华西药学杂志, 2000, 15(3):177-179. Pabinger I, Brenner B, Kalina U, et al. Prothrombin complex concentrate(Beriplexw P/N)for emergency anticoagulation reversal: A prospective multinational clinical trial . J Thromb Haemost, 2008, 6(4):622-631. Kiman E, Elela AA, Ramsis N, et al. Evaluation of the coagulation factors activity of Cryosupernatant . Suez Canal Univ Med J, 2003, 6(2):247-258.Tullis JL, Melin M, Jurigian P. Clinical use of human Prothrombin complexes . N Engl J Med, 1965, 73(13):667-674.马莉, 孙盼, 李长清, 等. 去冷沉淀血浆的质量分析 . 中国生物制品学杂志, 2013, 26(1):81-83.魏舒, 时凯, 刘国荣, 等. 冻干人凝血酶原复合物的生产工艺研究 . 中国输血杂志, 2008, 21(10):282-284.Samama CM. Prothrombin complex concentrates: a brief review . Eur J Anaesthesiol, 2008, 25(10):784-789.焦丽华, 代旭兰, 刘文芳. 凝血酶原复合物的制备及其临床应用进展 .中国输血杂志, 2008, 21(9):737-741.[/align][b] [/b]
[color=#333333]石墨烯是一种新型二维碳纳米材料,其具有独特而优异的物理化学性质,故引起了科学界及工程界的广泛关注。石墨烯巨大的比表面积使其成为一种潜在的固相吸附材料。为了实现复杂基体样品中蛋白质的高选择性分离纯化,本文制备了一系列功能化石墨烯复合材料,研究了其在蛋白质选择性分离纯化中的应用,建立了满足不同类型的复杂基体样品(全血,鸡蛋清和细胞裂解液)中目标蛋白质的高选择性分离纯化方法。第一章简要综述了石墨烯的研究历史,结构性质及其合成方法。概述了石墨烯的表面功能化,石墨烯复合材料的制备,以及石墨烯及其复合材料在样品预处理等领域中的应用进展。第二章制备了一种新型功能化石墨烯复合材料。通过共价功能化的方式,氧化石墨烯(GO)表面依次经过环氧氯丙烷(ECH),亚氨基二乙酸(IDA)和1-苯硼酸(1-PBA)修饰后,再进一步螫合镍金属离子得到复合材料。复合材料由FT-IR, XRD, SEM, TGA和[url=https://insevent.instrument.com.cn/t/yp][color=#3333ff]ICP-MS[/color][/url]等手段进行表征。[/color]
蛋白质数据库1.PIR和PSDPIR国际蛋白质序列数据库(PSD)是由蛋白质信息资源(PIR)、慕尼黑蛋白质序列信息中心(MIPS)和日本国际蛋白质序列数据库(JIPID)共同维护的国际上最大的公共蛋白质序列数据库。这是一个全面的、经过注释的、非冗余的蛋白质序列数据库,包含超过142,000条蛋白质序列(至99年9月),其中包括来自几十个完整基因组的蛋白质序列。所有序列数据都经过整理,超过99%的序列已按蛋白质家族分类,一半以上还按蛋白质超家族进行了分类。PSD的注释中还包括对许多序列、结构、基因组和文献数据库的交叉索引,以及数据库内部条目之间的索引,这些内部索引帮助用户在包括复合物、酶-底物相互作用、活化和调控级联和具有共同特征的条目之间方便的检索。每季度都发行一次完整的数据库,每周可以得到更新部分。PSD数据库有几个辅助数据库,如基于超家族的非冗余库等。PIR提供三类序列搜索服务:基于文本的交互式检索;标准的序列相似性搜索,包括BLAST、FASTA等;结合序列相似性、注释信息和蛋白质家族信息的高级搜索,包括按注释分类的相似性搜索、结构域搜索GeneFIND等。PIR和PSD的网址是:http://pir.georgetown.edu/。数据库下载地址是:ftp://nbrfa.georgetown.edu/pir/。2. SWISS-PROT SWISS-PROT是经过注释的蛋白质序列数据库,由欧洲生物信息学研究所(EBI)维护。数据库由蛋白质序列条目构成,每个条目包含蛋白质序列、引用文献信息、分类学信息、注释等,注释中包括蛋白质的功能、转录后修饰、特殊位点和区域、二级结构、四级结构、与其它序列的相似性、序列残缺与疾病的关系、序列变异体和冲突等信息。SWISS-PROT中尽可能减少了冗余序列,并与其它30多个数据建立了交叉引用,其中包括核酸序列库、蛋白质序列库和蛋白质结构库等。利用序列提取系统(SRS)可以方便地检索SWISS-PROT和其它EBI的数据库。SWISS-PROT只接受直接测序获得的蛋白质序列,序列提交可以在其Web页面上完成。SWISS-PROT的网址是:http://www.ebi.ac.uk/swissprot/。3. PROSITEPROSITE数据库收集了生物学有显著意义的蛋白质位点和序列模式,并能根据这些位点和模式快速和可靠地鉴别一个未知功能的蛋白质序列应该属于哪一个蛋白质家族。有的情况下,某个蛋白质与已知功能蛋白质的整体序列相似性很低,但由于功能的需要保留了与功能密切相关的序列模式,这样就可能通过PROSITE的搜索找到隐含的功能motif,因此是序列分析的有效工具。PROSITE中涉及的序列模式包括酶的催化位点、配体结合位点、与金属离子结合的残基、二硫键的半胱氨酸、与小分子或其它蛋白质结合的区域等;除了序列模式之外,PROSITE还包括由多序列比对构建的profile,能更敏感地发现序列与profile的相似性。PROSITE的主页上提供各种相关检索服务。PROSITE的网址是:http://www.expasy.ch/prosite/。4. PDB蛋白质数据仓库(PDB)是国际上唯一的生物大分子结构数据档案库,由美国Brookhaven国家实验室建立。PDB收集的数据来源于X光晶体衍射和核磁共振(NMR)的数据,经过整理和确认后存档而成。目前PDB数据库的维护由结构生物信息学研究合作组织(RCSB)负责。RCSB的主服务器和世界各地的镜像服务器提供数据库的检索和下载服务,以及关于PDB数据文件格式和其它文档的说明,PDB数据还可以从发行的光盘获得。使用Rasmol等软件可以在计算机上按PDB文件显示生物大分子的三维结构。RCSB的PDB数据库网址是:http://www.rcsb.org/pdb/。5. SCOP蛋白质结构分类(SCOP)数据库详细描述了已知的蛋白质结构之间的关系。分类基于若干层次:家族,描述相近的进化关系;超家族,描述远源的进化关系;折叠子(fold),描述空间几何结构的关系;折叠类,所有折叠子被归于全α、全β、α/β、α+β和多结构域等几个大类。SCOP还提供一个非冗余的ASTRAIL序列库,这个库通常被用来评估各种序列比对算法。此外,SCOP还提供一个PDB-ISL中介序列库,通过与这个库中序列的两两比对,可以找到与未知结构序列远缘的已知结构序列。SCOP的网址是:http://scop.mrc-lmb.cam.ac.uk/scop/。6. COG蛋白质直系同源簇(COGs)数据库是对细菌、藻类和真核生物的21个完整基因组的编码蛋白,根据系统进化关系分类构建而成。COG库对于预测单个蛋白质的功能和整个新基因组中蛋白质的功能都很有用。利用COGNITOR程序,可以把某个蛋白质与所有COGs中的蛋白质进行比对,并把它归入适当的COG簇。COG库提供了对COG分类数据的检索和查询,基于Web的COGNITOR服务,系统进化模式的查询服务等。蛋白质直系同源簇(COGs)数据库是对细菌、藻类和真核生物的21个完整基因组的编码蛋白,根据系统进化关系分类构建而成。COG库对于预测单个蛋白质的功能和整个新基因组中蛋白质的功能都很有用。利用COGNITOR程序,可以把某个蛋白质与所有COGs中的蛋白质进行比对,并把它归入适当的COG簇。COG库提供了对COG分类数据的检索和查询,基于Web的COGNITOR服务,系统进化模式的查询服务等。COG库的网址是:http://www.ncbi.nlm.nih.gov/COG。下载COG库和COGNITOR程序在:ftp://ncbi.nlm.nih.gov/pub/COG
基因组(genome)包含的遗传信息经转录产生mRNA,一个细胞在特定生理或病理状态下表达的所有种类的mRNA称为转录子组(transcriptome)。很显然,不同细胞在不同生理或病理状态下转录子组包含的mRNA的种类不尽相同。mRNA经翻译产生蛋白质,一个细胞在特定生理或病理状态下表达的所有种类的蛋白质称为蛋白质组(proteome)。同理,不同细胞在不同生理或病理状态下所表达的蛋白质的种类也不尽相同。蛋白质是基因功能的实施者,因此对蛋白质结构,定位和蛋白质-蛋白质相互作用的研究将为阐明生命现象的本质提供直接的基础。生命科学是实验科学,因此生命科学的发展极大地依赖于实验技术的发展。以DNA序列分析技术为核心的基因组研究技术推动了基因组研究的日新月异,而以基因芯片技术为代表的基因表达研究技术为科学家了解基因表达规律立下汗马功劳。在蛋白质组研究中,二维电泳和质谱技术的黄金组合又为科学家掌握蛋白质表达规律再铸辉煌。蛋白质组学(proteomics)就是指研究蛋白质组的技术及这些研究得到的结果。蛋白质组学的研究试图比较细胞在不同生理或病理条件下蛋白质表达的异同,对相关蛋白质进行分类和鉴定。更重要的是蛋白质组学的研究要分析蛋白质间相互作用和蛋白质的功能。蛋白质组学的研究内容包括:1.蛋白质鉴定:可以利用一维电泳和二维电泳并结合Western等技术,利用蛋白质芯片和抗体芯片及免疫共沉淀等技术对蛋白质进行鉴定研究。2.翻译后修饰:很多mRNA表达产生的蛋白质要经历翻译后修饰如磷酸化,糖基化,酶原激活等。翻译后修饰是蛋白质调节功能的重要方式,因此对蛋白质翻译后修饰的研究对阐明蛋白质的功能具有重要作用。3.蛋白质功能确定:如分析酶活性和确定酶底物,细胞因子的生物分析/配基-受体结合分析。可以利用基因敲除和反义技术分析基因表达产物-蛋白质的功能。另外对蛋白质表达出来后在细胞内的定位研究也在一定程度上有助于蛋白质功能的了解。Clontech的荧光蛋白表达系统就是研究蛋白质在细胞内定位的一个很好的工具。4.对人类而言,蛋白质组学的研究最终要服务于人类的健康,主要指促进分子医学的发展。如寻找药物的靶分子。很多药物本身就是蛋白质,而很多药物的靶分子也是蛋白质。药物也可以干预蛋白质-蛋白质相互作用。在基础医学和疾病机理研究中,了解人不同发育、生长期和不同生理、病理条件下及不同细胞类型的基因表达的特点具有特别重要的意义。这些研究可能找到直接与特定生理或病理状态相关的分子,进一步为设计作用于特定靶分子的药物奠定基础。不同发育、生长期和不同生理、病理条件下不同的细胞类型的基因表达是不一致的,因此对蛋白质表达的研究应该精确到细胞甚至亚细胞水平。可以利用免疫组织化学技术达到这个目的,但该技术的致命缺点是通量低。LCM技术可以精确地从组织切片中取出研究者感兴趣的细胞类型,因此LCM技术实际上是一种原位技术。取出的细胞用于蛋白质样品的制备,结合抗体芯片或二维电泳-质谱的技术路线,可以对蛋白质的表达进行原位的高通量的研究。很多研究采用匀浆组织制备蛋白质样品的技术路线,其研究结论值得怀疑,因为组织匀浆后不同细胞类型的蛋白质混杂在一起,最后得到的研究数据根本无法解释蛋白质在每类细胞中的表达情况。虽然培养细胞可以得到单一类型细胞,但体外培养的细胞很难模拟体内细胞的环境,因此这样研究得出的结论也很难用于解释在体实际情况。因此在研究中首先应该将不同细胞类型分离,分离出来的不同类型细胞可以用于基因表达研究,包括mRNA和蛋白质的表达。LCM技术获得的细胞可以用于蛋白质样品的制备。可以根据需要制备总蛋白,或膜蛋白,或核蛋白等,也可以富集糖蛋白,或通过去除白蛋白来减少蛋白质类型的复杂程度。相关试剂盒均有厂商提供。蛋白质样品中的不同类型的蛋白质可以通过二维电泳进行分离。二维电泳可以将不同种类的蛋白质按照等电点和分子量差异进行高分辨率的分离。成功的二维电泳可以将2000到3000种蛋白质进行分离。电泳后对胶进行高灵敏度的染色如银染和荧光染色。如果是比较两种样品之间蛋白质表达的异同,可以在同样条件下分别制备二者的蛋白质样品,然后在同样条件下进行二维电泳,染色后比较两块胶。也可以将二者的蛋白质样品分别用不同的荧光染料标记,然后两种蛋白质样品在一块胶上进行二维电泳的分离,最后通过荧光扫描技术分析结果。胶染色后可以利用凝胶图象分析系统成像,然后通过分析软件对蛋白质点进行定量分析,并且对感兴趣的蛋白质点进行定位。通过专门的蛋白质点切割系统,可以将蛋白质点所在的胶区域进行精确切割。接着对胶中蛋白质进行酶切消化,酶切后的消化物经脱盐/浓缩处理后就可以通过点样系统将蛋白质点样到特定的材料的表面(MALDI-TOF)。最后这些蛋白质就可以在质谱系统中进行分析,从而得到蛋白质的定性数据;这些数据可以用于构建数据库或和已有的数据库进行比较分析。实际上像人类的血浆,尿液,脑脊液,乳腺,心脏,膀胱癌和磷状细胞癌及多种病原微生物的蛋白质样品的二维电泳数据库已经建立起来,研究者可以登录www.expasy.ch/www/tools.html等网站进行查询,并和自己的同类研究进行对比分析。Genomic Solution可以为研究者提供除质谱外的所有蛋白质组学研究工具,包括二维电泳系统,成像系统及分析软件,胶切割系统,蛋白质消化浓缩工作站,点样工作站等;同时还可以提供相关试剂和消耗品。LCM-二维电泳-质谱的技术路线是典型的一条蛋白质组学研究的技术路线,除此以外,LCM-抗体芯片也是一条重要的蛋白质组学研究的技术路线。即通过LCM技术获得感兴趣的细胞类型,制备细胞蛋白质样品,蛋白质经荧光染料标记后和抗体芯片杂交,从而可以比较两种样品蛋白质表达的异同。Clontech最近开发了一张抗体芯片,可以对378种膜蛋白和胞浆蛋白进行分析。该芯片同时配合了抗体芯片的全部操作过程的重要试剂,包括蛋白质制备试剂,蛋白质的荧光染料标记试剂,标记体系的纯化试剂,杂交试剂等。对于蛋白质相互作用的研究,酵母双杂交和噬菌体展示技术无疑是很好的研究方法。Clontech开发的酵母双杂交系统和NEB公司开发的噬菌体展示技术可供研究者选用。关于蛋白质组的研究,也可以将蛋白质组的部分或全部种类的蛋白质制作成蛋白质芯片,这样的蛋白质芯片可以用于蛋白质相互作用研究,蛋白表达研究和小分子蛋白结合研究。Science,Vol.293,Issue 5537,2101-2105,September 14,2001发表了一篇关于酵母蛋白质组芯片的论文。该文主要研究内容为:将酵母的5800个ORF表达成蛋白质并进行纯化点样制作芯片,然后用该芯片筛选钙调素和磷脂分子的相互作用分子。最后有必要指出的是,传统的蛋白质研究注重研究单一蛋白质,而蛋白质组学注重研究参与特定生理或病理状态的所有的蛋白质种类及其与周围环境(分子)的关系。因此蛋白质组学的研究通常是高通量的。适应这个要求,蛋白质组学相关研究工具通常都是高度自动化的系统,通量高而速度快,配合相应分析软件和数据库,研究者可以在最短的时间内处理最多的数据。
[font=宋体][font=宋体]蛋白质浓度测定的各种方法及原理是生物化学和分子生物学实验中的重要环节。蛋白质浓度的准确测定对于研究生物分子相互作用、蛋白质功能和动力学、以及生物样品的分析和鉴定等方面都具有重要的意义。本文将介绍几种常用的蛋白质浓度测定方法及其原理,包括紫外吸收法、微量凯氏定氮法、双缩尿法、[/font][font=Calibri]Lowry [/font][font=宋体]法和考马斯亮蓝法等。通过对这些方法的比较和分析,可以更好地了解它们的优缺点,以便根据实际实验需求选择合适的方法来测定蛋白质浓度。[/font][/font][font=宋体] [/font][font=宋体][b]①紫外吸收法[/b][/font][font=宋体] [/font][font=宋体]检测原理:[/font][font=宋体] [/font][font=宋体][font=宋体]蛋白质分子中,酪氨酸、苯丙氨酸和色氨酸残基的苯环含有共扼双键,使蛋白质具有吸收紫外光的性质。吸收高峰在[/font][font=Calibri]280nm[/font][font=宋体]处,其吸光度(即光密度值)与蛋白质含量成正比。此外,蛋白质溶液在[/font][font=Calibri]238nm[/font][font=宋体]的光吸收值与肽键含量成正比。利用一定波长下,蛋白质溶液的光吸收值与蛋白质浓度的正比关系,进行蛋白质含量的测定。[/font][/font][font=宋体] [/font][font=宋体] [/font][font=宋体]方法特点:[/font][font=宋体] [/font][font=宋体]优点:简便、灵敏、快速,不消耗样品,测定后仍能回收使用。[/font][font=宋体] [/font][font=宋体]缺点:测定蛋白质含量的准确度较差,干扰物质多。[/font][font=宋体] [/font][font=宋体]干扰物:含有嘌呤、嘧啶、核酸等吸收紫外光的物质。[/font][font=宋体] [/font][font=宋体][font=宋体]检出限:[/font][font=Calibri]50~100ug[/font][font=宋体]蛋白含量。[/font][/font][font=宋体] [/font][font=宋体]适用范围:适于用测定与标准蛋白质氨基酸组成相似的蛋白质。[/font][font=宋体] [/font][font=宋体] [/font][font=宋体] [/font][font=宋体][b]②微量凯氏定氮法[/b][/font][font=宋体] [/font][font=宋体]凯氏定氮法被国内外视为蛋白质含量的标准检验方法,可作为衡量其他蛋白质含量检测方法准确性的标准。[/font][font=宋体] [/font][font=宋体]实验原理:[/font][font=宋体] [/font][font=宋体]样品与浓硫酸共热,含氮有机物即分解产生氨(消化),氨又与硫酸作用,变成硫酸氨。经强碱碱化使之分解放出氨,借蒸汽将氨蒸至酸液中,根据此酸液被中和的程度可计算得样品之氮含量。[/font][font=宋体] [/font][font=宋体]方法特点:[/font][font=宋体] [/font][font=宋体]优点:通用性强,测定费用低,易实现,仪器简单且测定结果的重复性和重现性好。[/font][font=宋体] [/font][font=宋体]缺点:实验耗时长、灵敏度低。[/font][font=宋体] [/font][font=宋体][font=宋体]检出限:[/font][font=Calibri]0.2~1mg[/font][font=宋体]蛋白含量。[/font][/font][font=宋体] [/font][font=宋体]适用范围:凯氏定氮法测的是总蛋白的量,一些非蛋白氮无法检测出。[/font][font=宋体] [/font][font=宋体] [/font][font=宋体] [/font][font=宋体][b]③双缩尿法[/b][/font][font=宋体] [/font][font=宋体]实验原理:[/font][font=宋体] [/font][font=宋体][font=宋体]双缩尿([/font][font=Calibri]NH3CONHCONH3[/font][font=宋体])是两个分子经[/font][font=Calibri]180[/font][font=宋体]℃左右加热,放出一个分子氨后得到的产物。在强碱溶液中,双缩尿与[/font][font=Calibri]CuSO4[/font][font=宋体]形成紫色络合物,称为双缩尿反应。凡具有两个酰胺基或两个直接连接的肽链,或能过一个中间碳原子相连的肽键,这类化合物都有双缩尿反应。紫色络合物颜色的深浅与蛋白质浓度成正比,与蛋白质分子量及氨基酸成分无关。[/font][/font][font=宋体] [/font][font=宋体]方法特点:[/font][font=宋体] [/font][font=宋体]优点:适合检测总蛋白质的含量,操作简单、测量速度快。[/font][font=宋体] [/font][font=宋体]缺点:标准物质必须使用代表性很强的样品,需使用其他参考方法测出标准物质中的蛋白质总含量,故测定工作费力费时。不宜测定样品种类多、彼此差异大的样品。[/font][font=宋体] [/font][font=宋体][font=宋体]检出限:测定蛋白质含量测定范围为[/font][font=Calibri]1-20mg[/font][font=宋体]蛋白质。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]干扰物:硫酸铵、[/font][font=Calibri]Tris[/font][font=宋体]缓冲液和某些氨基酸等。[/font][/font][font=宋体] [/font][font=宋体]适用范围:常用于需要快速,但并不需要十分精确的蛋白质测定。[/font][font=宋体] [/font][font=宋体] [/font][font=宋体] [/font][font=宋体][b][font=宋体]④[/font][font=Calibri]Lowry [/font][font=宋体]法[/font][/b][/font][font=宋体] [/font][font=宋体][font=Calibri]Lowry [/font][font=宋体]法是双缩脲法的发展,结合了双缩脲试剂和酚试剂与蛋白质的反应,是最灵敏的蛋白质测定方法之一,在生物化学领域得到广泛的应用,目前分为基本法和改良简易法,改良简易法可获得与基本法相近的结果。[/font][/font][font=宋体] [/font][font=宋体]基本法实验原理:[/font][font=宋体] [/font][font=宋体][font=宋体]显色原理与双缩尿法相同,但加入了[/font][font=Calibri]Folin-[/font][font=宋体]酚酞试剂,以增加显色量,从而提高检测蛋白质的灵敏度。这两种显色反应产生深兰色的原因是:①在碱性条件下,蛋白质中的肽键与铜结合生成复合物。②[/font][font=Calibri]Folin[/font][font=宋体]一酚试剂中的磷钼酸盐一磷钨酸盐被蛋白质中的酪氨酸和苯丙氨酸残基还原,产生深兰色(钼兰和钨兰的混合物)。在一定的条件下,兰色深度与蛋白的量成正比。[/font][/font][font=宋体] [/font][font=宋体]特点:[/font][font=宋体] [/font][font=宋体]优点:灵敏度高。[/font][font=宋体] [/font][font=宋体]缺点:耗费时间长,操作时间需精准控制,标准曲线绘制麻烦,专一性较差,干扰物质比较多。[/font][font=宋体] [/font][font=宋体][font=宋体]检出限:可检测的最低蛋白质量达[/font][font=Calibri]5ug[/font][font=宋体]。通常测定范围是[/font][font=Calibri]20~250ug[/font][font=宋体]。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]干扰物:酚类、柠檬酸、硫酸铵、[/font][font=Calibri]Tris[/font][font=宋体]缓冲液、甘氨酸、糖类、甘油等。[/font][/font][font=宋体] [/font][font=宋体]适用范围:除蛋白含量测定,也可用于酪氨酸和色氨酸的定量测定。[/font][font=宋体] [/font][font=宋体] [/font][font=宋体] [/font][font=宋体][b]⑤考马斯亮蓝法[/b][/font][font=宋体] [/font][font=宋体]实验原理:[/font][font=宋体] [/font][font=宋体][font=宋体]考马斯亮蓝[/font][font=Calibri]G-250[/font][font=宋体]染料,在酸性溶液中与蛋白质结合,使染料的最大吸收峰的位置([/font][font=Calibri]max[/font][font=宋体]),由[/font][font=Calibri]465mm[/font][font=宋体]变为[/font][font=Calibri]595nm[/font][font=宋体],溶液的颜色也由棕黑色变为蓝色。经研究认为,染料主要是与蛋白质中的碱性氨基酸(特别是精氨酸)和芳香族氨基酸残基相结合。在[/font][font=Calibri]595mm[/font][font=宋体]下测定的吸光度值[/font][font=Calibri]A595[/font][font=宋体],与蛋白质浓度成正比。[/font][/font][font=宋体] [/font][font=宋体] [/font][font=宋体]方法特点:[/font][font=宋体] [/font][font=宋体][font=宋体]优点:灵敏度比[/font][font=Calibri]Lowry[/font][font=宋体]高约[/font][font=Calibri]4[/font][font=宋体]倍,高效率、检测过程简便、只需要一种试剂,抗干扰能力强。[/font][/font][font=宋体] [/font][font=宋体]缺点:测定误差大,不适用于不同蛋白的检测。[/font][font=宋体] [/font][font=宋体][font=宋体]检出限:其最低蛋白质检测量可达[/font][font=Calibri]1ug[/font][font=宋体]。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]干扰物:干扰物质少,但去污剂、[/font][font=Calibri]TritonX-100[/font][font=宋体]、十二烷基硫酸钠、[/font][font=Calibri]0.1N[/font][font=宋体]的[/font][font=Calibri]NaOH[/font][font=宋体]会干扰实验测定。[/font][/font][font=宋体] [/font][font=宋体] [/font][font=宋体] [/font][font=宋体][b]蛋白质含量测定方法选择[/b][/font][font=宋体] [/font][font=宋体]蛋白质含量测定时,考虑以下因素后选定适用的检测方法。[/font][font=宋体] [/font][font=宋体]①实验对测定所要求的灵敏度和精确度;[/font][font=宋体] [/font][font=宋体]②蛋白质的性质;[/font][font=宋体] [/font][font=宋体]③溶液中存在的干扰物质;[/font][font=宋体] [/font][font=宋体]④测定所要花费的时间。[/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州提供多种类型的[url=https://cn.sinobiological.com/resource/protein-review][b]蛋白资源[/b][/url],不仅有重组蛋白服务还有各种大咖讲座,详情可以关注[/font][font=Calibri]https://cn.sinobiological.com/resource/protein-review[/font][/font][font=Calibri] [/font]
“高通量蛋白质分离检测关键技术研究取得的突破给我们很大鼓舞,但这只是我们大规模系统集成研究的一部分,我们正在着力于系统后续的研究。相信,在不久的将来,这套集成系统将为蛋白质组的分析提供一个完整规范的平台。”谈起不久前通过项目鉴定的《高通量蛋白质分离检测关键技术研究》和取得的成果,中国计量科学研究院生物、能源与环境研究所科学仪器研究室主任刘新志显得踌躇满志。 随着全球性的国际人类基因组计划的初步完成,一个以蛋白质和基因调节为研究重点的后基因组时代已经拉开序幕。蛋白质是生理功能的执行者,是生命现象的直接体现者,对蛋白质结构和功能的研究将直接阐明生命在生理或病理条件下的变化机制。伴随人类基因组研究而发展的蛋白质组学则是研究细胞内各种蛋白质的组成及其活动规律的一门新兴学科。后基因组时代,蛋白质组将成为重点研究方向之一,并将有力推动生物产业的持续性高速发展。 “蛋白质组研究是一门极为年轻的科学,从诞生到蓬勃发展也不过七八年历史,我国的研究时间也只有六年而已。但其发展速度非常迅猛,应用范围也非常广泛。”刘新志说。 蛋白质组研究对生命科学、化学分析、食品安全、人类健康等诸多领域都有着重要意义。例如,几乎所有的药物都是通过蛋白质发挥作用,蛋白质组学在药学研究中的应用不仅可直接产生新的药物,更重要的是可减少对新药开发研制的盲目性,大大加速和简化新药研制的过程;通过对疾病不同阶段蛋白质组的研究,还可帮助诊断和防治疾病。目前,蛋白质组学已成功用于肿瘤、糖尿病、艾滋病、关节炎等多种疾病的诊断和治疗。 “蛋白质组研究的核心技术分为两个部分:蛋白质分离技术和蛋白质鉴定技术。实验数据表明,现阶段依赖质谱分析的蛋白质鉴定技术的发展水平远高于蛋白质分离技术的发展水平。但对大分子、复合物、细胞的分离纯化是进行更详尽的生物鉴定和工程化应用所必需的重要步骤,如果不能快速有效地进行蛋白质分离,后续的鉴定也无法进行。所以,蛋白质组研究的瓶颈来自于蛋白质分离技术的限制。”刘新志打了一个比喻:“蛋白质鉴定技术好比一条宽敞的高速路,但通往这条高速路的必经路——蛋白质分离技术就好比一条小胡同,这条小胡同严重影响了车辆的快速通行。” 据介绍,目前蛋白质分离技术主要有两种——双向电泳技术和高效液相色谱技术。“这两种传统技术与生俱来的缺点是很难分解出难溶性蛋白,而且不能分解出不溶性蛋白。要打通这条小胡同,就必须找到一种新的方法、研制一种新的装置,能够有效地分离出难溶性蛋白和不溶性蛋白,并且要实现高通量快速分离。”刘新志介绍。 由中国计量科学研究院完成的《高通量蛋白质检测关键技术的研究》课题在解决蛋白质的快速分离技术方面取得了重大突破。研究建立了以反向加样连续自由流电泳(FFE)分离方法为核心的高通量蛋白质分离检测技术中最为关键的高稳定度自由流电泳(HSFFE)装置。“该装置最显著的特点就是解决了两种传统的分离技术所不能解决的问题——从蛋白混合物中有效地分离出可溶性蛋白、难溶性蛋白、不溶性蛋白,实现了对这三种蛋白的完全分离;其次,装置的通量高,速度快,能够满足蛋白质快速分离鉴定的需要。”刘新志说。
蛋白质数据库 1. PIR和PSDPIR国际蛋白质序列数据库(PSD)是由蛋白质信息资源(PIR)、慕尼黑蛋白质序列信息中心(MIPS)和日本国际蛋白质序列数据库(JIPID)共同维护的国际上最大的公共蛋白质序列数据库。这是一个全面的、经过注释的、非冗余的蛋白质序列数据库,包含超过142,000条蛋白质序列(至99年9月),其中包括来自几十个完整基因组的蛋白质序列。所有序列数据都经过整理,超过99%的序列已按蛋白质家族分类,一半以上还按蛋白质超家族进行了分类。PSD的注释中还包括对许多序列、结构、基因组和文献数据库的交叉索引,以及数据库内部条目之间的索引,这些内部索引帮助用户在包括复合物、酶-底物相互作用、活化和调控级联和具有共同特征的条目之间方便的检索。每季度都发行一次完整的数据库,每周可以得到更新部分。PSD数据库有几个辅助数据库,如基于超家族的非冗余库等。PIR提供三类序列搜索服务:基于文本的交互式检索;标准的序列相似性搜索,包括BLAST、FASTA等;结合序列相似性、注释信息和蛋白质家族信息的高级搜索,包括按注释分类的相似性搜索、结构域搜索GeneFIND等。 PIR和PSD的网址是:http://pir.georgetown.edu/。 数据库下载地址是:ftp://nbrfa.georgetown.edu/pir/。 2. SWISS-PROT SWISS-PROT是经过注释的蛋白质序列数据库,由欧洲生物信息学研究所(EBI)维护。数据库由蛋白质序列条目构成,每个条目包含蛋白质序列、引用文献信息、分类学信息、注释等,注释中包括蛋白质的功能、转录后修饰、特殊位点和区域、二级结构、四级结构、与其它序列的相似性、序列残缺与疾病的关系、序列变异体和冲突等信息。SWISS-PROT中尽可能减少了冗余序列,并与其它30多个数据建立了交叉引用,其中包括核酸序列库、蛋白质序列库和蛋白质结构库等。利用序列提取系统(SRS)可以方便地检索SWISS-PROT和其它EBI的数据库。 SWISS-PROT只接受直接测序获得的蛋白质序列,序列提交可以在其Web页面上完成。 SWISS-PROT的网址是:http://www.ebi.ac.uk/swissprot/。 3. PROSITE PROSITE数据库收集了生物学有显著意义的蛋白质位点和序列模式,并能根据这些位点和模式快速和可靠地鉴别一个未知功能的蛋白质序列应该属于哪一个蛋白质家族。有的情况下,某个蛋白质与已知功能蛋白质的整体序列相似性很低,但由于功能的需要保留了与功能密切相关的序列模式,这样就可能通过PROSITE的搜索找到隐含的功能motif,因此是序列分析的有效工具。PROSITE中涉及的序列模式包括酶的催化位点、配体结合位点、与金属离子结合的残基、二硫键的半胱氨酸、与小分子或其它蛋白质结合的区域等;除了序列模式之外,PROSITE还包括由多序列比对构建的profile,能更敏感地发现序列与profile的相似性。PROSITE的主页上提供各种相关检索服务。PROSITE的网址是:http://www.expasy.ch/prosite/。 4. PDB蛋白质数据仓库(PDB)是国际上唯一的生物大分子结构数据档案库,由美国Brookhaven国家实验室建立。PDB收集的数据来源于X光晶体衍射和核磁共振(NMR)的数据,经过整理和确认后存档而成。目前PDB数据库的维护由结构生物信息学研究合作组织(RCSB)负责。RCSB的主服务器和世界各地的镜像服务器提供数据库的检索和下载服务,以及关于PDB数据文件格式和其它文档的说明,PDB数据还可以从发行的光盘获得。使用Rasmol等软件可以在计算机上按PDB文件显示生物大分子的三维结构。RCSB的PDB数据库网址是:http://www.rcsb.org/pdb/。 5. SCOP 蛋白质结构分类(SCOP)数据库详细描述了已知的蛋白质结构之间的关系。分类基于若干层次:家族,描述相近的进化关系;超家族,描述远源的进化关系;折叠子(fold),描述空间几何结构的关系;折叠类,所有折叠子被归于全α、全β、α/β、α+β和多结构域等几个大类。SCOP还提供一个非冗余的ASTRAIL序列库,这个库通常被用来评估各种序列比对算法。此外,SCOP还提供一个PDB-ISL中介序列库,通过与这个库中序列的两两比对,可以找到与未知结构序列远缘的已知结构序列。SCOP的网址是:http://scop.mrc-lmb.cam.ac.uk/scop/。6. COG 蛋白质直系同源簇(COGs)数据库是对细菌、藻类和真核生物的21个完整基因组的编码蛋白,根据系统进化关系分类构建而成。COG库对于预测单个蛋白质的功能和整个新基因组中蛋白质的功能都很有用。利用COGNITOR程序,可以把某个蛋白质与所有COGs中的蛋白质进行比对,并把它归入适当的COG簇。COG库提供了对COG分类数据的检索和查询,基于Web的COGNITOR服务,系统进化模式的查询服务等。COG库的网址是:http://www.ncbi.nlm.nih.gov/COG。下载COG库和COGNITOR程序在:ftp://ncbi.nlm.nih.gov/pub/COG。
[color=#444444]检测单上有两个指标的意思不是很理解,“相对分子质量小于1000的蛋白质水解物”所占比例为80%,而“蛋白质(以干基计),%”为70%。为什么蛋白质(以干基计)的数值还要更低呢。[/color]
http://img3.17img.cn/bbs/upfile/images/20100518/201005181701392921.gifiCMS2014 质谱网络会议——蛋白质组学/代谢组学专场会议时间:2014年11月20日 09:30—17:00【简介】 仪器信息网将于2014年11月18-21日举办"第五届质谱网络会议(iConference on Mass Spectrometry,iCMS2014)",本届会议将与中国化学会质谱分析专业委员会合作举办,旨在通过网络会议平台给国内质谱科学家提供一个全新的沟通交流平台,提高质谱科学研究和应用水平。 本届网络会议为期四天,将开设质谱新技术专场、地质能源专场、药物分析专场(上)、药物分析专场(下)、蛋白质组学/代谢组学专场(上)、蛋白质组学/代谢组学专场(下)、环境专场、食品专场共8个主题,每个主题为1个分会场,时长为半天或一天,大会将提醒近30名著名质谱专家就不同的主题做精彩的报告并同期与大家进行交流。成功报名并准时参会的用户均可获得一份iCMS历届会议的精选光盘(2张),并有机会获赠100元手机充值卡和Kindle Paperwhite电子书阅读器(4GB)。 iCMS2014—蛋白质组学/代谢组学专场(上)1)蛋白质泛素化的定量蛋白质组学研究——李衍常 博士 北京蛋白质组研究中心2)Protein complex research approach based on protein immunoprecipitation in coupling with mass spectroemtry (基于蛋白免疫沉淀-质谱分析的蛋白质复合物研究) ——胡克平 教授 中国医学科学院药用植物研究所报名地址:http://www.instrument.com.cn/webinar/meeting/meetingInsidePage/1078 iCMS2014—蛋白质组学/代谢组学专场(下)1)细胞间信号传导的蛋白质组学方法探究——田瑞军 南方科技大学化学系2)Ion Mobility Derived Collision Cross Sections to Support Metabolomics and Lipidomics——Giuseppe Astarita Georgetown University Washington D.C. U.S.A.3)基于GC/Tof的代谢组学技术在基础及临床医学研究中的应用——王晓艳 上海交通大学系统生物医学研究院报名地址:http://www.instrument.com.cn/webinar/meeting/meetingInsidePage/1079-------------------------------------------------------------------------------1、报名条件:只要您是仪器网注册用户均可报名参加。2、报名及参会咨询:QQ群—231246773
蛋白质的英文名词来源于希腊文,其含义是“第一”和“基本的”。反映了蛋白质是生命活动中最基本的和最重要的物质。蛋白质由碳、氢、氧、氮4种主要元素组成,有的蛋白质还含有硫、磷等其他元素。如血红蛋白含有铁、甲状腺球蛋白含有碘等。蛋白质的基本结构单位是氨基酸。氨基酸的特点是在分子一端含有氮和氢元素组成的化学基团——氨基。动物不能合成氨基,只有植物有利用硝酸盐合成氨基的能力。所以在动物饲养中,要依靠含有氨基酸、蛋白质的饲料,使家畜、家畜等生产蛋白质(净肉)。 蛋白质由一长串氨基酸链组成。一般都很长,如血红蛋白是由580个氨基酸组成。但氨基酸种类只有20种,在蛋白质中按严格的顺序排列,构成多种多样的生物专一性的蛋白质。由于人体不能合成氨基酸,只能从食物中获得蛋白质,并在肠内将蛋白质分解成各种氨基酸,这些氨基酸被吸收后,重新合成人体的特殊蛋白质。合成蛋白质的主要器官是肝脏。 从蛋白质这个名字看,好像蛋白质来源离不开蛋。其实动物、植物以及其他生物体都含有蛋白质。虽然最常党见的蛋白质——蛋清是白色的。但并非所有蛋白质都是白色的。血液上的血红蛋白是红色的,绿色植物的叶绿蛋白是绿色的。 同碳水化物和脂肪相比,蛋白质的两个代谢特点,一是它主要在代谢中发挥作用,而不是分解后为人体提供能量;二是蛋白质代谢的起点和终点都是蛋白质,即起点是人体的异蛋白质(如鱼的蛋白质,鸡肉蛋白质等),而终点则成了人体特有的蛋白质。蛋白质由氨基酸组成,是另一种重要的供能物质,每克蛋白质提供4卡路里的热量。但蛋白质的更主要的作用是生长发育和新陈代谢。过量的摄入蛋白质会增加肾脏的负担。因此蛋白的摄入要根据营养状况、生长发育要求达到供求平衡。通常蛋白摄入所产生的热量约占总热量的20%左右为宜。
蛋白质,是身体构建和修复的基石!但你知道哪些食物富含蛋白质吗?别急,我来告诉你!肉类:牛肉、猪肉、鸡肉,都是优质蛋白的来源,每天来点,肌肉更结实!鱼类:三文鱼、金枪鱼,不仅蛋白质丰富,还有Omega-3,对心脏好哦![b]豆类:黄豆、黑豆、绿豆,植[/b]物蛋白的代表,素食者的好选择!奶制品:牛奶、酸奶、奶酪,钙质和蛋白质双丰收,每天一杯,骨骼更强壮!蛋白质摄入要适量,过多或过少都不利于健康。每天建议摄入量,成年男性约56克,女性约46克。均衡饮食,合理搭配,让蛋白质成为你健康生活的好伙伴!
蛋白质食物是指鱼、肉、蛋、奶和大豆制品。这些食物营养价值高,不但提供优质蛋白,还提供维生素和矿物质,如钙、铁、锌、维生素A、维生素B等,是人体营养的重要保障。
人类的营养物质有许多种类,最为重要的为蛋白质,碳水化合物和脂肪,其它则是微量营养物质,如维生素、电解质和微量元素等。虽然每一种营养物质对人体来说都是不可或缺的,但绝大多数的营养学家都会有充分的理由认为,真正最重要的营养物质是蛋白质。一、蛋白质是构成人体的基本物质。蛋白质是由氨基酸通过肽链相连而构成的,它是人体包括骨骼、肌肉、皮肤和脑的重要物质基础,同时氨基酸也是生成核酸的基本物质。我们知道,核酸既形成遗传密码,也是体内储存能量的基本物质。因而从根本上说,人体是由蛋白质组成的。构成人体蛋白质的生理功能概括有如下三个方面:1)人体组织的主要构成成份:如肌肉、骨骼、血液、皮肤、神经、肝、心等等。2)具有特殊生理功能:可以这样说,人类的一切生理活动都与蛋白质有关。如酶蛋白能催化机体的一切化学反应,包括蛋白质、脂肪、碳水化合物的消化等;载脂蛋白运送脂肪;血红蛋白运送氧;激素蛋白调节代谢与生理活动包括情感;血浆白蛋白调节渗透压、运输金属离子、胆红素和抗生素等。3)供给机体能量:成年人每日约需要更新400g蛋白质,每克蛋白质彻底分解能释放出约4 Kcal的热量。4)为机体提供氮原料:人体内所必需的嘧啶、嘌呤、肌酸、胆碱、肾上腺素、肉碱、牛磺酸等,都是以多肽、氨基酸为原料的。表1. 世界粮食组织(FAD)和世界卫生组织(WHO)根据中国人的体质和膳食结构推荐的中国人蛋白质的摄入量(RNLs)。年 龄 蛋白质RNL(g/d)初生—6个月 1.5-31岁 353岁 455岁 557岁 609岁 6510-16岁 75-85成年女性 65成年男性 75妊娠 +15乳母 +20根据统计资料:由于贫困、工作紧张、精神压力、减肥节食、以及肠胃疾病、癌症、贫血、肾病、各种结核病、肝硬化、腹水、烧伤、失血等,以及老龄人均不同程度地存在着蛋白质的摄入不足。上世纪80年代以来,我国营养学家对7个省18个贫困地区,1万名学龄前儿童进行了为期4年的连续调查,发现营养不良现象非常严重,其中蛋白质的摄入量不足WHO规定的60%。近年社会医学工作调查,在发达地区由于生活节奏加快,精神压力异常增加,以及办公室白领阶层的减肥节食,也导致蛋白质摄入不足,代谢异常的人群增加。二、蛋白质缺乏的体征和临床症状单纯的蛋白质营养不良又叫加西长病,这或许是来源于非洲的单词,单纯的能量不足时叫消瘦;临床上通常把这两种现象叫单纯性蛋白质能量营养不良症或PEM。单纯的PEM症在临床上较少见到,但在慢性消耗性疾病患者中则常见,尤其是在癌症患者和艾滋病的患者中几乎占到90%以上。现代都市和贫困地区存在着相当数量的蛋白质营养不良族群,他们的临床表现主要是能量损失或不足,如体力不支、睡眠不安、怕冷、怕热、性冷淡、无法进行正常的体力劳动和运动,其次为肌肉组织萎缩、皮肤松驰;腿部、脸部易水肿、脂肪肝、无名皮疹、伤口愈合不良、记忆力下降、视力减弱等。再者免疫力低下易感冒、感染。在做血检时通常会发现这些族群的血浆蛋白处于正常值的下限,其中白蛋白、转铁蛋白、甲状腺素结合前体蛋白和视轴蛋白(retinol-binding protein)均处于低水平时,患者易于感染各种疾病并且出现早衰症状,如果是儿童则感染后死亡率增加30%-40%,对于这类人群WHO的专家最好的建议就是迅速补充优质(或全价)的蛋白质。