沃特世公司:走在蛋白折叠和大分子复合物的研究前沿
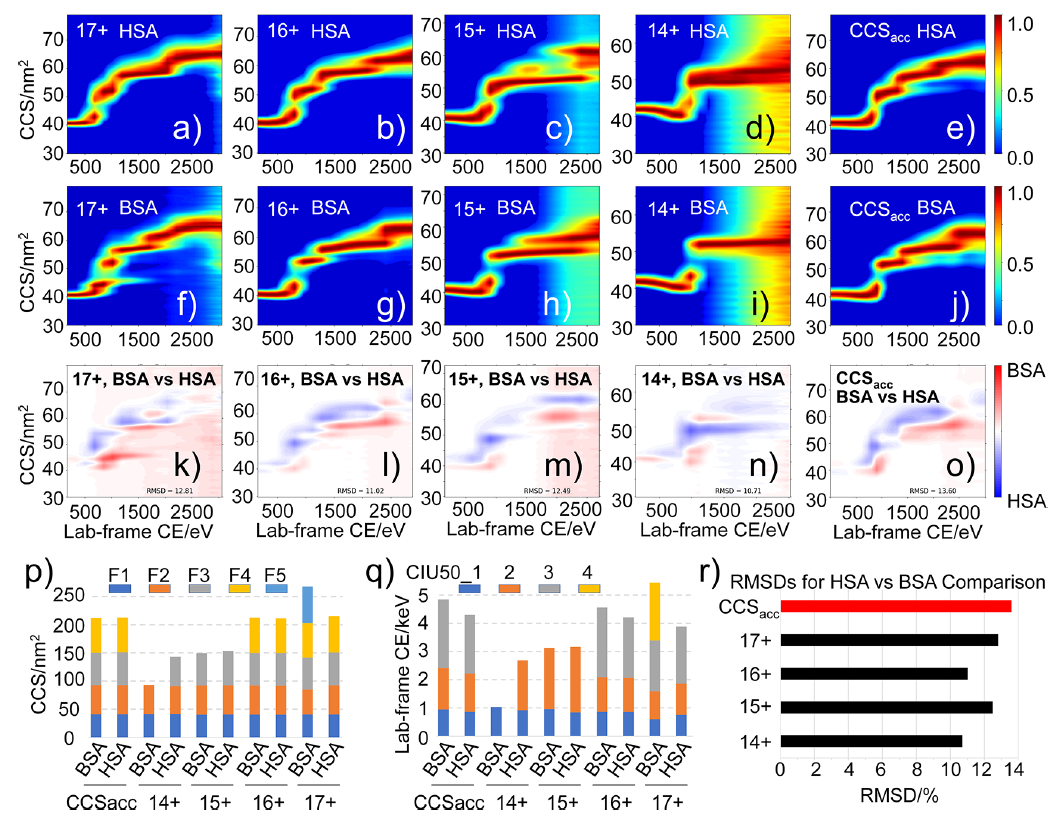
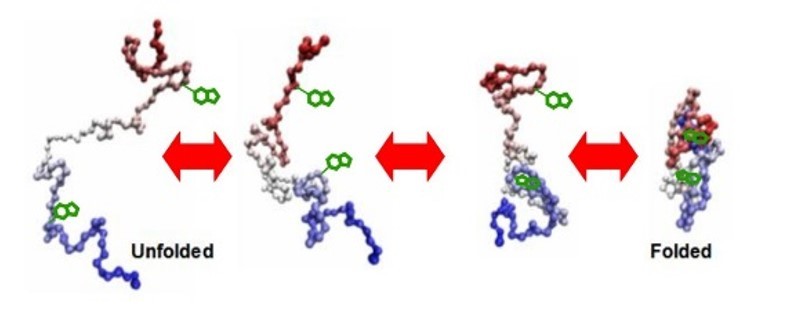
使用沃特世公司SYNAPT High Definition质谱系统, 利兹大学就所获得的结果发表文章 沃特世(Waters® )公司(股票代码NYSE: WAT) 2007年12月3日宣布利兹大学爱斯布理Astbury结构分子生物学中心使用最近购买的沃特世公司SYNAPT High Definition MS™ (HDMS) 质谱系统,在Journal of the American Society of Mass Spectrometry (JASMS) 美国质谱协会杂志上发表了蛋白研究的成果。 Ashcroft实验室正在使用SYNAPT® HDMS质谱系统研究生物分子功能。在2007年12月刊的一篇文章中,利兹的研究人员描述了对几种蛋白,如细胞色素C和贝塔-2-微球蛋白,的成功分离和分析,Ashcroft希望该成就可以通向对某些生物过程的完全了解,如淀粉纤维形成,细菌纤毛集结以及病毒衣壳的装配,这些过程都与衰老症有关。 蛋白质被人体小心地折叠,经三维长链分子装配而成。当正确地被折叠时,蛋白调节正常身体功能。当某些蛋白被折叠成特殊形状而变成错误折叠时,引起一系列反应,可导致自身聚集和淀粉纤维形成,因此一些高发疾病可能发生,包括老年痴呆症,疯牛病和帕金森氏综合症。在利兹大学,Alison Ashcroft艾利森艾斯克劳福特博士和她的同事Sheena Radford诗娜拉德福德教授就是研究这样一种蛋白,贝塔-2-微球蛋白,试图探索它是如何形成纤维,在透析病人的关节聚集,并与透析相关的淀粉样变性病有关。对这些过程在分子水平的完全了解将有助于治疗方法的设计。 新型质谱为生物学研究带来新领域 作为工具,常规质谱是区分不同质量蛋白质的优秀方法。然而,一个特定蛋白的不同构象或不同的折叠形式具有同一质量数,使用常规的方法是无法区分开来的。这就是沃特世公司SYNAPT HDMS质谱系统和镶嵌其中的离子淌度技术帮助利兹大学的方式。 “一个蛋白可以折叠成紧密的三维结构,或者在某些条件下,蛋白可以打开成伸展的结构。即使这些三维结构拥有相同的质量和质荷比(m/z),SYNAPT HDMS的离子淌度功能可以分离这些蛋白,并告诉您多少蛋白在折叠的形式而多少在非折叠的形式。而且,由于两种蛋白构象的横截面积不同,因为能够基于形状分离,SYNAPT HDMS质谱系统使我们能够区分各种不同的蛋白形状。 ”结果确实令人惊奇。”Alison Ashcroft艾利森艾斯克劳福特博士说,她是生物分子质谱研究员,质谱室主任。 来自沃特世公司的SYNAPT 质谱系统为实验室带来研究聚集过程的新的洞察力。“它为我们的研究提供新一维的空间。我们现在可以对原始状态的蛋白质定量,也可对非折叠或部分折叠的蛋白进行定量。我们也可以监测某种特定的蛋白构象在聚集过程被消耗。这为生物分子在分子水平如何工作提供了重要的新层面。”艾斯克劳福特博士补充道。 沃特世公司于2006年6月在美国西雅图美国质谱年会上推出SYNAPT HDMS质谱系统。它是第一台商业化的,在质量之外,基于尺寸,形状和电荷数分析离子的质谱。 一个管理万亿字节科学数据的决策 在生物技术和生物科学院(BBSRC) 和维尔康姆信托的资助下,艾斯克劳福特实验室拥有五台不同形式的质谱仪器,而管理其产生的数据是一个巨大的挑战。为了更有效地管理数据文件,该实验室选择沃特世公司NuGenesis Scientific Data Management System (SDMS)科学数据管理系统。 “每天在DVD上备份数据已经不需要了。科学数据管理系统SDMS 每天一次从五台质谱仪上将数据自动备份,我们的研究生和博士后可以直接从他们办公室的计算机上看到数据。存档文件对我们很重要,因为政府资助部门要求我们自建成之日起存储五或十年的数据。研究生花四年的时间拿到博士学位,所以他们需要四年或更长时间查看数据,特别是如果在拿到博士学位后要写文章” 艾斯克劳福特博士评论道。 “非分析化学背景的人们认为一台质谱就是一个复杂的称重机器。通常他们没有意识到使用这台仪器可以看到蛋白功能和行为。但是当他们发现了之后,会感到无比惊奇。”艾斯克劳福特博士说。 艾斯克劳福特博士在美国质谱协会杂志的文章全文参考: Monitoring co-populated conformational states during protein folding events using ESI-IMS-MS, D. P. Smith, K. Giles, R. H. Bateman, S. E. Radford,A. E Ashcroft, J. Am. Soc. Mass Spectrom., 2007 Dec 18 (12): 2180 – 90, DOI:10.1016/j.jasms.2007.09.017 文章再版要求请寄至A. E. Ashcroft 博士, Astbury Centre for Structural Molecular Biology, Astbury Building, Faculty of Biological Sciences, University of Leeds, Leeds LS2 9JT UK,或发电子邮件email: a.e.ashcroft@leeds.ac.uk 关于利兹大学生物科学系,请浏览(http://www.fbs.leeds.ac.uk/) 利兹大学的生物科学系是英国最大的生命科学研究团体之一,拥有将近一百五十名学者和四百多名博士后和研究生。该系目前活跃的研究基金约六千万英镑,资助者包括慈善,研究院,欧盟和企业。该系拥有杰出的研究成果,在上一期政府研究评价检查(HEFCE)中,所有主要评估项目均获得第五级。 关于利兹大学爱斯布理Astbury中心, 请浏览(http://www.astbury.leeds.ac.uk/) 爱斯布理Astbury结构分子生物学中心是利兹大学一个跨学科研究中心。成立该中心的目的是在结构分子生物学的各个领域从事国际水平的研究课题。Astbury中心汇集了五十多位来自利兹大学各学科的学者,拥有共同的学术兴趣。该中心以 W.T.Astbury 的名字命名,他是生物物理学家,在利兹大学长期从事科学研究(1928-1961),工作期间在该领域成立了多个基金会。 艾利森艾斯克劳福特博士,(http://www.astbury.leeds.ac.uk/facil/mass.htm) 是生物分子质谱研究员,利兹大学,生物科学系,爱斯布理Astbury结构分子生物学中心质谱室主任。她的研究着重于开发和使用质谱方法探索生物分子功能。 诗娜拉德福德教授,(http://bmbsgi10.leeds.ac.uk/),是利兹大学,生物科学系,爱斯布理Astbury结构分子生物学中心结构分子生物学教授。她的研究着重于蛋白质折叠,非折叠和聚集机理。 生物技术和生物科学研究院(BBSRC) (www.bbsrc.ac.uk)是英国生命科学资助机构。 政府投资的生物技术和生物科学研究院BBSRC 每年在很大范围的研究领域投资三亿八千万英镑,为英国国民的生活质量做出突出贡献。 维尔康姆信托(www.wellcome.ac.uk)是英国最大的慈善机构。它资助英国国内和国际创新生物医学研究,每年投资额在五亿英镑左右。 (Waters, SYNAPT, High Definition MS, High Definition Mass Spectrometry, NuGenesis 和 HDMS 是沃特世公司商标。)