高分子溶液中聚集体与单分散的分子氢谱会有区别吗?如果是通过加不良溶剂出现聚集体怎么通过核磁实验证明?谢谢!
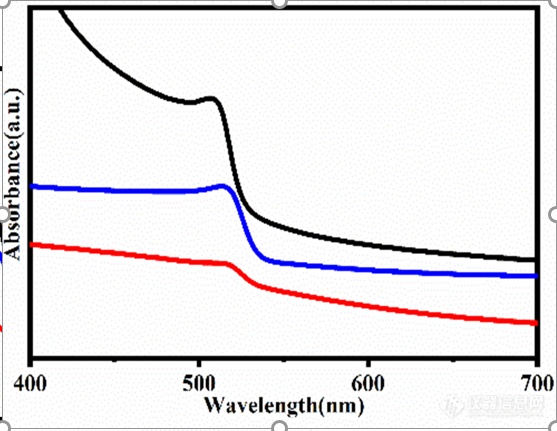
如图,这幅图到底那个地方暗示具有胶体非均质聚集体?特别是红色线,说是因为聚集发生了散射。求紫外相关大佬帮忙解答一下疑惑?这幅图是测的液紫。
【讲座主题】应用安捷伦最新AdvanceBio SEC色谱柱解决生物制药聚集体分析中挑战【讲座时间】2016年03月15日 10:00:00【主讲老师】米建秋 毕业于北京大学化学系,有着丰富的色谱、质谱经验!【会议简介】近年来随着生物制药行业在国内蓬勃发展,相应的产品表征方法研究成为行业热点。聚集体是生物药物的关键质量属性,也是表征的难点。聚集体的不稳定性以及与色谱柱之间的次级相互作用往往会带来测试结果偏离真实含量,甚至导致对产品质量和生产工艺的错误判断,影响药物的安全性。安捷伦致力于研发新一代创新的体积排阻硅胶填料,降低次级相互作用,消除聚集体分析中的不确定性。本次网络讲堂将会介绍安捷伦科技基于全新填料技术推出的高分辨、高惰性AdvanceBio SEC色谱柱在真实表征聚集体方面的应用。抗体药物结合物(ADC)由于连接了疏水性的药物,在SEC分析中疏水相互作用更为明显,导致峰拖尾和分离变差,本讲座特别呈现AdvanceBio SEC色谱柱在全面改善ADC聚集体分析峰形和分离的应用实例,为生物药物研究工作者提供性能优越的表征工具。AdvanceBio SEC 色谱柱亮点:• 2.7um小颗粒粒径实现更好的柱效• 优化的孔径实现更高的分离度和现更准确的定量• 良好的惰性可实现高灵敏度和低浓度聚集体的定量分析• 更高的重现性可避免重复工作【会议报名】http://www.instrument.com.cn/webinar/meeting/meetingInsidePage/1778
请问如果是溶液中有机分子可以形成聚集体,此时从NOE谱上我们得到的H-H的空间上的相关是分子内的相关还是分子间的相关?或者是与浓度有关?
【讲座主题】应用安捷伦最新AdvanceBio SEC色谱柱解决生物制药聚集体分析中挑战【讲座时间】2016年03月15日 10:00:00【主讲老师】米建秋 毕业于北京大学化学系,有着丰富的色谱、质谱经验!【会议简介】近年来随着生物制药行业在国内蓬勃发展,相应的产品表征方法研究成为行业热点。聚集体是生物药物的关键质量属性,也是表征的难点。聚集体的不稳定性以及与色谱柱之间的次级相互作用往往会带来测试结果偏离真实含量,甚至导致对产品质量和生产工艺的错误判断,影响药物的安全性。安捷伦致力于研发新一代创新的体积排阻硅胶填料,降低次级相互作用,消除聚集体分析中的不确定性。本次网络讲堂将会介绍安捷伦科技基于全新填料技术推出的高分辨、高惰性AdvanceBio SEC色谱柱在真实表征聚集体方面的应用。抗体药物结合物(ADC)由于连接了疏水性的药物,在SEC分析中疏水相互作用更为明显,导致峰拖尾和分离变差,本讲座特别呈现AdvanceBio SEC色谱柱在全面改善ADC聚集体分析峰形和分离的应用实例,为生物药物研究工作者提供性能优越的表征工具。AdvanceBio SEC 色谱柱亮点:• 2.7um小颗粒粒径实现更好的柱效• 优化的孔径实现更高的分离度和现更准确的定量• 良好的惰性可实现高灵敏度和低浓度聚集体的定量分析• 更高的重现性可避免重复工作【会议报名】http://www.instrument.com.cn/webinar/meeting/meetingInsidePage/1778
[font=Tahoma, Helvetica, SimSun, sans-serif, Hei]请问大家一个关于硫磺素T测淀粉样蛋白聚集的问题。是这样的,自由的硫磺素T的激发波长及发射波长分别为350及440;当其与淀粉样纤维结合时,其激发波长以及发射波长一定会红移至440(ex)以及482(em)吗?[/font]
蛋白质纯化及复性 重组蛋白在大肠杆菌(E. coli)高效表达时,往往以不溶的、无活性的蛋白聚集体,即包涵体(inclusion body)的形式存在于细胞内。必须从细胞内分离出包涵体,采用高浓度变性剂(如7.0mol/L盐酸胍、8.0mol/L脲)溶解包涵体,然后除去变性剂或降低变性剂的浓度,使包涵体蛋白得以复性,最后再用色谱法使目标蛋白质得到纯化。其中包涵体蛋白的复性和纯化是整个过程中的核心。 目前重组蛋白生产中普遍存在的问题是:(1)复性效率低。传统的复性方法稀释法和透析法。稀释复性法对样品几十倍,甚至上百倍的稀释会使样品的体积急剧增大,给后续的分离纯化带来很大的困难,而且复性过程中需要较大的复性容器。透析法耗时较长,而且要多次更换透析溶液。这两种方法的共同缺点是蛋白质在复性过程中会发生聚集而产生大量沉淀,复性效率低,通常蛋白质的活性回收率只有5~20%,而且复性后的蛋白质溶液中含有大量的杂蛋白,需要进行进一步的分离纯化。(2)工艺路线烦琐,生产周期长。在传统的重组蛋白质分离纯化工艺中,大多采用经典的软凝胶分离介质,由于这种介质的颗粒较大,分离效率较差,因此常常需要采用多种不同模式的色谱操作联用对目标蛋白质进行纯化,才能得到纯度符合一定标准的目标蛋白质。另外,这种色谱介质的耐压性很差,只能在流速较低的情况下进行操作,分离纯化时间较长。分离纯化步骤多和分离时间长使得蛋白质的质量回收率和活性回收率很低。而且在传统的重组蛋白质生产工艺中,蛋白质的复性和纯化是生产过程中两个独立的单元操作,也在很大程度上制约着生产效率。(3)生产成本高,设备投资大。由于复性和分离纯化分别单独进行,而且分离纯化步骤多,每一步都需要有与之配套的设备,致使设备投资大,生产成本高。随着生产规模的增加,这种弊端会愈来愈严重。 1991年耿信笃教授首先将高效疏水相互作用色谱(HPHIC)用于变性蛋白的复性,很好的解决了上述问题,现已成功用于重组人干扰素-g(rhIFN-g)、重组人干扰素-a(rhIFN-a)、人粒细胞集落刺激因子(rhG-CSF)、重组人胰岛素原(proinsulin)、重组牛朊病毒(prion)等重组蛋白以及溶菌酶和核搪核酸酶等标准模型蛋白的复性与同时纯化中。目前,排阻色谱法、离子交换色谱法和亲合色谱法也已用于蛋白质的复性和同时纯化中。与传统的稀释法及透析法比较,用色谱法进行蛋白复性的优点是:①在进样后可很快除去变性剂;②由于色谱固定相对变性蛋白质的吸附,可明显地减少、甚至完全消除复性过程中蛋白质聚集体和沉淀的产生,从而提高蛋白质复性的质量和活性回收率;③在蛋白质复性的同时可使目标蛋白质与杂蛋白分离以达到纯化的目的,使复性和纯化同时进行;④便于回收变性剂,以降低废水处理成本。简言之,色谱法复性可以提高蛋白质的活性和质量回收率,将蛋白复性和纯化集成在一步操作完成,缩短了操作步骤和生产时间,减少了设备投资,使生产成本大大降低,已经引起了全世界范围内许多生化研究者和重组蛋白药物生产厂家的关注。由于高效液相色谱(HPLC)分离效率高,往往在一步操作中便可得到纯度符合要求的蛋白质,而且分离速度快,在应用方面具有更大的优势。
[font=宋体][b]重组蛋白、融合蛋白与天然蛋白的区别:[/b][/font][font=宋体] [/font][font=宋体][font=宋体]重组蛋白是利用基因工程技术产生的,通常是由转基因动物的乳腺产生,其作为生物制药在医学领域中作用显著。利用基因工程技术,可以使哺乳动物本身变成[/font][font=宋体]“批量生产药物的工厂”。方法:是将药用蛋白基因与乳腺蛋白基因的启动子等调控组件重组在一起,通过显微注射等方法,导入哺乳动物(哺乳动物才会泌乳)的受精卵中,然后,将受精卵送入母体内,使其生长发育成转基因动物。转基因动物进入泌乳期后,可以通过分泌的乳汁来生产所需要的蛋白质药品,因而称为动物乳腺生物反应器或乳房生物反应器。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]融合蛋白又称为[/font][font=宋体]“标签蛋白”,常用的标签有[/font][font=Calibri]His[/font][font=宋体]、[/font][font=Calibri]GST[/font][font=宋体]、[/font][font=Calibri]Strep[/font][font=宋体]标签。融合蛋白是通过[/font][font=Calibri]DNA[/font][font=宋体]重组技术将要表达的目的蛋白基因和表达载体上融合蛋白基因相连,通过这种方式表达出来的蛋白质,就是既含有目的基因蛋白又含有融合基因蛋白的重组蛋白。融合蛋白表达是重组蛋白表达的一种策略,融合表达是一种方法。[/font][/font][font=宋体] [/font][font=宋体]天然蛋白质是在自然界中存在的,不经过人工的任何修饰或加工,比如大豆中的蛋白质和病毒表面的蛋白质。[/font][font=宋体] [/font][font=宋体] [/font][font=宋体][b]重组蛋白常见问题解析:[/b][/font][font=宋体][font=Calibri]1.[/font][font=宋体]蛋白为什么要冻干?冻干对蛋白的影响有哪些?[/font][/font][font=宋体] [/font][font=宋体]蛋白质对热敏感,冻干能使绝大部分蛋白质的活性保留下来,提高蛋白的稳定性并延长保存时间,同时降低运费。[/font][font=宋体] [/font][font=宋体][font=Calibri]2.[/font][font=宋体]冻干前为什么向蛋白溶液中加保护剂?一般冻干保护剂有哪几种?[/font][/font][font=宋体] [/font][font=宋体][font=宋体]保护剂是用来在冻干和储存过程中保护蛋白的。常用的保护剂或稳定剂有糖类,多元醇,聚合物,表面活性剂,某些蛋白和氨基酸等。我们通常加[/font][font=Calibri]8%[/font][font=宋体](质量比体积)的海藻糖和甘露醇作为冻干保护剂。海藻糖可明显阻止蛋白质二级结构改变以及冻干过程中蛋白质的伸展和聚集;甘露醇也是一种普遍应用的冻干保护剂和填充剂,可以降低某些蛋白的冻干后聚集情况。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]温馨提示:对于大多数蛋白,重悬后在[/font][font=Calibri]4[/font][font=宋体]℃仅能短期保存[/font][font=Calibri]([/font][font=宋体]约[/font][font=Calibri]1[/font][font=宋体]周[/font][font=Calibri])[/font][font=宋体]。如想长期保存,请先配制成稀释液[/font][font=Calibri]([/font][font=宋体]其中必须含有载体蛋白,如[/font][font=Calibri]0.1% BSA[/font][font=宋体],[/font][font=Calibri]5%HSA[/font][font=宋体],或[/font][font=Calibri]10% FBS)[/font][font=宋体],然后分装冻存于[/font][font=Calibri]-20[/font][font=宋体]℃或[/font][font=Calibri]-80[/font][font=宋体]℃。一定要避免反复冻融,因每次冻融均会引起蛋白的部分失活。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]3.[/font][font=宋体]如何重构冻干粉?[/font][/font][font=宋体] [/font][font=宋体]请查看您的货物随附的分析证书以获取有关重构的确切说明,因为并非所有产品都在相同条件下重构。一般来说,我们建议使用无菌水进行复溶。将推荐体积的无菌水加入小瓶中,轻轻摇晃以完全溶解蛋白质。不要涡旋。[/font][font=宋体] [/font][font=宋体][font=Calibri]4.[/font][font=宋体]为什么我的管内几乎看不见蛋白产品?[/font][/font][font=宋体] [/font][font=宋体][font=宋体]蛋白产品中不含载体蛋白或其它添加物[/font][font=Calibri]([/font][font=宋体]如牛血清白蛋白[/font][font=Calibri](BSA)[/font][font=宋体],人血清白蛋白[/font][font=Calibri](HSA)[/font][font=宋体]和蔗糖等,并以最低含盐量的溶液进行冻干时,常常不能形成白色网架结构,而是微量的蛋白在冻干过程中沉积在管内,形成很薄或肉眼不可见的透明蛋白层。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]5.[/font][font=宋体]应如何确定细胞因子的种属交叉活性?[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]1) [/font][font=宋体]除少数例外,大多数人类细胞因子对小鼠细胞均有活性。[/font][font=Calibri]2) [/font][font=宋体]许多小鼠细胞因子也可作用于人类细胞,但比活性可能低于对应的人类细胞因子。 [/font][font=Calibri]3) IL-7[/font][font=宋体]等为数不多的人类细胞因子作用于小鼠细胞时比对应的小鼠细胞因子活性更强。[/font][font=Calibri]4) [/font][font=宋体]干扰素,[/font][font=Calibri]GM-CSF, IL-3[/font][font=宋体]和[/font][font=Calibri]IL-4[/font][font=宋体]等细胞因子种属特异,对非同源细胞几乎没有活性。[/font][font=Calibri]5) [/font][font=宋体]相反,成纤维细胞生长因子[/font][font=Calibri](FGFs)[/font][font=宋体]和神经营养素[/font][font=Calibri](neurotrophins)[/font][font=宋体]高度保守,在不同动物种属细胞上均具有很好的活性。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]6.[/font][font=宋体]什么是载体蛋白?[/font][/font][font=宋体] [/font][font=宋体][font=宋体]载体蛋白如[/font] [font=Calibri]HSA [/font][font=宋体]或 [/font][font=Calibri]BSA [/font][font=宋体]用于提高重组蛋白的稳定性,并有助于避免产品粘在小瓶壁上。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]7.[/font][font=宋体]我应该如何储存重组蛋白?[/font][/font][font=宋体] [/font][font=宋体][font=宋体]对于长期储存,蛋白质溶液应与载体蛋白(例如[/font] [font=Calibri]0.1% BSA [/font][font=宋体]或 [/font][font=Calibri]0.1% HSA[/font][font=宋体])分装保存,并在 [/font][font=Calibri]-20[/font][font=宋体]°[/font][font=Calibri]C [/font][font=宋体]下冷冻保存。请记住,每个冷冻[/font][font=Calibri]/[/font][font=宋体]解冻循环都可能导致蛋白质变性。除非分析证书上另有说明,否则大多数重组蛋白的保质期为一年。如果将它们保存在分析证书上所述的最佳存储条件下,则提供此保证。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]8.[/font][font=宋体]如何确定重组蛋白的数量?为什么我的检测产生的蛋白质数量与您的结果不同?[/font][/font][font=宋体] [/font][font=宋体][font=宋体]我们通过[/font][font=Calibri]BCA[/font][font=宋体]、[/font][font=Calibri]SDS-PAGE[/font][font=宋体]、[/font][font=Calibri]HPLC[/font][font=宋体]等方法确定重组蛋白的数量。不同的测定产生不同的量化结果。有时,如果您进行不同的检测,差异可能会很大。蛋白质也有可能在储存过程中形成聚集体,在重组和离心后导致损失。我们对每批产品进行质量控制测试,但是,同一批次中的一些小瓶可能与其他小瓶不同(这种情况很少发生)。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]更多关于[url=https://cn.sinobiological.com/resource/protein-review][b]重组蛋白资源[/b][/url]详情可以查看:[/font][font=Calibri]https://cn.sinobiological.com/resource/protein-review[/font][/font]
人血白蛋白多聚体测定法本法系用分子排阻色谱法测定人血白蛋白多聚体含量。照分子排阻色谱法(附录Ⅲ D)测定。色谱条件与系统适用性试验 用亲水硅胶高效体积排阻色谱柱(SEC,排阻极限300kD,粒度10μm),柱直径7.5mm,长60cm;以含1%异丙醇的pH7.0 0.2mol/L磷酸盐缓冲液为流动相;检测波长为280nm ;流速为每分钟0.6ml。取每1ml含蛋白质为12mg 的人血白蛋白溶液20μl,注入色谱柱,记录色谱图,人血白蛋白单体峰与二聚体峰间的分离度应大于1.5,拖尾因子按人血白蛋白单体峰计算应为0.95~1.40。测定法 取供试品适量,用流动相稀释成每1ml约含蛋白质12mg的溶液,取20μl,注入色谱柱,记录色谱图60分钟(色谱柱长60cm)。按面积归一法计算,色谱图中未保留(全排阻)峰的含量(%)除以2,即为人血白蛋白多聚体含量请教:为何除以2呢?很奇怪呀
[font=宋体]重组蛋白在生物医药领域的应用越来越广泛,然而,许多研究者在使用过程中可能会遇到各种问题。本文将对重组蛋白常见问题进行解析,包括其制备、纯化、保存以及应用等方面的问题,为您提供权威的解答和全面的指导。通过阅读本文,您将能够更好地理解和应用重组蛋白技术,提高研究工作的效率和准确性。[/font][font=宋体] [/font][font=宋体][b][font=Calibri]1. [/font][font=宋体]如何生产重组蛋白?真核表达(酵母、昆虫和哺乳动物细胞)与大肠杆菌表达相比有什么优势?[/font][/b][/font][font=宋体]我们的大多数重组蛋白都是在真核系统中生产的,分析证书中会为您提供有关单个产品如何生产的具体信息。真核生物作为表达系统有几个优势。[/font][font=宋体] [/font][font=宋体]真核生物本身很少分泌原生蛋白,但却能分泌重组蛋白。因此,真核生物系统通常是分泌表达重组蛋白然后进行纯化。在大肠杆菌中制造的重组蛋白通常被定位在包涵体中。从包涵体中纯化重组蛋白需要在苛刻的条件下进行,然后再进行重折叠处理。这些苛刻的处理会对蛋白质的功能产生负面影响。[/font][font=宋体]真核生物分泌的重组蛋白由高尔基体处理,因此可以进行翻译后修饰。这些修饰包括糖基化、磷酸化和硫酸化。有许多蛋白质需要经过修饰才能发挥功能、正常折叠或溶解。[/font][font=宋体]真核生物没有像大肠杆菌那样的细菌细胞壁,因此不存在可影响目标系统炎症反应的内毒素(脂多糖)。[/font][font=宋体] [/font][font=宋体][b][font=Calibri]2. [/font][font=宋体]当我打开小瓶时,什么也没看到。我怎么知道小瓶里有蛋白质?[/font][/b][/font][font=宋体][font=宋体]打开小瓶之前要先离心!我们的大多数产品都是用低浓度缓冲液冻干的,因此几微克的产品可能不太明显。我们建议在打开前将小瓶放入微型离心机中离心[/font] [font=Calibri]20-30[/font][font=宋体]秒,以将可能滞留在瓶盖或试管侧面的蛋白质离心到小瓶底部。我们的质量控制程序可确保每小瓶中的产品量正确无误。[/font][/font][font=宋体] [/font][font=宋体][b][font=Calibri]3. [/font][font=宋体]如何复溶冻干粉?重组蛋白[/font][font=Calibri]f[/font][font=宋体]复溶可接受的体积是多少?重组蛋白复溶后的浓度是多少?[/font][/b][/font][font=宋体]请查阅您的货物中包含的分析证书,以了解复溶方法,因为并非所有产品都在相同的条件下进行复溶。一般来说,我们建议使用无菌水进行复溶。将推荐体积的无菌水加入小瓶中,轻轻摇动以完全溶解蛋白质。不要涡旋。[/font][font=宋体] [/font][font=宋体][font=宋体]重组蛋白的浓度取决于复溶体积。例如,如果在[/font][font=Calibri]100μL[/font][font=宋体]载体蛋白溶液中复溶[/font][font=Calibri]10μg[/font][font=宋体]重组蛋白,则浓度为[/font][font=Calibri]10μg/100μL[/font][font=宋体]或[/font][font=Calibri]100μg/mL[/font][font=宋体]。[/font][/font][font=宋体] [/font][font=宋体][b][font=Calibri]4. [/font][font=宋体]如何储存重组蛋白?重组蛋白的保质期多长?[/font][/b][/font][font=宋体][font=宋体]若要长期保存,蛋白溶液应与载体蛋白(如[/font][font=Calibri]0.1% BSA[/font][font=宋体]或[/font][font=Calibri]0.1% HSA[/font][font=宋体])一起以等分的形式保存,并在[/font][font=Calibri]-20[/font][font=宋体]°[/font][font=Calibri]C[/font][font=宋体]下冷冻保存。请注意,每次冷冻[/font][font=Calibri]/[/font][font=宋体]解冻循环都可能导致蛋白质发生变性。除非分析证书上另有说明,大多数重组蛋白的保质期为一年。请按照分析证书上的规定在最佳储存条件下保存。[/font][/font][font=宋体] [/font][font=宋体][b][font=Calibri]5. [/font][font=宋体]什么是载体蛋白?[/font][/b][/font][font=宋体][font=宋体]载体蛋白(如[/font][font=Calibri]HSA[/font][font=宋体]或[/font][font=Calibri]BSA[/font][font=宋体])用于提高重组蛋白的稳定性,避免产品粘附在瓶壁上。[/font][/font][font=宋体] [/font][font=宋体][b][font=Calibri]6. [/font][font=宋体]如何确定重组蛋白的量?为什么我的检测结果与你们的结果不同?[/font][/b][/font][font=宋体][font=宋体]我们通过[/font][font=Calibri]BCA[/font][font=宋体]、[/font][font=Calibri]SDS-PAGE[/font][font=宋体]、[/font][font=Calibri]HPLC[/font][font=宋体]和其他方法确定重组蛋白的量。不同的检测方法会产生不同的定量结果。如果您采用不同的检测方法,有时差异会很大。蛋白质在储存过程中也有可能形成聚集体,从而在复溶和离心后造成损失。[/font][/font][font=宋体] [/font][font=宋体][b][font=Calibri]7.[/font][font=宋体]义翘神州使用哪些标签进行蛋白质表达[/font][font=Calibri]/[/font][font=宋体]纯化? 如果我需要去除标签怎么办?[/font][/b][/font][font=宋体][font=宋体]常用标签有[/font][font=Calibri]His[/font][font=宋体]、[/font][font=Calibri]Flag[/font][font=宋体]、[/font][font=Calibri]Fc[/font][font=宋体]、[/font][font=Calibri]GST[/font][font=宋体]、[/font][font=Calibri]MBP[/font][font=宋体]、[/font][font=Calibri]SUMO[/font][font=宋体]、[/font][font=Calibri]Trx [/font][font=宋体]等。我们的科研人员会根据蛋白质的特性和客户的具体要求,为不同蛋白推荐不同表达[/font][font=Calibri]/[/font][font=宋体]纯化标签。一般,[/font][font=Calibri]His[/font][font=宋体]是蛋白纯化的首选标签,它也可以与其他标签构建双标签表达。义翘神州提供广泛的蛋白生产和纯化服务,包括标签去除和内毒素去除等服务。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州提供从基因合成、载体构建到蛋白质表达、纯化的一站式服务,可以根据客户需求,选用不同表达[/font][font=Calibri]/[/font][font=宋体]纯化标签、表达宿主等,真正为客户实现深度私人定制。多种纯化体系,为蛋白表达、纯化提供多种选择,帮助客户最大限度提高研究项目的成功率。如果对上述问题还有疑问,可以参看:[url=https://cn.sinobiological.com/services/recombinant-protein-expression-service][b]重组蛋白表达纯化服务[/b][/url]详情[/font][font=Calibri]https://cn.sinobiological.com/services/recombinant-protein-expression-service[/font][/font][font=宋体] [/font][font=Calibri] [/font]
[font=宋体][font=宋体]重组蛋白是由操作基因[/font][font=Calibri]-[/font][font=宋体]重组基因编码的蛋白,由特异性重组表达系统生产。重组基因是一种新的遗传组合,其中插入了来自不同分子或来自其他物种的一个或多个[/font][font=Calibri]DNA[/font][font=宋体]片段或基因。与天然蛋白相比,重组蛋白可以相对轻松地实现大量生产。[/font][/font][font=宋体] [/font][font=宋体]重组蛋白在细胞因子和生长因子的研究、酶和激酶的研究以及补体系统功能等生物过程方面发挥着重要作用。此外,重组蛋白被称为高效药物,不会产生脱靶副作用,比小分子药物的开发时间更短。[/font][font=宋体] [/font][b][font=宋体]下面是关于重组蛋白资源常见问题解析:[/font][/b][font=宋体] [/font][font=宋体][font=Calibri]1.[/font][font=宋体]蛋白为什么要冻干?冻干对蛋白的影响有哪些?[/font][/font][font=宋体]蛋白质对热敏感,冻干能使绝大部分蛋白质的活性保留下来,提高蛋白的稳定性并延长保存时间,同时降低运费。[/font][font=宋体] [/font][font=宋体][font=Calibri]2.[/font][font=宋体]冻干前为什么向蛋白溶液中加保护剂?一般冻干保护剂有哪几种?[/font][/font][font=宋体][font=宋体]保护剂是用来在冻干和储存过程中保护蛋白的。常用的保护剂或稳定剂有糖类,多元醇,聚合物,表面活性剂,某些蛋白和氨基酸等。我们通常加[/font][font=Calibri]8%[/font][font=宋体](质量比体积)的海藻糖和甘露醇作为冻干保护剂。海藻糖可明显阻止蛋白质二级结构改变以及冻干过程中蛋白质的伸展和聚集;甘露醇也是一种普遍应用的冻干保护剂和填充剂,可以降低某些蛋白的冻干后聚集情况。[/font][/font][font=宋体][font=宋体]温馨提示:对于大多数蛋白,重悬后在[/font][font=Calibri]4[/font][font=宋体]℃仅能短期保存[/font][font=Calibri]([/font][font=宋体]约[/font][font=Calibri]1[/font][font=宋体]周[/font][font=Calibri])[/font][font=宋体]。如想长期保存,请先配制成稀释液[/font][font=Calibri]([/font][font=宋体]其中必须含有载体蛋白,如[/font][font=Calibri]0.1%BSA[/font][font=宋体],[/font][font=Calibri]5%HSA[/font][font=宋体],或[/font][font=Calibri]10%FBS)[/font][font=宋体],然后分装冻存于[/font][font=Calibri]-20[/font][font=宋体]℃或[/font][font=Calibri]-80[/font][font=宋体]℃。一定要避免反复冻融,因每次冻融均会引起蛋白的部分失活。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]3.[/font][font=宋体]如何重构冻干粉?[/font][/font][font=宋体]请查看您的货物随附的分析证书以获取有关重构的确切说明,因为并非所有产品都在相同条件下重构。一般来说,我们建议使用无菌水进行复溶。将推荐体积的无菌水加入小瓶中,轻轻摇晃以完全溶解蛋白质。不要涡旋。[/font][font=宋体] [/font][font=宋体][font=Calibri]4.[/font][font=宋体]为什么我的管内几乎看不见蛋白产品?[/font][/font][font=宋体][font=宋体]蛋白产品中不含载体蛋白或其它添加物[/font][font=Calibri]([/font][font=宋体]如牛血清白蛋白[/font][font=Calibri](BSA)[/font][font=宋体],人血清白蛋白[/font][font=Calibri](HSA)[/font][font=宋体]和蔗糖等,并以最低含盐量的溶液进行冻干时,常常不能形成白色网架结构,而是微量的蛋白在冻干过程中沉积在管内,形成很薄或肉眼不可见的透明蛋白层。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]5.[/font][font=宋体]应如何确定细胞因子的种属交叉活性?[/font][/font][font=宋体][font=Calibri]1)[/font][font=宋体]除少数例外,大多数人类细胞因子对小鼠细胞均有活性。[/font][font=Calibri]2)[/font][font=宋体]许多小鼠细胞因子也可作用于人类细胞,但比活性可能低于对应的人类细胞因子。[/font][font=Calibri]3)IL-7[/font][font=宋体]等为数不多的人类细胞因子作用于小鼠细胞时比对应的小鼠细胞因子活性更强。[/font][font=Calibri]4)[/font][font=宋体]干扰素,[/font][font=Calibri]GM-CSF,IL-3[/font][font=宋体]和[/font][font=Calibri]IL-4[/font][font=宋体]等细胞因子种属特异,对非同源细胞几乎没有活性。[/font][font=Calibri]5)[/font][font=宋体]相反,成纤维细胞生长因子[/font][font=Calibri](FGFs)[/font][font=宋体]和神经营养素[/font][font=Calibri](neurotrophins)[/font][font=宋体]高度保守,在不同动物种属细胞上均具有很好的活性。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]6.[/font][font=宋体]什么是载体蛋白?[/font][/font][font=宋体][font=宋体]载体蛋白如[/font][font=Calibri]HSA[/font][font=宋体]或[/font][font=Calibri]BSA[/font][font=宋体]用于提高重组蛋白的稳定性,并有助于避免产品粘在小瓶壁上。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]7.[/font][font=宋体]我应该如何储存重组蛋白?[/font][/font][font=宋体][font=宋体]对于长期储存,蛋白质溶液应与载体蛋白(例如[/font][font=Calibri]0.1%BSA[/font][font=宋体]或[/font][font=Calibri]0.1%HSA[/font][font=宋体])分装保存,并在[/font][font=Calibri]-20[/font][font=宋体]°[/font][font=Calibri]C[/font][font=宋体]下冷冻保存。请记住,每个冷冻[/font][font=Calibri]/[/font][font=宋体]解冻循环都可能导致蛋白质变性。除非分析证书上另有说明,否则大多数重组蛋白的保质期为一年。如果将它们保存在分析证书上所述的最佳存储条件下,则提供此保证。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]8.[/font][font=宋体]如何确定重组蛋白的数量?为什么我的检测产生的蛋白质数量与您的结果不同?[/font][/font][font=宋体][font=宋体]我们通过[/font][font=Calibri]BCA[/font][font=宋体]、[/font][font=Calibri]SDS-PAGE[/font][font=宋体]、[/font][font=Calibri]HPLC[/font][font=宋体]等方法确定重组蛋白的数量。不同的测定产生不同的量化结果。有时,如果您进行不同的检测,差异可能会很大。蛋白质也有可能在储存过程中形成聚集体,在重组和离心后导致损失。我们对每批产品进行质量控制测试,但是,同一批次中的一些小瓶可能与其他小瓶不同(这种情况很少发生)。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]9.[/font][font=宋体]如何区分重组蛋白、融合蛋白和天然蛋白[/font][/font][font=宋体][font=宋体]重组蛋白是利用基因工程技术产生的,通常是由转基因动物的乳腺产生,其作为生物制药在医学领域中作用显著。利用基因工程技术,可以使哺乳动物本身变成[/font][font=宋体]“批量生产药物的工厂”。方法:是将药用蛋白基因与乳腺蛋白基因的启动子等调控组件重组在一起,通过显微注射等方法,导入哺乳动物(哺乳动物才会泌乳)的受精卵中,然后,将受精卵送入母体内,使其生长发育成转基因动物。转基因动物进入泌乳期后,可以通过分泌的乳汁来生产所需要的蛋白质药品,因而称为动物乳腺生物反应器或乳房生物反应器。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]融合蛋白又称为[/font][font=宋体]“标签蛋白”,常用的标签有[/font][font=Calibri]His[/font][font=宋体]、[/font][font=Calibri]GST[/font][font=宋体]、[/font][font=Calibri]Strep[/font][font=宋体]标签。融合蛋白是通过[/font][font=Calibri]DNA[/font][font=宋体]重组技术将要表达的目的蛋白基因和表达载体上融合蛋白基因相连,通过这种方式表达出来的蛋白质,就是既含有目的基因蛋白又含有融合基因蛋白的重组蛋白。融合蛋白表达是重组蛋白表达的一种策略,融合表达是一种方法。[/font][/font][font=宋体] [/font][font=宋体]天然蛋白质是在自然界中存在的,不经过人工的任何修饰或加工,比如大豆中的蛋白质和病毒表面的蛋白质。[/font][font=宋体] [/font][font=宋体][font=宋体]更多关于[url=https://cn.sinobiological.com/resource/protein-review][b]重组蛋白资源[/b][/url]详情可以参看:[/font][font=Calibri]https://cn.sinobiological.com/resource/protein-review[/font][/font]
[align=center][b][font=宋体]附录Ⅵ[/font][font=Times New Roman] Q[/font][font=宋体]人血白蛋白多聚体测定法[/font][/b][/align][font=宋体][size=3]本法系用分子排阻色谱法测定人血白蛋白多聚体含量。[/size][/font][size=3][font=宋体]照分子排阻色谱法(附录Ⅲ[/font][font=Times New Roman] D[/font][font=宋体])测定。[/font][/size][size=3][b][font=宋体]色谱条件与系统适用性试验[/font][/b][font=Times New Roman] [/font][font=宋体]用亲水硅胶高效体积排阻色谱柱([/font][font=Times New Roman]SEC[/font][font=宋体],排阻极限[/font][font=Times New Roman]300kD[/font][font=宋体],粒度[/font][font=Times New Roman]10[/font][font=宋体]μ[/font][font=Times New Roman]m[/font][font=宋体]),柱直径[/font][font=Times New Roman]7[/font][font=宋体].[/font][font=Times New Roman]5mm[/font][font=Times New Roman],[/font][font=宋体]长[/font][font=Times New Roman]60cm[/font][font=宋体];以含[/font][font=Times New Roman]1[/font][font=宋体]%异丙醇的[/font][font=Times New Roman]pH7[/font][font=宋体].[/font][font=Times New Roman]0 0[/font][font=宋体].[/font][font=Times New Roman]2mol/L[/font][font=宋体]磷酸盐缓冲液[取[/font][font=Times New Roman]0[/font][font=宋体].[/font][font=Times New Roman]5mol/L[/font][font=宋体]磷酸二氢钠[/font][font=Times New Roman]200ml[/font][font=宋体]、[/font][font=Times New Roman]0[/font][font=宋体].[/font][font=Times New Roman]5mol/L[/font][font=宋体]磷酸氢二钠[/font][font=Times New Roman]420ml[/font][font=宋体]、异丙醇[/font][font=Times New Roman]15[/font][font=宋体].[/font][font=Times New Roman]5ml[/font][font=宋体]及水[/font][font=Times New Roman]914.5ml[/font][font=宋体],混匀]为流动相;检测波长为[/font][font=Times New Roman]280nm [/font][font=宋体];流速为每分钟[/font][font=Times New Roman]0[/font][font=宋体].[/font][font=Times New Roman]6ml[/font][font=宋体]。取每[/font][font=Times New Roman]1ml[/font][font=宋体]含蛋白质为[/font][font=Times New Roman]12mg [/font][font=宋体]的人血白蛋白溶液[/font][font=Times New Roman]20[/font][font=宋体]μ[/font][font=Times New Roman]l[/font][font=宋体],注入色谱柱,记录色谱图[/font][font=Times New Roman],[/font][font=宋体]人血白蛋白单体峰与二聚体峰间的分离度应大于[/font][font=Times New Roman]1[/font][font=宋体].[/font][font=Times New Roman]5[/font][font=宋体],拖尾因子按人血白蛋白单体峰计算应为[/font][font=Times New Roman]0[/font][font=宋体].[/font][font=Times New Roman]95[/font][font=宋体]~[/font][font=Times New Roman]1[/font][font=宋体].[/font][font=Times New Roman]40[/font][font=宋体]。[/font][/size][size=3][b][font=宋体]测定法[/font][/b][font=Times New Roman] [/font][font=宋体]取供试品适量,用流动相稀释成每[/font][font=Times New Roman]1ml[/font][font=宋体]约含蛋白质[/font][font=Times New Roman]12mg[/font][font=宋体]的溶液[/font][font=Times New Roman],[/font][font=宋体]取[/font][font=Times New Roman]20[/font][font=宋体]μ[/font][font=Times New Roman]l[/font][font=宋体],注入色谱柱,记录色谱图[/font][font=Times New Roman]60[/font][font=宋体]分钟[/font][s][font=宋体](色谱柱长[/font][/s][s][font=Times New Roman]60cm[/font][/s][s][font=宋体])[/font][/s][font=宋体]。[/font][/size][size=3][color=#fe2419][font=宋体]按面积归一法计算,色谱图中未保留(全排阻)峰的含量[/font][font=Times New Roman](%)[/font][font=宋体]除以[/font][font=Times New Roman]2[/font][font=宋体],即为人血白蛋白多聚体含量。[/font][/color][/size][size=3][font=Times New Roman][b][color=#0021b0]计算方法不是很明白,为什么要除以2 ??? 全排阻的峰指的是哪一个??谢谢[/color][/b][/font][/size]

[img]http://ng1.17img.cn/bbsfiles/images/2008/11/200811031423_116006_1628184_3.jpg[/img]三聚氰胺鸡蛋门再次引起了人们对三聚氰胺添加到饲料中问题的关注。近日,网上爆出“猛帖”———《三聚氰胺冒充蛋白质是中科院发明并推广的》、《添加三聚氰胺是中科院的科研成果?》,怀疑中科院研究生院一位教授研制的“DH蛋白精饲料添加剂”就是三聚氰胺。另一位知名的生物技术专家也因曾研制蛋白精而受到网友的质疑。网友人肉搜索蛋白精 据香港媒体报道,香港中文大学生化系副教授陈竟明说,鸡只不断进食含三聚氰胺的饲料,体内会有残留,甚至聚积在鸡蛋中,估计饲料中的三聚氰胺含量“绝不会低”。 饲料中的三聚氰胺是怎么来的?2007年,出口美国的宠物食品三个月内数十只宠物猫狗死亡。美国食品药品管理局(FDA)的调查已最终确证,位于沛县的江苏徐州安营生物技术开发公司出口到美国的小麦蛋白粉中所含的三聚氰胺是导致宠物死亡的罪魁祸首。 在此次三鹿奶粉事件中,蛋白精一再被认为是三聚氰胺的别名而广为人知。于是,网友们搜索重点便是“蛋白精”三字。他们惊奇地发现,中科院跟这个事儿扯上了关系。 1999年就研制蛋白精? 今年9月12日,网友“敖卖糕”即在“E舟宁波团购网”发了一个帖子:《这位可是三聚氰胺蛋白精的发明人?》。 最近这个帖子被改成了类似《三聚氰胺冒充蛋白质是中科院发明的?》这样的题目广为流传。 帖子只列出了一个名为“DH合成高蛋白饲料添加剂”的介绍。其中提到:“利用有机氮及催化剂合成的高蛋白精料,作为畜禽高蛋白饲料添加剂补充料,具有含氮量高(36%以上,非蛋白250%以上),成本低,来源广等优点。本技术项目的原料为有机化工原料及农用化肥原料;主要生产设备为开口式反应釜或大蒸锅、混合机、精料粉碎机、烘干机。” “技术转让方”还详细地介绍了这个技术的成本。“厂房面积按日产1吨计算为80平方米;设备投资10万元,流动资金10万元。本项目具有投资小、见效快,土法也可上马(产品当地可销售),工艺简单等优点。技术合作转让费1万元,函授费5000元。负责培训1-2名技术人员,长期咨询服务。” 联系单位竟然是“中科院研究生院应用技术研究所”,而联系人叫高银相。发布时间为1999年7月30日。 此外,记者在网上查到,中国科学院老专家技术中心山西工作站于2007年10月发布的首批40项成果转化项目名单中,有一项名为、“DH蛋白精 ”饲料添加剂。简介称:“粗蛋白含量在160%-200%,开创解决了蛋白质资源紧缺的途径,显著降低了饲料厂的生产成本,是目前饲料行业粗蛋白质不足的良好补足剂。”■五问三聚氰胺饲料 问:三聚氰胺是谁发明的? 答:没人发明。三聚氰胺是一种三嗪类含氮杂环有机化合物,被用作化工原料,不存在被发明的问题,德国化学家李比希在1834年最早合成了三聚氰胺。 问:那谁“发明”把三聚氰胺添加到饲料里的? 答:还没有一个权威的说法,公开信息显示,三聚氰胺和饲料联系起来就是去年的美国猫狗死亡案,当时两家中国企业被起诉。其中,徐州安营生物技术开发有限公司2007年初就在网上公开求购“三聚氰胺下脚料”。在采购单说明中,该公司写道:“我们求三聚氰胺下脚料。徐州安营生物技术开发有限公司成立于一九九五年,地处江苏省徐州沛县,交通便利。公司技术实力雄厚,现经营生物饲料、畜禽添加剂、谷朊粉(小麦蛋白)、保鲜蔬菜等多项产品。”———当时没人知道为什么一家经营“生物饲料、畜禽添加剂”的企业会求购化工原料三聚氰胺。 问:我还听说饲料里加尿素,这也可以吗? 答:尿素含氮量为42%~46%,1kg尿素经转化后,可提供相当于约4.5kg豆饼的蛋白质。尿素由于成本低,效果好,当前,普遍采用尿素作为NPN添加在反刍动物饲料中。牛羊胃中微生物分泌的尿素酶活性很强,尿素进入瘤胃后很快会分解完,如不合理使用,可引起反刍畜尿素中毒。 问:如果饲料产品中含有三聚氰胺,其可能来源是什么? 答:存在三种可能性: 一是以“蛋白精”的形式直接在饲料产品中添加; 二是由蛋白原料中加入,即三聚氰胺加入蛋白原料如豆粕、棉粕、酵母或酵母饲料、玉米蛋白饲料和DDGS等,以提高这些蛋白原料的蛋白含量; 三是在饲料种植过程中可能的农药污染、加工环节中自然形成或意外污染。 问:其它国家对饲料中三聚氰胺残留有规定吗? 答:中国农业大学教授李胜利介绍,由于三聚氰胺不是饲料添加剂,不能在饲料中添加,所以目前世界上还没有国家对饲料中的三聚氰胺有残留的限量标准。
[font=宋体]抗体,作为一类特殊的蛋白质,在免疫系统中发挥着至关重要的作用,它们能够特异性地识别并中和外来病原体,如细菌和病毒。而蛋白质,作为生命活动的基础分子,具有多种多样的功能,从酶催化到结构支撑,无所不包。抗体与蛋白的区别在于,抗体是一类具有特定功能的蛋白质,而蛋白质则是更广泛的一类生物分子。本文将深入探讨抗体与蛋白的具体区别,并详细解析抗体蛋白的结构与功能,为读者提供一个全面而深入的理解。[/font][font=宋体] [/font][b][font=宋体]抗体与蛋白的区别?[/font][/b][font=宋体] [/font][font=宋体]定义:[/font][font=宋体][font=宋体]抗体([/font][font=Calibri]antibody[/font][font=宋体])是指机体由于抗原的刺激而产生的具有保护作用的蛋白质。它(免疫球蛋白不仅仅只是抗体)是一种由浆细胞(效应[/font][font=Calibri]B[/font][font=宋体]细胞)分泌,被免疫系统用来鉴别与中和外来物质如细菌、病毒等的大型[/font][font=Calibri]Y[/font][font=宋体]形蛋白质,仅被发现存在于脊椎动物的血液等体液中,及其[/font][font=Calibri]B[/font][font=宋体]细胞的细胞膜表面。抗体能识别特定外来物的一个独特特征,该外来目标被称为抗原。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]抗体是一类能与抗原特异性结合的免疫球蛋白。抗体按其反应形式分为凝集素、沉降素、抗毒素、溶解素、调理素、中和抗体、补体结合抗体等。按抗体产生的来源分为正常抗体(天然抗体),如血型[/font][font=Calibri]ABO[/font][font=宋体]型中的抗[/font][font=Calibri]A[/font][font=宋体]和抗[/font][font=Calibri]B[/font][font=宋体]的抗体,和免疫抗体如抗微生物的抗体。按反应抗原的来源分为异种抗体,异嗜性抗体,同种抗体和自身抗体。按抗原反应的凝集状态分为完全抗体[/font][font=Calibri]IgM[/font][font=宋体]和不完全抗体[/font][font=Calibri]IgG[/font][font=宋体]等。抗体在医疗实践中应用甚为广泛。如用于疾病的预防、诊断和治疗方面都有一定的作用。临床上用丙种球蛋白预防病毒性肝炎、麻疹、风疹等,国际上用抗[/font][font=Calibri]Rh[/font][font=宋体]免疫球蛋白预防因[/font][font=Calibri]Rh[/font][font=宋体]血型不合引起的溶血症。诊断上如类风湿因子用于类风湿性关节炎,抗核抗体([/font][font=Calibri]ANA[/font][font=宋体])、抗[/font][font=Calibri]DNA[/font][font=宋体]抗体用于系统性红斑狼疮,抗精子抗体用于原发性不孕症的诊断等;治疗上如毒素中毒用抗毒治疗以及免疫缺陷性疾病的治疗等。[url=https://cn.sinobiological.com/resource/antibody-technical][b]抗体相关资源[/b][/url][/font][/font][font=宋体] [/font][font=宋体]蛋白:[/font][font=宋体][font=宋体]蛋白质是生命的物质基础,是有机大分子,是构成细胞的基本有机物,是生命活动的主要承担者。没有蛋白质就没有生命。氨基酸是蛋白质的基本组成单位。它是与生命及与各种形式的生命活动紧密联系在一起的物质。机体中的每一个细胞和所有重要组成部分都有蛋白质参与。蛋白质占人体重量的[/font][font=Calibri]16%~20%[/font][font=宋体],即一个[/font][font=Calibri]60kg[/font][font=宋体]重的成年人其体内约有蛋白质[/font][font=Calibri]9.6~12kg[/font][font=宋体]。人体内蛋白质的种类很多,性质、功能各异,但都是由[/font][font=Calibri]20[/font][font=宋体]多种氨基酸([/font][font=Calibri]Amino acid[/font][font=宋体])按不同比例组合而成的,并在体内不断进行代谢与更新。点击查看:[url=https://cn.sinobiological.com/resource/protein-review][b]蛋白相关资源[/b][/url][/font][/font][font=宋体] [/font][b][font=宋体]区别与联系:[/font][/b][font=宋体][font=宋体]蛋白质还是有一定的区别以及关联性的,虽然说抗体是蛋白质,但是蛋白质不一定是抗体。[/font] [font=宋体]主要是因为抗体是通过人体内的浆细胞所产生的,而且还可以喝相应的抗原特异性相互结合,这样在一定程度上就能发挥出蛋白质。[/font][/font][font=宋体] [/font][b][font=宋体]抗体[/font][font=宋体]蛋白[/font][font=宋体]结构[/font][font=宋体]解析[/font][font=宋体]:[/font][/b][font=宋体][font=宋体]抗体是一种免疫球蛋白,由[/font][font=Calibri]B[/font][font=宋体]淋巴细胞产生。抗体的单体是一个[/font][font=Calibri]Y[/font][font=宋体]形的分子,有[/font][font=Calibri]4[/font][font=宋体]条多肽链组成。其中包括两条相同的重链,以及两条相同的轻链,之间由双硫键连接在一起。每条重链[/font][font=Calibri]50kDa[/font][font=宋体],每条轻链[/font][font=Calibri]25kDa[/font][font=宋体],轻重链间存在二硫键链接。[/font][/font][font=宋体] [/font][font=宋体]轻链[/font][font=宋体][font=宋体]轻链包括可变区和恒定区,可变区约占轻链的[/font][font=Calibri]1/2[/font][font=宋体]。[/font][/font][font=宋体] [/font][font=宋体]重链[/font][font=宋体][font=宋体]重链包括可变区和恒定区。根据重链的不同,可以将抗体分为不同的种类,例如哺乳动物[/font] [font=Calibri]Ig [/font][font=宋体]的重链有α、δ、ε、γ和 μ 五种[/font][font=Calibri],[/font][font=宋体]相对应可以将哺乳动物[/font][font=Calibri]Ig[/font][font=宋体]分为 [/font][font=Calibri]IgA[/font][font=宋体]、[/font][font=Calibri]IgD[/font][font=宋体]、[/font][font=Calibri]IgE[/font][font=宋体]、[/font][font=Calibri]IgG [/font][font=宋体]和 [/font][font=Calibri]IgM [/font][font=宋体]五类。[/font][/font][font=宋体] [/font][font=宋体]可变区[/font][font=宋体][font=宋体]抗体分子的[/font][font=Calibri]N[/font][font=宋体]端存在一段氨基酸序列变化较大的区域,该区域称为可变区。可变区中存在可以与抗原特结合的部位,即抗原结合位点。一个抗体有两个抗原结合位点,可以同时结合两个抗原分子。在可变区中有三个区域的序列高度变化,成为高变区([/font][font=Calibri]hypervariable region[/font][font=宋体],[/font][font=Calibri]HVR[/font][font=宋体])又称为抗原互补决定区([/font][font=Calibri]complementarity determining region[/font][font=宋体],[/font][font=Calibri]CDR[/font][font=宋体])。可变区主要通过其[/font][font=Calibri]3[/font][font=宋体]个[/font][font=Calibri]CHR[/font][font=宋体]区形成[/font][font=Calibri]3[/font][font=宋体]个环状结构与抗原特异性结合。可变区中非[/font][font=Calibri]CDR[/font][font=宋体]部分成为骨架区([/font][font=Calibri]framework region[/font][font=宋体],[/font][font=Calibri]FR[/font][font=宋体]),其氨基酸组成和排列变化相对[/font][font=Calibri]CDR[/font][font=宋体]较少。[/font][/font][font=宋体] [/font][font=宋体]恒定区[/font][font=宋体][font=宋体]抗体分子[/font][font=Calibri]C[/font][font=宋体]端氨基酸序列相对稳定,该区域称为恒定区。同一种抗体的恒定区是相同的。抗体轻链的恒定区由一个[/font][font=Calibri]Ig[/font][font=宋体]结构域构成;重链的恒定区由[/font][font=Calibri]3-4[/font][font=宋体]个串联的[/font][font=Calibri]Ig[/font][font=宋体]结构域及一个用于增加灵活性的铰链区构成。[/font][font=Calibri]IgA[/font][font=宋体]、[/font][font=Calibri]IgE[/font][font=宋体]、[/font][font=Calibri]IgG[/font][font=宋体]有三个结构域([/font][font=Calibri]CH1[/font][font=宋体]、[/font][font=Calibri]CH2[/font][font=宋体]、[/font][font=Calibri]CH3[/font][font=宋体]),[/font][font=Calibri]IgD[/font][font=宋体]、[/font][font=Calibri]IgM[/font][font=宋体]有四个结构域([/font][font=Calibri]CH1[/font][font=宋体]、[/font][font=Calibri]CH2[/font][font=宋体]、[/font][font=Calibri]CH3[/font][font=宋体]、[/font][font=Calibri]CH4[/font][font=宋体])。不同种类抗体的铰链区存在一定的差异,[/font][font=Calibri]IgA[/font][font=宋体]的铰链区较短,[/font][font=Calibri]IgD [/font][font=宋体]的铰链区较长,[/font][font=Calibri]IgM [/font][font=宋体]和[/font][font=Calibri]IgE [/font][font=宋体]无铰链区。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]Fab[/font][font=宋体]片段[/font][/font][font=宋体][font=Calibri]IgG[/font][font=宋体]分子在木瓜蛋白酶的作用下可以被降解为两个[/font][font=Calibri]Fab[/font][font=宋体]段及一个[/font][font=Calibri]Fc[/font][font=宋体]段。[/font][font=Calibri]Fab[/font][font=宋体]段由抗体轻链的可变区、轻链的恒定区、重链的可变区及重链恒定区构成。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]Fc[/font][font=宋体]段[/font][/font][font=宋体][font=Calibri]Fc[/font][font=宋体]段包含了所有抗体分子共有的蛋白质序列以及各个类别独有的决定簇。[/font][font=Calibri]Fc[/font][font=宋体]段有多种生物学活性,具有结合补体、结合[/font][font=Calibri]Fc[/font][font=宋体]受体、通过胎盘等作用。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]更多关于[url=https://cn.sinobiological.com/resource/antibody-technical/antibody-structure-function][b]抗体的结构和功能[/b][/url]详情:[/font][font=Calibri]https://cn.sinobiological.com/resource/antibody-technical/antibody-structure-function[/font][/font][font=宋体] [/font][b][font=宋体][font=宋体]义翘神州:蛋白与抗体的专业引领者,欢迎通过百度搜索[/font][font=宋体]“义翘神州”与我们取得联系。[/font][/font][/b]
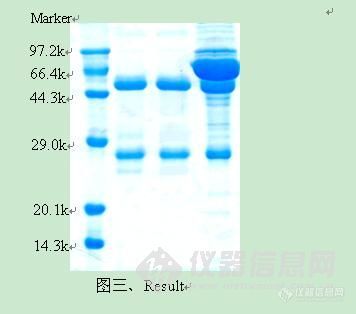
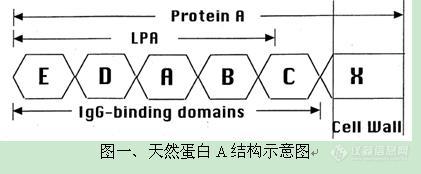
http://simg.instrument.com.cn/bbs/images/brow/em09511.gif一种新型的重组蛋白A柱 洗脱条件温和,充分防止蛋白变性蛋白A是一种金黄色葡萄球菌细胞壁蛋白质,能特异性地与人和哺乳动物抗体(主要是IgG)的Fc区结合。因而,将蛋白A与琼脂糖凝胶以一定的方式结合,可制备用于抗体纯化的亲和填料。早期的蛋白A柱结合的都是天然蛋白A。天然蛋白A由5个IgG结合域和其它未知功能的非Fc结合域组成,分子量约42KD,结构如图一所示。这种柱子对IgG的亲和能力很强,可以吸附大量的lgG。但同时,天然蛋白A的其他非结合域会和非目标蛋白结合,这样被洗脱下来的蛋白质纯度不够,会影响到后续的试验。为了解决这些问题,科学家们运用基因工程技术,克隆出蛋白A的基因,并对其进行改造,除去了一些不重要的非结合域。偶联这种重组蛋白A的琼脂糖凝胶柱在蛋白质纯化中,的确是提高了产物的纯度。目前,市场上绝大部分重组蛋白A柱都是这种产品。但是,纯化时所用的洗脱液一般为pH=2.7的甘氨酸溶液,如果洗脱效果不是很理想,还要降低pH,采用pH=1.9的甘氨酸溶液。由此可见,此法洗脱条件比较剧烈,最后收集的蛋白质很有可能变性,或者是复性困难。 这种洗脱条件剧烈的柱子结合的重组蛋白A一般具有5个串联结构域:E、D、A、B、C。虽然每个域均可以和IgG的Fc段结合,但不同的域结合强度略有差异。因此洗脱条件不均一,而且经常需要较低的pH值。GE的重组蛋白A柱即为这种类型,如图二所示。考虑到减少串联结构域的个数,并且采取同型结构域串联,就可以避免不同结构域与抗体Fc 段亲和性的差异从而使洗脱条件温和而均一,Putus研制出了含有三个串联B结合域的重组蛋白A,如图二所示。同时,我们用Putus重组蛋白A柱和GE重组蛋白A柱纯化人血浆,纯化的结果用于比较两种纯化柱的纯化效果,结果如图三所示。GE Putus 图二、重组蛋白A结构示意图待纯化样品:人血浆实验材料:GE公司的重组蛋白A柱(E、D、A、B、C结构域串联,见图二)Putus公司的重组蛋白A柱(3个B结构域串联,见图二)实验方法:分别按照每个公司的说明书来操作,洗脱条件分别为pH值3.0和4.5, SDS-PAGE检测结果如下: 上图从左边起,泳道1为标准蛋白Marker,泳道2为经过GE填料洗脱后抗体,泳道3为经过Putus填料洗脱抗体,泳道4为人血浆。从图中,我们可以看出,与GE 重组蛋白A填料从人血浆纯化抗体纯度比较,拥有3个同型结构域的Putus填料可以获得同样纯度的抗体。但是,后者的洗脱条件仅为4.5,高于前者的洗脱条件3.0。由此可见,使用具备较少B结构域的重组蛋白A柱也能获得高纯度的IgG,并且洗脱条件温和,能防止蛋白质聚集,保护蛋白质活性。http://cp00a3cee71b5f96adf6e669b5d7f56a9f11.jpg/http://C:\Documents and Settings\adim\桌面\001.jpghttp://ng1.17img.cn/bbsfiles/images/2017/01/201701191653_632703_1672347_3.jpghttp://ng1.17img.cn/bbsfiles/images/2009/12/200912021052_187444_1672347_3.jpghttp://ng1.17img.cn/bbsfiles/images/2009/12/200912021052_187445_1672347_3.jpg
1、C反应蛋白概述 1930年Tillet和Francis在急性大叶性肺炎患者血清中发现一种物质,能在钙离子存在时与肺炎球菌C-多糖起沉淀反应,随后证实这种能与C-多糖反应的物质是一种蛋白质,因而将这种蛋白质命名为C反应蛋白(C-reactive protein,CRP)。 CRP是机体受到微生物入侵或组织损伤等炎症性刺激时肝细胞合成的急性相蛋白(注:急性时相反应包括感染、炎症及创伤时某些血清蛋白浓度的变化,这些蛋白除CRP外,还包括血清淀粉样蛋白A、纤维蛋白原、触珠蛋白、α1酸性糖蛋白、铜蓝蛋白、α1抗胰蛋白酶等。其中CRP在健康人血清中浓度<5mg/L,而在细菌感染或组织损伤时,浓度可升高上千倍,循环中的CRP半衰期为19小时,故被认为其最有价值),由五个相同的亚基依靠非共价键形成的环状五聚体,这一特征性结构使其归类于五聚素(一组具有免疫防御特性的钙结合蛋白)家族。CRP是机体非特异性免疫机制的一部分,它结合C-多糖,在Ca2+存在时可结合细胞膜上磷酸胆碱,可激活补体的经典途径,增强白细胞的吞噬作用,调节淋巴细胞或单核/巨噬系统功能,促进巨噬细胞组织因子的生成,在动脉粥样硬化斑块中也可检测到CRP。 人CRP主要生物学功能: 通过与配体(凋亡与坏死的细胞,或入侵的细菌、真菌、寄生虫等的磷酰胆碱)结合,激活补体和单核吞噬细胞系统,将载有配体的病理物质或病原体清除。 (1)识别外来物质,激活补体系统; (2)增强条理作用,增强吞噬细胞吞噬作用; (3)与血小板激活因子(RAF)结合,降低炎症反应; (4)与染色体结合,消除坏死组织里的细胞DNA。
蛋白质是一类重要的营养素,它的存在与生命的各种活动紧密联系,例如参与机体的构成及机体的代谢,参与遗传信息构成和代谢,同时也为机体提供热量。 蛋白质的种类极其繁多,不同食物来源的蛋白质,能被人体消化、吸收和利用的程度也不同,也就是说,不同种类的蛋白质其营养价值有所区别,而决定蛋白质营养价值的主要因素是蛋白质中必需氨基酸的种类和含量。氨基酸评分(AAS)是测评蛋白质中必需氨基酸种类和含量的一个常用指标。蛋白质含有的氨基酸之所以会有不同,与蛋白质的来源有很大的关系。蛋白质主要来源于动物性食物与植物性食物,动物性蛋白质和植物性蛋白质所含的氨基酸是不同的,这即意味着它们的营养价值也有差异。动物性蛋白质主要来源于禽、畜及鱼类等的肉、蛋、奶。其蛋白质构成以酪蛋白为主(78~85%),能被成人较好地吸收与利用。更重要的是,动物性蛋白质的必需氨基酸种类齐全,比例合理,因此比一般的植物性蛋白质更容易消化、吸收和利用,营养价值也相对高些。一般来说,肉类(如鱼肉、牛肉)蛋白质和奶类中的蛋白质,其氨基酸评分均在0.9~1.0的水平。植物性蛋白质主要来源于米面类、豆类,但是米面类和豆类的蛋白质营养价值不同。米面类来源的蛋白质中缺少赖氨酸(一种必需氨基酸),因此其氨基酸评分较低,仅为0.3~0.5,这类蛋白质被人体吸收和利用的程度也会差些。当然,这种不足可以通过科学的方法加以改善,例如在米面中适当加入富含赖氨酸的豆类食品,则可明显提高蛋白质的氨基酸评分。 在众多的植物性蛋白质中,营养价值最高的是豆类蛋白质(又称大豆蛋白),而且豆类食物不含胆固醇,这是动物性食物所不具备的特点。没有经过任何加工的大豆蛋白质有它的缺陷:蛋氨酸(一种必需氨基酸)含量相对较少。因此,整粒大豆的氨基酸评分大约为0.6~0.7。

结构生物学是用物理学方法在原子水平阐明生物大分子的三维结构,进而诠释生物大分子的生物学功能及其分子机制的科学。近几年,冷冻电镜在生物物理,特别是结构生物学领域掀起了一轮新的革命。冷冻电镜技术包括单颗粒技术和原位冷冻电镜技术,2017年单颗粒技术已获得诺贝尔奖,放眼未来,冷冻电镜更多的是要应用于获取细胞和组织样品的原位信息,尤其是利用冷冻电镜电子断层扫描成像技术(Cryo-ET)获得三维图像,将细胞内的生命过程可视化,在原位对生物大分子的结构进行解析,并进一步分析其与所处周围环境之间的相互作用关系,进而阐明其发挥功能的分子机制。蛋白质聚集是许多神经退行性疾病的典型症状,包括帕金森病(Parkinson’sdisease)、亨廷顿病(Huntington’sdisease)、以及肌萎缩侧索硬化症(amyotrophiclateral sclerosis)等,至今为止还没有针对这类疾病的有效治疗方案,因此了解这类疾病的致病机理尤为重要。在细胞内表达这些疾病相关的蛋白会导致细胞毒性以及形成大的胞内包涵体,然而这些包涵体的具体致病机理还不清楚,而且这些包涵体的组成以及其精细的细胞原位结构信息也无人知晓。为了回答这一科学问题,德国马克斯普朗克生物化学研究所Baumeister教授组的研究人员利用先进的冷冻电镜光电关联技术(Cryo-CLEM)、冷冻聚焦离子束切割技术(Cryo-FIB)、以及冷冻电子断层扫描三维重构技术(Cryo-ET),在小鼠原代神经细胞原位解析了亨廷顿基因1号外显子中衍生的多聚谷氨酰胺(polyQ)所形成的包涵体及其微环境的原位精细结构,相关结果发表在2017年9月的Cell杂志。他们发现polyQ包涵体是由淀粉样肽的纤维构成,与细胞的内膜系统特别是内质网相互作用,使内质网膜发生形变并扰乱其组成,还改变了包涵体周围的内质网膜的动态性。该研究结果暗示淀粉样肽的纤维和内质网的异常相互作用导致了蛋白质聚集物所产生的细胞毒性。[align=center][img=,690,424]https://ng1.17img.cn/bbsfiles/images/2018/11/201811271518599236_8463_3224499_3.jpg!w690x424.jpg[/img][/align]2018年3月,该研究组在PNAS杂志发表在酵母系统内的polyQ原位分子的结构解析,他们发现在酵母细胞内polyQ蛋白聚集体形成了无定形的包涵体以及少量的纤维丝,并使线粒体和脂滴的形态发生变形。对比这两种不同的机体系统下的差异,我们可以看到同样的polyQ蛋白聚集体在不同的环境中采用了不同的构像并利用特定的机制来靶向不同的细胞结构,从而产生细胞毒性。[align=center][img=,690,770]https://ng1.17img.cn/bbsfiles/images/2018/11/201811271519325828_4209_3224499_3.jpg!w690x770.jpg[/img][/align]另外,2018年2月的Cell杂志报道了该研究组在大鼠神经细胞原位解析了一种重复短肽(poly-GA)蛋白聚集体及其微环境的结构,不同于polyQ形成的纤维状结构,poly-GA聚集体是由平面扭曲的长短不一的丝带状结构组成。poly-GA聚集体大量募集了26S蛋白酶体复合物,而其他生物大分子如核糖体或分子伴侣却被排除在聚集体外部。与poly-GA的直接相互作用使蛋白酶体处于失活状态,虽然在整体水平上细胞内的蛋白酶体表达量没有变化,但有功能的蛋白酶体的数量大幅减少,揭示了蛋白质聚集物所产生细胞毒性的另一原因。[align=center][img=,690,378]https://ng1.17img.cn/bbsfiles/images/2018/11/201811271519469883_8555_3224499_3.jpg!w690x378.jpg[/img][/align]Baumeister教授组是Cryo-CLEM、Cryo-FIB以及Cryo-ET等关键技术方法发展的开拓者和领航者。Cryo-CLEM-FIB-ET即是在整个细胞内定位荧光标记的特定目标分子,观察其动态变化并在感兴趣的时刻进行快速冷冻,然后转移到冷冻扫描电镜利用冷冻聚焦离子束进行光电关联匹配,精确定位目标分子位置并进行聚焦离子束切割产生一层100-200nm厚的切片,最后利用冷冻电子断层扫描成像从原子分辨率上解析其未被破坏的天然原位结构信息。目前冷冻光电关联的一大瓶颈是光镜的分辨率较低,虽然超分辨光电关联技术在飞速发展,但是其缺点如高强度激光照射可能使样品升温,成像速度慢等还需要一一克服。超分辨光电关联令人振奋的一大潜在应用是来精确指导冷冻聚焦离子束切割,使得大的细胞样品中的任何感兴趣目标分子都能被精确定位切割,进而进行高分辨率数据收集。另外,随着技术进一步发展,用高电子密度标签来标记目标分子并在电镜下直接成像也将会成为可能。结构生物学的终极目标是了解细胞生命过程中每一个分子的结构、功能以及它们之间的相互作用,Cryo-CLEM-FIB-ET则是在结构生物学与细胞生物学之间架起的一座桥梁,让细胞内的微观生命动态过程可视化![b]参考文献[/b]1. Bauerlein,F. J. B., et al. 2017. In Situ Architecture and Cellular Interactions of PolyQInclusions. Cell 171(1): 179-187.2. Guo, Q., etal. 2018. In Situ Structure of Neuronal C9orf72 Poly-GA Aggregates RevealsProteasome Recruitment. Cell 172(4): 696-705.3. Gruber, A.,et al. 2018. Molecular and structural architecture of polyQ aggregates inyeast. Proc Natl Acad Sci U S A. .4. Wolff, G.,et al. 2016. Towards correlative super-resolution fluorescence and electroncryo-microscopy. Biol Cell 108(9): 245-258.Oikonomou, C. M. 2017. Cellular ElectronCryotomography: Toward Structural Biology In Situ. Annu Rev Biochem 20(86):873-896.来源:【生物成像中心】
[b][font=宋体]整合蛋白和跨膜蛋白定义:[/font][/b][font=宋体] [/font][font=宋体]整合蛋白和跨膜蛋白是两类重要的蛋白质,它们在细胞分子水平上起着重要的作用。[/font][font=宋体] [/font][font=宋体]整合蛋白,也称为内在蛋白或跨膜蛋白,部分或全部镶嵌在细胞膜中或内外两侧,以非极性氨基酸与脂双分子层的非极性疏水区相互作用而结合在质膜上。它们是生物膜的基本结构成分,许多具重要生理功能的膜蛋白均属整合蛋白,如膜结合的酶类、载体蛋白、通道蛋白、膜受体等。[/font][font=宋体] [/font][font=宋体]跨膜蛋白,是可以跨越细胞膜的蛋白,它在细胞的信号传递系统中担当着重要的角色。跨膜蛋白在结构上可以分为单次跨膜、多次跨膜、多亚基跨膜等,它们具有能够跨越细胞膜的能力。[/font][font=宋体] [/font][b][font=宋体]整合蛋白和跨膜蛋白在位置、结构和功能上存在显著的差异[/font][/b][font=宋体] [/font][font=宋体]①位置:整合蛋白主要存在于细胞质内,细胞核或其他非细胞膜结构中,它们容易在细胞中自由移动。而跨膜蛋白则嵌入细胞膜中,一部分位于细胞膜的胞外侧,另一部分位于细胞膜的胞内侧,形成了一个穿过细胞膜的通道。[/font][font=宋体][font=宋体]②结构:整合蛋白的结构通常由两个独立的部分组成,一个是靠近细胞膜的膜结合区域([/font][font=Calibri]TM[/font][font=宋体]),另一个是靠近细胞骨架的非膜结合区域([/font][font=Calibri]N-TM[/font][font=宋体])。当接受到外界的信号时,整合蛋白的[/font][font=Calibri]TM[/font][font=宋体]区域会被激活,把来自外界的信号转化为细胞内可以识别的信号,直接参与细胞信号传导系统中。[/font][/font][font=宋体]③功能:整合蛋白主要是用来从外界传达信号到细胞内,充当细胞与外界信号的桥梁。而跨膜蛋白则在细胞的信号传递系统中担当着重要的角色。[/font][font=宋体]总的来说,整合蛋白和跨膜蛋白在位置、结构和功能上存在显著的差异,这些差异使得它们在生物体中扮演着不同的角色。[/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州提供[url=https://cn.sinobiological.com/resource/protein-review/transmembrane-proteins][b]跨膜蛋白表达与制备服务[/b][/url],制备流程图:基因合成[/font][font=宋体]→载体构建→细胞转化[/font][font=Calibri]/[/font][font=宋体]转染→蛋白表达→细胞收集→细胞破碎→膜脂提取→膜脂增溶→蛋白纯化→质量检测,同时义翘拥有[/font][/font][b][font=宋体]三大跨膜蛋白制备平台[/font][/b][font=宋体],可以为客户提供全面的多次跨膜蛋白产品和服务。同时,为基础研究和药物研发提供更加优质的原材料。[/font][font=宋体] [/font][b][font=宋体][font=Calibri]VLP[/font][font=宋体]技术平台[/font][/font][/b][font=宋体][font=宋体]正确折叠的膜蛋白在细胞膜上表达,类病毒颗粒[/font][font=Calibri]VLP[/font][font=宋体]通过出芽的方式包裹上携带有靶标蛋白的细胞膜,形成包膜的[/font][font=Calibri]VLP[/font][font=宋体]。它是由病毒的衣壳蛋白通过自组装而形成的纳米级颗粒(直径约[/font][font=Calibri]100[/font][font=宋体]~[/font][font=Calibri]300[/font][font=宋体]纳米),不含病毒核酸,不能进行自主复制,生产操作过程中较为安全。产生的[/font][font=Calibri]VLP[/font][font=宋体]蛋白可直接像可溶蛋白一样进行包被进行[/font][font=Calibri]ELISA[/font][font=宋体]检测。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州已成功开发[/font][font=Calibri]VLP[/font][font=宋体]技术平台,它可以将完整天然构象的膜蛋白展示在类病毒颗粒表面,这种方法不仅可以保留膜蛋白的完整结构,同时也能够真实地模拟其在细胞膜上的位置和构象。[/font][/font][font=宋体] [/font][b][font=宋体]去垢剂技术平台[/font][/b][font=宋体][font=宋体]由于存在疏水结构域,跨膜蛋白与膜的结合非常紧密,需要用去垢剂([/font][font=Calibri]detergent[/font][font=宋体])才能从膜上洗涤下来,[/font][font=Calibri]Detergent[/font][font=宋体]作为一种两亲性分子,疏水尾部包裹目的蛋白的疏水区域,亲水头部位于与溶液接触的界面。微团的形成是膜蛋白增溶的基础,当去垢剂浓度高于[/font][font=Calibri]CMC[/font][font=宋体]([/font][font=Calibri]Critical micelle concentration[/font][font=宋体],临界胶束浓度)时会形成微团,增溶后,去垢剂将蛋白周围的磷脂置换,从而实现收集目标膜蛋白的目的,后续再进行蛋白纯化,最终蛋白呈现在含有[/font][font=Calibri]Detergent[/font][font=宋体]的溶液中。义翘神州成功搭建了去垢剂技术平台,利用该平台可有效提高跨膜蛋白的产量和纯度。[/font][/font][font=宋体] [/font][b][font=宋体][font=Calibri]Nanodisc[/font][font=宋体]技术平台[/font][/font][/b][font=宋体][font=Calibri]Nanodisc[/font][font=宋体]结构稳定,与天然的生物膜非常相似,使得[/font][font=Calibri]Nanodisc[/font][font=宋体]能够很好地应用于膜蛋白的研究。目前[/font][font=Calibri]Nanodisc[/font][font=宋体]平台有[/font][font=Calibri]2[/font][font=宋体]种方式,一种是基于苯乙烯马来酸酐共聚物([/font][font=Calibri]SMA[/font][font=宋体])组装的[/font][font=Calibri]SMA-Nanodisc[/font][font=宋体]平台,如下图(左)所示,它可以直接从细胞膜上提取膜蛋白,使其变为可溶性蛋白,组装完成的蛋白样品很稳定,更能维持蛋白的天然构象。另一种是基于膜骨架蛋白([/font][font=Calibri]MSP[/font][font=宋体])的[/font][font=Calibri]MSP-Nanodisc[/font][font=宋体]平台(下图右),它需要先将膜蛋白利用去垢剂制备出来,然后再加入磷脂分子和[/font][font=Calibri]MSP[/font][font=宋体]进行组装。通过调整磷脂、[/font][font=Calibri]MSP[/font][font=宋体]和待组装膜蛋白三者的比例,可以使得待组装膜蛋白在[/font][font=Calibri]Nanodisc[/font][font=宋体]中呈不同聚集状态。义翘神州已成功搭建了[/font][font=Calibri]Nanodisc[/font][font=宋体]技术平台,利用跨膜蛋白与磷脂结合能够维持其良好活性的特性,制备出稳定的产品,满足动物免疫、抗体筛选、[/font][font=Calibri]cell-based assays[/font][font=宋体]等场景。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]详情可以关注:[/font][font=Calibri]https://cn.sinobiological.com/resource/protein-review/transmembrane-proteins[/font][/font]
[font=宋体][url=https://cn.sinobiological.com/resource/protein-review/protein-purification-protocol][b]蛋白纯化[/b][/url]是生物实验室和制药工业中至关重要的技术。它涉及从复杂的混合物中分离出目标蛋白质,同时保持蛋白质的结构和功能。了解蛋白纯化的原理和步骤不仅有助于提高实验效率,还可以降低实验失败的风险。在本篇文章中,我们将详细介绍蛋白纯化的定义、原理和步骤。[/font][font=宋体] [/font][font=宋体][b]蛋白纯化定义及原理[/b][/font][font=宋体] [/font][font=宋体]蛋白纯化是生物研究常用的一种技术,是指从蛋白混合物中得到纯度较高的某种蛋白的过程。根据样本和杂质的特性选择适合的纯化方法,纯化技术的选择要简单化,并且要产生最佳的纯化效果。如果纯度的要求很高,再增加一个离子交换或疏水作用色谱的额外中间步骤。不过尽量尝试使用尽可能少的步骤,因为步骤增多会降低总蛋白产出量。亲和步骤常用重力柱,有时其他色谱步骤中会使用恒压泵,然而蛋白纯化系统将提供更多的控制,可获得更详细的目标蛋白和杂质信息,并为色谱柱提供更好的保护。[/font][font=宋体] [/font][font=宋体][b]可溶性蛋白纯化的步骤[/b][/font][font=宋体] [/font][font=宋体]用于分离可溶性重组或非重组蛋白的分离方法取决于蛋白的内在生理化学特性(被标记蛋白除外)。典型的纯化方案如下所示(使用离子交换色谱法)。[/font][font=宋体] [/font][font=宋体][font=Calibri]1[/font][font=宋体]、细胞裂解液[/font][/font][font=宋体]澄清裂解液[/font][font=宋体][font=宋体]离心([/font][font=Calibri]60000[/font][font=宋体]×[/font][font=Calibri]g[/font][font=宋体],[/font][font=Calibri]90 [/font][font=宋体]分钟)过滤或脱盐和交换缓冲液[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]2[/font][font=宋体]、澄清裂解液[/font][/font][font=宋体]①用亲和法[/font][font=宋体][font=宋体]([/font][font=Calibri]1[/font][font=宋体])进行[/font][font=Calibri]DEAE-Sepharose[/font][font=宋体]离子交换[/font][/font][font=宋体]交换缓冲液[/font][font=宋体] [/font][font=宋体][font=宋体]([/font][font=Calibri]2[/font][font=宋体])进行离子交换[/font][/font][font=宋体][font=宋体]? 弱阳离子[/font][font=Calibri]-[/font][font=宋体]羧甲基[/font][/font][font=宋体][font=宋体]? 强阳离子[/font][font=Calibri]-[/font][font=宋体]甲基磺酸盐[/font][/font][font=宋体][font=宋体]? 强阴离子[/font][font=Calibri]-[/font][font=宋体]季铵盐[/font][/font][font=宋体][font=宋体]? 弱阴离子[/font][font=Calibri]-[/font][font=宋体]二乙氨基乙基[/font][/font][font=宋体]? 磷酸纤维素[/font][font=宋体] [/font][font=宋体][font=宋体]([/font][font=Calibri]3[/font][font=宋体])用其他色谱方法[/font][/font][font=宋体]? 染料基质[/font][font=宋体]? 疏水[/font][font=宋体]? 羟磷灰石[/font][font=宋体]? 层析聚焦[/font][font=宋体] [/font][font=宋体]②浓缩[/font][font=宋体] [/font][font=宋体]③进行凝胶过滤[/font][font=宋体]④无菌过滤[/font][font=宋体] [/font][font=宋体][font=Calibri]3[/font][font=宋体]、经纯化的蛋白[/font][/font][font=宋体] [/font][font=宋体][b]包涵体蛋白的折叠与纯化[/b][/font][font=宋体]在大肠杆菌中表达的重组蛋白位于细胞裂解后低速颗粒部分,它们高度聚集。包涵体通常来自于细胞质(或细胞周质,如使用了分泌载体)中的蛋白聚集。如前所述,由于与细菌核酸的相互作用,蛋白也可以位于低速或高速颗粒部分中。[/font][font=宋体] [/font][font=宋体][font=宋体]采用蛋白变性剂提取蛋白,如盐酸胍[/font][font=Calibri](Gu[/font][font=宋体][/font][font=Calibri]HCl)[/font][font=宋体]、尿素或有机酸。使用还原剂二硫苏糖醇[/font][font=Calibri](DTT)[/font][font=宋体]防止人工二硫键形成(尤其是分子间键)。变性后的蛋白可以通过各种方法纯化后再折叠,也可以直接折叠。通常建议在折叠前进行一些纯化(如[/font][font=Calibri]Gu[/font][font=宋体][/font][font=Calibri]HCl[/font][font=宋体]中的凝胶过滤),因为这往往会带来更高的折叠产率。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]原文转载:[/font][font=Calibri]https://cn.sinobiological.com/resource/protein-review/protein-purification-protocol[/font][/font]
朊蛋白与免疫系统相互作用的新发现http://www.bioon.com/biology/UploadFiles/201112/2011123113381385.jpg 12月29日,据《每日科学》报道,痒病是一种神经退行性疾病,它可以作为其他由蛋白积累致组织畸形(蛋白质病)疾病的模型,如阿尔兹海默氏病和帕金森氏病。有关这些基因的许多问题仍然悬而未决。在一个新的博士论文研究中,发现了数个与阮蛋白(PrPSc,与疾病的发展有关)摄取相关的因子以及朊蛋白是如何与肠道内的免疫细胞相互作用。 羊瘙痒病属于一组被称为"传染性海绵状脑病(TSE)"的疾病,因为它们可以在动物个体之间传播,并导致大脑产生海绵状、退行性改变。这些疾病不仅折磨羊,还折磨牛(牛海绵状脑病,又称疯牛病,BSE)、鹿(鹿慢性消耗性疾病,又称疯鹿病,CWD)以及人类(克雅氏病CJD)。它们在一定程度上也可以在物种见传播,在20世纪90年代,超过200人经由食物感染而患上了克雅氏病。 传染性海绵状脑病(TSE),或者称阮病毒疾病,被认为是感染了一种能致病的蛋白质变体--朊蛋白,它是机体细胞的正常组成部分,在脑中含量最为丰富。一般而言,阮病毒疾病可能是传染的、遗传的或偶发/自发的。当正常的朊蛋白突变成致病的变种,疾病便发生了,变种朊蛋白在空间结构上与健康的朊蛋白不同。由于变种的朊蛋白具有不同的空间结构,机体细胞很难降解它,因此它就一直在积累。 因为朊蛋白(PrPSc)是在疾病早期在肠道系统的淋巴组织中被发现,推测它是经由肠胃道传染。在兽医学家Caroline Piercey Akesson博士研究杂交仪期间,研究了朊蛋白在肠道内的吸收,从而对疾病发展的早期阶段所发生的过程有了新的了解。与早先的推测相反,她通过免疫电镜证明阮蛋白不是直接从肠道转运到肠道相关的的淋巴组织。相反,她发现朊蛋白自由地穿过或穿进肠道淋巴组织之外的淋巴细胞。 树突状细胞据推测发挥着"看门人"的作用,它决定机体能容忍什么以及当面对外来物时该策划哪一种免疫防御反应。Akeeson的目标之一就是树突细胞与朊蛋白摄取之间的相互作用。首先,需要了解正常的羊肠道内树突状细胞的特点;其次,去调查哪一类型的细胞与阮病毒的摄取有关。 她的研究结果表明,不是树突状细胞,而是巨噬细胞负责朊蛋白的摄取。Akesson的研究揭示,朊蛋白利用了肠道中大分子物质摄取的正常生理通道,这可能对机体的免疫监视系统有显著影响。一个可能的后果就是免疫耐受被激活,从而阻碍了肠道对所吸收的朊蛋白的正常免疫反应。 今后的研究能够揭示免疫细胞是如何运输朊蛋白及机体是如何处理朊蛋白,这将具有非常重要的意义,不仅是为了提供更多的关于痒病的知识,还为研究人类和其他动物中神经退行性蛋白质病提供重要见解。 Caroline Piercey Akesson于12月20日在挪威兽医科学系进行了博士论文答辩,论文的题目是:研究阮病毒的摄取及其与羊肠道中免疫细胞的早期相互作用。
许多人喝牛奶是为了补钙,不过你如果留心一下国内鲜牛奶包装上的标注,一般没有列出钙的含量,标明的营养成分含量只有两种:脂肪和蛋白质。鲜牛奶有全脂、低脂、脱脂之分,其脂肪含量各不相同,而且在脂肪被视为健康杀手的今天,一般人不会在乎脂肪含量是否达标。蛋白质才是牛奶中的主要营养成分,鲜牛奶包装上都会注着蛋白质含量为100毫升≥2.9克,以表明符合鲜牛奶的国家标准(100毫升≥2.95克)。 生鲜牛奶的蛋白质含量一般在3%以上,所以一般都能达到国家标准,除非往原奶中兑水。要提防有人拿水卖出奶价钱,就有必要在收购生鲜牛奶时检测蛋白质的含量。根据蛋白质的化学性质,有几种检测方法,各有优缺点。食品工业上普遍采用的、被定为国家标准的是凯氏定氮法。这是19世纪后期丹麦人约翰凯达尔发明的方法,原理很简单:蛋白质含有氮元素,用强酸处理样品,让蛋白质中的氮元素释放出来,测定氮的含量,就可以算出蛋白质的含量。牛奶蛋白质的含氮率约16%,根据国家标准,把测出的氮含量乘以6.38,就是蛋白质含量。 所以凯氏定氮法实际上测的不是蛋白质含量,而是通过测氮含量来推算蛋白质含量,显然,如果样品中还有其他化合物含有氮,这个方法就不准确了。在通常情况下,这不是个问题,因为食物中的主要成分只有蛋白质含有氮,其他主要成分(碳水化合物、脂肪)都不含氮,因此凯氏定氮法是一种很准确的测定蛋白质含量的方法。但是如果有人往样品中偷加含氮的其他物质,就可以骗过凯氏定氮法获得虚假的蛋白质高含量,用兑水牛奶冒充原奶。 常用的一种冒充蛋白质的含氮物质是尿素。不过尿素的含氮量不是很高(46.6%),溶解在水中会发出刺鼻的氨味,容易被觉察,而且用一种简单的检测方法(格里斯试剂法)就可以查出牛奶中是否加了尿素。所以后来造假者就改用三聚氰胺了。三聚氰胺含氮量高达66.6%(含氮量越高意味着能冒充越多的蛋白质),白色无味,没有简单的检测方法(要采用“高效液相色谱”这种高科技去检测),是理想的蛋白质冒充物。三聚氰胺是一种重要的化工原料,广泛用于生产合成树脂、塑料、涂料等,目前的价格大约是1吨12000元。在生产三聚氰胺过程中,会出现废渣,废渣中还含有70%的三聚氰胺。造假者用来冒充蛋白质的就是三聚氰胺渣,国内有不少“生物技术公司”在网上推销“蛋白精”,其实就是三聚氰胺渣。在饲料、奶制品中添加“蛋白精”冒充蛋白质,已成了公开的秘密,它的流行让这种本来免费的化工废料的价格攀升到了1吨300~400元。 三聚氰胺是怎么加到牛奶中的呢?有两种可能途径。一种是奶站加到原奶中。这样做有一定的局限,因为三聚氰胺微溶于水,常温下溶解度为3.1克/升。也就是说,100毫升水可以溶解0.31克三聚氰胺,含氮0.2克,相当于1.27克蛋白质,由此可以算出,要达到100毫升≥2.95克蛋白质的要求,100毫升牛奶最多只能兑75毫升水(并加入0.54克三聚氰胺)。另一种途径是在奶粉制造过程中加入三聚氰胺,这就不受溶解度限制了,想加多少都可以。 三聚氰胺在国内之所以被当成了“蛋白精”来用,可能是因为觉得它毒性很低,吃不死人。大鼠口服三聚氰胺,半致死量(毒理学常用指标,指能导致一半的实验对象死亡)大约为每千克体重3克,和食盐相当。大剂量喂食大鼠、兔、狗也未观察到明显的中毒现象。三聚氰胺进入体内后似乎不能被代谢,而是从尿液中原样排出,但是,动物实验也表明,长期喂食三聚氰胺能出现以三聚氰胺为主要成分的肾结石、膀胱结石,并诱发膀胱癌。2007年,从中国出口到美国的宠物食品导致许多宠物肾衰竭死亡,调查表明可能是因为宠物食品中混入了三聚氰胺导致的。那么三聚氰胺是否也会对人有同样的毒性?我们无法拿人体做试验,而即使患肾结石的人曾经服用过偷加了三聚氰胺的食物,也很难确定三聚氰胺就是罪魁祸首,除非患者的食物来源很单一,例如只吃配方奶粉的婴儿——没想到还真有人敢拿婴儿来做试验证明了它能吃死人! 有人认为既然蛋白质检测法的缺陷导致了致命的造假,还不如干脆取消蛋白质检测,默许牛奶兑水得了。其实凯氏定氮法的缺陷并不难弥补,只要多一道步骤即可:先用三氯乙酸处理样品。三氯乙酸能让蛋白质形成沉淀,过滤后,分别测定沉淀和滤液中的氮含量,就可以知道蛋白质的真正含量和冒充蛋白质的氮含量。这是生物化学的常识,也早成为检测牛奶氮含量的国际标准(ISO 8968)。“蛋白精”骗局在国内出现已有一些年头,“三鹿奶粉”事件不过是把这一“行业秘密”摆在了公众面前。只有改进国家标准,堵住漏洞,才能挽回人们对国产乳业的信心。2008.9.14(《中国青年报》2008.9.17)转自方舟子博客
为何添加三聚氰胺 三聚氰胺分子式为C3N3(NH2)3,又名氰尿酰胺,俗称蜜胺,是一种有机化工中间体,日常主要用途是与醛缩合,生成三聚氰胺-甲醛树脂,用于涂料、层压板、模塑料、粘合剂、纺织和造纸等,此外还可用于皮革鞣制、阻燃化学品以及脱漆剂等。不法厂商在植物蛋白粉中添加三聚氰胺的前提之一是,三聚氰胺物理性状为“白色单斜晶体、无味”,这与蛋白粉相仿。前提之二,此物质易于购买,也易于生产,成本很低。符合这两个前提的化学物质较多,而三聚氰胺含氮量高才是最根本原因。据业内专业人员介绍,目前,国际上使用最多的饲料蛋白质含量检测办法为“凯氏定氮法”,即测定受检饲料中氮所占的比例,再乘以一定系数得到蛋白质含量。南京大学高分子化学教授谌东中解释说,蛋白质主要由氨基酸组成,其含氮量一般不超过30%,而三聚氰胺的分子式显示,其含氮量为66%左右。由于“凯氏定氮法”只能测出含氮量,并不能区别饲料中有无合规添加剂或违规化学物质,所以,加了三聚氰胺的饲料理论上可以测出较高的“蛋白质含量”。但是,三聚氢胺本身无法替代蛋白质,几乎没有任何营养价值。加了这种物质,造成的只是蛋白质含量提高的假象。三聚氰胺并非惟一的替代添加物,很多厂商用三聚氢胺拉高饲料蛋白质含量后,再加入低价的淀粉等,作低蛋白质含量。以上两种操作,从经济上讲都有较大套利空间。出于相同的原理,只要含氮量大于普通植物蛋白质的化学物质,且性状和价格具备条件,在理论上都存在被不法厂商利用的可能性。《精细有机化工原料及中间体手册》显示,三聚氰胺“本品低毒,无刺激性……高温下可能分解产生氰化物(有较大毒性),故应避免高温”。由国际化学品安全规划署和欧洲联盟委员会合编的《国际化学品安全手册》(第三卷),对三聚氰胺则有如下描述:“长期或反复接触作用:该物质可能对肾发生作用”。三聚氰胺分子式为C3N3(NH2)3,又名氰尿酰胺,俗称蜜胺,是一种有机化工中间体,日常主要用途是与醛缩合,生成三聚氰胺-甲醛树脂,用于涂料、层压板、模塑料、粘合剂、纺织和造纸等,此外还可用于皮革鞣制、阻燃化学品以及脱漆剂等。不法厂商在植物蛋白粉中添加三聚氰胺的前提之一是,三聚氰胺物理性状为“白色单斜晶体、无味”,这与蛋白粉相仿。前提之二,此物质易于购买,也易于生产,成本很低。符合这两个前提的化学物质较多,而三聚氰胺含氮量高才是最根本原因。据业内专业人员介绍,目前,国际上使用最多的饲料蛋白质含量检测办法为“凯氏定氮法”,即测定受检饲料中氮所占的比例,再乘以一定系数得到蛋白质含量。南京大学高分子化学教授谌东中解释说,蛋白质主要由氨基酸组成,其含氮量一般不超过30%,而三聚氰胺的分子式显示,其含氮量为66%左右。由于“凯氏定氮法”只能测出含氮量,并不能区别饲料中有无合规添加剂或违规化学物质,所以,加了三聚氰胺的饲料理论上可以测出较高的“蛋白质含量”。但是,三聚氢胺本身无法替代蛋白质,几乎没有任何营养价值。加了这种物质,造成的只是蛋白质含量提高的假象。三聚氰胺并非惟一的替代添加物,很多厂商用三聚氢胺拉高饲料蛋白质含量后,再加入低价的淀粉等,作低蛋白质含量。以上两种操作,从经济上讲都有较大套利空间。出于相同的原理,只要含氮量大于普通植物蛋白质的化学物质,且性状和价格具备条件,在理论上都存在被不法厂商利用的可能性。《精细有机化工原料及中间体手册》显示,三聚氰胺“本品低毒,无刺激性……高温下可能分解产生氰化物(有较大毒性),故应避免高温”。由国际化学品安全规划署和欧洲联盟委员会合编的《国际化学品安全手册》(第三卷),对三聚氰胺则有如下描述:“长期或反复接触作用:该物质可能对肾发生作用”。(来源:《财经》)以上文章来源联众论坛:http://bbs.ourgame.com/bbs_look.asp?Subject_ID=34&BBS_ID=20080912619011&bPage=1 相关联接: 蛋白精(粗蛋白200%)本产品是全国著名生物技术专家王厚德教授的发明专利产品。专利号:cn1119071a。可等蛋白替代鱼粉、豆粕等高蛋白原料,也可以单独添加,使每吨全价饲料降低成本15~80元,且安全无毒,经济效益显著。 沧州市厚德生物新技术研究所 王厚德:全国著名微生物学专家、中国农业大学客座教授、华中师范大学兼职教授、武警医学院高级顾问、天津医科大学教授、中国保健科技学会微生态学会理事长。近20年来在微生物发酵领域获得国家星火二等奖1项,省级科技进步奖8项,并获数枚国际国内金奖,主持过省和国家级科研计划项目26项,并通过了相关级别技术鉴定,拥有32项发明专利
[font=宋体]跨膜蛋白是生物体内广泛存在的一类蛋白质,它们在细胞膜上以不同的方式与其相互作用,从而发挥各种生物学功能。根据不同的结构和功能,[/font][b][font=宋体]跨膜蛋白可以分为三种类型:通道型跨膜蛋白、受体型跨膜蛋白和泵型跨膜蛋白。[/font][/b][font=宋体] [/font][font=宋体][font=宋体]通道型跨膜蛋白是跨膜蛋白中最为简单的类型,它们主要的功能是在细胞膜上形成一些具有选择性通透性的孔道,使得离子和小分子物质能够通过。通道型跨膜蛋白具有多个跨膜域,通常由[/font] [font=宋体]α 螺旋和 β 折叠两种二级结构组成。α 螺旋通道如 [/font][font=Calibri]K+ [/font][font=宋体]通道能够容纳阳离子,β 折叠如离子泵[/font][font=Calibri]Na+/K+-ATPase [/font][font=宋体]能够承载各种离子。[/font][/font][font=宋体] [/font][font=宋体]受体型跨膜蛋白是一类比较复杂的蛋白质,它们能够接受信号分子的结合,从而调节细胞内的生物学路径。受体型跨膜蛋白通常由单个跨膜域和两个不同构的端基组成,其中一个端基是细胞外的受体结构域,能够特异性地与信号分子结合;另外一个端基是细胞内的调节结构域,能够将受体活性传递到细胞内部。受体型跨膜蛋白具有多种作用方式,如酪氨酸激酶受体,转录因子受体等。[/font][font=宋体] [/font][font=宋体][font=宋体]泵型跨膜蛋白是一类能够通过能量输入来驱动物质运输的蛋白质。它们能够将离子或者小分子物质从低浓度区域转运到高浓度区域,从而维持细胞内的化学平衡和稳态。泵型跨膜蛋白一般由多个跨膜域组成,并能借助外源性能量如[/font][font=Calibri]ATP[/font][font=宋体]进行运输。常见的泵型跨膜蛋白有[/font][font=Calibri]Na+/K+-ATPase, H+/K+-ATPase[/font][font=宋体]等。[/font][/font][font=宋体] [/font][b][font=宋体][font=宋体]义翘神州提供跨膜蛋白制备平台,包括:[/font][font=Calibri]VLP[/font][font=宋体]技术平台[/font][font=Calibri]/[/font][font=宋体]去垢剂技术平台[/font][font=Calibri]/Nanodisc[/font][font=宋体]技术平台。[/font][/font][font=宋体][font=Calibri]VLP[/font][font=宋体]技术平台[/font][/font][/b][font=宋体][font=宋体]正确折叠的膜蛋白在细胞膜上表达,类病毒颗粒[/font][font=Calibri]VLP[/font][font=宋体]通过出芽的方式包裹上携带有靶标蛋白的细胞膜,形成包膜的[/font][font=Calibri]VLP[/font][font=宋体]。它是由病毒的衣壳蛋白通过自组装而形成的纳米级颗粒(直径约[/font][font=Calibri]100[/font][font=宋体]~[/font][font=Calibri]300[/font][font=宋体]纳米),不含病毒核酸,不能进行自主复制,生产操作过程中较为安全。产生的[/font][font=Calibri]VLP[/font][font=宋体]蛋白可直接像可溶蛋白一样进行包被进行[/font][font=Calibri]ELISA[/font][font=宋体]检测。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州已成功开发[/font][font=Calibri]VLP[/font][font=宋体]技术平台,它可以将完整天然构象的膜蛋白展示在类病毒颗粒表面,这种方法不仅可以保留膜蛋白的完整结构,同时也能够真实地模拟其在细胞膜上的位置和构象。[/font][/font][font=宋体][font=宋体]利用[/font][font=Calibri]VLP[/font][font=宋体]平台制备跨膜蛋白具有以下优势:[/font][/font][font=宋体]? 全长跨膜蛋白,保持完整的天然构象[/font][font=宋体][font=宋体]? 适用于动物免疫、[/font][font=Calibri]ELISA[/font][font=宋体]检测、[/font][font=Calibri]CAR[/font][font=宋体]阳性率检测、抗体筛选等。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州搭建了基于[/font][font=Calibri]HEK293[/font][font=宋体]表达系统的[/font][font=Calibri]VLP[/font][font=宋体]([/font][font=Calibri]virus-like particle[/font][font=宋体])技术平台,能够将目的膜蛋白完整展示在[/font][font=Calibri]VLP[/font][font=宋体]表面,使其能够像普通蛋白一样进行检测,义翘神州目前可以为客户提供膜蛋白定制服务,助力药物研发进程。[/font][/font][font=宋体] [/font][b][font=宋体]去垢剂技术平台[/font][/b][font=宋体][font=宋体]由于存在疏水结构域,跨膜蛋白与膜的结合非常紧密,需要用去垢剂([/font][font=Calibri]detergent[/font][font=宋体])才能从膜上洗涤下来,[/font][font=Calibri]Detergent[/font][font=宋体]作为一种两亲性分子,疏水尾部包裹目的蛋白的疏水区域,亲水头部位于与溶液接触的界面。微团的形成是膜蛋白增溶的基础,当去垢剂浓度高于[/font][font=Calibri]CMC[/font][font=宋体]([/font][font=Calibri]Critical micelle concentration[/font][font=宋体],临界胶束浓度)时会形成微团,增溶后,去垢剂将蛋白周围的磷脂置换,从而实现收集目标膜蛋白的目的,后续再进行蛋白纯化,最终蛋白呈现在含有[/font][font=Calibri]Detergent[/font][font=宋体]的溶液中。义翘神州成功搭建了去垢剂技术平台,利用该平台可有效提高跨膜蛋白的产量和纯度。[/font][/font][font=宋体]去垢剂技术平台的优势:[/font][font=宋体]? 可精确定量[/font][font=宋体]? 胶束为膜蛋白疏水基团提供保护并稳定构象[/font][font=宋体][font=宋体]? 适用于动物免疫、[/font][font=Calibri]ELISA[/font][font=宋体]检测、[/font][font=Calibri]SPR/BLI[/font][font=宋体]检测等[/font][/font][b][font=宋体] [/font][font=宋体][font=Calibri]Nanodisc[/font][font=宋体]技术平台[/font][/font][/b][font=宋体][font=Calibri]Nanodisc[/font][font=宋体]结构稳定,与天然的生物膜非常相似,使得[/font][font=Calibri]Nanodisc[/font][font=宋体]能够很好地应用于膜蛋白的研究。目前[/font][font=Calibri]Nanodisc[/font][font=宋体]平台有[/font][font=Calibri]2[/font][font=宋体]种方式,一种是基于苯乙烯马来酸酐共聚物([/font][font=Calibri]SMA[/font][font=宋体])组装的[/font][font=Calibri]SMA-Nanodisc[/font][font=宋体]平台,如下图(左)所示,它可以直接从细胞膜上提取膜蛋白,使其变为可溶性蛋白,组装完成的蛋白样品很稳定,更能维持蛋白的天然构象。另一种是基于膜骨架蛋白([/font][font=Calibri]MSP[/font][font=宋体])的[/font][font=Calibri]MSP-Nanodisc[/font][font=宋体]平台(下图右),它需要先将膜蛋白利用去垢剂制备出来,然后再加入磷脂分子和[/font][font=Calibri]MSP[/font][font=宋体]进行组装。通过调整磷脂、[/font][font=Calibri]MSP[/font][font=宋体]和待组装膜蛋白三者的比例,可以使得待组装膜蛋白在[/font][font=Calibri]Nanodisc[/font][font=宋体]中呈不同聚集状态。义翘神州已成功搭建了[/font][font=Calibri]Nanodisc[/font][font=宋体]技术平台,利用跨膜蛋白与磷脂结合能够维持其良好活性的特性,制备出稳定的产品,满足动物免疫、抗体筛选、[/font][font=Calibri]cell-based assays[/font][font=宋体]等场景。[/font][/font][font=宋体][font=Calibri]SMA-Nanodisc[/font][font=宋体]技术平台的优势:[/font][/font][font=宋体]? 可精确定量[/font][font=宋体][font=宋体]? [/font][font=Calibri]SMA[/font][font=宋体]共聚物包裹的膜蛋白稳定性更好,有助于更好地研究膜蛋白的结构和功能[/font][/font][font=宋体][font=宋体]? 适用于动物免疫、[/font][font=Calibri]ELISA[/font][font=宋体]检测、[/font][font=Calibri]SPR/BLI[/font][font=宋体]检测、[/font][font=Calibri]CAR[/font][font=宋体]阳性率检测及细胞实验等[/font][/font][font=宋体] [/font][font=宋体][font=宋体]更多[url=https://cn.sinobiological.com/resource/protein-review/transmembrane-proteins][b]跨膜蛋白[/b][/url]详情可以关注:[/font][font=Calibri]https://cn.sinobiological.com/resource/protein-review/transmembrane-proteins[/font][/font][font=Calibri] [/font]
功能性蛋白及一例分析自19世纪中叶荷兰化学家Gerardus Mul-der从动物组织和植物体中提取出蛋白质以来,人们发现了越来越多的蛋白质,据估计生物界中蛋白质的种类可达1010~1012之多;在这如此众多的蛋白质中,功能性蛋白发挥着极其重要的生理功能 。功能性蛋白也有人称其为活性蛋白。它们的特点是都有识别功能,能与其他分子特异性结合.完成各种复杂的生命活动:在结构上主要是一些球状蛋白质。1 功能性蛋白的种类按其作用方式不同可分为酶蛋白、运输蛋白、运动蛋白、免疫球蛋白、毒蛋白、激素蛋白(1)酶蛋白: 细胞的生长和繁殖、代谢物的合成和分解、能量的产生和利用,这些过程所需要的物质都是通过无数的生物化学反应来提供的.而这些反应又都是在一类特殊蛋白质—酶蛋白的催化下完成的。酶的催化效率极高,且具有高度的专一性,也正是这种高度的专一性使一种特定的酶只能作用于一种或少数几种结构相似的化合物,这就要求有各种不同的酶去作用于不同的化合物。在酶的作用下,生物细胞才得以合成各种复杂的化合物,也才能使各种大分子物质被分解、吸收和利用.且这些反应都要在适合于生物体本身的温度、压力和pH值等非常温和的条件下进行,能使生物细胞按照这种方式进行化学变化是蛋白质最重要的功能之一。常见的酶蛋白如淀粉酶使淀粉分解形成葡萄糖,蛋白酶、肽酶使蛋白质分解为氨基酸;溶菌酶使细菌细胞壁中的肤聚糖被破坏;凝血系统酶的有序作用使凝血过程得以有条不紊地进行.合成酶能合成多种体内所需要的大分子物质。应用举例:由于近年来鱼粉资源价格上涨,冷向军等人通过向鱼粉含量较低(10﹪)的饲料个添加蛋白酶AG使鱼的前肠蛋白酶有显著提高。同样有实验证明在玉米-豆粕型粮食中添加蛋白酶可以改善肉鸡的生长性能,提高蛋白质的消化率。(2)运输蛋白:有些蛋白质起载体的作用可以运输特定的物质到达必须的部位,使其完成特定的功能,这种蛋白质称为运输蛋白。如哺乳动物的血红蛋白能将氧从氧气充裕的肺内运送到各个组织中去:血清蛋白能与游离脂肪酶等多种物质结合,并将这些物质在脂肪组织与身体的其他部位间运送(最典型的β1-脂蛋白可随血流运输脂肪),铁传递蛋白能传递血液中的铁。无脊椎动物体内的血蓝蛋白,大豆根瘤中的豆血红蛋白也起着输送氧气的作用。另外还有一些能携带物质通过细胞膜进出细胞的蛋白质,如细菌过膜运输中的载体蛋白等,它们都属于运输蛋白。(3)运动蛋白:参与运动功能的蛋白质种类较多如脊椎动物中骨骼肌的主要成分就是肌动蛋白和肌球蛋白,肌肉的收缩就是靠着这两种互相联系的平行丝状蛋白相对滑动来完成的;细菌的运动器官——鞭毛也是由鞭毛蛋白组成的;绿藻的运动也离不开蛋白质;有丝分裂的完成,精子的运动等都与运动蛋白有关,所以绝大多数生物的运动和收缩过程都是运动蛋白参与的结果。应用举例:邱永忠等人在研究烟草花叶病毒(TMV)在植物细胞间的运动时发现用体外定位突变引起L株上,被点突变的DNA体外转录成RNA后感染感病烟草,结果定位突变的L株表型30kD蛋白基因四种位点不同的移码突变和一种基因中间大部分缺失的突变体均使病毒不能感染植株。这证明TMV 30kD蛋白与病毒运动有关,而与病毒复制无关。同时因为胞间连丝一般只能让小于1kD的分子通过,其通透范围远小于病毒颗粒,也小于折叠的病毒核酸分子,Wolf等实验证明正时因为30kD蛋白才使得植株分子半径扩散了三倍多。(4)免疫球蛋白:指具有抗体活性的动物蛋白。主要存在于血浆中,也见于其他体液、组织和一些分泌液中。脊椎动物的免疫系统能抵抗外来的入侵物质,如病毒、细菌以及其他机体的细胞,当外来的这些入侵物质(抗原)进入机体后就会激发机体的免疫系统而产生特异性的免疫球蛋白(抗体),通常每一种抗体对于相应的某一特定抗原具有高度的专一性,抗原与抗体结合形成抗原-抗体复合物.使入侵物质——抗原失活而排出体外,从而消除外来物质对机体的干扰。由此看来蛋白质不仅参与了高等动物的免疫反应,而且起着重要的作用,由于抗原和抗体结合的高度专一性,必然有数量众多的抗体作用于不同的抗原物质,据估计抗体的类型可能有10O万种,即免疫球蛋白可能有100万种之多。(5)毒蛋白:动物、植物和微生物都可以产生某些特殊的物质来防御敌害,这些物质中绝大多数是蛋白质类物质,由于它们对高等动物具有毒性,故称为毒蛋白。蝎类能产生毒性很强的蝎毒蛋白.用来攻击敌害,保护自己;蛇类产生的神经毒素和心赃毒素其主要成分也是小分子量的蛋白质;毒蘑菇中的相当一部分蘑菇毒素也是蛋白质;细菌产生的毒素,毒性极强的肉毒梭菌毒素(人的致死量小于19m)和破伤风痉挛毒素、白喉杆菌毒素等外毒素均是蛋白质。应用举例:王峰等人研究核糖体失活蛋白(RIPS)是一类能够抑制细胞核糖体合成蛋白质,从而导致宿主死亡的毒蛋白,广泛存在于植物、细菌中。发现其在在细胞内的转运途径研究很多,目前较为清楚的是逆向转运途径,其中以蓖麻毒素、志贺菌毒素、霍乱毒素为代表,大体过程为:内吞一内吞小体一高尔基体一内质网一胞液。(6)激素蛋白:是由特殊细胞所产生的一类物质,它们通过与靶细胞或系统内其它器官的相互作用来发挥其代谢上的功能,其实许多激素本身就是蛋白质,这样的蛋白质称为激素蛋白,它们在生物合成上具有重要的功能。如胰高血糖素、胰岛素、胃泌素、生长激素、促甲状腺激素、促肾上腺皮质激素和促脂解激素等均是蛋白
[em09511]一种新型的重组蛋白A柱 洗脱条件温和,充分防止蛋白变性蛋白A是一种金黄色葡萄球菌细胞壁蛋白质,能特异性地与人和哺乳动物抗体(主要是IgG)的Fc区结合。因而,将蛋白A与琼脂糖凝胶以一定的方式结合,可制备用于抗体纯化的亲和填料。早期的蛋白A柱结合的都是天然蛋白A。天然蛋白A由5个IgG结合域和其它未知功能的非Fc结合域组成,分子量约42KD,结构如图一所示。这种柱子对IgG的亲和能力很强,可以吸附大量的lgG。但同时,天然蛋白A的其他非结合域会和非目标蛋白结合,这样被洗脱下来的蛋白质纯度不够,会影响到后续的试验。为了解决这些问题,科学家们运用基因工程技术,克隆出蛋白A的基因,并对其进行改造,除去了一些不重要的非结合域。偶联这种重组蛋白A的琼脂糖凝胶柱在蛋白质纯化中,的确是提高了产物的纯度。目前,市场上绝大部分重组蛋白A柱都是这种产品。但是,纯化时所用的洗脱液一般为pH=2.7的甘氨酸溶液,如果洗脱效果不是很理想,还要降低pH,采用pH=1.9的甘氨酸溶液。由此可见,此法洗脱条件比较剧烈,最后收集的蛋白质很有可能变性,或者是复性困难。 这种洗脱条件剧烈的柱子结合的重组蛋白A一般具有5个串联结构域:E、D、A、B、C。虽然每个域均可以和IgG的Fc段结合,但不同的域结合强度略有差异。因此洗脱条件不均一,而且经常需要较低的pH值。GE的重组蛋白A柱即为这种类型,如图二所示。考虑到减少串联结构域的个数,并且采取同型结构域串联,就可以避免不同结构域与抗体Fc 段亲和性的差异从而使洗脱条件温和而均一,Putus研制出了含有三个串联B结合域的重组蛋白A,如图二所示。同时,我们用Putus重组蛋白A柱和GE重组蛋白A柱纯化人血浆,纯化的结果用于比较两种纯化柱的纯化效果,结果如图三所示。GE Putus 图二、重组蛋白A结构示意图待纯化样品:人血浆实验材料:GE公司的重组蛋白A柱(E、D、A、B、C结构域串联,见图二)Putus公司的重组蛋白A柱(3个B结构域串联,见图二)实验方法:分别按照每个公司的说明书来操作,洗脱条件分别为pH值3.0和4.5, SDS-PAGE检测结果如下: 上图从左边起,泳道1为标准蛋白Marker,泳道2为经过GE填料洗脱后抗体,泳道3为经过Putus填料洗脱抗体,泳道4为人血浆。从图中,我们可以看出,与GE 重组蛋白A填料从人血浆纯化抗体纯度比较,拥有3个同型结构域的Putus填料可以获得同样纯度的抗体。但是,后者的洗脱条件仅为4.5,高于前者的洗脱条件3.0。由此可见,使用具备较少B结构域的重组蛋白A柱也能获得高纯度的IgG,并且洗脱条件温和,能防止蛋白质聚集,保护蛋白质活性。[IMG]http://CP00A3CEE71B5F96ADF6E669B5D7F56A9F11.jpg[/IMG][URL=http://C:\Documents and Settings\adim\桌面\001.jpg]http://C:\Documents and Settings\adim\桌面\001.jpg[/URL][img]http://ng1.17img.cn/bbsfiles/images/2009/12/200912021052_187443_1672347_3.jpg[/img][img]http://ng1.17img.cn/bbsfiles/images/2009/12/200912021052_187444_1672347_3.jpg[/img][img]http://ng1.17img.cn/bbsfiles/images/2009/12/200912021052_187445_1672347_3.jpg[/img]
1.原理等电聚焦凝胶电泳是依据蛋白质分子的静电荷或等电点进行分离的技术,等电聚焦中,蛋白质分子在含有载体两性电解质形成的一个连续而稳定的线性pH梯度中电泳。载体两性电解质是脂肪族多氨基多羧酸,在电场中形成正极为酸性,负极为碱性的连续的pH梯度。蛋白质分子在偏离其等电点的pH条件下带有电荷,因此可以在电场中移动;当蛋白质迁移至其等电点位置时,其静电荷数为零,在电场中不再移动,据此将蛋白质分离。 等电聚焦中,只有在凝胶两端给以高电压时,才能获得较好的蛋白质条带分辨率,这就需要非常有效的凝胶冷却系统(否则会导致烧胶),即凝胶同期周围液体之间的热传递效率要高。由于平板胶热传递能力高,并可方便的同时比较多种蛋白质样品,所以平板胶用在等电聚焦上的居多。由于等电聚焦对蛋白质的电荷差异非常敏感,若要好的重复性,制备蛋白样品时一定要小心,要避免任何对蛋白质化学组成和结构的修饰。另外,蛋白质-脂类、蛋白质-蛋白质相互作用可引起电荷改变,进而导致等电点迁移或纹理现象。除非特殊需要研究蛋白质-蛋白质相互作用或者必须保持蛋白质的生物学功能,等电聚焦通常在含有尿素的变性凝胶系统中进行。使用非离子去垢剂也可以提高分辨率。 2.主要仪器、试剂仪器:微型电泳系统、电源、注射器、固定和染色用容器 试剂:丙稀酰胺、双-丙稀酰胺、载体两性电解质、尿素、过硫酸胺、TEMED、TritonX-100、2-巯基乙醇、溴酚蓝、磷酸、氢氧化钠、氯化钾、三氯乙酸、考马斯亮蓝、甲醇、乙酸。 储存液:1)30%(w/v)丙稀酰胺,1%(w/v)双-丙稀酰胺;2)20%Triton X100;3)10%三氯乙酸;4)1%三氯乙酸;5)1%溴酚蓝;6)考马斯亮蓝染色液;7)考马斯亮蓝脱色液;
您好!想请教蛋白酶酶解糖蛋白的具体问题,蛋白酶在酶解糖蛋白的过程中是否与糖蛋白上的糖链构象有关系?有相关方面的书籍或者文献可供参考吗?谢谢
新技术可揭示蛋白间相互作用 为膜蛋白研究提供了有力工具 科技日报多伦多3月28日电 (记者冯卫东)据最新一期《自然·方法学》杂志网络版报道,加拿大多伦多大学研究人员开发出一种研究人体蛋白质的新技术。该技术可追踪膜蛋白与其他蛋白之间的相互作用。 膜蛋白占人体所有蛋白的约三分之一,有500多种疾病与其失能相关。膜蛋白的研究难点在于,要了解其作用,必须基于对其与其他蛋白相互作用的观察。 多伦多大学细胞与生物分子研究中心教授伊戈尔·斯坦戈利亚称,新技术为检视人体细胞自然环境中的膜蛋白提供了新工具。其灵敏度足以检测到引入药物的微量变化,因此对癌症及神经疾病治疗方法的研发具有重要意义。 研究人员采用了一种被称为MaMTH(哺乳动物膜双杂交法)的新技术,来确定CRKII蛋白在最常见肺癌——非小细胞肺癌中的作用。CRKII蛋白可与表皮生长因子受体蛋白相互作用,而表皮生长因子受体的基因突变可导致癌细胞的增殖。 研究报告的主要作者、多伦多大学博士后研究员茱莉亚·佩斯奇尼格称,CRKII最有可能调控突变表皮生长因子受体的稳定性,并通过促进癌细胞间的信令传递或通信来推动肿瘤生长。研究发现,可抑制这些突变受体和CRKII的一种组合化疗法或对肺癌治疗大有助益。 此项研究汇聚了多伦多和波士顿地区的5个实验室的研究人员及癌症临床医师、生物信息学家。佩斯奇尼格及其实验室历时4年对适用于酵母的蛋白—蛋白相互作用的类似技术进行了改进,从而开发出新的MaMTH技术。研究人员下一步将对其他人体疾病中的突变蛋白进行研究。来源:中国科技网-科技日报 2014年03月31日
[font=宋体][font=宋体]在生物科学领域,蛋白质纯化是一项关键的技术,它对于研究生物分子的结构和功能至关重要。谷胱甘肽[/font][font=Calibri]S-[/font][font=宋体]转移酶([/font][font=Calibri]GST[/font][font=宋体])是一种在许多生物体中发现的蛋白质,它参与了多种生物学过程,包括解毒和细胞保护。在实验室中,我们常常使用[/font][font=Calibri]GST[/font][font=宋体]来纯化目标蛋白。然而,在这个过程中,可能会遇到一些常见问题。本文将探讨这些问题,并提出相应的解决方案。[/font][/font][font=宋体] [/font][b][font=宋体]一、目的蛋白结合效率低或不结合[/font][/b][font=宋体]①裂解方式:过分的裂解会使标签蛋白变性,阻止其结合[/font][font=宋体][font=宋体]建议:在裂解过程中调节合适的超声功率和间隔时间或采用温和的机械[/font][font=Calibri]/[/font][font=宋体]化学裂解方法。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]②缓冲液条件:谷胱甘肽[/font][font=Calibri]-[/font][font=宋体]琼脂糖树脂在[/font][font=Calibri]pH[/font][font=宋体]值低于[/font][font=Calibri]6.5[/font][font=宋体]或高于[/font][font=Calibri]8.0[/font][font=宋体]时,结合效率会降低[/font][/font][font=宋体][font=宋体]建议:使用前需用[/font][font=Calibri]pH[/font][font=宋体]为[/font][font=Calibri]6.5~8.0[/font][font=宋体]的[/font][font=Calibri]PBS[/font][font=宋体]进行平衡。[/font][/font][font=宋体] [/font][font=宋体]③蛋白发生变性或聚集[/font][font=宋体][font=宋体]建议:使用前需用[/font][font=Calibri]pH[/font][font=宋体]为[/font][font=Calibri]6.5~8.0[/font][font=宋体]的[/font][font=Calibri]PBS[/font][font=宋体]进行平衡。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]建议:可在裂解前加入[/font][font=Calibri]1-10mM[/font][font=宋体]的[/font][font=Calibri]DTT[/font][font=宋体],在缓冲液中也加入[/font][font=Calibri]DTT[/font][font=宋体];蛋白[/font][font=Calibri]-[/font][font=宋体]核酸结合或蛋白[/font][font=Calibri]-[/font][font=宋体]蛋白结合可加氯化钠。[/font][/font][font=宋体] [/font][font=宋体]④蛋白或脂类在介质中聚集[/font][font=宋体]建议:及时清洗介质或更换新的介质。[/font][font=宋体] [/font][font=宋体][font=宋体]⑤上样过程:上样量过载与上样流速过高均会影响[/font][font=Calibri]GST[/font][font=宋体]标签蛋白的结合[/font][/font][font=宋体]建议:在上样过程中要注意控制上样量与保持低流速。[/font][font=宋体] [/font][font=宋体][font=宋体]⑥[/font][font=Calibri]GST [/font][font=宋体]融合蛋白发生聚集沉淀[/font][/font][font=宋体][font=宋体]建议:在裂解[/font][font=Calibri]Buffer[/font][font=宋体]和其他缓冲体系中加入[/font][font=Calibri]DTT[/font][/font][font=宋体] [/font][font=宋体][font=宋体]⑦[/font][font=Calibri]GST[/font][font=宋体]融合蛋白被过度稀释[/font][/font][font=宋体]建议:重新浓缩样品,增加蛋白浓度。[/font][font=宋体] [/font][font=宋体][b]二、目的蛋白洗脱不下来或洗脱率低[/b][/font][font=宋体]①洗脱条件[/font][font=宋体]建议:可以通过加大洗脱液体积、降低流速以及延长洗脱液的保留时间等措施提高洗脱效率。[/font][font=宋体] [/font][font=宋体]②样品没有经过前处理[/font][font=宋体]建议:样品上柱前必须要经过离心或过滤。[/font][font=宋体] [/font][font=宋体]③非特异性吸附[/font][font=宋体]建议:适当选择添加剂降低非特异性吸附。[/font][font=宋体] [/font][font=宋体]④洗脱缓冲液中谷胱甘肽被氧化[/font][font=宋体][font=宋体]建议:洗脱缓冲液需现配现用,另外可以尝试加入[/font][font=Calibri]1-5mM[/font][font=宋体]的[/font][font=Calibri]DTT[/font][font=宋体]。[/font][/font][font=宋体] [/font][font=宋体]⑤洗脱蛋白有杂质[/font][font=宋体][font=Calibri]GST[/font][font=宋体]融合蛋白被蛋白酶部分降解[/font][/font][font=宋体][font=宋体]建议:加入蛋白酶抑制剂[/font][font=Calibri]PMSF[/font][font=宋体]。注:丝氨酸蛋白酶抑制剂必须在使用凝血酶或凝血因子[/font][font=Calibri]Xa [/font][font=宋体]前除去。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]⑥[/font][font=Calibri]GST[/font][font=宋体]融合蛋白被蛋白酶部分降解[/font][/font][font=宋体][font=宋体]建议:使用蛋白酶缺陷型菌株[/font][font=Calibri]lon-[/font][font=宋体]或[/font][font=Calibri]ompT[/font][font=宋体],或[/font][font=Calibri]ompT[/font][font=宋体]和[/font][font=Calibri]lon[/font][font=宋体]双缺陷型菌株。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]更多详情可以关注:[/font][url=https://cn.sinobiological.com/resource/protein-review/gst-tag-protein-expression][b][font=Calibri]GST[/font][font=宋体]标签蛋白纯化[/font][/b][/url][font=Calibri]https://cn.sinobiological.com/resource/protein-review/gst-tag-protein-expression[/font][/font]