各位大侠、专家,由于刚接触储藏稳定性的试验,很多不懂的地方,请问大家,一种农药的储藏稳定性除了JMPR中有记录,还有别的报告中有吗?怎么查询?万分感激,谢谢大家!
在做一个抗菌药[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LCMS[/color][/url]MS方法学时,待分析物储备液稳定性先考察了6个月的稳定情况,储备液配制时间分别在20200915和20210304(如图1中的蓝色部分),稳定性没有问题。在8个月的时候,又重新配制了一份新的储备液20210510,并继续考察8个月和2个月的稳定性,发现20200915和20210304的峰面积近似,但是与20210510的峰面积想比少了近25%(图2蓝色部分),同时与2个月前想比也少了近25%,这也就是说之前考察6个月稳定性是好的,但是仅仅过了2个月,考察8个月和2个月的稳定性都不好了,这与原来的结果矛盾了,问题是储存条件并没有改变,想问下有哪位遇到类似问题?[img]https://ng1.17img.cn/bbsfiles/images/2021/05/202105110936521974_9937_2360491_3.png[/img][img]https://ng1.17img.cn/bbsfiles/images/2021/05/202105110936523654_6682_2360491_3.png[/img]
氯胺T的稳定性测定水中的氰化物测定出来的标准溶液吸光度很低查看资料说是 氯胺T的问题氯胺T的稳定性这么差?如何保存呢
ARL3460长期数据稳定性跟短期数据稳定性对SD和RSD有什么要求
辅料37度72h降解,但在25度很稳定,规定的储存温度为15-30度,该如何做稳定性加速实验呢?
稳定性指示性的分析方法(Stability-indicating method)是指一种应用于制药工业中稳定性样品的测试方法,利用这类方法测定样品能够反映出在稳定性试验条件下产品质量的变化。FDA、ICH、EMEA等各类药政部门都对该方法有严格的要求,并且强调稳定性考察的样品必须采用具有稳定指示性的方法,那么到底哪些方法具有稳定指示性呢?请大家谈谈自己的看法哟
2010已经开始实施,因此,不可避免的就遇到了稳定性试验的问题,所有的试验方案均是在2005版的基础上起草和实施的,那么,当药典升版后,我们应该怎么办?继续执行老标准,还是直接换成新标准,那么换了后又如何做趋势分析,如何判断稳定性结果
国产石墨炉稳定性与进口石墨炉稳定性有啥区别?哪位大仙帮助一下?推荐一下那个厂家?

[b][url=http://www.linpin.com/]药品稳定性试验箱[/url][/b]在各行各业以精确的温度控制、精美外观及方便快捷的实际操作、及时地售后服务等作为各行各业带来了便捷。药物箱在之上好几个行业,以基优异的安全配置,易上手的人性化的设计以及其它诸多的优势,为药物箱客户提供了具备极为平稳温度环境和保安的功能储存自然环境。[align=center][img=,690,690]https://ng1.17img.cn/bbsfiles/images/2022/09/202209211645546206_8976_5295056_3.jpg!w690x690.jpg[/img][/align] 1、该试验设备适用存储有温度的标准的生物制药、生物制品、药物、血夜或储放必须15-55℃中间物品 2、药品稳定性试验箱设定为控温环节中,具备高低温试验警报作用,当药物箱内体内温度贴近15℃或是高过设定值4℃,警报声音传来,点一下任意键解除警报声。 3、该设备可用领域:医疗卫生行业,药品检验、环境保护、食品类、疾病预防、化工厂等相关部门,药物箱用以实验试剂、预苗等商品的存储与检测及升温。 4、药品稳定性试验箱全锁作用,药物箱避免环境温度原来值设置的更改。 该试验设备属新式多用途控温加温箱,可任意设置所需要的标值,药物箱用途广泛,适用范围强,药物箱非常适合诊疗、环境卫生、疫防、食品化工、军用、科学研究等相关部门液态升温应用。 以上就是药品稳定性试验箱的适用性剖析,想了解更多最新资讯,敬请期待!
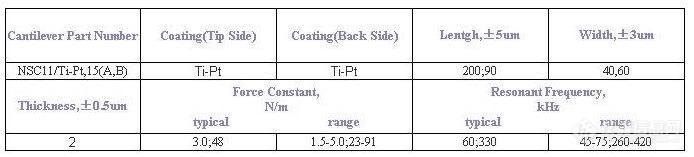
不久前买了一批micromasch的针尖,按我的理解,非接触模式的afm针尖的力常数和共振频率越高针尖越稳定,因此我特地选取了高力常数,高共振频率的NSC11(三角的悬臂梁,参数详见附件),现在实验发现测试时针尖稳定性非常差,即使是在扫描起伏10nm,范围100nm^2的表面仍然发现针尖很容易失振。在这之前我在同样的样品上也用过micromasch(75kHz,力常数大概几个N/m)和nanosensor(290kHz,40N/m)的针尖,悬臂梁都是长方形的,但是并没有发现如此不稳定的状况。新买的针尖到目前试了7个针尖,都是同样的情况。有那位高手给点意见,在非接触模式的afm下可以通过调节哪些参数有效的控制针尖的不稳定性,可不可以通过一些什么测试(比如力曲线)从中看出针尖和表面间的作用如何,从而对此时的稳定性做出一定的评价。我用的Omicron的AFM/STM.另外我觉得可能是针尖的质量有问题,不过针尖的参数既然接近,那问题又会出在哪?不知有没有人向这些针尖代理要求更换针尖的,介绍下经验。谢谢![img]http://ng1.17img.cn/bbsfiles/images/2007/04/200704272212_50265_1606326_3.jpg[/img]
[color=#660000][b]1.标准样品的稳定性[/b][/color] 根据标准样品技术的基本理论,在测量、确定标准样品特性值时,该值的测量不确定度是由三个互相独立的分量合成的。这就是:测量方法引入的测量不确定度分量、瓶-瓶之间非均匀性引入的测量不确定度分量和随时间变化样料不稳定性引入的测量不确定度分量。 由于标准样品在运输过程中或贮存在仓库期间内时,标准样品的特性值可能会随运输条件的变化或在规定的贮存条件下随时间的改变而变化。在标准样品技术领域内,我们把在合适的运输条件下,在运输期间标准样品特性的变化程度称为短周期稳定性(short-termstability);把保存在合适的贮存条件下,标准样品特性随时间变化的程度称为长周期稳定性(long-termstability)。为此,在研制标准样品的过程中,必须进行短周期稳定性研究,目的就是通过试验分析,研究确定标准样品合适的运输条件。即确保在规定的运输条件下分发标准样品时,由于运输引起的标准样品特性变化不会增加其特性标准值的测量不确定度。同时也必须进行长周期稳定性研究,目的就是通过试验分析,研究确定两个问题:一是标准样品合适的贮存条件;二是在这种贮存条件下,标准样品特性标准值保持有效的时间周期。即确保有效期内,在规定的条件下贮存标准样品时,标准样品特性变化不会增加其特性标准值的测量不确定度。 如果更深入一步研究、分析标准样品稳定性研究的内在机理,还可以发现如下两种情况: 第一种情况是:所有的样料均匀的随时间(或运输条件)发生变化。表现形式为:虽然整批样料的特性值发生了变化,但在每个选定的检测时间点,标准样品特性标准值的一致性很好。也就是说,在不同的时间点标准样品的特性标准值不相同,但在任何特定的一个时间点,该批标准样品的特性标准值则是一致的。这种情况的特征是:在任何一个检测时间点,整批标准样品的样料仍然保持均匀,只是每个检测点标准样品特性的标准值发生了变化,而相应的测量不确定度则没有发生变化。 第二种情况是:在每一个检测时间点,整批样料发生的变化不均匀(同一瓶内有的样料发生了变化,有的没有变化,即瓶内均匀性发生了变化;或有的瓶内样料发生了变化,有的瓶没有变化,即瓶-瓶之间均匀性发生了变化),表现形式为:在任何一个检测时间点,标准样品的样料均匀性发生了变化,因此相应的特性标准值和测量不确定度都发生了变化。 由此可以看出:稳定性问题从本质上讲,就是研究随时间变化标准样品均匀性变化的问题。因此我们可以根据此原理把稳定性研究分为三种类型: 第一类是样料随时间变化而均匀发生变化的情况。这时可以通过稳定性研究,找出样料特性值变化与时间的相关关系,采用《回归分析》方法,研究寻找出合适的回归方程,如果能获得回归方程,就可以对标准样品的稳定性变化进行预测。 第二类是样料随时间变化而发生不均匀变化的情况。可以通过稳定性研究,判断、确定每个检测时间点标准样品特性的标准值变化是否在相应的测量不确定度范围内,判断的统计检验方法为F检验或t检验。 第三类是运输条件稳定性研究。由于在实际运输中,运输环境、条件常常比较严酷且不能避免,此时稳定性研究的目的就变为寻找运输条件引入的测量不确定度,然后在标准样品特性值的测量不确定度中附加上这个测量不确定度分量。
[size=15px]期间核查与稳定性考核有相似之处,同时也是有差异的。[/size][size=15px]1.期间核查与稳定性考核考查的对象是相同的,都是实验室用于出具数据的测量仪器。JJF1001-2011《通用计量术语及定义》中,测量仪器是实物量具、测量系统、测量设备等的统称,它们均列于测量仪器的标题下。测量标准是具有确定的量值和相关联的测量不确定度,实现给定量定义的参照对象。给定量的定义可通过测量系统、实物量具或有证标准物质复现。因此,测量标准实际上是一种特别设计的,或者经过特别考核过的,准确度达到一定水平的,经过授权的测量仪器。[/size][size=15px]2.期间核查与稳定性考核都是考核计量特性不随时间变化的能力,只是稳定性考核的参考点是从设备的最初示值开始,期间核查是从前一次校准后的示值开始。[/size][size=15px]3.期间核查与稳定性考核都是考核测量仪器在一个时间周期内量值的变化情况。但是稳定性考核查看的是被考核对象建立以后的长期变化,时间跨越多个校准周期,延续到这个测量仪器的生命周期;期间核查查看的仅是被考核对象在一个校准周期内的变化,下一次校准后,其参考值被归零。[/size][size=15px]4.期间核查与稳定性考核都需要有一个稳定的核查标准,其与被考核计量特性对应的量值必须非常稳定。对于稳定性考核,在被考核仪器的整个生命周期内,核查标准量值的变化应可以忽略;而对于期间核查用的核查标准,其稳定性在一个校准周期内的变化可以忽略即可。[/size][size=15px]5.期间核查与稳定性考核均可以绘制一条量值变化曲线。由于稳定性考核跨越被考核测量仪器的整个生命周期,这条曲线肯定可以被画出。期间核查的数据仅限于一个校准周期,如果实验室制定的期间核查计划,每个校准周期仅一次核查,就无从绘制曲线。[/size][size=15px]6.任何测量仪器均可以进行稳定性考核。有些测量仪器需要利用一个稳定的实物量具进行稳定性考核,例如,三等量块检定装置;有些实物量具可以通过每年的校准数据进行稳定性考核,例如,三等量块标准装置。但是期间核查不是每个测量仪器可以做的,例如,三等量块标准装置,三等量块本身已经是建标单位的最高标准,建标单位本身没有更高准确度的测量仪器对其实施期间核查。[/size]
长期稳定性试验必须按照药典温湿度要求去做吗?如果我的品种要求的储存温度是阴凉,也要在25度下做长期考察吗?大家做长期试验的时候都是在药品稳定箱或是培养箱中进行考察的吗?没有在规定储存条件下进行的吗?
按照光谱检定规则:1.A级 B级仪器短程稳定性RSD/% 2.0 4.0仪器长期稳定性RSD/% 4.0 8.0性能低于B级的,不能用于公证数据测试。2. 一般验收时的两个稳定性要求:短期稳定性:repeat n=10 RSD0.5%长期稳定性:repeat/10min,n=24 RSD2%你的ICP-OES稳定性如何?

[font=微软雅黑, &][size=14px][color=black]就如[/color][/size][/font][font=微软雅黑, &][size=14px][color=black]ISO/IEC 17043:2010条款中所述,能力验证计划(能力验证)提供者所面临的其中一项挑战是证明样品足够稳定以确保产品在整个能力验证计划的实施过程,包括存储和运输时不会发生任何重大[/color][/size][/font][font=微软雅黑, &][size=14px][color=black]的变化。[/color][/size][/font][font=微软雅黑, &][size=14px][color=black]尽管产品会在能力验证提供者内部进行稳定性测试,但仍不可能完全预测或重现在运输过程中有可能接触到的所有环境条件,包括温度,湿度以及大气压。[/color][/size][/font][font=微软雅黑, &][size=14px][color=black]虽然能力验证计划的组织者可以采取一些相关措施以预防这些环境变化,例如冷链运输, 但这些措施往往会增加成本, 并且仍无法完全确保所有样品在运输的过程中都暴露在相同的环境下。[/color][/size][/font][font=微软雅黑, &][size=14px][color=black]LGC已经组织了超过20年的能力验证计划,参加者遍布全球的150多个国家。其中规模最大,运行时间最长的能力验证计划之一是食品微生物计划(QMS),该计划有超过2000名参加者。并且为了提高稳定性,所有QMS样品均由冻干微生物制备而成。因此,本研究着眼于从QMS中获得的大量数据以了解各种运输状况是否以及如何影响参加者的结果。[/color][/size][/font]
我现在正在做兽药原料药,不知道该怎么去做稳定性试验,查资料说稳定性试验主要用来为药品的保质期提供依据,听说需要把药品 放置一个季度之后拿出来做全检,然后每个季度全检一次,药典上面的有效期是两年,我们是不是需要把每批产品都拿来做稳定性试验?还是只需要其中几批就可以了,具体方案该如何确定?希望大家帮帮忙,谢谢!
想向大家请教一下醛类的稳定性问题,一般说醛类既有氧化性又有还原性,那么它的氧化还原反应在自然水体中容不容易发生呢?还有就是关于 不饱和的烯醛类,在自然水体中它的稳定性如何,更容易发生哪些反应? 比如2,4-Heptadienal、2,4-Decadienal和2,4,7-Decatrienal这类物质?
稳定性研究的目的是考察药物在温度、湿度、光线的影响下随时间变化的规律,为药品的生产、包装、贮存、运输条件提供科学依据,并确定药品的有效期。药品的稳定性是其质量的重要评价指标之一。中成药稳定性研究的范围一般根据稳定性变化的实质分为化学的、物理的及生物学的三种。中成药在制备和储存过程中,因温度、水分、光线、pH值、微生物等因素的影响,易发生变质,轻则引起制剂外观的变化,重则导致药效降低,甚至毒性增大,影响药品的安全性和有效性。通过研究揭示中药制剂稳定性变化的实质,探讨其影响因素,可采取相应的措施避免或延缓制剂的不稳定性,确定有效期,是中药制剂稳定性研究的基本任务。药品的安全、有效、质量稳定、可控是对药品的基本要求,而稳定性又是保证有效性和安全性的重要因素。因此稳定性研究在中药新药研究中占有重要的地位,是不可缺少的内容。一、中药稳定性研究的现状 1.中药新药稳定性研究技术要求 (1)《中药新药研究指南》中有明确要求。在申报临床时,待测样品于临床试验用包装条件下(在包装材料质地和结构上相当于上市药品的包装)放置,并记录室温和湿度,根据该制剂申报资料临床研究质量标准草案所列性状、鉴别、检查、浸出物、含量测定等项并结合《新药审批办法》“有关中药部分的修订和补充规定“(1992年)以下《补充规定》中附件八之附表中不同剂型的稳定性考察项目要求进行。但需注意检测成分是否能说明该制剂的稳定性。如含大黄的制剂,不能单测总蒽醌,应同时检测游离蒽醌或结合蒽醌才能确定反映其成分的变化。在常温下进行考察,开始考察时间应在样品制备后1个月之内,以开始考察的结果作为0月结果,以后每月考察一次,不得少于3个月。如预测药品远期稳定性,也可在37℃一40℃和相对湿度75%条件下保存,以开始考察的结果作为0月结果,以后每月考察一次,不得少于3个月,如稳定,相当于样品保存2年内质量稳定。但稳定性试验结果,仍以常温下为准。考察样品应在3批以上,各批样品应达中试以上规模,不得将同一批样品分成3份代表3批样品,每批样品均应留有足够在稳定性试验中各次考察所需的数量。在申请生产时,药品在上市包装条件下,根据该制剂生产用质量标准草案所列项目并结合补充规定附件八附表中不同剂型的稳定性考察项目要求进行考察。同时应注意观察直接与药品接触的包装材料对药品稳定性的影响。在常温下进行考察,一般可在初步稳定性考察后继续考察,即在初步稳定性考察3个月后,放置3个月再考察一次,然后每半年一次。药品的稳定性试验在达到规定的考察时间后还可在正常室温下继续考察,每半年一次,不超过5年,为该药品审定使用期限提出依据。(2)1999年底颁布的“中药新药质量稳定性研究技术要求“,其对稳定性的要求与1992年技术要求内容基本相同。稳定性试验结果、有效期的确定,仍以常温下为准。(3)仿制药及增加规格品种,稳定性研究参照新药要求。由于申报时间较短,在提供常温稳定性资料时应同时申报3~6个月加速稳定性试验资料,以暂定有效期。但应继续进行常温试验考察,以常温下为准,最终确定有效期。2.中药稳定性研究状况从上世纪50年代开始,人们对化学药制剂的稳定性进行研究至今已积累了不少丰富的资料和经验,对考察药物制剂的质量、确定有效期、保证临床疗效的发挥起了积极的作用。中成药稳定性研究工作是从液体制剂开始的,且多为单方制剂。最先报道…的是对威灵仙注射液中原白头翁素稳定性的研究。经考察pH值、温度、光线、添加剂等因素对原白头翁素的稳定性均有影响。通过对恒温加速试验数据处理后,认为原白头翁素的化学动力学为伪一级反应,预测有效期t25℃0.9为2.3d。近10余年来,对这方面的研究引起了药学界的普遍重视,有关研究报告逐年增多,研究水平不断提高,尤其在利用稳定性研究来筛选处方、优化工艺、预测有效期等方面取得了可喜的成绩。由于液体制剂溶液的颜色、澄明度等对pH值、温度、光线、添加剂等因素较敏感,经常出现颜色变化、产生沉淀等问题,经研究不仅是物理的变化,还有化学的变化,从而影响到药效的变化,这就促使液体制剂稳定性研究的发展。由于液体制剂的稳定性影响因素较多,不容易控制,所以对液体制剂稳定性的研究报道较多,研究的范围亦较广。固体、半固体制剂一般较液体制剂稳定,但也存在不稳定的问题,且比液体制剂复杂,近几年研究报道亦在逐年增加。由于中药成分的复杂性,1992年《补充规定》要求必须报送稳定性研究资料以来,新药研究中稳定性研究工作向规范、研究内容深度和广度迈进了一大步。1999年又颁布了稳定性技术要求。但中药稳定性研究中仍存在着一些需进一步探讨的问题。如:考察稳定性指标的选择、复方中各成分相互干扰的问题,辅料对稳定性的影响及反应机理等,有些试验方法尚需进一步完善。3.目前存在的主要问题现阶段申报的稳定性资料中仍存在着以下问题:(1)没有说明包装材料的材质及包装情况;(2)没有说明稳定性试验储存条件;(3)0月考察时间表达不准确,开始考察时间应在样品制备后一个月之内,以开始考察的结果作为O月结果;(4)没有按质量标准及制剂要求进行全面检查;(5)对于中药新药注册分类l、5类原料药没有对高温、高湿等与储存条件有关的影响因素进行考察;(6)稳定性考察所用样品不是中试生产样品;(7)没有提供包装材料对药品稳定性影响的研究资料等。
AA火焰稳定性不好的处理方法1.AA火焰稳定性不好的处理方清洗燃烧头,确保出火细缝没积碳,污垢,内腔没锈迹。若半年以上没洗燃烧头,可能要拆开刮除磨去污迹、锈迹(虽然我不建议你拆开); 2.同样清洗雾化室,雾化器组件,加装扰流器(若没装);3.按以上所述调节灵敏度,有必要降低一点灵敏度,来获得多一点稳定性;4.所有的溶液(空白,标准,样品)都要用1%的硝酸来定容.注意:含氰电镀样要充分稀释后再加酸;5 .元素灯点亮20分钟,火焰点燃30分钟以达稳定,且样品与样品之间吸喷1%的硝酸冲洗;6. 吸光值低于0.01的样品,要获得好的(低的)RSD是不切实际的;7.用擦镜纸清洁光路窗口(元素灯窗口、进光路窗口、燃烧头两端窗口);8.部分元素的推荐波长强度弱,在测量浓度高的样品时改用第二波长(As197.2,Fe372.0,Ni352.5,Pb283.3,Pd340.5,Sb231.2,)来检测;9. 测碱土元素(钡、锶、钙、镁)时要加比它活泼的碱金属或碱土金属来防止电离(且关掉扣背景),提高稳定性;或用发射法来测。
大家说说现在荧光上哪些技术可以提高测汞的稳定性。。。。同时测汞时要注意哪些地方,可以保证不被交叉污染,和保证测汞的稳定性?
一个品种,现在做到了稳定性考察6月,发现加速6月有关物质的单杂和特定的杂质都超过了原来拟定的质量标准。长期6月虽然没超,但看趋势的话,在24月内铁定要超的。我们和参比制剂同比做的稳定性,参比制剂也是这种情况。请问这时候该怎么办呢?更改质量标准有关物质的限度吗?可是这个限度又是怎么定的呢?
乳液是热力学不稳定的体系,其寿命是有限的。预示乳液的稳定性是化妆品配方师重要的问题。市售化妆品必须有2—3年的货架寿命。乳液货架寿命可定义为乳液变坏至消费者不可接受的程度所经历的时间长短。市售化妆品由于分销、储存至消费者全部用完,需经历较长一段时间,一般化妆品货架寿命为2~3年,一些国家要求含防晒剂非处方药(OTC)的乳液,稳定性长于5年。由于实时货架寿命测定费时,一般化妆品公司较少进行实时货架寿命的研究,所以设计准确预示乳液货架寿命的试验是重要的。尽管目前这类方案也不少,但还是与实际有一定距离,预示乳液的稳定性不是一件简单的事情。 (一)乳液不稳定性的机理 当乳液陈化时,经历物理变化使乳液不稳定。其中包括重力作用分层、絮结和歧化作用。 重力作用分离可能的结果是絮凝,絮凝是一种沉降或分层现象,絮凝时仍然是被乳化,但富被分散相层浓集在上层(在O/W乳液中),或在下层(在W/O乳液中)。这两种重力引起变化是可逆的,摇动可使聚集的物料重新分散。这些情况服从Stokes定律,即分离速度与油相和水相之间的密度差,连续相的黏度和被分散相粒子大小成比例。因而,增加连续相的黏度,或使用胶体磨或均质作用降低粒子大小可增加乳液的稳定性。 当被分散相液滴聚到一起,结合形成较大的液滴,发生聚结作用。最终会产生相分离。如果当乳化剂的用量不足以使液滴保持较小的尺小,但足以防止絮凝,或进一步聚结成有较大粒子分布的乳液时,这样情况称为有限聚结作用。 歧化作用是由于液滴内部压力较液滴外部压力大引起的结果。这样推动力将引起化学组分由小液滴扩散至较大的液滴,或可能扩散至连续相。由于表面活性剂体系不同组分可能由以不同的速率由小液滴扩散至大液滴,结果小液滴变小,大液滴变大。
如题,欢迎讨论!稳定性考察项目是否有差别? 样品处理、放置有差异吗?

[b]药品稳定性试验箱[/b]采用了温度、湿度、光照等综合性环境模拟方式,来对药品进行温度、湿度、光照等条件下的稳定性。对于制药行业来说,药品稳定性试验箱是必不可少的药品检验试验设备,根据其检测药品保存的温度、湿度、光照强度等情况来了解药品的很佳保存方式,以及药品的稳定性检测。[align=center][img=,348,348]https://ng1.17img.cn/bbsfiles/images/2021/07/202107291711294462_7879_1037_3.jpg!w348x348.jpg[/img][/align] 药品稳定性试验箱利用温度、湿度、光照环境来对药品的失效条件和时间进行检测,尤其是对一些新药进行加速试验、高温试验和强光照试验,这种方式是目前制药企业对药品的稳定性进行检测的很佳方式。 综合药品稳定性的作用有两种,一是采用高温、低温、高低温交变、空气湿润、强光照等多环境因素来对药品的稳定性进行测试,根据试验测试情况来对药品进行改善,以得到稳定性很强的药物 二是对于一些特殊药物进行检测,找到其保存的很佳环境因素。目前药品稳定性试验箱主要是用来检验药品在环境因素下的稳定性。 通过药品稳定性试验箱的测试,可以获得关于药品对温度、湿度、光照条件下的测试数据,可以了解该药品在环境因素下稳定性变化情况,然后根据这些数据制药企业可以确定药物生产的包装、储存条件和安全的有效使用期限。
现在XRF设备越来越普及了,但是我们应该怎样去评定一个仪器的好坏呢! 有人说要看仪器的稳定性来判定?但是具体的稳定性测试有一个准确的标准吗?那又怎样测试仪器的稳定性呢?
仪器的稳定性怎么做,分析方法的稳定性怎么做?
稳定性实验中各项对样品有什么要求呢?如影响因素实验是用实验室放大的呢?还是中试放大批呢?
农药稳定性直接影响检测结果,甲拌磷、辛硫磷、三氯杀螨醇、咪酰胺、百菌清、福美肿等农药稳定性差,易氧化、水解、分解或易热分解。对这些农药应采用合适的检测方法,并关注其代谢产物。辛硫磷可用液相检测,其它几种用什么方法检测呢?
我想请教一下各位对于产品的稳定性实验是采用留样室内的样品还是在仓库库存的产品进行稳定性实验的。
药品的稳定性是指原料药及制剂保持其物理、化学、生物学和微生物学的性质,通过对原料药和制剂在不同条件(如温度、湿度、光线等)下稳定性的研究,掌握药品质量随时间变化的规律,为药品的生产、包装、贮存条件和有效期的确定提供依据,以确保临床用药的安全性和临床疗效。 稳定性研究是药品质量控制研究的主要内容之一,与药品质量研究和质量标准的建立紧密相关。稳定性研究具有阶段性特点,贯穿药品研究与开发全的过程,一般始于药品的临床前研究,在药品临床研究期间和上市后还应继续进行稳定性研究。 本文为一般性原则,具体的试验设计和评价应遵循具体问题具体分析的原则。 二、稳定性研究设计的考虑要素 稳定性研究的设计应根据不同的研究目的,结合原料药的理化性质、剂型的特点和具体的处方及工艺条件进行。 (一)样品的批次和规模 一般地,影响因素试验采用一批样品进行,加速试验和长期试验采用三批样品进行。 稳定性研究应采用一定规模生产的样品,以能够代表规模生产条件下的产品质量。原料药的合成工艺路线、方法、步骤应与生产规模一致;药物制剂的处方、制备工艺也应与生产规模一致。 稳定性研究中,原料药的供试品量应满足其制剂稳定性试验所要求的用量。口服固体制剂如片剂、胶囊应为10000个制剂单位左右。大体积包装的制剂(如静脉输液等)每批中试规模的数量至少应为各项试验所需总量的10倍。特殊品种、特殊剂型所需数量,视具体情况而定。 (二)包装及放置条件 稳定性试验要求在一定的温度、湿度、光照条件下进行,这些放置条件的设置应充分考虑到药品在贮存、运输及使用过程中可能遇到的环境因素。 原料药的加速试验和长期试验所用包装应采用模拟小包装,所用材料和封装条件应与大包装一致。药物制剂应在影响因素试验结果基础上选择合适的包装,在加速试验和长期试验中的包装应与拟上市包装一致。 稳定性研究中所用设备应能较好地对各项试验条件的要求的环境参数进行控制和监测。 (三)考察时间点 由于稳定性研究目的是考察药品质量随时间变化的规律,因此研究中一般需要设置多个时间点考察样品的质量变化。 考察时间点应基于对药品的理化性质的认识、稳定性趋势评价的要求而设置。如长期试验中,总体考察时间应涵盖所预期的有效期,中间取样点的设置要考虑药品的稳定性特点和剂型特点。对某些环境因素敏感的药品,应适当增加考察时间点。 (四)考察项目 稳定性研究的考察项目应选择在药品保存期间易于变化,并可能会影响到药品的质量、安全性和有效性的项目,以便客观、全面地反映药品的稳定性。根据药品特点和质量控制的要求,尽量选取能灵敏反映药品稳定性的指标。 一般地,考察项目可分为物理、化学、生物学和微生物学等几个方面。具体品种的考察项目设置应结合药品的特性进行。 (五)显著变化 稳定性研究中如样品发生了显著变化,则试验应中止。一般来说,原料药的“显著变化”应包括: 1、性状,如颜色、熔点、溶解度、比旋度超出标准规定,及晶型、水分等变化超出标准规定。 2、含量测定超出标准规定。 3、有关物质,如降解产物、异构体的变化等超出标准规定。 4、结晶水发生变化。 一般来说,药物制剂的“显著变化”包括: 1、含量测定中发生5%的变化;或者不能达到生物学或者免疫学检测过程的效价指标。 2、药品的任何一个降解产物超出标准规定。 3、性状、物理性质以及特殊制剂的功能性试验(如颜色、相分离、再混悬能力、结块、硬度、每揿给药剂量等)超出标准规定。 4、pH值超出标准规定; 5、制剂溶出度或释放度超出标准规定。 (六)分析方法 评价指标所采用的分析方法应经过充分的验证,能满足研究的要求,具有一定的专属性、准确性、灵敏度、重现性等。