1.色谱出峰但是峰上没有保留时间是怎么回事?2.色谱峰分离不开怎么回事?
我现在使用GC-MS监测环境中的PAHs。GC-MS型号:GC-17A;GC-MS QP5050Column: Rtx-5MS; 低极性,5% diphenyl/95% dimethyl polysiloxane,30m 0.25mm 0.25温度程序:70度(4分钟),升温至300度(10度/分),300度(10分钟)PAHs:16种问题:1.分子质量和沸点相同或相似的物质无法分离,出现在一个波峰中2. 同一种物质出现两个保留时间,其中有一种物质的保留时间相差将近1分钟,其他物质的保留时间相差不大希望得到高手的指教,谢谢!
前一段时间找出了比较好的方法,可是一段时间不测后,再用这个方法,保留时间和分离度都变了很多,请问是什么原因?做的是2,5-二羟基苯甲酸和水杨酸的分离,前一段时间已经做出了一个比较稳定的方法了,中间有4天不做,一直用95%的乙醇泡着柱子,再做的时候发现保留时间和分离度都一致地变了。就是说新做的这一批样保留时间和分离度都比较一致,可是跟之前做的数据完全不同。有人知道这是什么原因吗?
[b]问[/b]:我新建了一种[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相[/color][/url]分离方法,但该方法似乎对 pH 值的变化非常敏感。这是一个简单的反相色谱方法,我没有使用任何的离子对试剂。我发现保留时间每天都有很大的变化,我可以确认 pH 值确实存在微小变化。问题出在哪里?[b]答[/b]:从您对问题的描述来看,您所处理的是:pKa 值接近流动相[i][/i] pH 值的离子型化合物。因此,您需要处理两种保留时间明显不同的化合物。例如,这可能是质子化和非质子化形式的酸。带电形式化合物的保留因子要比不带电形式的要小得多。两者之间的平衡取决于 pH 值。流动相 pH 值的微小变化会改变化合物两种形式的比例,从而影响保留时间。因此,有必要严格控制 pH 值。由于您已经做了一些实验,您可能已经获得了足够的信息来定量了解保留时间与 pH 值的关系。如果还没有,可以做一些对照实验来获得这方面的知识。此外,您还可以查看该方法的历史记录。这些信息应该是在方法稳健性测试过程中产生的。一旦有了依赖性,您就需要决定您可以接受的保留时间波动范围。然后计算 pH 值调整的精度。即使在困难的情况下,±0.02 pH 单位的精度也应该足够了。
如题,样品是酸类的,已经知道样品有顺反异构体,试了甲醇和乙腈。出峰就一个峰,想知道是不是峰的保留时间差不多而重叠了,如果是这样该用什么好的方法来分离开
极性化合物完美分离保留 Atlantis色谱柱 给极性化合物和非极性化合物的保留提供了完美的平衡下载Atlantis色谱柱介绍资料(PDF) Atlantis 色谱柱使用高纯度硅胶及双键键合 C18 技术,并对填料的孔径大小、端基封口以及 C18 的键合密度进行优化,从而使 Atlantis 色谱柱具有: 对极性化合物保留能力强,在水流动相中性能稳定,低 pH 条件下色谱柱寿命长,与质谱兼容,色谱峰形优异,重现性好等优点。Atlantis 色谱柱目前提供3um和5um两种粒度填料,键合相类型则有dC18和HILIC(亲水交互作用)两种类型。Atlantis 资料目录:极性化合物的保留ATLANTI dC18 反相HPLC分析的理想选择极性化合物的保留增强色谱柱的长寿命和低pH稳定性为使用水溶液流动相优化的填料即使没有内嵌极性官能团也与水溶液兼容完全端基封口色谱柱的优势极性和非极性化合物保留的最佳平衡ATLANTI dC18 色谱柱在肽谱方面的应用ATLANTI dC18快速分析柱优异的重现性轻松放大、更长、可预计的色谱柱寿命保留和高上样量的优化亲水相互作用色谱柱(HILIC)ATLANTIS HILIC 硅胶色谱柱适合于在反相色谱柱上不能保留的化合物的分离HILIC能够提高ESI-MS的灵敏度简化样品制备过程Atlantis dC18 色谱柱使用过程中的问题解决方案与故障排除HILIC Silica 色谱柱HILIC与反相色谱互补的选择性提高LC/MS灵敏度世界一流的宽PH值 极限色谱柱 Waters XTerra色谱柱 PH1-12 无与伦比的批间重现性 极佳的对称性 纯水流动相 Symmetry色谱柱100%纯水流动相 宽PH值 XTerra RP纯水极限色谱柱 PH2-12SunFire色谱柱 最好的低PH值稳定性 最佳粒度和批次重现性 满足制药行业最严格的性能要求
各位在下正在优化液相方法分析甜菜碱。现在分析条件如下: 色谱柱为Waters HILIC,检测器为DAD,等度洗脱, 流动相为:A-10 mM 的乙酸铵;B-乙腈,A:B=30:70。我想 1.将6.4min的色谱峰保留时间后移,且6.4min后面还有一个峰完全没有分开; 2.将保留时间为15.3min、15.8min和16.4min三个色谱峰的完全分离;求各位大牛们,多给支招啊!不胜感激!
请问各位老师,是什么原因造成保留时间拖后反而分离不好了呢?同一根柱子[img=,690,517]https://ng1.17img.cn/bbsfiles/images/2022/06/202206091729474684_7663_5072614_3.png[/img]
柱温对分离度和保留时间有何影响呢,欢迎大家来讨论
色谱分离不好和组分保留时间显著变短是色谱柱失效吗?什么原因?
色谱柱有长有短,长的250mm,短的只有10mm,除了改善分离度和延长保留时间外还有什么作用呢?

各位在下正在优化液相方法分析甜菜碱。现在分析条件如下: 色谱柱为Waters HILIC,检测器为DAD,等度洗脱, 流动相为:A-10 mM 的乙酸铵;B-乙腈,A:B=30:70。我想 1.将6.4min的色谱峰保留时间后移,且6.4min后面还有一个峰完全没有分开; 2.将保留时间为15.3min、15.8min和16.4min三个色谱峰的完全分离;求各位大牛们,多给支招啊!不胜感激!http://ng1.17img.cn/bbsfiles/images/2015/06/201506261536_551908_2648817_3.jpg
求助各位大神,在岛津的[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]液质[/color][/url]上跑的磺胺对甲氧嘧啶和磺胺甲氧哒嗪在C18的色谱柱上保留时间一样完全分不开,尝试了降低有机相的浓度,还是不行。在质谱上也只有一个峰。怎么才能将两种化合物分离开呢?
使用离子对试剂四丁基硫酸氢铵的问题使用离子对试剂四丁基硫酸氢铵进行梯度洗脱分析一染料中间体的乙酸溶液时(流动相A :100ml乙腈+900ml水+1.5g四丁基硫酸氢铵;流动相B:900ml乙腈+100ml水+1.5g四丁基硫酸氢铵),前一样品分析正常,用水:乙腈=90:10 洗脱2小时,再用流动相平衡后再做一样品就发现分离效果不好,有两个保留时间相近的峰分离不开,而且有时出现了两峰位置互换的现象,清洗时间延长至10小时以上,又可恢复。有时重新配置流动相后也可恢复,请教是什么原因,如何避免?谢谢!
[font=微软雅黑, sans-serif][size=14px][color=#545454]欢迎来到ChromClass,我们在使用色谱仪器时,经常会遇到一些专业术语,很多同学对它们并不是非常的了解,今天,我们就带大家解读一些常用的色谱术语。[/color][/size][/font][font=微软雅黑, sans-serif][size=14px][color=#545454][/color][/size][/font][color=#0db4f8]保留时间[/color][font=微软雅黑, sans-serif][size=14px][color=#545454]首先是保留时间t[/color][/size][/font][font=微软雅黑, sans-serif][size=14px][color=#545454]R,[/color][/size][/font][font=微软雅黑, sans-serif][size=14px][color=#545454]它代表了色谱组份从进样到到达峰顶的时间,通常用来定性。[/color][/size][/font][align=center][img]https://img.antpedia.com/instrument-library/attachments/wxpic/a4/e8/6a4e8962fbc1625c0c7ecceb97deeef7.jpeg[/img][/align][font=微软雅黑, sans-serif][size=14px][color=#545454][/color][/size][/font][color=#0db4f8]死时间[/color][font=微软雅黑, sans-serif][size=14px][color=#545454]其次是死时间tM:死时间代表不保留组份的保留时间,通常用来校正[url=https://insevent.instrument.com.cn/t/Mp][color=#3333ff]气相色谱[/color][/url]柱柱长。[/color][/size][/font][align=center][img]https://img.antpedia.com/instrument-library/attachments/wxpic/0c/bd/20cbd0c9abdb7aec285607f83b962f16.jpeg[/img][/align][font=微软雅黑, sans-serif][size=14px][color=#545454][/color][/size][/font][font=微软雅黑, sans-serif][size=14px][color=#545454][/color][/size][/font][color=#0db4f8]调整保留时间[/color][font=微软雅黑, sans-serif][size=14px][color=#545454]而调整保留时间tR’指的是保留时间减去死时间。[/color][/size][/font][align=center][img]https://img.antpedia.com/instrument-library/attachments/wxpic/9e/61/f9e61aa3bc37b1f8704c7151bca0ba8a.jpeg[/img][/align][font=微软雅黑, sans-serif][size=14px][color=#545454][/color][/size][/font][color=#0db4f8]分离度R[/color][font=微软雅黑, sans-serif][size=14px][color=#545454]分离度R代表两个峰相对其峰宽的[/color][/size][/font][font=微软雅黑, sans-serif][size=14px][color=#0db4f8]分离程度[/color][/size][/font][font=微软雅黑, sans-serif][size=14px][color=#545454],公式如下:[/color][/size][/font][align=center][img]https://img.antpedia.com/instrument-library/attachments/wxpic/50/a8/d50a839cc7bf5e3c371a6616f5e82149.jpeg[/img][/align][font=微软雅黑, sans-serif][size=14px][color=#545454][/color][/size][/font][font=微软雅黑, sans-serif][size=14px][color=#545454]当R=1时,两个峰的峰面积有5%的重叠,即两个峰的分开程度是95%;[/color][/size][/font][align=center][img]https://img.antpedia.com/instrument-library/attachments/wxpic/cf/69/fcf695efbe029a621885a90f527420ca.jpeg[/img][/align][font=微软雅黑, sans-serif][size=14px][color=#545454][/color][/size][/font][font=微软雅黑, sans-serif][size=14px][color=#545454]R=1.5时,两个峰的分开程度是99.7%,我们认为此时实现了基线分离;[/color][/size][/font][align=center][img]https://img.antpedia.com/instrument-library/attachments/wxpic/9f/5c/99f5cd26d0ce236bc22cc66bdea4616d.jpeg[/img][/align][font=微软雅黑, sans-serif][size=14px][color=#545454][/color][/size][/font][color=#0db4f8]容量因子k[/color][font=微软雅黑, sans-serif][size=14px][color=#545454]还有一个术语叫容量因子k,它指的是在一定的温度和压力下,组分在固定相和流动相中分配达到平衡时,分配在固定相和流动相中的质量比, 代表了样品与填料的作用强度。公式如下:[/color][/size][/font][align=center][img]https://img.antpedia.com/instrument-library/attachments/wxpic/75/c8/175c843c8de2f625d0bd47885ae68e37.jpeg[/img][/align][font=微软雅黑, sans-serif][size=14px][color=#545454][/color][/size][/font][font=微软雅黑, sans-serif][size=14px][color=#545454]当k=0时,代表化合物全部存在于流动相中,在固定相中不保留,此时调整保留时间为0;[/color][/size][/font][align=center][img]https://img.antpedia.com/instrument-library/attachments/wxpic/32/17/b3217b86263610f5ffbfe89a18ffa83a.jpeg[/img][/align][font=微软雅黑, sans-serif][size=14px][color=#545454][/color][/size][/font][font=微软雅黑, sans-serif][size=14px][color=#545454]当k越大,就说明固定相对此组分的容量越大,出柱越慢,保留时间也越长。[/color][/size][/font][align=center][img]https://img.antpedia.com/instrument-library/attachments/wxpic/87/46/d8746e617bee4898397f7358386dd343.jpeg[/img][/align]
在进行多种化合物同时分析时,经常会遇见两种化合物保留时间tR一致或相近成并肩峰,就是指前一色谱峰的峰尾还没有完全结束,后面的色谱峰峰前端已经出来,从而造成两峰完全重叠或成并肩峰。利用分离度R考察,一般R≤1时,认为两色谱峰有明显重叠。有时候是最开始就分离不开,有时候是原来能分开的,由于某些原因导致后来分不开。在未知样品检测中出现这种情况,就会导致我们无法对该色谱峰进行准确的定性和定量,那么到底有哪些原因会造成这种情况?遇到这种情况,该如何改善其分离效果,增加定性定量准确度?
替xiaoyujin版友发试验帖。五十种左右的混标包括一些毒品、精神类药物还有有机磷农药,将这混标进入GC/MS分析,发现有两种组分(共四组)无法分开,保留时间完全重合或者几乎重合,我把进样口温度从250度调到280度,又把升温速率从5℃/min降为3℃/min,发现对那几种物质的分离效果基本没有任何改善。请各位帮忙,有什么好的解决办法?
在保证分离度的前提下,气相色谱保留时间一般控制在多长时间比较好?
应邀参加体育赛,色谱县令乐开怀,随同前往有三君,A君B君和C君,A君长着极性相,常与碱性有来往,B君温柔又善良,不左不右好心肠,C君外貌并不洋,私下与酸谈对象。 色谱县令坐上轿,前面三君来开道,一路正在往前赶,遇到情况不一般,绿女红男路两边,硅胶基质路上现,不酸不碱没有盐,貌似甲醇与水在中间。 A君显得很怠慢,一见绿女不想前,拉在后面嘴真甜,还想留影做留念。 B君什么都不见,一心一意保安全。 C君跑在最前边,摇摇欲试跑得欢,虽然没有强保留,但有尾巴在后头。 色谱县令连忙喊,A君为何走得慢,C君等等本县官…… 这时县令心里着急,却陡然想起色谱柱分离——这现象虽然与色谱无关,但貌似与色谱分离有缘! 中性,酸性化合物在中性条件下,具有较好的保留,碱性化合物容易受硅醇活性的影响引起拖尾。 有些碱性化合物,在具有显著硅醇活性固定相的色谱柱上大部分都会发生拖尾现象,而且在中性pH(6~8)比在酸性pH(3)条件下更易发生。 中性,和酸性化合物一般不受影响,一些碱性化合物更易受到此效应的影响。 说时迟那时快,色谱县令登上检阅台,三君进行热身赛,全力争夺金银牌。 首先进行游泳赛,先把规则晒一晒,游泳赛道有规定:第一赛道显酸性,第二赛道呈碱性,硅胶基质键合相,羟基藏在泳道旁;中间流体甲醇水,体积比例正相当;池中温度正适宜,极性相比较大滴;三人一道同时比,名次分出三二一。 第一赛道已上场,三君优势不一样,各有诀窍心中藏,面对泳道有幻想,浑身聚集正能量,只等发令往前闯! 呯……一声发令枪响,哗……三君冲入赛塘,这可是要命的比量…… 色谱县令看得清亮,C君很快沉入池塘,若隐若现像捉迷藏;B君悠然自得往前闯,环境基本没有影响;A君却是一如既往,发挥相对比较正常,色谱县官连连赞赏,鼓励A君继续发扬。本次比赛排名A——B——C。 此时,县令心中窃喜,这不正是色谱分离? 中性,和酸性化合物在酸性的条件下,具有较好的保留,有的会发生拖尾。 某些碱性化合物在酸性的条件下,发生拖尾现象,甚至没有保留,提前出柱。 酸类化合物在酸性条件下,有时会引起峰的展宽和拖尾,主要由于硅胶固定相的吸附——纠正由此类原因引起的拖尾,就应提高流动相中缓冲盐的浓度来抑制二次反应,降低流动相的pH使硅醇和溶质质子化,必要时可以向流动相中加入竞争性的酸,改善峰型,达到更好的分离效果。 第二赛道接着上场,三君表现又会怎样,不要着急请看比赛现场! 发令枪一声鸣响,三君一起冲进泳塘,这次比赛不太一样:A君立马将身隐藏,不知不觉早出池塘;B君竭尽全力往前闯,整个赛程痛断心肠;C君表现比较顽强,小小差错比较正常,总体发挥值得赞赏,赢得冠军美名远扬;本次比赛排名C——B——A。 色谱县令看傻了眼,A君让他产生失望感,总体来说还不错,不过都有拖尾巴。三人一道超限量,争抢第一太慌忙。条件不适调配方,因人而异不勉强。 三君泳赛已完毕,问题暴露很彻底。不言而喻不多言,色谱分离在里面。http://ng1.17img.cn/bbsfiles/images/2016/03/201603231943_588030_2960432_3.png 碱性化合物在碱性的条件下,具有较好的保留,但中性化合物和碱性化合物在碱性条件下,有时会出现拖尾——解决的办法提高流动相的PH值,抑制碱性化合物的电离,使其为分子状态。 固定相表面的酸性硅醇基可以形成与碱性化合物反应的离子交换位点,经反相HPLC分离某些化合物时,这种离子交换反应常常引起峰的保留(二次保留)和峰拖尾。 对于一个碱性化合物,在无盐流动相下保留时间过长,那么可以采用控制流动相为低pH条件,使其达到完全解离,增加其极性,达到缩短分离时间的目的。如果分离的化合物pKa比较低(酸性化合物),在无盐流动相下保留时间比较长,可以采用控制流动相为高一些的pH条件,道理相同。对于保留时间过短的采用相反的调整方式即可, 当进样量超过柱子的容量,样品峰会呈现一个直角三角形。当更多的样品量注入时,峰的前端变得很尖而后端就拖尾更严重。 另一个现象就是色谱柱过载后保留时间会随样品量的增加而提前。 游泳比赛已结束,稍作休整进入下一步,后面的赛事更残酷,三君便要下功夫,比赛要有好基础,切记不要出事故。 色谱县令看得明,每个赛点都很清,有话想对三君言,他们已在赛道前。无奈回到观赏台,也许赛事更精彩! 下面进行跨栏赛,三君状态有好坏。A君身高体重大,矮子一见吓趴下,虽然优势比较大,赛道并不适合他。B君小巧又玲珑,伶俐机动好名声,自信赛出高水平,努力争创第一名。C君B君像孪生,只是不如B聪明,总结经验记心中,赛出风格显威名。 三君耳闻令枪响,如龙似虎奔前方,A君好像被栏挡,一脚摔在赛道旁,B君C君受影响,三人跌在栏板上,A君倒下起不来,大赛提前被淘汰,B君机灵觉醒快,恢复状态把路带,C君随后跟其上,仅排第二把名扬。 色谱县令观其景,评价三君各不同,A君确实不适应,摔倒也在料想中,身高体大便臃肿,堵了赛道没功名,B君C君都拖尾,埋怨A君伤感情。 这个道理很显明,分离原理在其中: 对于不适应色谱柱检测的化合物,污染色谱柱的可能性很大,被污染的色谱柱,影响正常检测,使被测组分出现拖尾现象,甚至不出峰。 这场大赛进行中,色谱县令主意生,一声令下招三君,总结失败啥原因…… http://ng1.17img.cn/bbsfiles/images/2017/10/2015071305022999_01_2960432_3.png
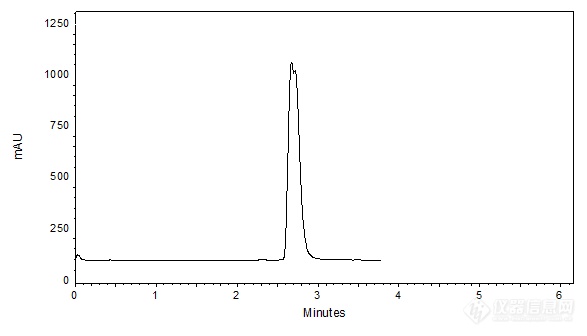
[align=center][b]肌肽和鹅肌肽的液相拆分[/b][/align]肌肽(β-丙氨酰-L-组氨酸,L-Carnosine),是由β-丙氨酸和L-组氨酸两种氨基酸组成的二肽;鹅肌肽(β-丙氨酰-1-甲基-L-组氨酸,Anserine),为高度稳定的水溶性二肽,天然存在于脊椎动物的骨骼肌组织和脑组织中。客户提供了肌肽和鹅肌肽单标,希望本实验室建立液相分离方法。由于肌肽和鹅肌肽二者结构只相差一个甲基,极性差异较小,相对分离难度大。 [img=,144,124]http://ng1.17img.cn/bbsfiles/images/2018/08/201808090931580308_6331_2222981_3.gif!w144x124.jpg[/img] [img=,161,101]http://ng1.17img.cn/bbsfiles/images/2018/08/201808090931577848_7200_2222981_3.gif!w161x101.jpg[/img] 肌肽 鹅肌肽 L-Carnosine L-Anserine MW:226.23 MW:240.26首先,尝试使用键合立体笼状结构金刚烷基官能团的高表面极性色谱柱——CAPCELL PAK ADME,在酸性纯水相条件下进行分析,发现肌肽和鹅肌肽出现分离趋势,但由于保留时间较短,无法达到有效分离,结果如图1所示。[align=center][img=,587,336]http://ng1.17img.cn/bbsfiles/images/2018/08/201808090933111788_8226_2222981_3.png!w587x336.jpg[/img][/align][align=center]图1 CAPCELL PAK ADME在酸性条件下分析结果[/align][img=,585,234]http://ng1.17img.cn/bbsfiles/images/2018/08/201808090933114648_9590_2222981_3.png!w585x234.jpg[/img]为了延长保留时间,将0.1%磷酸水溶液更换为0.1%三氟乙酸(TFA)水溶液,使用耐纯水的高极性色谱柱——CAPCELL PAK C[sub]18[/sub] AQ色谱柱进行分析,希望能在离子对试剂的作用下加强保留。如图2,TFA条件下保留时间延长至4min,但分离趋势减弱;同时我们也将离子对试剂更换为辛烷磺酸钠,进一步延长了保留时间,但同样分离趋势不明显。[align=center][img=,551,310]http://ng1.17img.cn/bbsfiles/images/2018/08/201808090934074804_4574_2222981_3.png!w551x310.jpg[/img][/align][align=center]图2 CAPCELL PAK C[sub]18[/sub] AQ色谱柱在TFA条件下分析结果[/align][img=,585,240]http://ng1.17img.cn/bbsfiles/images/2018/08/201808090934078134_1337_2222981_3.png!w585x240.jpg[/img]由于在酸性反相条件下保留时间较短未能得到分离,因此也考虑尝试使用HILIC模式加强保留。使用PC HILIC色谱柱在80%乙腈条件下进行分析,结果如图3所示,肌肽保留时间能够延长至10 min以上,但峰形较宽,无法得到二者分离。[align=center][img=,520,287]http://ng1.17img.cn/bbsfiles/images/2018/08/201808090936103468_4971_2222981_3.png!w520x287.jpg[/img][/align][align=center]图3 PC HILIC色谱柱分析结果[/align][img=,584,240]http://ng1.17img.cn/bbsfiles/images/2018/08/201808090936106174_1801_2222981_3.png!w584x240.jpg[/img]综合考虑上述分析结果后,继续尝试在碱性条件(pH 9.0)使用反相色谱柱进行分析。由于流动相条件碱性较强,且不含有机相,因此首先使用了[color=#2E74B5]耐碱性较强的[/color][b][color=#2E74B5]CAPCELL PAK C[sub]18[/sub] BB[/color][/b][color=#2E74B5]色谱柱[/color]进行尝试,如图4,在碱性条件下肌肽和鹅肌肽保留时间较长,且分离良好。[align=center][img=,643,354]http://ng1.17img.cn/bbsfiles/images/2018/08/201808090936537848_7200_2222981_3.png!w643x354.jpg[/img][/align][align=center]图4 CAPCELL PAK C[sub]18[/sub] BB在碱性条件下分析结果[/align][align=left][img=,586,240]http://ng1.17img.cn/bbsfiles/images/2018/08/201808090936539754_4627_2222981_3.png!w586x240.jpg[/img][/align][align=left][/align][align=left]然而,考虑到[color=red]碱性的纯水相条件非常苛刻[/color],即使使用耐碱性色谱柱进行分析,仍可能对色谱柱自身[color=red]寿命[/color]造成不良影响,因此我们进一步尝试将流动相条件由碱性调整为中性,同时比较耐碱型色谱柱BB和耐水型色谱柱AQ的分析结果。如图5,在中性条件下,耐水型色谱柱AQ的保留及分离情况要优于BB色谱柱。[/align][align=left][/align][align=center][img=,685,380]http://ng1.17img.cn/bbsfiles/images/2018/08/201808090937301594_4721_2222981_3.png!w685x380.jpg[/img][/align][align=center]图5 中性条件下CAPCELL PAK C[sub]18 [/sub]BB与AQ色谱柱分析结果对比[/align][align=left][img=,644,234]http://ng1.17img.cn/bbsfiles/images/2018/08/201808090937303774_3593_2222981_3.png!w644x234.jpg[/img][/align][align=left][/align][align=left]最终,我们选择CAPCELL PAK C[sub]18[/sub] AQ色谱柱在中性分析条件下添加5%甲醇,同时优化柱温,得到最终分析结果如图6所示,肌肽与鹅肌肽之间分离度为2.82,能够达到基线分离。[/align][align=left][/align][align=center][img=,690,406]http://ng1.17img.cn/bbsfiles/images/2018/08/201808090937597754_6120_2222981_3.png!w690x406.jpg[/img][/align][align=center]图6 CAPCELL PAK C[sub]18 [/sub]AQ色谱柱优化条件分析结果[/align]注:峰上标数字为分离度。[align=left][img=,690,225]http://ng1.17img.cn/bbsfiles/images/2018/08/201808090937599944_7234_2222981_3.png!w690x225.jpg[/img][/align][align=left][/align][align=left]综上所述,使用[b][color=#2E74B5]CAPCELL PAK C[sub]18[/sub] AQ S5 4.6 mm i.d. × 250 mm[/color][/b]色谱柱在中性高水相条件下可完成肌肽和鹅肌肽的良好保留与基线分离;实际样品分离过程中,客户可根据实际需要再做pH调整等措施来改善分离及保留。[/align][align=left][/align][align=left][/align][align=right][img=,690,127]http://ng1.17img.cn/bbsfiles/images/2018/08/201808090939079178_5457_2222981_3.png!w690x127.jpg[/img][/align]
在保证分离度的前提下,[url=https://insevent.instrument.com.cn/t/Mp]气相色谱[/url]保留时间一般控制在多长时间比较好?
在保证分离度的前提下,[url=https://insevent.instrument.com.cn/t/Mp]气相色谱[/url]保留时间一般控制在多长时间比较好?
[size=18px][font=&][url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相[/color][/url]如何改善峰形与提升分离度[/font][font=&]良好的分离度与定量的准确性密切相关。“昨天的分离度不太行呀,流动相要再调调!”这话是不是很熟悉?调调?!咋调?如果不知道如何配制合适的流动相请看过来!今天大家整理了[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相[/color][/url]改善峰形与提升分离度相关的知识,仅供大家参考~[/font][font=&]秘诀1:由强到弱[/font][font=&]一般先用90%的乙腈(或甲醇)/水(或缓冲溶液)进行试验,这样可以很快地得到分离结果,然后根据出峰情况调整有机溶剂(乙腈或甲醇)的比例。 [/font][font=&]秘诀2:三倍规则[/font][font=&]每减少10%的有机溶剂(甲醇或乙腈)的量,保留因子约增加3倍,此为三倍规则。这是一个聪明而又省力的办法。调整的过程中,注意观察各个峰的分离情况。 [/font][font=&]秘诀3:粗调转微调[/font][font=&]当分离达到一定程度,应将有机溶剂10%的改变量调整为5%,并据此规则逐渐降低调整率,直至各组分的分离情况不再改变。[/font][font=&]1.流动相的性质要求一个理想的[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]流动相溶剂应具有低粘度、与检测器兼容性好、易于得到纯品和低毒性等特征。[/font][font=&]选择流动相时应考虑以下几个方面:[/font][font=&]①流动相应不改变填料的任何性质。低交联度的离子交换树脂和排阻色谱填料有时遇到某些有机相会溶胀或收缩,从而改变色谱柱填床的性质。碱性流动相不能用于硅胶柱系统。酸性流动相不能用于氧化铝、氧化镁等吸附剂的柱系统。[/font][font=&]②纯度。色谱柱的寿命与大量流动相通过有关,特别是当溶剂所含杂质在柱上积累时。[/font][font=&]③必须与检测器匹配。使用UV检测器时,所用流动相在检测波长下应没有吸收,或吸收很小。当使用示差折光检测器时,应选择折光系数与样品差别较大的溶剂作流动相,以提高灵敏度。[/font][font=&]④粘度要低(应2cp)。高粘度溶剂会影响溶质的扩散、传质,降低柱效,还会使柱压降增加,使分离时间延长。最好选择沸点在100℃以下的流动相。[/font][font=&]⑤对样品的溶解度要适宜。如果溶解度欠佳,样品会在柱头沉淀,不但影响了纯化分离,且会使柱子恶化。[/font][font=&]⑥样品易于回收。应选用挥发性溶剂。[/font][font=&]2.流动相的pH值采用反相色谱法分离弱酸(3≤pKa≤7)或弱碱(7≤pKa≤8)样品时,通过调节流动相的pH值,以抑制样品组分的解离,增加组分在固定相上的保留,并改善峰形的技术称为反相离子抑制技术。对于弱酸,流动相的pH值越小,组分的k值越大,当pH值远远小于弱酸的pKa值时,弱酸主要以分子形式存在;对弱碱,情况相反。分析弱酸样品时,通常在流动相中加入少量弱酸,常用50mmol/L磷酸盐缓冲液和1%醋酸溶液;分析弱碱样品时,通常在流动相中加入少量弱碱,常用50mmol/L磷酸盐缓冲液和30mmol/L三乙胺溶液。[/font][font=&]注:流动相中加入有机胺可以减弱碱性溶质与残余硅醇基的强相互作用,减轻或消除峰拖尾现象。所以在这种情况下有机胺(如三乙胺)又称为减尾剂或除尾剂。[/font][font=&](三乙胺triethylamine 氨分子中的氢原子被3个乙基取代的产物。分子式(CH3CH2)3N。易挥发的无色液体,有氨的气味。熔点-114.7℃,沸点89.3℃,相对密度0.7275(20/4℃)。溶于水和乙醇、乙醚等有机溶剂。三乙胺有碱性,与无机酸能生成易溶于水的盐类。可由N,N- 二乙基乙酰氨与氢化铝锂反应制取,也可用乙醇胺进行[url=https://insevent.instrument.com.cn/t/Mp][color=#3333ff]气相[/color][/url]烷基化反应合成。用于制橡胶硫化促进剂、润湿剂和杀菌剂等,也可用作溶剂和用于合成四级铵化合物)。[/font][font=&]3. 如何选择缓冲液PH值在选择缓冲液PH值之前,应先了解被分析物的Pka,高于或低于Pka两个PH值单位的,有助于获得好的、尖锐的峰,从HH公式:PH=Pka+log([A-]/[A])得知,溶液PH值高于或低于Pka两个单位,化合物中99%以一种形式存在,而一种形式存在的化合物才能获得好的尖锐的峰。显示的是它的离子形式和中性化合物的转变,苯甲酸的Pka等于4.2,理论上由HH公示得知,当溶液PH值等于2.2时,99%的苯甲酸以中性化合物存在,PH值等于6.2时99%的苯甲酸以离子形式存在,所以当缓冲液PH值等于2.2时,中性化合物以羧酸形式保留于反相柱。[/font][font=&]当化合物只有氨基时,缓冲体系的选择十分简单,大多数氨基化合物在PH值小于9时都被质子化,所以所有PH值在7或更低的溶液均适合应用,你也许会问水的PH值大约是7,为什么还用缓冲盐,因为缓冲盐有助于增加方法的可靠性,以及色谱峰的尖锐性,PH值的降低有助于氨基化合物保留的减弱,减小化合物与硅胶表面硅羟基的作用,而使峰更尖锐,从表1 可知,任何缓冲液均可应用于氨基化合物的分析,但我们认为PH值等于3的磷酸钾盐最适合用于氨基化合物的分析。[/font][font=&]在上面两个例子中,PH=3的磷酸钾盐都能获得良好的应用,在一般情况下,它是含羧基和氨基化合物分析中最好的缓冲液,并且我们认为在氨基化合物分析中钾盐比钠盐更好。[/font][font=&]4.流动相的脱气HPLC所用流动相必须预先脱气,否则容易在系统内逸出气泡,影响泵的工作。气泡还会影响柱的分离效率,影响检测器的灵敏度、基线稳定性,甚至使无法检测。(噪声增大,基线不稳,突然跳动)。此外,溶解在流动相中的氧还可能与样品、流动相甚至固定相(如烷基胺)反应。溶解气体还会引起溶剂pH的变化,对分离或分析结果带来误差。溶解氧能与某些溶剂(如甲醇、四氢呋喃)形成有紫外吸收的络合物,此络合物会提高背景吸收(特别是在260nm以下),并导致检测灵敏度的轻微降低,但更重要的是,会在梯度淋洗时造成基线漂移或形成鬼峰(假峰)。在荧光检测中,溶解氧在一定条件下还会引起淬灭现象,特别是对芳香烃、脂肪醛、酮等。在某些情况下,荧光响应可降低达95%。在电化学检测中(特别是还原电化学法),氧的影响更大。[/font][font=&]除去流动相中的溶解氧将大大提高UV检测器的性能,也将改善在一些荧光检测应用中的灵敏度。常用的脱气方法有:加热煮沸、抽真空、超声、吹氦等。[/font][font=&]对混合溶剂,若采用抽气或煮沸法,则需要考虑低沸点溶剂挥发造成的组成变化。[/font][font=&]超声脱气比较好,10~20分钟的超声处理对许多有机溶剂或有机溶剂/水混合液的脱气是足够了(一般500ml溶液需超声20~30min方可),此法不影响溶剂组成。超声时应注意避免溶剂瓶与超声槽底部或壁接触,以免玻璃瓶破裂,容器内液面不要高出水面太多。[/font][font=&]离线(系统外)脱气法不能维持溶剂的脱气状态,在你停止脱气后,气体立即开始回到溶剂中。在1~4小时内,溶剂又将被环境气体所饱和。[/font][font=&]在线(系统内)脱气法无此缺点。最常用的在线脱气法为鼓泡,即在色谱操作前和进行时,将惰性气体喷入溶剂中。严格来说,此方法不能将溶剂脱气,它只是用一种低溶解度的惰性气体(通常是氦)将空气替换出来。此外还有在线脱气机。[/font][font=&]一般说来有机溶剂中的气体易脱除,而水溶液中的气体较顽固。在溶液中吹氦是相当有效的脱气方法,这种连续脱气法在电化学检测时经常使用。但氦气昂贵,难于普及。[/font][font=&]5.流动相的滤过所有溶剂使用前都必须经0.45μm(或0.22μm)滤过,以除去杂质微粒,色谱纯试剂也不例外(除非在标签上标明“已滤过”)。用滤膜过滤时,特别要注意分清有机相(脂溶性)滤膜和水相(水溶性)滤膜。有机相滤膜一般用于过滤有机溶剂,过滤水溶液时流速低或滤不动。水相滤膜只能用于过滤水溶液,严禁用于有机溶剂,否则滤膜会被溶解!溶有滤膜的溶剂不得用于HPLC。对于混合流动相,可在混合前分别滤过,如需混合后滤过,首选有机相滤膜。现在已有混合型滤膜出售。流动相的贮存流动相一般贮存于玻璃、聚四氟乙烯或不锈钢容器内,不能贮存在塑料容器中。因许多有机溶剂如甲醇、乙酸等可浸出塑料表面的增塑剂,导致溶剂受污染。这种被污染的溶剂如用于HPLC系统,可能造成柱效降低。贮存容器一定要盖严,防止溶剂挥发引起组成变化,也防止氧和二氧化碳溶入流动相。[/font][font=&]磷酸盐、乙酸盐缓冲液很易长霉,应尽量新鲜配制使用,不要贮存。如确需贮存,可在冰箱内冷藏,并在3天内使用,用前应重新滤过。容器应定期清洗,特别是盛水、缓冲液和混合溶液的瓶子,以除去底部的杂质沉淀和可能生长的微生物。因甲醇有防腐作用,所以盛甲醇的瓶子无此现象。[/font][font=&]6.卤代有机溶剂应特别注意的问题卤代溶剂可能含有微量的酸性杂质,能与HPLC系统中的不锈钢反应。卤代溶剂与水的混合物比较容易分解,不能存放太久。卤代溶剂(如CCl4、CHCl3等)与各种醚类(如乙醚、二异丙醚、四氢呋喃等)混合后,可能会反应生成一些对不锈钢有较大腐蚀性的产物,这种混合流动相应尽量不采用,或新鲜配制。此外,卤代溶剂(如CH2Cl2)与一些反应性有机溶剂(如乙腈)混合静置时,还会产生结晶。总之,卤代溶剂最好新鲜配制使用。如果是和干燥的饱和烷烃混合,则不会产生类似问题。[/font][/size]
现在在用Waters 2695,2475荧光检测器流动相用的是甲醇:乙腈:0.05mol/L磷酸二氢钾溶液(ph5.0)=10:5:85 柱温是35℃ 更改了流动相配比,更改盐的ph等条件后,两个化合物的保留时间始终一致我接下去该怎么尝试?这是分不开的两种化合物,可以尝试梯度分离吗?[img=,343,155]https://ng1.17img.cn/bbsfiles/images/2022/12/202212271650588428_7267_5900589_3.png!w343x155.jpg[/img][img=,250,151]https://ng1.17img.cn/bbsfiles/images/2022/12/202212271651121397_5543_5900589_3.png!w250x151.jpg[/img]
我们已经用纯物质实验了,它们的保留时间是一样的,我还是觉得按说HP-1可以分离出,但是就是不行。如果用PEG,可以分离出DMAC吗,用哪种PEG,PEG600的行吗
我最近更换了另一种牌号的ODS柱,虽然分离情况仍可以,但保留时间不能重现,为什么?
很分离分离正丁醇部位成分,我有个流份应在分析住上有3个峰,保留值相差1分钟,在制备柱上总是分不开,请高手指点一下吧。
杂质和主峰的保留时间差不多,除了改变流速和梯度外,还有什么方法能增加它们的分离度
请教各位高手:我有一个样品,其中有两个物质,在美国那边能分开,保留时间一个是1min,一个是11min,但在我们这边这两个物质却分不开,保留时间都在6min左右(部分重叠,改变条件都不见效,包括换柱子)。我们所用柱子和美国那边所用柱子固定相一样,美国那边是柱子是15m*0.53mm*1mm ,载气流速是10mL/min,我们这边柱子是60m*0.32mm*1mm,载气流速4mL/min。很是不解,按理说美国那边所用柱子短,流速大,保留时间应该都比我这边短才对。请问谁有高见?谢谢![em06]
请教各位高手,我在使用离子色谱柱(戴安ICS1500)的时候,感觉被铜离子污染,因此用草酸冲洗然后用水再走流动相,结果现在保留时间提前,而且,原来的分析条件不能将常见的7种离子分离得很好,因此,相当郁闷,请问谁有没有好的办法,挽救我的柱子?先谢谢了