平时都是做氨氮的说,前两天送来一批样品要做非离子氨,上网查标准发现GHZB 1—1999里面要求非离子氨的实验方法为《纳氏试剂比色法》(GB 7479-87),那与做氨氮的方法不是一样吗?想请教一下,究竟氨氮和非离子氨是否一样?还是有公式进行换算?!先谢谢各位大大啦
谁能提供溶液中氨离子的分析方法,在此谢过!
请问测氨氮用去离子水做零样的么?去离子水的氨氮是0么?去离子水可以放多久?谢谢了
小弟现在要测锅炉水中的氨离子含量,想做条标准曲线,手头上的方法比较繁琐,用苯酚跟氨离子反应显色用625nm波长测吸光度来做曲线,有朋友知道更好的方法么,或者类似的不需要苯酚这样有毒的试剂的好方法,谢谢
请问测氨氮用去离子水做零样的么?去离子水的氨氮是0么?去离子水可以放多久?谢谢了[em58]
请教通过[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]阳离子分析得出的铵离子含量,能不能通过计算转化成氨氮的结果,如何计算?能不能代替水质纳氏试剂比色法测氨氮?
前几天听环评说氯离子影响氨氮的测定值 ,我想知道为什么?网上没百度到原因,只说影响?
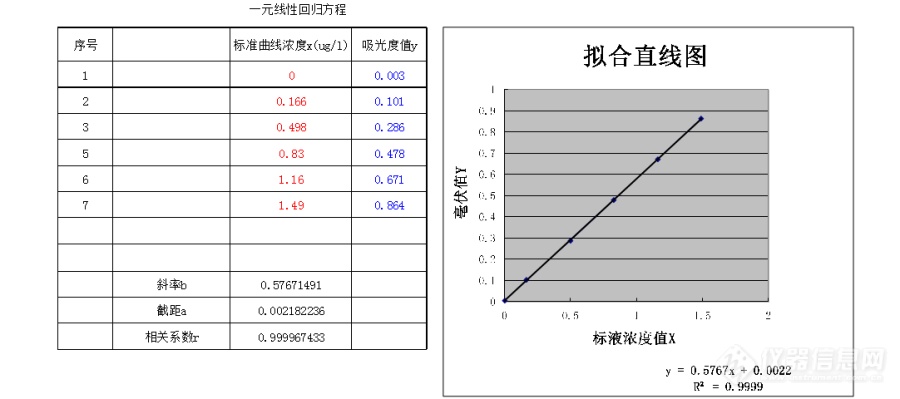
离子色谱测氨离子时,氨离子浓度在10ppm以下时是直线,但在10ppm以上时就是曲线了,不能用直线的标准曲线计算,是不是这样呢,为什么?最好有文献,谢谢各位大神了!!
氨离子选择性电极从那儿买的
如题,氨基酸中混有的氨根离子怎么测定??哪位知道,谢谢!
测定水中硝酸氨溶液氨离子浓度,最大吸收波长是多少?急问,谢谢!
我是新手,请问氨气敏电极和氨离子选择电极有什么区别吗?他们还得配着参比电极一起使用吗?用什么显示读数呢?需要配什么主机?谢谢各位大侠解答!
国产的离子选择法测量氨氮的设备,用在工艺上的
测氨氮时钙镁离子高 加完试剂水样混浊 用絮凝法感觉作用不大 怎么办呢
[size=5] [color=#013add] [size=4]那位大侠能帮我找到测试水中氨氮的离子选择电极法的标准吗?国标或行业标准或EPA方法,或EN方法... ...,多谢了![/size][/color][/size]
我们是做烟包产品的,现在想要测定成品中是否含有氨离子,需要有些什么配置呢?现有基本配置:安6820GC+7694HS美国Supelco公司VOCs专用色谱柱:60m*0.32um*1.8mmFID检测器
有人参加 IREM T11-04 水中阴离子和氨氮的测定吗?
如何使用PXSJ-216型离子分析仪测量溶液中的氨根离子和氢氰酸根离子浓度,测量范围是多少?
求助:可见分光光度法快速准确检测氨根离子,希望哥哥姐姐们帮忙出谋划策,小弟感激不尽!
用HJ889-2017三氯化六氨合钴测土壤中阳离子,标准曲线如下,样品土分别是1.5、0.8、3.6,土壤PH值是7.55,7.91。[img=,690,305]https://ng1.17img.cn/bbsfiles/images/2019/06/201906041109194001_9498_1645480_3.png!w690x305.jpg[/img]
[font=&][color=#666666]氨氮可对水体环境、鱼类等水生生物造成危害,并且引起饮水卫生问题,因此成为水质的重要监测指标之一。现行氨氮国标检测方法存在操作繁琐、引入污染、干扰因素多等弊端。与国标方法相比,[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]法具有检测形态更稳定、特异性强、干扰因素少、操作简单、环境友好等特点,且其灵敏度高、准确度高、重现性好,在基层生活饮用水检测工作中更具优势,但目前该法尚未被纳入国标方法中。为顺应当前标准方法向无害化、仪器化方向发展的趋势,促进广大基层水质检测工作高效、便捷、环保展开,建议增加[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]法作为生活饮用水中氨氮的国标检测方法,替代纳氏试剂分光光度法。[/color][/font]
离子色谱能做水中的氰化物、总磷、氨氮、硫化物、碳酸盐吗?
水质氨氮项目,酒石酸钾钠到底是怎么屏蔽金属离子的干扰的,原理是什么,谢谢大神
急!!急急!!!请问氨离子选择性电极捡漏是用多少浓度的氢氧化钠?加几滴?
求YC/T 377-2010标准中文名称:卷烟 主流烟气中氨的测定 离子色谱法,不胜感谢!
急需标准:高氯高氨废水 化学需氧量的测定 氯离子校正法GB/T 31195-2014,哪位老大帮忙传一份,谢谢!!!
各位前辈,地下水氨氮值,10月份测水源水氨氮值是0.12mg/L,12月份,冬季,温度在零下20℃,测氨氮值0.07mg/L,氨氮包括游离氨和铵离子,温度会对游离氨和氨离子有影响,但应该不会影响氨氮值吧
氨氮的性质氨氮以游离氨或铵盐的形式存在于水中,两者的组成比取决于水的PH 值和水温。当PH值偏高时,游离氨的比例较高。反之,则铵盐的比例高,水温则相反。氨氮是指水中以游离氨(NH3)和铵离子(NH4)形式存在的氮。 动物性有机物的含氮量一般较植物性有机物为高。同时,人畜粪便中含氮有机物很不稳定,容易分解成氨。因此,水中氨氮含量增高时指以氨或铵离子形式存在的化合氨。
现在有强酸型阳离子交换树脂,标准说水要通过强酸型阳离子交换树脂柱,不知道交换柱长什么样子?把树脂加到图中的柱子里,再让水通过,这样可以吗?之前没做过水中氨氮检测,麻烦有知道的老师指点一下,谢谢了。[img]https://ng1.17img.cn/bbsfiles/images/2022/10/202210092259084902_6550_5321045_3.png[/img][img]https://ng1.17img.cn/bbsfiles/images/2022/10/202210092259084623_8983_5321045_3.png[/img]
一、氨的分子结构 氮原子有5个价电子,其中有3个未成对,当它与氢原子化合时,每个氮原子可以和3个氢原子通过极性共价键结合成氨分子,氨分子里的氮原子还有一个孤对电子。 氨分子的空间结构是三角锥形,三个氢原子处于锥底,氮原子处在锥顶。每两个N—H键之间夹角为107°18’,因此,氨分子属于极性分子。 H H .. | 电子式: H:N:H 结构式: H-N-H .. 二、氨的性质 化学式 NH3 1、物理性质 相对分子质量 17.031 氨气在标准状况下的密度为0.7081g/L 氨气极易溶于水,溶解度1:700 2、化学性质 (1)跟水反应 氨溶于水时,氨分子跟水分子通过*氢键结合成一水合氨(NH3• H2O),一水合氨能小部分电离成铵离子和氢氧根离子,所以氨水显弱碱性,能使酚酞溶液变红色。氨在水中的反应可表示为: 一水合氨不稳定受热分解生成氨和水 氨水中存在三分子、三离子、三平衡 分子:NH3、NH3• H2O、H2O; 离子:NH4+、OH-、H+; 三平衡:NH3+H2O NH3• H2O NH4++OH- H2O H++OH- 氨水在中学化学实验中三应用 ①用蘸有浓氨水的玻璃棒检验HCl等气体的存在;②实验室用它与铝盐溶液反应制氢氧化铝;③配制银氨溶液检验有机物分子中醛基的存在。 (2)跟酸反应 2NH3+H2SO4===(NH4)2SO4 3NH3+H3PO4===(NH4)3PO4 NH3+CO2+H2O===NH4HCO3 (反应实质是氨分子中氮原子的孤对电子跟溶液里具有空轨道的氢离子通过配位键而结合成离子晶体。若在水溶液中反应,离子方程式为: 8NH3+3Cl2===N2+6NH4Cl (黄绿色褪去,产生白烟) 反应实质:2NH3+3Cl2===N2+6HCl NH3+HCl===NH4Cl 总反应式:8NH3+3Cl2===N2+6NH4Cl 三、氨的制法 1.工业制法:工业上氨是以哈伯法通过N2和H2在高温高压和催化剂存在下直接化合而制成: 工业上制氨气 高温高压 N2(g)+3H2(g)========2NH3(g)(可逆反应) 催化剂 △rHθ =-92.4kJ/mol 2. 实验室制备: 实验室,氨常用铵盐与碱作用或利用氮化物易水解的特性制备: △ 2NH4Cl + Ca(OH)2===2NH3↑+ CaCl2 + 2H2O↑ Li3N + 3H2O === LiOH + NH3↑ 四、铵盐 铵盐是氨与酸作用得到铵盐,铵盐是由铵离子(NH4+)和酸根离子组成的化合物。一般为无色晶体,易溶于水,是强电解质。从结构来看,NH4+离子和Na+离子是等电子体。NH4+离子的半径比Na+离子的大,而且接近于K+离子,一般铵盐的性质也类似于钾盐,如溶解度,一般易溶,易成矾。铵盐和钾盐是同晶型等,在化合物分类中常把铵盐和碱金属盐归为一类。铵盐的化学性质:①有一定程度的水解。因为氨是弱碱,铵盐是弱碱强酸盐或弱碱弱酸盐,前者水解后溶液显酸性: NH4++H2O== NH3• H2O+H+ ②受热分解,所有的铵盐加热后都能分解,其分解产物与对应的酸以及加热的温度有关。分解产物一般为氨和相应的酸。如果酸具有氧化性,则在加热条件下,氧化性酸和产物氨将进一步反应,使NH3氧化为N2或其氧化物: 人 碳酸氢铵最易分解,分解温度为30℃: 氯化铵受热分解成氨气和氯化氢。这两种气体在冷处相遇又可化合成氯化铵。这不是氯化铵的升华,而是它在不同条件下的两种化学反应: ③跟碱反应放出氨气 1、人工固氮 工业上通常用H2和N2 在催化剂、高温、高压下合成氨 最近,两位希腊化学家,位于Thessaloniki的阿里斯多德大学的George Marnellos和MichaelStoukides发明了一种合成氨的新方法(Science,2Oct.1998,P98)。 2、天然固氮 闪电能使空气里的氮气转化为一氧化氮,一次闪电能生成80~1500kg的一氧化氮。这也是一种自然固氮。自然固氮远远满足不了农业生产的需求。 六、注意事项 氨对接触的皮肤组织都有腐蚀和刺激作用,可以吸收皮肤组织中的水分,使组织蛋白变性,并使组织脂肪皂化,破坏细胞膜结构。氨的溶解度极高,所以主要对动物或人体的上呼吸道有刺激和腐蚀作用,常被吸附在皮肤粘膜和眼结膜上,从而产生刺激和炎症。可麻痹呼吸道纤毛和损害粘膜上皮组织,使病原微生物易于侵入,减弱人体对疾病的抵抗力。氨通常以气体形式吸入人体,氨被吸入肺后容易通过肺泡进入血液,与血红蛋白结合,破坏运氧功能。进入肺泡内的氨,少部分为二氧化碳所中和,余下被吸收至血液,少量的氨可随汗液、尿液或呼吸排出体外。 七.NH3系列常用方程式 NH4+ + H2O NH3.H2O + H+ 2NH4+ + SiO32- + H2O == H4SiO4↓ + 2NH3↑ NH4+ + AlO2- + H2O == Al(OH)3↓ + NH3↑ NH4+ + HCO3- + 2OH- == CO32- + H2O + NH3.H2O(向NH4HCO3溶液中加入足量NaOH溶液) 次文章转载自www.3017.cn 东方嘉仪仪器网