方案详情文
智能文字提取功能测试中
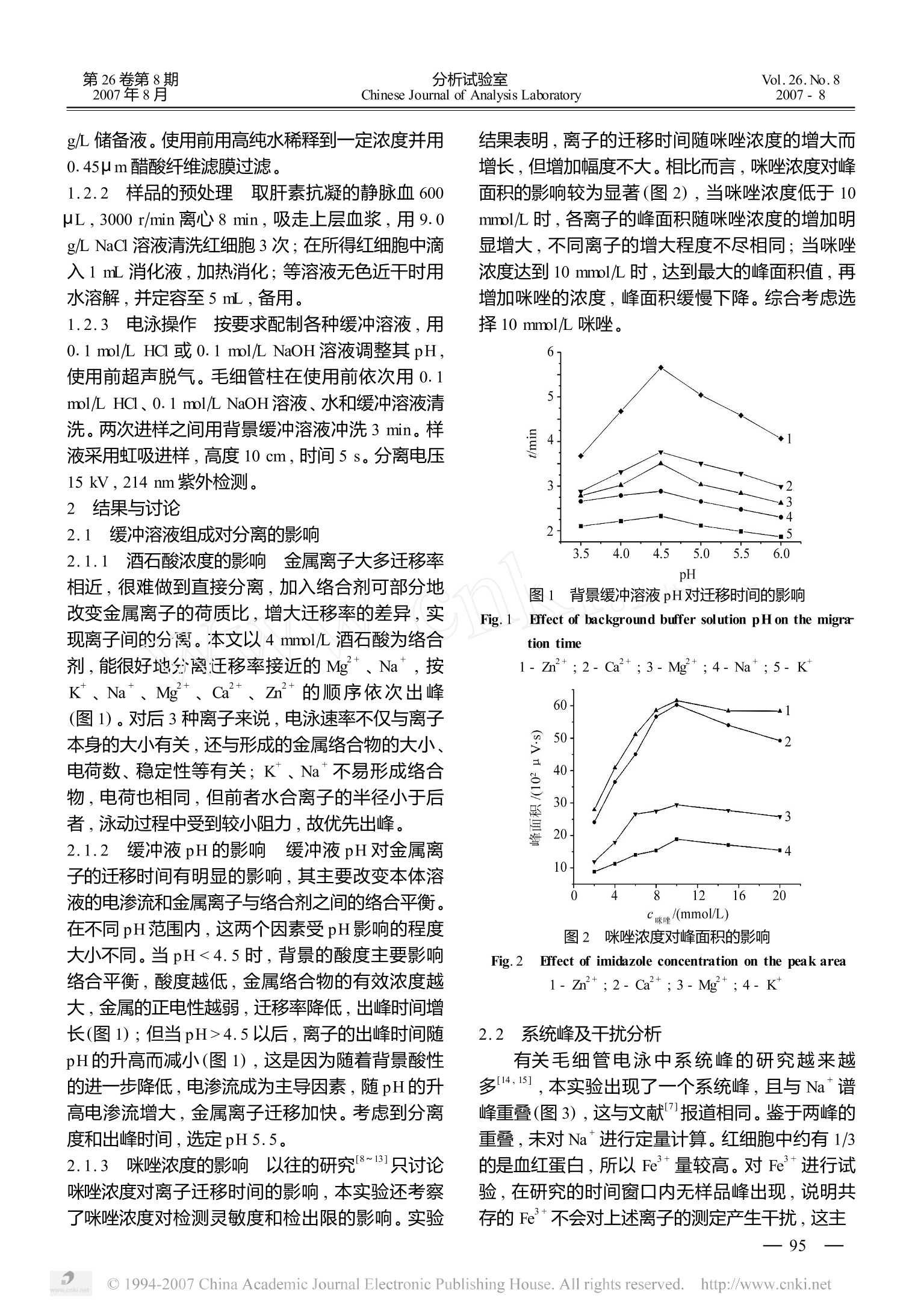
第26卷第8期2007年8月分析试验室Chinese Journal of Analysis LaboratoryVo1.26.No.82007-8 分析试验室Chinese Journal of Analysis Laboratory第26卷第8期2007年8月Vol.26.No.82007-8 毛细管区带电泳法间接测定红细胞中的主要无机阳离子 冯海燕1,2,马登军,3,4,王月伶,李向军,袁倬斌*1 (1.中国科学院研究生院化学与化学工程学院,北京100049;2.石家庄学院化工学院,石家庄050035;3.河北大学化学与环境学院,保定071002;4.华北科技学院资源与环境工程系,北京101601) 摘 要:建立了间接测定红细胞中主要无机阳离子的毛细管区带电泳方法,考察了背景溶液pH、咪唑和酒石酸浓度等对无机离子分离效果及峰面积的影响。以10mmol/L 咪唑-4 mmol/L酒石酸(pH5.5)为背景,在15 kV、214 nm 的条件下,对红细胞中K*、Mg+、ca 和Zn*进行了定性、定量分析,回收率在96%~104%之间,迁移时间和峰面积的相对标准偏差分别低于0.76%和2.8%(日内),0.85%和3.7%(日间)。所建方法有望成为一种测定细胞内离子含量的辅助方法。 关键词:毛细管电泳;红细胞;无机阳离子;系统峰 中图分类号:0657.8 文献标识码:A 文章编号:1000-0720(2007)08-094-04 无机离子对于人体的生理和病理作用已引起国内外学者的高度重视,其在人体内含量的多少与疾病的发生、发展关系密切,糖尿病、肾功能障碍等疾病都会引起无机离子含量的异常变化化。红细胞作为人体的重要生命单元,其无机离子的测定则具有重要的生理和临床诊断意义。测定无机阳离子最为广泛的方法是原子吸收光谱法2此法操作简单,但常规仪器一次只能测定一种元素。离子选择电极法13]选择性较高,也存在类似的缺点。等离子体发射光谱和液相色谱能够同时分析样品中共存的多种元素,但仪器价格相对昂贵,实际应用不多[2]。 毛细管电泳(CE)是上世纪八十年代发展起来的一种分析技术,能够一次完成多种元素的测定,且分析速度快、样品用量少,在无机离子分析方面得到广泛的应用4~6.,其测定过的实际样品有自来水、矿泉水、饮料、药片、土壤溶液等,用于细胞中无机阳离子测定的报道很少。Barry 运用毛细管电泳-激光诱导荧光法间接检测了红细胞中K*、Na*离子,迄今所查文献中尚未见过其它 的报道。本文以10 mmol/L咪唑-4 mmol/L酒石酸(pH5.5)为背景缓冲液,6 min 内实现 K*、NaMg*、Ca、Zn的基线分离,同时考察了咪唑浓度对金属离子出峰时间和谱峰面积的双重影响。运用所建毛细管电泳方法,成功地对红细胞样品中的主要金属阳离子进行了定性、定量分析。 实验部分 1.1 仪器与试剂 CL1020高效毛细管电泳仪(北京彩陆科学仪器公司),未涂层熔融石英毛细管(55cm ×75 umi.d.,有效长度47 cm,河北永年光纤厂); PHS-3B型精密酸度计(上海雷磁仪器厂); WFX-130 原子吸收分光光度计(北京瑞利分析仪器公司)。 酒石酸、HNO、HClO4为优级纯,咪唑等其它试剂均为分析纯,消化液:V(HNO3):V(HCIO4)=2:1,水为石英高纯水。 1.2 实验方法 1.2.1 标准溶液配制 分别称取适量K*、Na*、Mg*、Ca、Zn的氯化物,加水溶解,配成1.0 ( * 收稿日期:2007-05-10;修订日期:2007-07-01 ) ( 基金项目:国家自然科学基金分析化学重点基金(20235010);国际合作基金(20611140646);中科院长春应化所电分析化学国家重点实验室基金;中科院研究生院院长基金项目资助 ) ( 作者简介:冯海燕(1974-),女,博士研究生 ) g/L储备液。使用前用高纯水稀释到一定浓度并用0.45 um醋酸纤维滤膜过滤。 1.2.2 样品的预处理 取肝素抗凝的静脉血600L,3000 r/min离心8 min, 吸走上层血浆,用9.0g/L NaCl溶液清洗红细胞3次;在所得红细胞中滴入1mL消化液,加热消化;等溶液无色近干时用水溶解,并定容至5mL,备用。 1.2.3 电泳操作 按要求配制各种缓冲溶液,用0. 1 mol/L HCl 或 0. 1 mol/L NaOH 溶液调整其pH,使用前超声脱气。毛细管柱在使用前依次用0.1mol/L HC1、0.1 mol/L NaOH溶液、水和缓冲溶液清洗。两次进样之间用背景缓冲溶液冲洗3 min。样液采用虹吸进样,高度10 cm,时间5s。分离电压15 kV, 214 nm 卜外检测。 2 结果与讨论 2.1 缓冲溶液组成对分离的影响 2.1.1 酒石酸浓度的影响 金属离子大多迁移率相近,很难做到直接分离,加入络合剂可部分地改变金属离子的荷质比,增大迁移率的差异,实现离子间的分离。本文以4 mmol/L酒石酸为络合剂,能很好地收离迁移率接近的Mg*、Na,按K*、Na*、、Mg+、ca+、、Zn的的顺序依次出峰(图1)。对后3种离子来说,电泳速率不仅与离子本身的大小有关,还与形成的金属络合物的大小、电荷数、稳定性等有有;K*、Na*不易形成络合物,电荷也相同,但前者水合离子的半径小于后者,泳动过程中受到较小阻力,故优先出峰。 2.1.2 缓冲液pH的影响 缓冲液pH对金属离子的迁移时间有明显的影响,其主要改变本体溶液的电渗流和金属离子与络合剂之间的络合平衡。在不同pH范围内,这两个因素受pH影响的程度大小不同。当pH<4.5时,背景的酸度主要影响络合平衡,酸度越低,金属络合物的有效浓度越大,金属的正电性越弱,迁移率降低,出峰时间增长(图1);但当pH>4.5以后,离子的出峰时间随pH的升高而减小(图1),这是因为随着背景酸性的进一步降低,电渗流成为主导因素,随pH的升高电渗流增大,金属离子迁移加快。考虑到分离度和出峰时间,选定pH5.5。 2.1.3 咪唑浓度的影响 以往的研究[8~13]只讨论咪唑浓度对离子迁移时间的影响,本实验还考察了咪唑浓度对检测灵敏度和检出限的影响。实验 结果表明,离子的迁移时间随咪唑浓度的增大而增长,但增加幅度不大。相比而言,咪唑浓度对峰面积的影响较为显著(图2),当咪唑浓度低于10mmol/L时,各离子的峰面积随咪唑浓度的增加明显增大,不同离子的增大程度不尽相同;当咪唑浓度达到10 mmol/L时,达到最大的峰面积值,再增加咪唑的浓度,峰面积缓慢下降。综合考虑选择10 mmol/L咪唑。 图1 背景缓冲溶液 pH对迁移时间的影响 Fig.1Effect of background buffer solution pH on the migration time 1- Zn+;2- Ca*;3-Mg*;4-Na*;5-K* 图2 咪唑浓度对峰面积的影响 Fig.2 Effect of imidazole concentration on the peak area 1-Zn*;2-Ca+;3-Mg*:4-K 2.2 系统峰及干扰分析 有关毛细管电泳中系统峰的研究越来越三14,15],本实验出现了一个系统峰,且与 Na谱峰重叠(图3),这与文献报道相同。鉴于两峰的重叠,未对Na进行定量计算。红细胞中约有1/3的是血红蛋白,所以Fe量较高。对 Fe进行试验,在研究的时间窗口内无样品峰出现,说明共存的Fe不会对上述离子的测定产生干扰,这主 图3 标准品的毛细管电泳图谱 Fig.3 Electropherogram of the standard mixture 1- K*;2-Na*+系统峰;3-Mg*;4-Ca*;5-Zn 要是由于Fe与酒石酸形成的络合物比较稳定,其更多地以金属络合物的形式存在,迁移速率相应减缓,出峰较晚甚至不出峰。 2.3 检出限和重现性 分别配制各金属离子不同浓度的标准溶液,在选定条件下进行电泳实验,以峰面积(Y)对质量浓度(p)进行线性回归,按3倍信噪比计算检出限,结果见表1。对同一标准混合溶液,连续6次进样,迁移时间和峰面积的相对标准偏差(RSD)分别低于0.76%和2.8%。同时做日间(n=3)重现性实验,迁移时间和峰面积的RSD分别低于0.85%和3.7%。 表1 离子的线性方程、线性范围、相关系数及检出限 Tab. 1 Linear equations,linear range , correlation coefficients and limit of detection of the metal ions quantified 离子 线性方程 线性范围 p/(ug/mL) 相关系数 检出限p/(ug/mL) K* Y=376.510-75.17 0.50~80 0.9994 0.20 Mg Y=2372.96p+814.00 0.20~70 0.9991 0.06 Ca2*+ Y=1087.10p+190.65 0.20~80 0.9998 0.12 zn2+ Y=1767.23p+898.94 0.60~70 0.9993 0.40 2.4 样品分析 取健康成人静脉血,按1.2.2节样品预处理步骤进行消化,同时做空白实验,电泳图见图4。图4与标准品图谱非常一致,说明样品中共存的其他成分不会对实验产生干扰,所建方法选择性较高。直接取消化样品定量Mg、Ca和 Zn,K的定量需将样品稀释70倍,扣除空白后的测定结 果见表2。为了比较,运用原子吸收分光光度计测定两份红细胞样品中Ca的浓度,分别为18.95和22.96 ug/mL,与毛细管电泳则定结果(19.83±1.56 ug/mL, 21.63 ±1.72 ug/mL)基本一致,说明所建方法准确可靠。结合常规细胞计数,可得出单个红细胞中4种金属离子的量(表2),可用于与红细胞元素含量相关疾病的辅助诊断。 图4 红细胞消化液(a)和空白(b)的毛细管电泳图谱 Fig. 4 Electropherograms of erythrocytes lysing solution (a) and blank lysing solution (b) 1-K*;2-Na*+系统峰;3-Mg*;4-Ca+;5-Zn* 表2红细胞中金属离子的测定结果及回收率 Tab.2 Concentration of metal ions in erythrocytes, recovery and RSD(%) 1 2 样品 测定值 回收率 RSD/% 单细胞中 测定值 回收率 RSD/% 单细胞中 p/(ug/mL) 7% (n=6) 的量/fg p/(ug/mL) /% (n=6) 的量/fg K* 5310.15 103.2 0.8 2658.69 5308.69 103.7 0.6 2657.69 Mg 10.49 96.8 2.6 5.00 6.90 101.1 1.4 3.29 Ca+ 19.83 97.1 2.1 9.22 21.63 100.2 2.5 10.06 zn2+ 2.98 102.9 1.5 1.38 5.89 97.5 2.0 2.73 ( 参考文献 ) ( [1 Wan QJ, K ub anP, Tanyanyiwa J e t al. A nal Chim Acta, 2004, 5 25(1) : 11 ) ( [2] 戚仁铎,杨兴季.实用诊断学,山东:山东科学技术 出版社,2003.631 ) ( [3] Malon A, Maj-zurawska M. Sensor. Actua t B: Chem,2005, 108(1-2):828 ) ( 141 屈 锋,王 敏,林金明.分析化学,2005,33(4): 562 ) ( 5] Liu B F , L iu L B, C heng J K . J Chromatogr A , 1 999, 834(1-2):277 ) Timerbaev A R. Talanta,2000,52(4):573B ( 7] Hogan B L, Yeung E S. Anal Chem , 1992,64(22):2841 ) ( 3] Nemutlu E, Caln N. Anal B ioanal Chem,2005,383(5): 833 ) ( 91 Timerbaev A R. Electrophoresis , 2004, 25(23-2 4 ): ) ( 4008 ) ( 1101 傅小芸,吕建德,夏旭建.分析化学,1996,24(8): 943 ) ( [111 Su dezLuque S , M a to I, H u i dobroJ F e t a l. Tal a nta,2006,68(4):1143 ) ( 1121 杨永坛,欧庆瑜,刘风景.分析化学,1999,27(4):433 ) ( 1131 Shakulashvili N , F aller T, E ngelhardt H . J C hromatogr A , 2000,895(1-2):205 ) ( 141 Beckers J L , Urb dek M, B o cek P . E le ctrophoresis, 2005,26(10): 1 869 ) ( 1151 ] Sellmeyer H, Poppe H. J Chromatogr A,2002,960(1- 2):175 ) ( 161 ]Shi Y C, F ritz J S. J Chromatogr, 1993, 640(1 - 2 ) : 473 ) Indirect determination of inorganic cations in erythrocytes by capillary zone electrophoresis FENG 1 xi-ym2, MA Deng-jun 34, WANG Yue-ling, LI Xiang jun and YUAN Zhuo bin(1. College of Chem istry and Chemical Engineering, the Graduate University of the Chinese Academy of Sciences, Beijing 100049;2. School of Chemical Engineering, Shijiazhuang University , Shijiazhuang 050035; 3. Institute of Chemistry and Environment, Hebei University, Baoding 071002; 4. Department of resource and Environment, North China Institute ofScience and Technology, Beijing 101601) , Fenxi Shiyanshi, 2007,26(8):94~97 Abstract: A method for indirect determination of major inorganic cations in the erythrocytes was established by capillary zone electrophoresis. The effect of electrolyte composition such as pH in background solution, the concentrations ofimidazole and tartrate on the separation and peak area of metal ions was investigated. The concentrations of K,Mg*,Cat, Znin the lysing solution of erythrocytes of the healthy persons were analyzed under the following conditions: background solution of 10 mmol/L imidazole and 4 mmol/L tartrate (pH=5.5); running voltage 15 kV; de-tection wavelength 214 nm. Under the given conditions the recovery of standard sample ranged from 96% to 104 %.The repeatability , intraday and interday analysis were <0.76%and <0.85% for migration time and <2.83 % and<3.69 % for peak area , respectively. The established method is expected to be a subsidiary method for routine analysis of intracellular ion concentrations. Key words: Capillary electrophoresis; Erythrocyte; Inorganic cations; Systempeak —China Academic Journal Electronic Publishing House. All rights reserved. http://www.cnki.net
关闭-
1/4

-
2/4
还剩2页未读,是否继续阅读?
继续免费阅读全文产品配置单
北京华阳利民仪器有限公司为您提供《红细胞中主要无机阳离子检测方案(毛细管电泳仪)》,该方案主要用于其他中主要无机阳离子检测,参考标准《暂无》,《红细胞中主要无机阳离子检测方案(毛细管电泳仪)》用到的仪器有高效毛细管电泳仪(紫外检测)CL1020。
我要纠错
相关方案





 咨询
咨询




