方案详情文
智能文字提取功能测试中
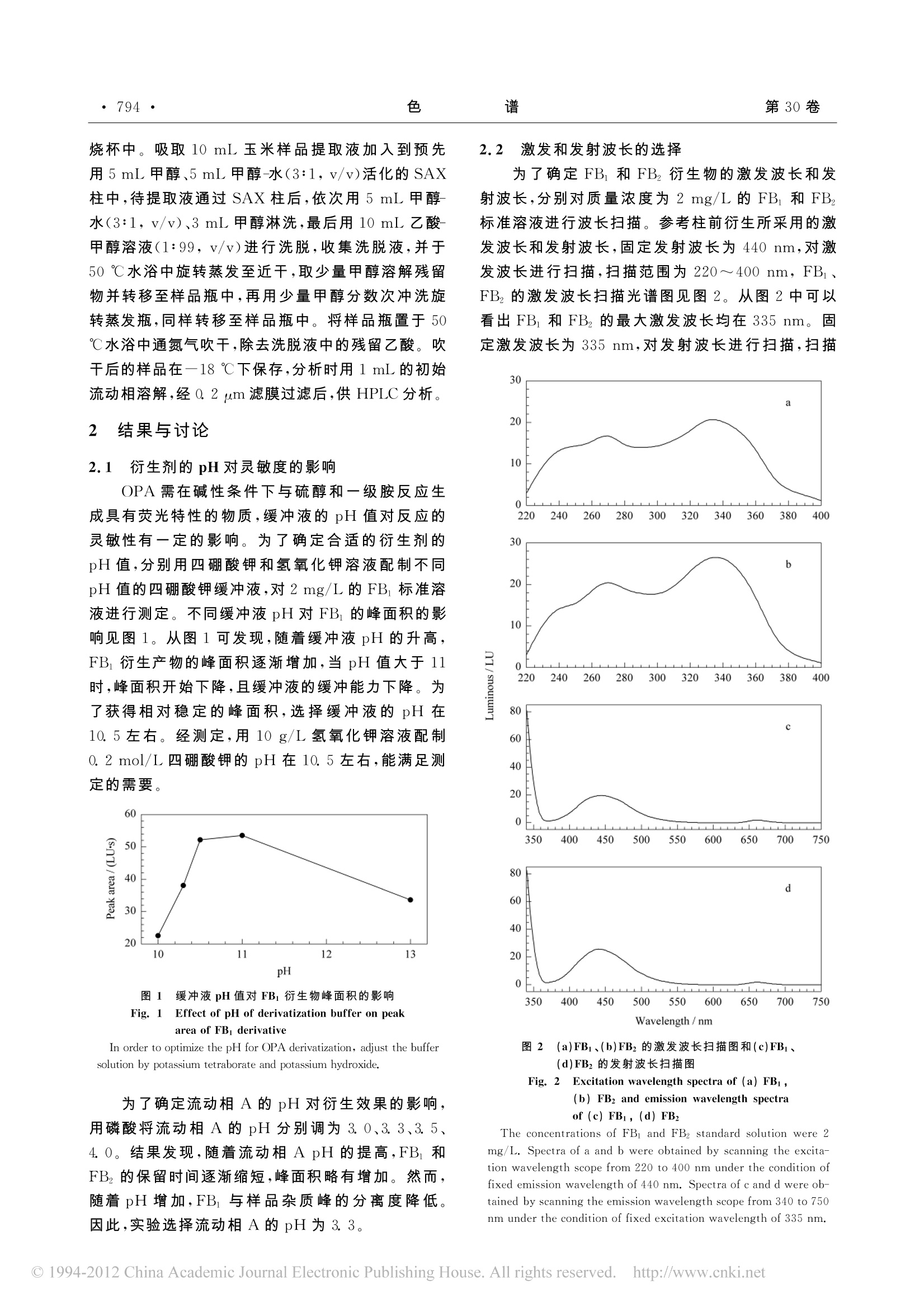
第8期张晓旭,等:柱后衍生高效液相色谱法测定玉米中伏马菌素B 和Bz·793· 色 谱·794·第30卷 伏马菌素(fumonisins)是1988年南非 Gelder-blom等发现的一组结构相似的真菌毒素,主要由串珠朱刀菌(F. moniliforne)、多育镰刀菌(F.proliferatum)产生,到目前为止已有28种伏马菌素被分离、鉴定,其中以伏马菌素B(FB)和伏马菌素B(FB2)存在最广,毒性最强。伏马菌素可引起马脑白质软化症、猪的肺水肿、对老鼠的肝脏和肾脏造成伤害、诱导癌症的发生,破坏家禽的免疫系统等[3-6]。伏马菌素对人类健康的影响目前尚不清楚,但流行病学调查发现该毒素与人类食道癌、肺癌、神经管畸形的发生率存在某种相关性7-91。国际癌症研究机构已将伏马马素宣布为“2B”级毒物10]。2001年 FAO/WHO(Food and AgricultureOrganization of the United Nations/World HealthOrganization)食品添加剂联合专家委员会第56次会议上,临时确立了人体每日允许摄入 FB、FBz的最大限量(provisional maximum tolerable dailyintake, PMTDI)为 2ug/kg11,2007年欧盟规定供人直接食用的玉米及其制品中FB 和FB2总和最高限量为1000 ug/kg,用于早餐和小吃的玉米制品为800 ug/kg,加工的玉米制品及婴儿食品为200ug/kg12]。我国尚未制定食品中伏马菌素的限量标准。因此,建立一种有效的检测方法开展谷物及食品中伏马菌素的监控,对于保障食品安全、制定适宜的限量标准是非常必要的。 伏马菌素的检测方法主要有薄层色谱法(TLC)、气相色谱-质谱联用法(GC-MS)、酶联免疫吸附法(ELISA)L13J、液相色谱质谱联用法(LC-MS)L14J以及高效液相色谱法(HPLC)L15,16」等。0HPLC 方法由于操作简单,准确可靠,重复性好,是目前国际上普遍采用的伏马菌素的检测方法16.171。由于伏马菌素分子没有特定的紫外吸收,本身也不产生荧光,应用 HPLC 时需要衍生后才能进行定性、定量分析。目前 HPLC 以邻苯二甲醛(o-phtha-laldehyde, OPA)柱前衍生为主_16-18」,操作简单,反应迅速,但OPA 衍生产物的荧光强度随着时间延长逐渐降低,对衍生反应时间要求相对较严格,需要在衍生后2 min内进样19];相比于柱前衍生,柱后衍生方法有效地克服了检测中荧光反应物稳定性对时间的依赖,消除了基质效应以及杂质的干扰,具有稳定性高、重现性好、操作简便、适用于大量样品的连续检测等优势[20]。利用 OPA柱后衍生测定伏马菌素方法虽有报道21],但缺乏对衍生 pH值、衍生剂浓度、衍生剂流速等多种柱后衍生影响因素的分析和比较。本文优化了 OPA 柱后衍生的条件,建 立了玉米中伏马菌素的柱后衍生高效液相色谱方法,实现了伏马菌素的衍生反应和检测自动化控制,避免了人员操作的误差。结果表明,该方法准确、重现性好,适用于批量样品的检测分析。 1 实验部分 1.1 仪器与试剂 Agilent 1200 高效液相色谱仪,配荧光检测器(Agilent 1200,美国 Agilent 公司); PCX柱后衍生仪(美国Pickering Laboratories 公司);高速万能粉碎机(天津市泰斯特仪器有限公司);IKA T18组织匀浆机(广州仪科实验室技术有限公司),WH-90A微型混合器(上海亚荣生化仪器厂);Milli-Q超纯水仪(美国 Millipore 公司);固相萃取装置(美国Supelco 公司); SAX 固相萃取柱(3mL,500 mg;美国 Supelco 公司); DCY-Ⅲ水浴浓缩仪(北京金科精华苑技术研究所); RE52-99 旋转蒸发器(上海亚荣生化仪器厂)。 FB和FB标准品(纯度≥98%, Sigma 公司);OPA(Fluka 公司);β-巯基乙醇(Sigma 公司);甲醇、乙腈(HPLC纯,美国 Fisher公司);其他试剂为分析纯(北京化学试剂公司)。水为超纯水。 1.2 衍生剂的配制 OPA稀释液:称取6.11g四硼酸钾,用100mL 10 g/L 氢氧化钾溶液溶解,混匀即得。 OPA衍生剂:称取0.2g OPA,用5mL甲醇溶解,加入100 mL OPA 稀释液,混匀,加入100 pL p-巯基乙醇,混匀,过0.2 pm滤膜。 1.3 色谱条件 色谱普:ZORBAX SB-Ci8 柱(150mm×4.6mm, 5 pm;美国 Agilent 公司);流动相:A相为0.1mol/L 磷酸二氢钠溶液(用磷酸调pH至3.3); B相为甲醇。梯度洗脱程序:0~2 min,35%A;2~7min, 30%A;77~16 min, 20%A; 16~18 min35%A。流动相流速:0.8 mL/min;进样体积:20uL;柱温:40℃。荧光检测测:激发波长335 nm,发射波长440 nm。衍生反应线圈的体积为100 uL,衍生温度为室温,OPA衍生剂流速0.4 mL/min。 1.4 样品处理方法 实验所用玉米样品购自北京市集贸市场,用粉碎机粉碎后,过0.45 mm筛。 样品处理方法参考文献16进行。称取50g试样于150 mL锥形瓶中,准确加入100 mL甲醇-水溶液(3:1,v/v),用高速匀浆机提取 3 min,于4℃、5 000 r/min 离心 15 min,将上清液过滤至100 mL 烧杯中。吸取10mL 玉米样品提取液加入到预先用5 mL 甲醇、5mL甲醇-水(3:1,v/v)活化的 SAX柱中,待提取液通过 SAX 柱后,依次用5mL甲醇-水(3:1,v/v)、3mL甲醇淋洗,最后用10 mL 乙酸甲醇溶液(1:99,v/v)进行洗脱,收集洗脱液,并于50℃水浴中旋转蒸发至近干,取少量甲醇溶解残留物并转移至样品瓶中,再用少量甲醇分数次冲洗旋转蒸发瓶,同样转移至样品瓶中。将样品瓶置于50℃水浴中通氮气吹干,除去洗脱液中的残留乙酸。吹干后的样品在一18℃下保存,分析时用1mL 的初始流动相溶解,经0.2 um滤膜过滤后,供 HPLC 分析。 2 结果与讨论 2.1 衍生剂的pH对灵敏度的影响 OPA 需在碱性条件下与硫醇和一级胺反应生成具有荧光特性的物质,缓冲液的 pH 值对反应的灵敏性有一定的影响。为了确定合适的衍生剂的pH值,分别用四硼酸钾和氢氧化钾溶液配制不同pH值的四硼酸钾缓冲液,对2mg/L的FB标准溶液进行测定。不同缓冲液pH对FB的峰面积的影响见图1。从图1可发现,随着缓冲液pH的升高,FB衍生产物的峰面积逐渐增加,当pH值大于11时,峰面积开始下降,且缓冲液的缓冲能力下降。为了获得相对稳定的峰面积,选择缓冲液的pH在10.5左右。经测定,用10 g/L氢氧化钾溶液配制0.2 mol/L四硼酸钾的pH在10.5左右,能满足测定的需要。 图1 缓冲液 pH 值对FB1 衍生物峰面积的影响 Fig.1 Effect of pH of derivatization buffer on peakarea of FB derivative In order to optimize the pH for OPA derivatization, adjust the buffersolution by potassium tetraborate and potassium hydroxide. 为了确定流动相A的pH对衍生效果的影响,用磷酸将流动相A的pH分别调为3.0、3.3、3.5、4.0。结果发现,随着流动相A pH的提高,FB和FB2的保留时间逐渐缩短,峰面积略有增加。然而,随着pH增加,FB与样品杂质峰的分离度降低。因此,实验选择流动相A的pH为3. 3。 2.2 激发和发射波长的选择 为了确定FB和FB衍生物的激发波长和发射波长,分别对质量浓度为2 mg/L 的 FB 和 FB标准溶液进行波长扫描。参考柱前衍生所采用的激发波长和发射波长,固定发射波长为440 nm,对激发波长进行扫描,扫描范围为220~400 nm, FB、FB的激发波长扫描光谱图见图2。从图2中可以看出 FB和FBz的最大激发波长均在335 nm。固定激发波长为 335 nm,对发射波长进行扫描,扫描 30 图2 (a)FBi、(b)FB2 的激发波长扫描图和(c)FB1、(d)FBz的射射波长扫描图 Fig.2 Excitation wavelength spectra of (a) FBi,(b) FBz and emission wavelength spectra of (c) FBi, (d) FB2 The concentrations of FBi and FB2 standard solution were 2mg/L. Spectra of a and b were obtained by scanning the excita-tion wavelength scope from 220 to 400 nm under the condition offixed emission wavelength of 440 nm. Spectra of c and d were ob-tained by scanning the emission wavelength scope from 340 to 750nm under the condition of fixed excitation wavelength of 335 nm. 范围为340~750 nm, FB和FBz的发射波长扫描图见图2。由图2中可以看出,FB和FB的最大发射波长为440 nm。因此实验选择激发波长为335nm,发射波长为440 nm。 2.3 OPA 浓度对测定结果的影响 称取适量的 OPA 用甲醇溶解,加入到OPA缓冲体系中,使衍生剂中OPA的质量浓度分别为0.5、1.0、2.0、3.0、4.5g/L,对质量浓度为2 mg/L的FB 和FB,混合标准溶液进行色谱分析,结果见图3。从图3中可以看出,随着 OPA 浓度的增加,伏马菌素衍生物的峰面积逐渐增加,从0.5到2.0g/L时增加效果非常显著;继续增加OPA浓度,峰面积增加速度相对缓慢。同时发现OPA 浓度升高会导致基线升高,因此本方法选择 OPA 的质量浓度为 2 g/L。 图33OPA浓度对FB1、FB2峰面积的影响 Fig. 33Effect of OPA concentration onpeak areas of FB1、FB2 Conditions: pH of derivatization buffer,10. 5; flow rate ofOPA, 0. 4 mL/min. 2.4 衍生剂的流速对衍生反应的影响 柱后衍生的效果与衍生剂的流速关系密切。为了获得较好的衍生效果,将流动相的流速设为0.8mL/min,调整衍生剂的流速分别为0.3、0.4、0.5、0.6 mL/min,对质量浓度为2 mg/L的FB 和FB混合标准溶液进行色谱分析,结果见图4。从图4中可以看出,随着衍生剂流速的增加,FB和FB峰面积逐渐提高。这可能是由于衍生剂在低流速时,单位时间内与样品中伏马菌素发生反应的 OPA 数量较少,生成的荧光产物相对较少,荧光强度较低;随着衍生剂流速的增加,单位时间内与样品反应的OPA数量增加,峰面积也随之增加。然而,随着流速的增加,一方面使衍生体系泵的压力会逐渐增加,噪声提高;另一方面会造成衍生剂的浪费。因此,实验选择衍生剂的流速为0.4mL/min。 2.5 不同溶剂对分离效果的影响 图4 衍生剂的流速对 FB1、FB2峰面积的影响 Fig. 4 Effect of flow rate of OPA onpeak areas of FBi and FB2 Conditions: pH of derivatization buffer, 10. 5; mass concentration of OPA, 2 g/L. 分别用甲醇、乙腈-水(1/1,v/v)和初始流动相配制1mg/L的FB和FBz混合标准溶液进行色谱分析,不同溶剂对伏马菌素分离效果的影响见图5。从图5可以看出,不同溶剂对FB和FBz的分离度、响应值有一定的影响,尤其对FB 的影响较大。以流动相作为溶剂时,色谱分离效果好,响应值最强;以甲醇为溶剂时响应值最低。因此实验选择用初始流动相溶解标准溶液和样品。标准溶液和玉米样品的色谱图见图6。 图5 不同溶剂溶解样品对FB1、FB2分离效果的影响 Fig. 5 Effect of different solvents forFB and FB2 separation 2.6 线性范围、检出限、准确度和精密度 分别测定用初始流动相配制的质量浓度为0.2、0.5、1.0、2.0、5.0、10、20 mg/L 的 FB、FB混合标准溶液,以各分析物的质量浓度(x)为横坐标、色谱峰面积(y)为纵坐标进行回归分析,得到的FB的线性方程为y=25. 153x-1.7061,相关系数为0.9999;FB的线性方程为y=25. 882x0.4238,相关系数为0.9998。以信噪比(S/N)为3求得FB、FB的出限均为0.02 mg/kg。 将玉米样品分成2份,1份中不添不 FB、FB2 图6(a)标准溶液和(b)玉米样品的色谱图 Fig. 6 Chromatograms of (a) standard solutionand (b) a corn sample 作为空白样品测定;1份中分别添加0.1、1.0、4.0mg/kg的FB 和0.1、0.5、2.0mg/kg 的 FBz,按样品处理方法提取、分析。玉米样品中伏马菌素的加标回收率和精密度(以相对标准偏差(RSD)计)测定结果见表1。结果显示,FB 的回收率为 82.5%~88.0%, RSD 为3.6%~5.3%;FB2 的回收率为83.0%~89.8%, RSD 为3.2%~5.6%. 表1 玉米样品中伏马菌素的加标回收率和精密度 Table 1 Recoveries and precisions (RSDs) of fumonisinsspiked in a corn sample (n=6) Compound Background/ Spiked/ Found/ Recovery/ RSD/ (mg/kg) (mg/kg) (mg/kg) % % FB: nd 0.1 0.0825 82.5 3.9 nd 1.0 0.837 83.7 3.6 nd 4.0 3.52 88.0 5.3 FB, nd 0.1 0.0830 83.0 3.2 nd 0.5 0.449 89.8 3.5 nd 2.C 1.72 86.0 5.6 nd: not detected. 2.7 玉米样品分析 按照上述优化方法测定了10个玉米样品,结果见表2。通过检测发现,10个样品中有7个样品含有伏马菌素,阳性率为70%;从组成上看,玉米中FB的含量高于 FBz,这与 Rheeder 等2的报道相符合。他们认为在玉米或大米的培养物中FB 占整个伏马菌素的70%~80%, FBz 为 15%~25%.从含量上看,有3个样品的含量超过了1 mg/kg,其中1个样品中的含量达到了4.09 mg/kg。上述结果说明,本方法可以用于玉米中伏马菌素的检测,同 时也提示我国玉米中伏马菌素的安全性不容乐观加强对玉米中伏马菌素的监控对保护消费者健康具有重要的意义。 表210个玉米样品中 FB1和FBz的含量 Table 2 Contents of FBi and FBz in 10 corn samples Content of Content of Total content of Sample FB/ FB2/ FBi and FB2/ (mg/kg) (mg/kg) (mg/kg) 1 3.27 0.821 4.09 2 0.0633 nd 0.0633 3 nd nd nd 4 1.42 0.205 1.62 5 nd nd nd 6 0.314 0.0468 0.361 7 0.526 0.107 0.633 8 0.285 0.0659 0.351 9 0.291 0.779 1.07 10 nd nd nd Mean 0.0617 0.202 0.819 nd: not detected. 3 结论 本实验建立了 OPA 柱后衍生-高效液相色谱测定玉米中FB、FB的方法。与柱前衍生相比,柱后衍生反应由衍生装置控制,有效地保证了衍生时间的精确控制,消除了柱前衍生法普遍存在的受人为因素影响的弊端,具有稳定性高、重现性好、操作简便、适用于大量样品连续检测等优势,为食品中伏马菌素的检测提供了新的方法和思路。 ( 参考文献: ) ( [1] Gelderblom W C A, Jaskiewicz K, Marasas W F O, e t a l. J A ppl Environ Microbiol, 1988, 5 4(7):1 8 06 ) ( [2 2] :Rheeder J P, Marasas W F O, V ismer H F . J A p pl Environ M icrobiol, 2002, 68( 5 ): 2101 ) ( [3 Ross PF, Ledet A E , Owens D L, e t al. J V et D iagn Invest, 1993, 5 (1):69 ) ( M ilicevic D R , Skrinjar M, Ba l tic T . Toxins, 2010, 2( 4 ):5 7 2 ) ( Voss K A , Smith G W, H aschek W M. A n im Feed Sci Tech, 2007, 137(3): 2 99 ) ( [6] B ouhet S, Oswald I P. Mol N utr Food R ES, 2007, 51(8): 925 ) ( [7] C Odhav B , A dam J K , Bhoola K D. In t I m munopharmacol, 2008,8(6):799 ) ( [8] Stockmann-Juvala H , Savolainen K. Hum Ex p Toxicol, 20 0 8, 27(11): 7 99 ) ( [9 Yazar S, Omurtag G Z . I ntJ M ol Sci, 2008, 9( 1 1):2062 ) ( [10] M unkvold G P, Desjardins A E . Plant Dis, 1997, 81 ( 6): 556 ) ( 117 Food a n d A g riculture Organization of the United Nations andWorld Health Organization. Fifty-sixth Report o f t he JointFAO/W H O Expert Committee on F o od Additives.[2012-03- 2 6] . http:/ /w w w. wh o . in t /fo o dsafety/c h em/je c fa/p u blica- ) ◎ China Academic Journal Electronic Publishing House. All rights reserved. http://www.cnki.net 伏马菌素(fumonisins)是1988年南非Gelderblom等[1]发现的一组结构相似的真菌毒素,主要由串珠镰刀菌(F.moniliforne)、多育镰刀菌(F.proliferatum)产生,到目前为止已有28种伏马菌素被分离、鉴定[2],其中以伏马菌素B1(FB1)和伏马菌素B2(FB2)存在最广,毒性最强。伏马菌素可引起马脑白质软化症、猪的肺水肿、对老鼠的肝脏和肾脏造成伤害、诱导癌症的发生,破坏家禽的免疫系统等[3-6]。伏马菌素对人类健康的影响目前尚不清楚,但流行病学调查发现该毒素与人类食道癌、肺癌、神经管畸形的发生率存在某种相关性[7-9]。国际癌症研究机构已将伏马菌素宣布为“2B”级毒物[10]。2001年FAO/WHO(Food and Agriculture Organization of the United Nations/World HealthOrganization)食品添加剂联合专家委员会第56次会议上,临时确立了人体每日允许摄入FB1、FB2的最大限量(provisional maximum tolerable dailyintake,PMTDI)为2μg/kg[11],2007年欧盟规定供人直接食用的玉米及其制品中FB1和FB2总和最高限量为1 000μg/kg,用于早餐和小吃的玉米制品为800μg/kg,加工的玉米制品及婴儿食品为200μg/kg[12]。我国尚未制定食品中伏马菌素的限量标准。因此,建立一种有效的检测方法开展谷物及食品中伏马菌素的监控,对于保障食品安全、制定适宜的限量标准是非常必要的。
关闭-
1/4

-
2/4
还剩2页未读,是否继续阅读?
继续免费阅读全文产品配置单
天津市兰博实验仪器设备有限公司为您提供《玉米中伏马菌素B_1检测方案(柱后衍生装置)》,该方案主要用于其他粮食加工品中真菌毒素检测,参考标准《暂无》,《玉米中伏马菌素B_1检测方案(柱后衍生装置)》用到的仪器有Laba PCR3 第三代柱后衍生系统。
我要纠错
推荐专场
相关方案





 咨询
咨询




