方案详情文
智能文字提取功能测试中
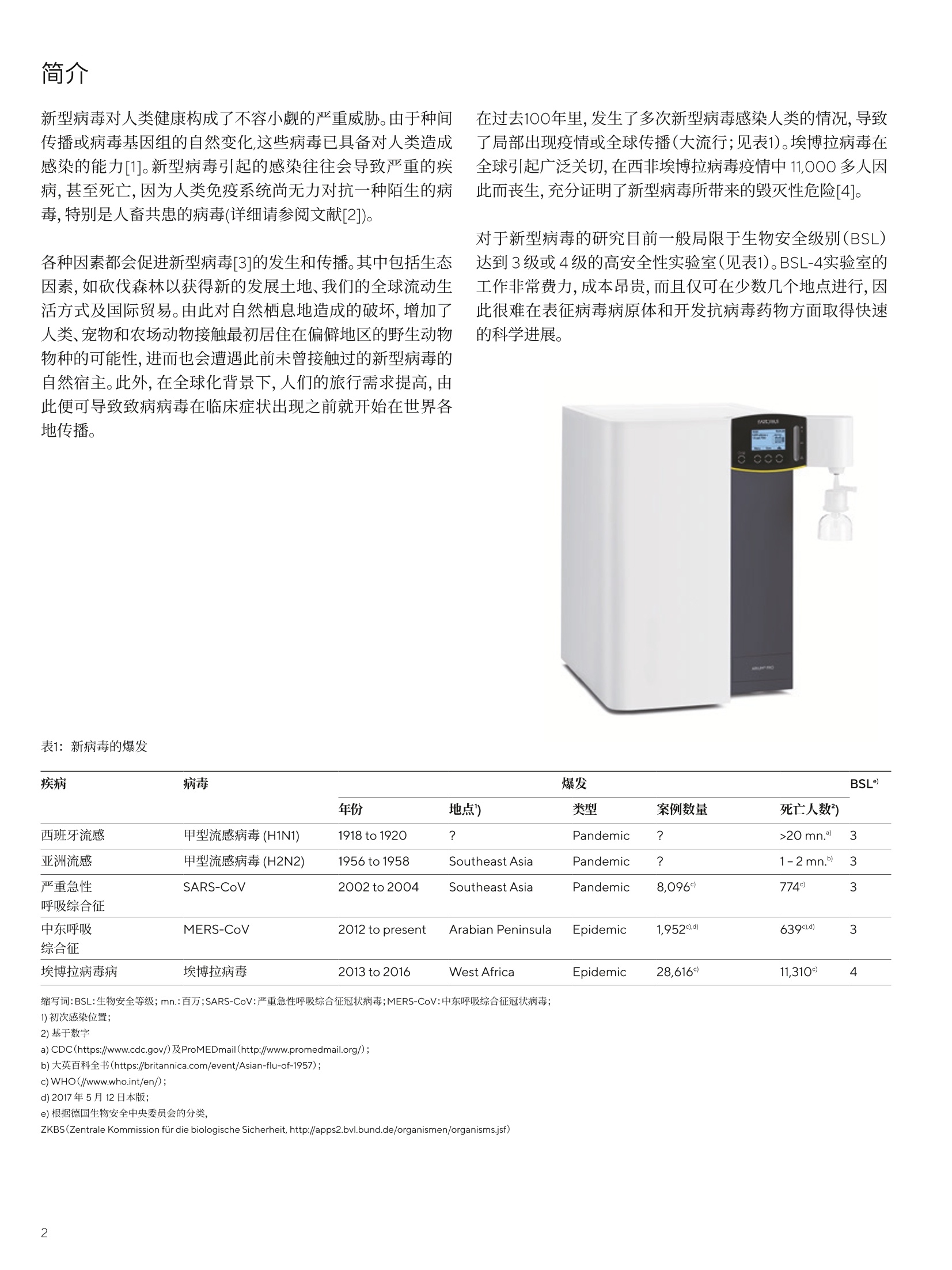
SARTORIUS 应用说明 2021年2月18日 关键词或短语:病毒生产、致病病毒、超纯水、Arium ProVF进入宿主细胞、假型VSV的稳定性 利用假型病毒对高致病性病毒进行研究 超纯水对数据质量的影响 Markus Hoffmann, Mahmoud Tarek Elzayat'and Elmar Herbig² 1.德国灵长类动物研究中心感染生物学研究室- Leibniz Institute for Primate Research, 37077 Gottingen, Germany 2. Sartorius Lab Instruments GmbH & Co. KG, 37079 Gottingen, Germany 摘要 2013年至2016年,西非有超过 11,000人死于埃博拉病毒感染。最近的疫情也表明了新型病毒的危险性。假型病毒可用于轻松研究此类病毒的进入路径。阅读本文,了解超纯水质量在这种假型病毒制备中的重要性。 简介 新型病毒对人类健康构成了不容小觑的严重威胁。由于种间传播或病毒基因组的自然变化,这些病毒已具备对人类造成感染的能力[1]。新型病毒引起的感染往往会导致严重的疾病,甚至死亡,因为人类免疫系统尚无力对抗一种陌生的病毒,特别是人畜共患的病毒(详细请参阅文献[2])。 在过去100年里,发生了多次新型病毒感染人类的情况,导致了局部出现疫情或全球传播(大流行;见表1)。埃博拉病毒在全球引起广泛关切,在西非埃博拉病毒疫情中 11,000多人因此而丧生,充分证明了新型病毒所带来的毁灭性危险[4]。 各种因素都会促进新型病毒[3]的发生和传播。其中包括生态因素,如砍伐森林以获得新的发展土地、我们的全球流动生活方式及国际贸易。由此对自然栖息地造成的破坏,增加了人类、宠物和农场动物接触最初居住在偏僻地区的野生动物物种的可能性,进而也会遭遇此前未曾接触过的新型病毒的自然宿主。此外,在全球化背景下,人们的旅行需求提高,由此便可导致致病病毒在临床症状出现之前就开始在世界各地传播。 对于新型病毒的研究目前一般局限于生物安全级别(BSL)达到3级或4级的高安全性实验室(见表1)。BSL-4实验室的工作非常费力,成本昂贵,而且仅可在少数几个地点进行,因此很难在表征病毒病原体和开发抗病毒药物方面取得快速的科学进展。 表1:新病毒的爆发 疾病 病毒 爆发 BSL 年份 地点) 类型 案例数量 死亡人数) 西班牙流感 甲型流感病毒(H1N1) 1918 to 1920 ? Pandemic ? >20 mn.' 3 亚洲流感 甲型流感病毒(H2N2) 1956 to 1958 Southeast Asia Pandemic ? 1-2 mn.) 3 严重急性 SARS-CoV 2002 to 2004 Southeast Asia Pandemic 8,096° 774° 3 呼吸综合征 中东呼吸 MERS-CoV 2012 to present Arabian Peninsula Epidemic 1,952d) 639c).d 3 综合征 埃博拉病毒病 埃博拉病毒 2013 to 2016 West Africa Epidemic 28,616° 11,310° 4 缩写词:BSL:生物安全等级; mn.:百万;SARS-CoV:严重急性呼吸综合征冠状病毒;MERS-CoV:中东呼吸综合征冠状病毒; 1)初次感染位置; 2)基于数字 ( a) CDC(https://www.cdc.gov/)及ProMEDmail(http://www.promedmail.org/); ) ( b) 大 英 百 科全 书 (h t t p s://britannica.com/event/Asian-flu-of-1 9 57); ) c) WHO(//www.who.int/en/); d)2017年5月12日本版; e)根据德国生物安全中央委员会的分类, ( Z KBS(Zentrale Kommission fur die biologische Sicherheit, http://apps2.bvl.bund.de/organismen/organisms.jsf) ) 在这种情况下,假型病毒为安全有效地研究高致病性病毒进入细胞提供了一个有效的选择。由于不用分析整个病原体,而仅是其介导宿主细胞进入的组分,即包膜蛋白,因此才具备可行性。这些是病毒进入细胞的关键。就假型病毒而言,高致病性病毒的包膜蛋白被整合到载体病毒(假型),其不能自主复制,即复制缺陷。假型的常用系统基于弹状病毒(例如,水泡性口炎病毒、VSV;图1)和逆转录病毒。 本项研究的目的是验证包膜蛋白介导的假型病毒进入是否反映了完整病毒的宿主细胞进入。此外,该研究旨在确定所用试剂(在本例中为实验室用水)的纯度水平对假型病毒产生的影响。 材料和方法 细胞培养、表达质粒和转染:采用含10%胎牛血清和1%青霉素/链霉素溶液的DMEM培养基在37℃和5%CO,下培养HEK-293T、MDCKII和Vero E6细胞。传代和接种时,细胞用磷酸盐缓冲液(PBS)洗涤,用胰蛋白酶/EDTA消化分离。 为了制备假型VSV,将以下病毒包膜蛋白的质粒用作表达载体:VSV糖蛋白(VSVG)、埃博拉病毒糖蛋白(EBOVGP)、中东呼吸综合征冠状病毒S糖蛋白(MERS-CoV S)、导致“西班牙流感”大流行的H1N1(1918)的甲型流感病毒的血凝素(HA)和神经氨酸酶(NA)。此外,使用二肽基肽酶4(DPP4)的表达质粒。空白表达质粒作为对照。使用钙|磷酸盐沉淀转染HEK-293T细胞,其中所有缓冲液和溶液均使用去离子水或赛多利斯Arium@Pro VF超纯水制备。 图1:假型VSV的制备: 1)VSV G反式互补VSV进入表达包膜蛋白的细胞。 2)中和过量病毒。 3)将待研究的包膜蛋白包埋在假型VSV的膜中,收获假型VSV。 超纯水的制备 按照Nitzki和 Herbig(2013)的描述制备所用的Arium@ Pro VF超纯水(该系统显示在前一页上)[5]。水的TOC含量(总有机碳,即有机结合碳)降至2 ppb,电导率为 0.055 pS/cm(18.2MQxcm的电阻率),补偿至25℃。 假型VSV的制备 为了制备假型VSV,使用复制缺陷型VSV载体,其中VSV糖蛋白(VSVG)的基因组信息被两个报告基因替代,即编码绿色荧光蛋白(GFP)和萤火虫荧光素酶(fLUC)的开放阅读框(ORF)。为了增殖该病毒(VSV *AG-fLUC), VSVG必须以反式提供(例如通过转染表达质粒)。如Hoffmann等人所述制备假型VSV, (2016) [6]。 结果 众所周知,中东呼吸综合征冠状病毒(MERS-CoV,原名人类冠状病毒,EMC=hCoV-EMC)通过病毒S糖蛋白(S)和细胞膜蛋白二肽基肽酶4(DPP4)的相互作用结合到细胞表面,从而进入细胞[7]。为了确认这是否也适用于假型VSV的情况,用DPP4表达载体或空表达质粒(无受体)转染靶细胞。正如预期,如果假型的包膜中嵌入了MERS-CoV S,则DPP4的定向表达使假型VSV进入宿主细胞显著增加。 甲型流感病毒是流感疾病的病原体,需要末端糖结构,即所谓的唾液酸,其是细胞膜糖蛋白和糖脂的天然修饰,也是介导进入靶细胞的受体(详情请参见文献[8])。为了研究在假型VSV中掺入甲型流感病毒包膜蛋白是否也导致唾液酸依赖性细胞进入,使用具有H1N1(1918)HA/NA的假型VSV,并从靶细胞表面酶解唾液酸。正如预期的那样,唾液酸的去除导致假型VSV进入宿主细胞显著减少,该假型VSV有H1N1(1918)HA/NA嵌入其包膜中(见图2B)。这一发现证实假型病毒反映了真正的甲型流感病毒进入细胞的机制。 用唾液酸酶或抑制剂预处理靶细胞: 用200 mU重组唾液酸酶处理MDCKII细胞,以从质膜的糖蛋白和糖脂中去除末端唾液酸。为了检测是否包膜蛋白介导的假型VSV进入细胞取决于酸性pH值和细胞半胱氨酸蛋白酶的活性,将VeroE6细胞与50nM巴弗洛霉素A1或 50uME-64d一起孵育。所用化学品在细胞培养基中稀释;在37°℃和5%CO,下孵育2小时。未处理的细胞作为对照。 将靶细胞和假型VSV培养1小时,然后用PBS洗涤,并进一步用细胞培养基培养16-20小时。之后,使用萤光素酶裂解缓冲液裂解细胞,并且使用市售的测定试剂盒在化学发光仪中测量细胞裂解物中萤光素酶活性,以评估由包膜蛋白介导的转导(即,假型进入宿主细胞)的效率。 图2.假型病毒受体依赖性进入细胞:(A)将具有VSV G或MERS-CoV S的假型VSV用于接种之前已经用空载体(无受体)或人二肽基肽酶4(DPP4)的表达质粒转染的HEK-293T细胞。(B)用具有VSV G或H1N1 (1918) HA/NA包膜蛋白的假型VSV接种经唾液酸酶预处理或未经处理的MDCKII细胞。转导效率,即进入效率,由病毒编码的萤光素酶的活性确定并标准化。此外,数据的统计显着性通过t检验得到确认(*:p<0.05)。 埃博拉病毒糖蛋白在细胞进入过程中的激活具有pH依赖性并且需要半胱氨酸蛋白酶活性 埃博拉病毒糖蛋白(EBOV Gp)经翻译后修饰含有多个寡聚糖,而这种聚糖的密集聚集被认为可以保护病毒免受人类免疫系统的有效监测[9]。然而,在进入宿主细胞期间,必须去除带有大部分糖修饰的部分EBOV GP[101。这钟功能性启动是由细胞半胱氨酸蛋白酶介导的[11],这些半胱氨酸蛋白酶存在于内含体囊泡中,且仅在低低体pH下起作用。 在下文中,我们研究了EBOV GP介导的假型VSV的进入是否也依赖于细胞半胱氨酸蛋白酶的活性和低pH值。为此制作了包膜嵌有EBOV GP的假型VSV,并随后用于接种预先用巴佛洛霉素A1(通过质子泵阻断防止内含体内酸化)或半胱氨酸蛋白酶抑制剂(E-64d)孵育的靶细胞。这表明在假型VSV背景下的EBOV GP介导的细胞进入还取决于酸性环境(见图3A)和半胱氨酸蛋白酶的活性(见图3B)。此外,我们还可以证明用E-64d处理特异性阻断EBOV GP驱动的细胞进入,因为VSV-G介导的假型与半胱氨酸蛋白酶无关,尽管它依赖于低内含体pH。 图3:假型病毒pH依赖性进入细胞:带VSV G或EBOV GP的假型VSV用于接种预先用巴佛洛霉素A1(A)或E-64d(B)处理的Vero E6细胞(未处理的细胞用作对照)。通过病毒编码的萤光素酶的活性确定假型病毒的转导效率,即进入效率,并将所得数据标准化。此外,数据的统计学意义通过t检验得到确认(*:p<0.05). 实验室用水的水质影响假型VSV的质量: 此前的试验证明假型VSV是研究高致病性病毒进入宿主细胞的合适模型之后,下一个需要澄清的问题是实验室用水的纯度水平对假型VSV质量的具体影响。在假型VSV的生产过程中,会使用各种缓冲液和溶液,它们都是用水制备。然而,必须指出的是,并非任何一种水都适合制备这些试剂。更确切地说,必须选择适当纯度的实验室用水。 为了研究超纯水是否能够生成更高质量的假型VSV,在平行实验中生成了两批假型VSV:一批使用中心实验室供水源的去离子水(19℃时电导率为 3.7-4.1pS/cm)作为所有溶液和缓冲液的基本溶剂;另一批使用基于Arium@ Pro VF超纯水的溶液和缓冲液(电导率为0.055 uS/cm,补偿至25℃)来制备。检测了作为包膜蛋白的EBOV GP和MERS-CoV S.通过保持相同的孵育条件平行生产假型VSV,接种靶细胞,并量化包膜蛋白介导的假型VSV进入。 讨论 本研究以复制缺陷型水疱性口炎病毒(VSV)为基础产生假型病毒,并对各种高致病性病毒的包膜蛋白进行了研究。我们发现宿主细胞进入依赖于如真实病毒所描述的相同受体分子和生化过程。此外,我们还证明使用超纯水生产假型VSV可以优化这一过程。今后的研究应旨在阐明这一发现的依据:这是由于假型VSV数量的增加、是更有效的细胞进入还是假型稳定性的改善?例如,我们可以推测,当使用超纯水,不存在盐、蛋白酶或脂肪酶时,假型VSV的稳定性提高。 综上所述,可以说假型病毒是研究高致病性病毒进入宿主细胞的重要工具。这些假型病毒未将这种高致病性病毒的研究限制于BLS-3或BLS-4实验室,因此大量科学设施都能够开展此类研究。 该实验设置表明,使用Arium@ pro VF超纯水作为所有缓冲液和溶液的基本溶剂生产的假型VSV的宿主进入(作为质量程度的参数)显著高于使用去离子水的假型的宿主进入(图4)。 图4:实验室用水的纯度水平影响假型病毒的质量:具有EBOVGP或MERS-CoVS的假型VSV用基于去离子水(显示在“去离子水”状态下)和Arium@ Pro VF超纯水(显示在"超纯水"状态下)的缓冲液和溶液制备,并用于接种Vero E6细胞。通过定量病毒编码的萤光素酶来确定假型病毒的转导效率,即进入效率,并将所得数据标准化。此外,数据的统计学意义通过t检验得到确认(*:p<0.05)。 因此,可以表征新型病毒的细胞进入,并且可以更快地开发合适的检测程序和抗病毒策略(药物、疫苗)。假型病毒的使用还降低了要求全身防护服的高安全性实验室的劳动强度,以及相关的成本和其它诸多限制性因素(例如,不能接近不直接位于高安全性实验室内部的设备)。此外,与真正的高致病性病毒相比,假型病毒可将意外接触的实验室人员感染的风险降至最低,显著提高了操作的安全性。 例如,通过使用高纯试剂,特别是基于水的试剂,优化的生产过程有助于提高后续测试程序的灵敏度,增加产量,从而进一步降低生产成本。 致谢 作者特别感谢Pohlmann博士,他负责监督此项研究,审阅手稿,并通过对课题的建设性讨论提供了重要的指导。 ( 文献资料 ) ( [1] Li, W. et a l . Animal origins of the severe acute respiratory syndrome coronavirus: Insight from ACE2-Sproteininteractions. Journal of Virology 2016; 80:4211-4219. ) ( [2] Mandl,J. et al. Rese r voir host immune responses toemerging zoonotic viruses. Cell 2015;160:20-35. ) ( [3] Morse, S. S. Factors in the emergence of infectious diseases.Emerging Infectious Diseases 1995; 1: 7 -15. ) ( [4] Shiwani, H. A. et al. An update on the 2014 Ebola outbreak in Western Africa. Asian Pacific Journal of Tropical Medicine 2017;10:6-10. ) ( [5] Nitzki , F, Herbig , E. In s i tu Hybridisierung-DieBedeutung von Reinstwasser fur RNA Technologien",GIT Labor-Fachzeitschrift 57. Jahrgang, 3;2013 [ also available i n English:In Situ Hybridization: The Importance of Ultrapure Water for RNA T echnologies]. ) [6] Hoffmann,M. et al. The glycoproteins of all filovirusspecies use the same host factors for entry into bat andhuman cells but entry efficiency is species dependent.PLoSOne; 2016, Vol.11. ( [7] Raj, V. S . et al. Dipeptidyl peptidase 4 is a functionalreceptor for the emerging human coronavirus-EMC. Nature 2013;495:251-254. ) ( [8] De Graaf, M., Fouchier, R. A. M. Role of receptor binding s pecificity in influenza A virus transmission andpathogenesis.The EMBO Journal 2014; 33:781-935. ) ( [9] Cook, J. D.,Lee, J. E. The secret life of viral entryglycoproteins: Moonlighting in immune evasion.PLoS Pathogens 2013;Vol.9. ) ( [10] White,J.M.,Schornberg, K. L. A new player in the puzzle of filovirus entry. Nature Reviews Microbiology 2012;10:317-322. ) ( [ 1 1] Chandran, K. et al. Endosomal p roteolysis of the Ebola virus glycoprotein is necessary for infection. Science 2005;308:1643-1645. ) 销售与服务联系方式 更多联系信息,请访问 www.sartorius.com.cn 赛多利斯(上海)贸易有限公司 邮箱 lab.cn@sartorius.com 服务热线 400 920 9889|800 820 9889 上海北京上海市浦东新区盛荣路388北京市顺义区空港工业区 B弄百佳通产业园3号楼区裕安路 33号, 1013007-11层,200120电话 +86 10 8042 6300 电话+8621 6066 6100 苏州广州 苏州市虎丘区科技城锦峰路广州市越秀区水荫路117号 158 号 101park-28 幢201,1105单元, 510075 215163电话+86 20 37617284 电话+86 512 6616 0490 成都西安成都市上东大街246号新良西安市和平路 118号和平银大厦2406室,610012座1107室, 710001电话+8628 8666 6877电话 +86 29 87512305 ( 技木规格如有变更,恕不 另 行通知。 ) ( 赛多利斯保留最终解释权和修改权。 ) ( 版本05|2022 ) 了解更多信息: www.sartorius.com Abstract新型病毒对人类健康构成了不容小觑的严重威胁,它们引起的感染往往会导致严重的疾病,甚至死亡,因为人类免疫系统尚无力对抗一种陌生的病毒,特别是人畜共患的病毒。最近的疫情也表明了新型病毒的危险性。假型病毒可用于轻松研究此类病毒的进入路径。Download下载本篇《利用假型病毒对高致病性病毒进行研究》应用说明了解超纯水质量在这种假型病毒制备中的重要性。点击下载 获取全文简介由于种间传播或病毒基因组的自然变化,新型病毒已具备对人类造成感染的能力,各种因素都会促进新型病毒的发生和传播。在过去100年里,发生了多次新型病毒感染人类的情况,导致了局部出现疫情或全球传播(大流行;见表1)。表1:新病毒的爆发对于新型病毒的研究目前一般局限于生物安全级别(BSL)达到 3 级或 4 级的高安全性实验室(见表1)。BSL-4实验室的工作非常费力且成本昂贵,而且仅可在少数几个地点进行,因此很难在表征病毒病原体和开发抗病毒药物方面取得快速的科学进展。在这种情况下,假型病毒为安全有效地研究高致病性病毒进入细胞提供了一个有效的选择。假型的常用系统基于弹状病毒(例如,水泡性口炎病毒、VSV;图1)和逆转录病毒。本项研究的目的是验证包膜蛋白介导的假型病毒进入是否反映了完整病毒的宿主细胞进入,以及确定所用试剂(在本例中为实验室用水)的纯度水平对假型病毒产生的影响。图1:假型VSV的制备:1)VSV G反式互补VSV进入表达包膜蛋白的细胞。2)中和过量病毒。3)将待研究的包膜蛋白包埋在假型VSV的膜中,收获假型VSV。材料和方法采用含 10 %胎牛血清和 1 %青霉素/链霉素溶液的DMEM培养基在 37 °C和 5 % CO2下培养HEK-293T、MDCKII和Vero E6细胞。传代和接种时,细胞用磷酸盐缓冲液(PBS)洗涤,用胰蛋白酶/EDTA消化分离。将VSV糖蛋白(VSV G)、埃博拉病毒糖蛋白(EBOV GP)、中东呼吸综合征冠状病毒S糖蛋白(MERS-CoV S) 、H1N1(1918)的甲型流感病毒的血凝素(HA)和神经氨酸酶(NA) 病毒包膜蛋白的质粒用作表达载体。此外,使用二肽基肽酶4(DPP4)的表达质粒。空白表达质粒作为对照。使用钙|磷酸盐沉淀转染HEK-293T细胞,其中所有缓冲液和溶液均使用去离子水或赛多利斯Arium® Pro VF超纯水制备。- 超纯水的制备使用Arium® Pro VF制备的超纯水,水的TOC含量降至 2 ppb,电导率为 0.055 μS/cm(18.2MΩ×cm的电阻率),补偿至25°C。- 假型VSV的制备使用复制缺陷型VSV载体制备假型VSV,其中VSV糖蛋白(VSV G)的基因组信息被两个报告基因替代,且 VSV G必须以反式提供。- 用唾液酸酶或抑制剂预处理靶细胞用 200 mU重组唾液酸酶处理MDCKII细胞,以从质膜的糖蛋白和糖脂中去除末端唾液酸。- 分析包膜蛋白介导的宿主细胞进入将靶细胞和假型VSV培养 1 小时,然后用PBS洗涤,并进一步用细胞培养基培养 16 – 20 小时。之后,使用萤光素酶裂解缓冲液裂解细胞,并且使用市售的测定试剂盒在化学发光仪中测量细胞裂解物中萤光素酶活性,以评估由包膜蛋白介导的转导的效率。结果如果假型的包膜中嵌入了MERS-CoV S,则DPP4的定向表达使假型VSV进入宿主细胞显著增加(见图2A)。唾液酸的去除导致假型VSV进入宿主细胞显著减少,该假型VSV有H1N1(1918)HA/NA嵌入其包膜中(见图2B)。这一发现证实假型病毒反映了真正的甲型流感病毒进入细胞的机制。图2. 假型病毒受体依赖性进入细胞:(A)将具有VSV G或MERS-CoV S的假型VSV用于接种之前已经用空载体(无受体)或人二肽基肽酶4(DPP4)的表达质粒转染的HEK-293T细胞。(B)用具有VSV G或H1N1 (1918) HA/NA包膜蛋白的假型VSV接种经唾液酸酶预处理或未经处理的MDCKII细胞。转导效率,即进入效率,由病毒编码的萤光素酶的活性确定并标准化。此外,数据的统计显着性通过t检验得到确认(*:p<0.05)。埃博拉病毒糖蛋白在细胞进入过程中的激活具有pH依赖性并且需要半胱氨酸蛋白酶活性。在假型VSV背景下的EBOV GP介导的细胞进入还取决于酸性环境(见图3A)和半胱氨酸蛋白酶的活性(见图3B)。图3:假型病毒pH依赖性进入细胞:带VSV G或EBOV GP的假型VSV用于接种预先用巴佛洛霉素A1(A)或E-64d(B)处理的Vero E6细胞(未处理的细胞用作对照)。通过病毒编码的萤光素酶的活性确定假型病毒的转导效率,即进入效率,并将所得数据标准化。此外,数据的统计学意义通过t检验得到确认(*:p<0.05)。实验室用水的水质影响假型VSV的质量:在平行实验中生成两批假型VSV:一批使用中心实验室供水源的去离子水(19 °C时电导率为 3.7 – 4.1 μS/cm)作为所有溶液和缓冲液的基本溶剂;另一批使用基于Arium® Pro VF超纯水的溶液和缓冲液(电导率为0.055 μS/cm,补偿至 25 °C)来制备。检测了作为包膜蛋白的EBOV GP和MERS-CoV S。通过保持相同的孵育条件平行生产假型VSV,接种靶细胞,并量化包膜蛋白介导的假型VSV进入。实验表明,使用Arium® Pro VF超纯水作为所有缓冲液和溶液的基本溶剂生产的假型VSV的宿主进入(作为质量程度的参数)显著高于使用去离子水的假型的宿主进入(图4)。图4:实验室用水的纯度水平影响假型病毒的质量:具有EBOV GP或MERS-CoVS的假型VSV用基于去离子水(显示在“去离子水”状态下)和Arium® Pro VF超纯水(显示在“超纯水”状态下)的缓冲液和溶液制备,并用于接种Vero E6细胞。通过定量病毒编码的萤光素酶来确定假型病毒的转导效率,即进入效率,并将所得数据标准化。此外,数据的统计学意义通过t检验得到确认(*:p<0.05)。讨论本研究以复制缺陷型水疱性口炎病毒(VSV)为基础产生假型病毒,并对各种高致病性病毒的包膜蛋白进行了研究。我们发现宿主细胞进入依赖于如真实病毒所描述的相同受体分子和生化过程。此外,我们还证明使用超纯水生产假型VSV可以优化这一过程。假型病毒是研究高致病性病毒进入宿主细胞的重要工具,不需要将这种高致病性病毒的研究限制于BLS-3或BLS-4实验室。假型病毒的使用还降低了劳动强度、成本和其它诸多限制性因素,并显著提高了操作的安全性。Arium® Pro VF超纯水系统更多详细解读 敬请下载全文
关闭-
1/8

-
2/8
还剩6页未读,是否继续阅读?
继续免费阅读全文产品配置单
德国赛多利斯集团为您提供《高致病性病毒中研究检测方案(超纯水器)》,该方案主要用于其他中生化检验检测,参考标准《暂无》,《高致病性病毒中研究检测方案(超纯水器)》用到的仪器有赛多利斯超纯水系统 arium® pro 、赛多利斯 Arium® Comfort II 纯水超纯水一体机。
我要纠错
推荐专场
纯水器、超纯水器、纯水机、超纯水机
更多相关方案







 咨询
咨询





