方案详情文
智能文字提取功能测试中
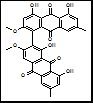
考马斯亮蓝G-250有红、蓝两种不同颜色的形式,在一定浓度的乙醇和酸性条件下,可配成淡红色的溶液,与蛋白结合后形成蓝色化合物,该化合物在595 nm处有最大吸收值,化合物颜色深浅与蛋白的浓度高低成正比。 该法操作简便迅速,消耗样品量少,但不同蛋白质之间差异大,且标准曲线线性差。高浓度的Tris、EDTA、尿素、甘油、蔗糖、丙酮、硫酸铵和去污剂对测定有干扰。缓冲液浓度过高时,改变测定液pH值会影响显色。 Bradford法(考马斯亮蓝法) 实验原理: Bradford蛋白质测定法是根据蛋白质与染料结合的原理设计的。考马斯亮蓝染料(G-250)在酸性溶液中与蛋白质的碱性氨基酸和芳香族氨基酸残基结合,使得染料的最大光吸收峰位置由原来的465nm变为595nm,溶液颜色也由原来的棕红色变为蓝色,反应迅速且稳定,形成的化合物颜色深浅在一定范围内与蛋白质浓度成正比关系,因此可通过测定结合染色后溶液在595nm处的光吸收度值来计算溶液中蛋白质的含量。 Bradford法测蛋白浓度的误差主要来源于几个方面: 1.样品稀释倍数的影响:当样品浓度较低时,读数的轻微波动会导致浓度测定的较大偏差。例如,如果浓度较高,读数从0.31波动至0.33,这对最终浓度影响不大;但如果浓度很低,读数从0.07波动至0.09,这一波动对蛋白浓度的测到值却有很大影响,分别达到0.14和0.18,误差高达30%左右1。 2.标准曲线和线性范围:只有在一定范围内,测定值才处在线性范围内。浓度太低或太高时,测定值都会有偏差。因此,建议在较高蛋白浓度条件下测定蛋白,以此为准进行稀释,不需要对稀释后的蛋白再次测定。 3.染料与蛋白质结合的过程:虽然染料与蛋白质结合的过程只需要2min,复合物的颜色在1h内保持稳定,但标准曲线的轻微非线性以及染料与蛋白质反应的竞争性抑制(如盐酸胍、抗坏血酸等化合物的影响)也可能导致测量误差23。 4.实验操作和仪器的影响:实验过程中的操作误差,如样品稀释、标准曲线的制备、吸光度的测量等,都可能引入误差。此外,使用的检测器皿类型、清洁度以及检测时的温度等因素也可能影响结果的准确性。 综上所述,Bradford法测蛋白浓度的误差来源多样,包括样品稀释倍数、标准曲线的线性范围、染料与蛋白质的结合过程以及实验操作和仪器的影响。 为了减少误差,应在较高蛋白浓度条件下进行测定,并注意实验操作的规范性和仪器的准确性。
关闭-
1/1

产品配置单
上海远慕生物科技有限公司为您提供《bradford法测蛋白浓度误差原因分析》,该方案主要用于其他中bradford法测蛋白浓度检测,参考标准《暂无》,《bradford法测蛋白浓度误差原因分析》用到的仪器有考马斯亮蓝法蛋白含量测试盒 可见分光光度法、考马斯亮蓝G250染料试剂、考马斯亮蓝G-2506104-59-2报价。
我要纠错
相关方案



 咨询
咨询