-
+关注
私聊
-

yhl-87_
第21楼2009/11/09
电化学分析法(22)—电导与电导率
3.1.1 电导与电导率
电解质溶液的导电能力用电导(G)表示,单位为西门子,简称西(S)。电导是电阻(R)的倒数,同样遵守欧姆定律:
由于两电极间的距离及电极面积不易准确测量,因此电解质溶液的电导率不能直接准确测得,一般是通过测定已知电导率的标准溶液的电导,先求出电导池常数θ,再通过测定待测溶液的电导,可计算出待测溶液的电导率。表3-1所示为KCl溶液的电导率。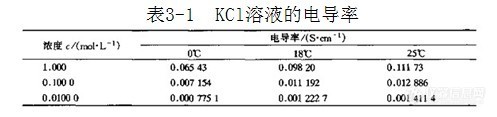
电导率与电解质溶液的浓度及性质有关:在一定范围内,离子浓度越大、单位体积内离子的数目越多、离子的价数越高、离子迁移速率越快、电导率越大。因此,电导率不但与离子种类有关,还与影响离子迁移速率的外部因素如温度、溶剂、黏度等有关。
对于同一电解质,当外部条件一定时,溶液的电导取决于溶液的浓度。因为电导率的概念中规定溶液的体积为lcm3,所以电导率实际上取决于溶液中所含电解质的物质的量。为了比较和衡量不同电解质溶液的导电能力,有必要引入“摩尔电导率’的概念。
-
+关注
私聊
-

yhl-87_
第22楼2009/11/09
电化学分析法(23)—摩尔电导率
3.1.2 摩尔电导率及无限稀释摩尔电导率
摩尔电导率A。是指在两个相距1cm的平行电极之间,溶液中电解质的物质的量为 1mol时所具有的电导。国家标准规定
由于摩尔电导率规定了在两电极间电解质的物质的量是lmol,若通过改变电极面积来改变电极间的电解质溶液的浓度,则随着溶液浓度的增大,离子间的相互作用力加大,离子的迁移速率降低。摩尔电导率随之减小。对弱电解质而言,浓度增大,电离度减小,实际参与导电的离子数目减少,摩尔电导率也随之减小;相反,溶液的浓度越稀,离子间的相互作用越小,摩尔电导率越大。溶液在无限稀释时,溶液中各离子间的相互作用力几乎为零;弱电解质的电离度也几乎达到100%,溶液的摩尔电导率达到最大值。此时,电解质溶液的摩尔电导率称为无限稀释摩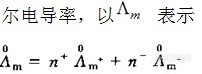
各种离子在一定温度和溶剂中的无限稀释摩尔电导率是个常数,是由离子的某些性质决定的,是离子的特征参数,在一定程度上反映了各离子导电能力的大小。表3-2列出了常见离子在水溶液中的无限稀释摩尔电导率。
表3-2 常见离子在水溶液中的无限稀释摩尔电导率(25℃)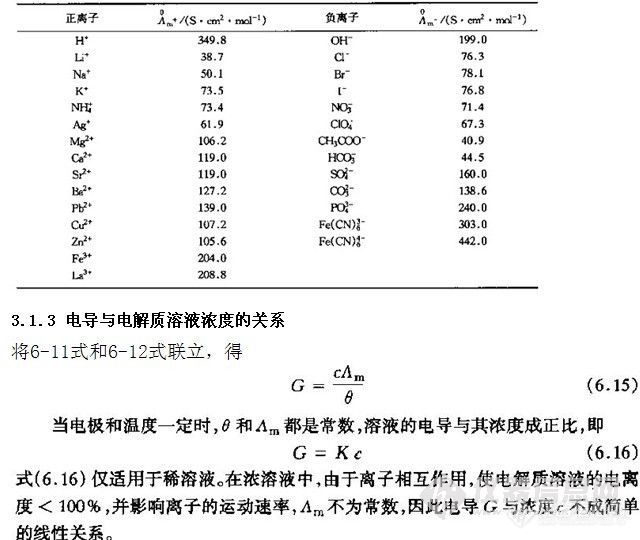
-
+关注
私聊
-

yhl-87_
第23楼2009/11/09
电化学分析法(24)—电导池
3.2 电导测量装置
测定溶液电导,实际上就是测定溶液的电阻。测定时,必须插入一对电极。如果用直流电源进行测量,电流通过溶液时,两电极上会发生电极反应形成一个电解池,电极附近溶液的组成发生改变,产生极化,使测量产生误差。因此,必须使用600~1000Hz的较高频率的交流电测量电导以降低极化效应。电导的测量装置包括电导池和电导仪两个部分。
3.2.1 电导池
电导池是用以测量电解质溶液电导的专用设备,它是由两个电极组成,结构如图3-1所示。
电导电极一般由两片平行的铂(石墨、钽、镍金或不锈钢等)制成的。电导池中电极片的形状、面积及两片间的距离可根据不同的要求进行设计,结构如图3-2所示。
为了减少交流电的极化效应,可在铂电极表面上覆盖颗粒很细的“铂黑”,铂黑电极由于有较大的表面积,电流密度较小,因而极化较少,一般用于测量电导率高的溶液。在测量低电导率溶液时,由于铂黑对电解质由强烈的吸附作用,使测定值不稳定,此时可采用光亮铂电极。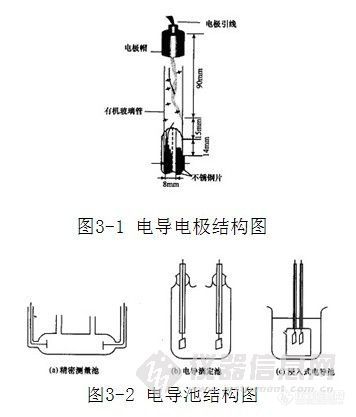
-
+关注
私聊
-

yhl-87_
第24楼2009/11/09
电化学分析法(25)—电导率仪
3.2.2 电导率仪
电导率仪是溶液电导测量的专用设备,根据作用原理可分为平衡电桥式和直读式两类。
l)平衡电桥式电导率仪
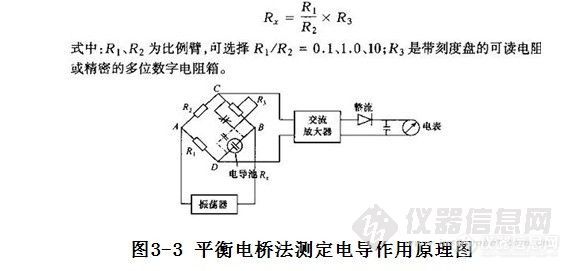
测量电导的最简单仪器是平衡电桥式,如国产雷磁-27型和D5906型电导率仪,作用原理如图3-3所示。
将电导池插入盛装待测溶液的容器中,由标准电阻R1、R2、R3和电导池Rx构成惠斯顿电桥。在A、B间接上正弦波振荡器,产生1000Hz的交流电压作为电源。电流从A、B两端通过电桥,经交流放大器放大后,再整流将交流信号变成直流信号推动电表,当电桥平衡时电表指零,C、D两端的电位相等,此时
2)直读式电导率仪
由于直读式电导率仪有利于快速和连续自动测量,在实际工作中,大多数采用此类电导率仪。国产的DD-11型和DDS-11A型电导率仪就是这类仪器。采用电阻分压法原理,作用原理如图3-4所示。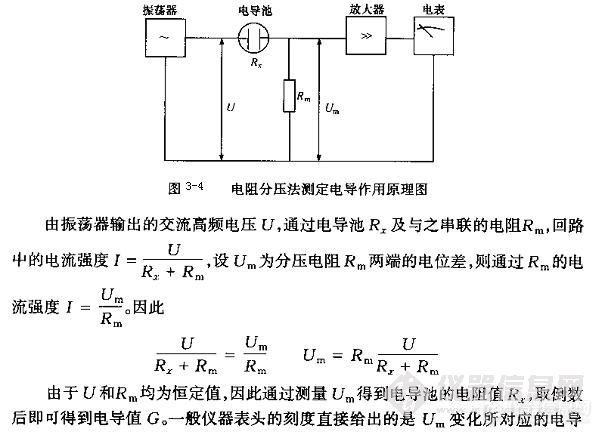
值G。若要以电导率表示,则可按下式计算。
k = Gθ
在电导率仪上有电导池常数θ的校正装置,电导率仪可直接显示电导率的值。
-
+关注
私聊
-

yhl-87_
第25楼2009/11/09
电化学分析法(26)—电导分析法的应用(直接电导法)
3.3 电导分析法的应用
3.3.1 直接电导法
直接电导法是通过直接测定溶液的电导以求得溶液中电解质含量的方法,主要用于监测水的纯度、大气中有害气体及某些物理常数的测定等。
1)水质监测
电导法是检验水质纯度的最佳方法之一。电导率是水质的一个很重要的指标,它反映了水中电解质的总量。但电导率不能反映水中有机物、细菌、藻类及其他悬浮杂质等。实验室测量水的电导率常用DDS-11A型电导率仪。一些典型水质的电导率如图3-5所示。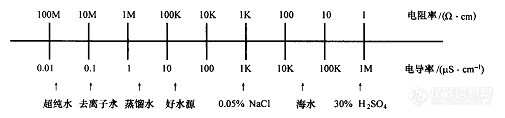
图3-5 一些典型水质的电导率
应注意:强电解质浓度低于10%~20%(质量分数)时,电导率值随浓度的增加呈线性增加。但在高浓度溶液中,离子间的作用力增加,线性关系不成立。
2)大气监测
测定大气污染气体如SO2、CO、CO2及NxOy等时,可利用气体吸收装置,通过反应前后吸收液电导率的变化来间接反映所吸收的气体浓度。该法灵敏度高、操作简单,并可获得连续读数,在环境监测中广泛应用。例如,大气中的SO2可用酸性过氧化氢溶液作吸收液,被过氧化氢氧化为硫酸后使溶液的电导率明显增加,其增加量在一定范围内与SO2气体的浓度成正比,由此计算出SO2的含量。在气体进口处设一气体净化装置,如用Ag2SO4固体可除去H2S、KHSO4及HCl等的干扰。
-
+关注
私聊
-

yhl-87_
第26楼2009/11/09
电化学分析法(27)—电导分析法的应用(电导滴定法)
3.3.2 电导滴定法
滴定分析过程中,伴随着溶液离子浓度和种类的变化,溶液的电导也发生变化,利用被测溶液电导的突变指示理论终点的方法称为电导滴定法。例如,以C+D- 滴定A+B-,强电解质的电导滴定曲线如图3-6所示。设反应式为
(C++D-)+(A++B-)→AD+C++B-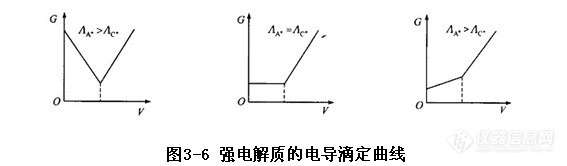
+逐渐减少,而C+逐渐增加。这一阶段的溶液电导变化取决于A A+和A C+的相对大小。当A A+>A C+时,随着滴定的进行,溶液电导逐渐降低;当A A+<A C+时,溶液电导逐渐增加;当A A+=A C+时,溶液电导恒定不变。在化学计量点后,由于过量C+和D+的加入,溶液的电导明显增加。电导滴定曲线中两条斜率不同的直线的交点就是化学计量点。有弱电解质参加的电导滴定情况要复杂一些,但确定滴定终点的方法是相同的。
电导滴定时,溶液中所有存在的离子,无论是否参加反应,都对电导值有影响。因此,为使测量准确可靠,试液中不应含有不参加反应的电解质。为避见在滴定过程中产生稀释作用,所用标准溶液的浓度常十倍于待测溶液,以使滴定过程中溶液的体积变化不大。
对于滴定突跃很小或有几个滴定突跃的滴定反应,电导滴定可以发挥很大作用,如弱酸弱碱的滴定、混合酸碱的滴定、多元弱酸的滴定以及非水介质的滴定等。电导滴定在酸碱、沉淀、配位和氧化还原滴定中都能应用。
-
+关注
私聊
-

yhl-87_
第27楼2009/11/09
电化学分析法(28)—库仑分析法
4 库仑分析法
库仑分析是根据电解过程中消耗的电量,由法拉第定律来确定被测物质含量的方法。库仑分析法分为恒电流库仑分析法和控制电位库仑分析法两种。
恒电流库仑分析法是在恒定电流的条件下电解,由电极反应产生的电生“滴定剂”与被测物质发生反应,用化学指示剂或电化学的方法确定“滴定’’的终点,由恒电流的大小和到达终点需要的时间算出消耗的电量,由此求得被测物质的含量。这种滴定方法与滴定分析中用标准溶液滴定被测物质的方法相似,因此恒电流库仑分析法也称库仑滴定法。
控制电位库仑分析法以控制电极电位的方式电解,当电流趋近于零时表示电解完成,由测得电解时消耗的电量求出被测物质的含量。
库仑分析法的基本要求是100%的电流效率。
-
+关注
私聊
-

yhl-87_
第28楼2009/11/09
电化学分析法(29)—库仑滴定法的原理和装置
4.3.1 库仑滴定法
1 原理和装置
库仑滴定的装置如图所示.它由电解系统和指示终点系统两部分组成。电解系统包括电解池(或称库仑池)、计时器和恒电流源。电解池中插入工作电极,辅助电极以及用于指示终点的电极。
以强度一定的电流通过电解池,在100%的电流效率下由电极反应产生的电生滴定剂与被侧物质发生定量反应,当到达终点时,由指尔终点系统发出信号,立即停止电解,由电流强度和电解时问按法拉第定律计算出被测物质的质量
m=it/96485·M/z
或由库仑仪直接显示电量或被测物质的含量。
图4-1 库仑滴定装置示意图
由电解产生滴定剂的条件和应用见表4.1 】
】
进行库仑滴定也可以用电极本身,如用银阳极氧化产生的Ag+来测定卤素、硫化物、硫醇或巯基化合物
Ag + X- = AgX + e
AgX直接沉积在电极上。
-
+关注
私聊
-

yhl-87_
第29楼2009/11/09
电化学分析法(30)—库仑分析法指示终点的方法
2 指示终点的方法
库仑滴定指示终点的方法有化学指示剂法、电位法、永停终点法以及光度法等。
〔1〕化学指示剂法
滴定分析中使用的化学指示剂基本上也能用于库仑滴定用,化学指示剂指示终点可省去库仑滴定中指示终点的装置,在常量的库仑滴定中比较简便。
(2)电位法
库仑滴定中用电位法指示终点与电位滴定法确走终点的方法相似。在库仑滴定过程中可以记录电位(或pH)对时间的关系曲线,用作图法或微商法求出终点也可用pH汁或离子计,由指针发生灾变表示终点到达。
(3)永停终点法
永停终点法指示终点的装置如图4-2所示,在指示终点系统的两支大小相向的铂电极上,加50~200mV的电压.当到达终点时,由于电解液中产生可逆电对或原来的可逆电对消失,使该铂电极回路中的电流迅速变化或停止变化。永停终点法指示终点非常灵敏,常用于氧化还原滴定体系。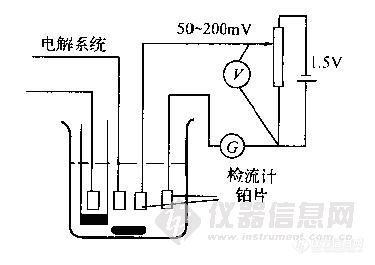
图4-2 永停终点法装置示意图
4.2 100%电流效率
电流效率是指电解池流过一定电量后,某一生成物的实际质量与理论生成质量之比。为了能准确进行电量测定,库仑分析时必须注意使通入电解池的电流100%地用于工作电极的反应,而没有漏电现象和其他副反应发生,即电极反应的电流效率为100%,只有这样才能正确地根据所消耗的电量求得析出物质的量,这是库仑分析法测定的先决条件。
为了保证100%的电流效应,电解装置中可采用盐桥,或将产生干扰物质的电极置于底部装有烧结玻璃或离子交换膜的玻璃套管内隔离等方式。
-
+关注
私聊
-

yhl-87_
第30楼2009/11/09
电化学分析法(31)—控制电位库仑法
4.3 控制电位库仑法
控制电位库仑法是在控制电极电位的情况下,将待测物质全部电解,测量电解所需消耗的总电量。根据法拉第电解定律,得出待测物质的量。
控制电位库仑法必须注意两个问题:第一,在所控制的电极电位下完成对待测物质的电解;第二,电解的电流效率必须是100%,即消耗的电量都用于待测物质的电解,无副反应。以上两个问题相互关联,只有电极电位控制适当,才能保证在此电位下待测物质在电极上完全电解,非待测物质不发生电解,电流效率为100%。
根据电解方程式U外= U分十IR =(φ平(阳) -η阳)-(φ平(阴) -η阴)十 IR,外加电压U外必须大于分解电压U分,电解池才能发生电解。但在实际电解过程中,电解开始时的电流较大,随着电解反应的进行,由于待电解离子浓度不断下降以及极化现象,阴极和阳极的电位不断发生变化,电解电流也逐渐降低。为使电极电位恒定,保证电解电流效率为100%,工作中一般不采用控制外加电压的方式,而是控制工作电极的电位。
为了使工作电极的电位保持恒定,电解过程中,必须不断减小外加电压,而电流不断减小。当待电解物质电流趋于零(残余电流量)时停止电解。电解时,在电路上串联一个库仑计或电子积分仪,可指示出通过电解池的电量,测定结果准确性的关键是电量的测量。