- 分
- 该帖子已被版主-逆天加2积分,加2经验;加分理由:支持
-
+关注
私聊
-

用心飞
第20楼2011/07/06
"此时它的光谱项为47S3,受激发产生跃迁,7S3—7P4,波长为357.9nm;7S3—7P3,波长为359.4nm;7S3—7P2,波长为360.3nm。"这一段还是没看懂。
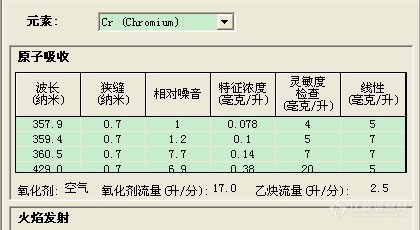
前两个是相同的,后面的波长跟你的有区别啊。7S3—7P2是说s轨道,跃迁到p轨道吗?那个7是什么意思?wmj31(wmj31) 发表:不知道怎解释这个概念。铬的基态的电子组态为d5s1(即在d轨道有5个电子,在s轨道有一个电子),此时它的光谱项为47S3,受激发产生跃迁,7S3—7P4,波长为357.9nm;7S3—7P3,波长为359.4nm;7S3—7P2,波长为360.3nm。