Hongwei Xie, Weibin Chen, Martin Gilar, St John Skilton, and Jeffery R. Mazzeo
Waters Corporation, Milford, MA, U.S.
前言
流感是一种呼吸道病毒感染,它是美国主要的致死原因之一,每年有超过50,000人死于流感1。流感疫苗是一种主要的流感预防措施,也是降低季节性流感发病率和死亡率的主要策略。疫苗通过结合病毒血凝素(HA)抗体为人体提供保护,血凝素在流感感染中起到关键的作用。
经批准的季节性流感灭活疫苗通常含有规定量的HAs——H1、H3和B的混合物,对应3种最常见的病毒流感A亚型的H1N1和H3N2和流感B的HA蛋白。这些HA蛋白是糖蛋白类,每个糖基化位点均含有多种N-糖基化基序且每个位点含多种糖形。由于HAs在流感结合至宿主细胞,即感染过程中的重要决定作用,HAs中糖基化的精细鉴定和监测对疫苗的开发和生产都非常重要。
目前,N-糖基化鉴定方法包括释放的游离聚糖分析2-4和完整质量分析5-7。这些方法对于分析含确定糖基化位点的糖蛋白类是有效的,如单克隆抗体。聚糖谱分析可在完整蛋白水平(完整质量分析)或作为碳水化合物(游离聚糖谱)进行。由于糖基化的天冬酰胺(N)残基的质量在去糖基化时增加了1 Da,糖基化位点通常可由经酶(通常是PNGase F)去除聚糖部分后的肽谱来检测。
然而,这些方法很难区分同一蛋白不同糖基化位点上的聚糖分子,因此用这些方法表征含多个糖基化位点的糖蛋白,如HAs,是极富挑战的。而且,如疫苗等复杂样品均含有带-NXS/T-基序的多个N糖基化位点。由于N位点修饰后1Da 质量增加可能是由其他位点糖基化或脱酰胺作用造成,通过肽谱确定N-链糖基化位点是非常困难的。
采用UPLC®革新的分离能力,经由LC/UV-MS系统分析了单克隆鼠lgG1抗体胰蛋白酶消化所得胰蛋白酶肽的四种主要的N-糖形9。结果显示该方法可检测并量化糖基化。且采用该方法可同时鉴定糖基化位点和聚糖分子。
在以前的研究中10-11,我们证实采用UPLC/MSE获得的胰蛋白酶肽谱能够准确的分离和鉴定位点特异性修饰,如N-去氨酰作用和M-氧化。
在本应用实例中,我们证明UPLC/MSE可区分离并鉴定由昆虫细胞-杆状病毒重组表达系统(BEVS)表达的流感疫苗候选物HAs蛋白的N-糖基化。糖肽和糖形可由ACQUITY UPLC®系统在多肽水平分离,并由SYNAPT™ MS系统在线检测。UPLC/MSE数据经BiopharmaLynx™ 软件处理并报告N-糖基化信息。该方法改进了表征质量并减少数据处理时间。此外,该方案有一个为非专业研究者提供了解决这类问题的通用流程,工作流程化可使整个团队受益。
实验
由昆虫细胞BEVS系统表达的含有HA蛋白H1,H3和B的流感疫苗候选物经胰蛋白酶消化。肽段混合物含有N-糖肽及来自于目的蛋白的其它肽段。制备的过程包括:
1. 蛋白溶解于0.05% RapiGest™ SF、pH 7.4的溶液中,80 °C 加热10 min变性
2. 56°C,DDT还原30 min
3. 黑暗,室温下采用碘乙酰胺烷基化30 min
4. 37 °C,pH 7.4下,胰蛋白酶消化4 hrs
5. 加入0.1%甲酸终止反应,并灭活胰蛋白酶。
消化产物经汗0.1%甲酸的5%乙腈(ACN)溶液稀释成0.2 μg/μL,用于UPLC/MS分析。
UPLC/MSE实验采用ACQUITY UPLC-SYNAPT质谱偶联系统分析。UPLC系统配置2.1 x 150 mm、BEH300 C18 1.7-μm肽分离柱。取20-μL含约4 μg肽混合物进样,采用120-min 梯度洗脱(1至40% ACN0.1% FA溶液),流速0.2 mL/min,柱温60 °C。重复进样四次。
采用ESI阳离子模式获得MSE 数据,低碰撞能(5 V)采集肽前体(MS)数据和提高能量(20-40V之间调整)获得肽片段(MSE)数据。扫描时间为0.5秒(总工作周期1 sec)。分析中各种参数为:柱压3.0 kV,源温度100 °C,锥孔电压 37 V,且锥孔气流10 L/h。该系统调至最低分辨率10,000(V-模式),并采用100 fmol/μL Glu1-fibrinopeptide B(GFP)校正, GFP由含0.1% FA 50:50 ACN/水溶液配制,通过LOCKSPRAY通道每分钟进样一次以确保高质量准确度。
采集的数据经BiopharmaLynx, v. 1.2,MassLynx™ 软件的应用管理程序进行处理,采用strict tryptic cleavage rule,且设置cysteine carbamidomethylation为固定修饰,以及N-糖基化作为可变修饰。其它BiopharmaLynx 方法设置参照我们以前发表的文章。12
结果和讨论
据报道,昆虫细胞系表达的糖蛋白具有两种主要的N-聚糖类型:少甘露糖苷结构(Man (1-3) GlcNAc2 or Man (1-3) GlcNAc[Fuc]GlcNAc)和寡聚甘露糖结构(Man(5-9)GlcNAc2),这里Man表示甘露糖,GlcNAc为N-乙酰葡糖胺,而Fuc是海藻糖。BiopharmaLynx含有11种可能的可变N-糖基化修饰糖形。HA 蛋白H1、H3和B的可能的N-糖基化位点(含-NXS/T基序)数目分别为9、12和10。对采集的UPLC/MSE数据经BiopharmaLynx处理后,可分别判定H1、H3和B 7、4和6个N_糖基化位点。每个N_糖基化位点可能有多种连接的糖形。以下我们挑选出3个典型样品(其中一个来自于疫苗样本中的HA蛋白),以阐释UPLC/MSE 是如何用于分离和表征糖肽和糖形。
图1显示了HA蛋白B中糖基化和未糖基化的胰蛋白肽T8(分别命名为B_T8*和B_T8,在后面的文章中,所有的糖基化肽均采用型号(*)标记以表明相应的修饰形式)的分离和鉴定。
由于添加的糖基团增加了亲水性,B_T8*洗脱较B_T8早(图1A)。胰蛋白酶肽序列由MSE谱确定(图1B和1C)。
B_T8*的糖基化由一系列低m/z 范围的特征糖离子m/z 138.05,m/z 204.09,m/z 366.14和m/z 528.12展示,并由y28离子确证。y28糖基化修饰前后1038.36的质量变化与一种聚糖分子质量相对应(-Man3NAcGlc[Fuc]NAcGlc)。高m/z 范围的糖基碎片离子可以给出所连接聚糖分子的进一步结构信息。基于BiopharmaLynx的质谱信号强度和前体物质的提取离子流色谱面积,B_T8*的相对浓度为 20%。
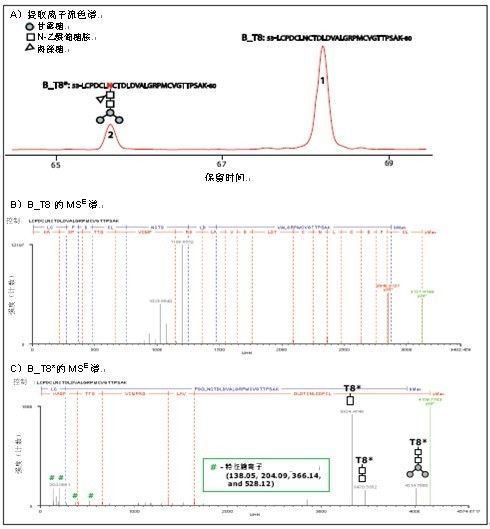
图1. HA蛋白B 中糖基化和未糖基化胰蛋白酶肽段 T8的分离和鉴定
A) 前体的提取离子色谱
B) B_T8(未指定离子m/z 1199.65 和m/z 1023.5为在疫苗制剂的过程中加入的Twin-20碎片)的MSE谱
C) B_T8*MSE 谱
与B_T8*不同,大多数已经鉴定的糖肽类是由多种糖形完全糖基化的,如HA蛋白H1肽段T24,未检测出未修饰的H1_T24,但H1_T24*的四种修饰糖形经层析法获得分离和鉴定(图 2A)。糖形的洗脱顺序与聚糖的大小有关。聚糖越重,这种聚糖形的糖基化肽洗脱越早。该肽含有两个N位点,但MSE 谱确定糖基化仅发生在含有-NSS-基序的N286,而含有-NVH-基序的N293则无糖基化修饰。这一现象与N-糖基化仅发生在含有-NXS/T-基序的N位点的定律一致。图2B中显示了H1_T24*-Man3NAcGlc2的MSE谱。同样的,低m/z范围的特征糖离子和高m/z范围的糖基碎片离子进一步确认了糖基化并提供了聚糖分子的结构信息。
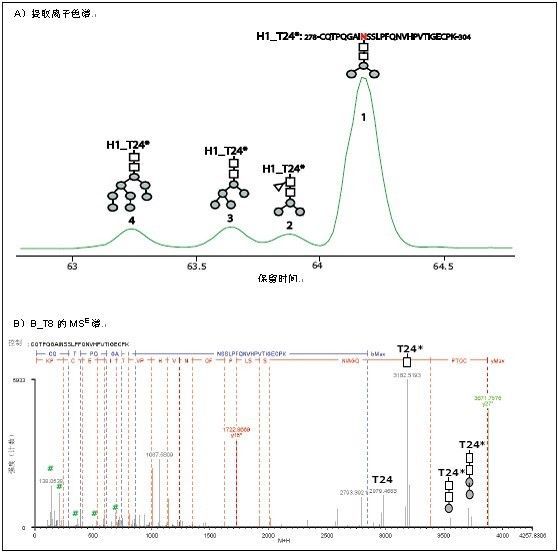
图2. HA蛋白H1中糖肽T24*的糖形的分离与鉴定
A) 前体的提取离子色谱
B) H1_T24*-Man3NAcGlc2 MSE 谱
# –特征糖离子
然而,并非所有已鉴定的糖形均可用层析法分离,如HA蛋白H3的胰蛋白酶肽T21中经鉴定的5种糖形(见图3A),但这些糖形在91.65 min 的同一个LC峰被洗脱。它们在提取离子色谱的保留时间仅有微小差异(~ 2秒)(数据未显示)。这些证据和上述的例子表明糖形的色谱行为与聚糖连接的肽序列的性质有关。H3_T21的肽段序列和糖基化可由MSE 谱确定。图3B中展示了一个H3_T21*-Man9NAcGlc2 MSE谱的例子。
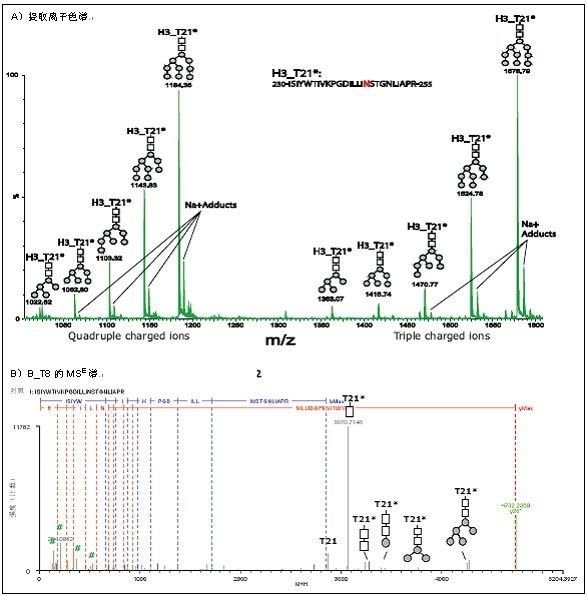
图3. HA蛋白H3中糖肽T21*糖形的分离和鉴定.
A) MS谱
B) H3_T21*-Man9NAcGlc2.的MSE谱
# – 特征糖离子
讨论
本文的数据表明UPLC/MSE 可分离并鉴定流感疫苗样品血凝素糖蛋白中多个糖肽及多种糖形。由于HA 蛋白有多个糖基化位点和多种糖形,传统的方法如聚糖分析和完整质量分析很难胜任流感疫苗样本糖基化的鉴定。
与传统的糖基化鉴定方法不同,本研究中糖基化位点已采用MSE技术清晰的进行鉴定。MSE中的糖碎片离子的聚糖分子提供了有用的结构信息。此外,这些方法无需任何额外的富集或纯化流程,获得的数据可由BiopharmaLynx自动进行处理。
进一步的优化可使得该方法不仅适用于复杂样品,如流感疫苗的糖基化的鉴定,也可作为一种鉴定糖蛋白的快速和常规方法。
参考文献
1. Stevens J, Corper AL, Basler CF, Taubenberger JK, Palese P, Wilson IA. Science. 2004; 303:1866-1870.
2. Yu YQ, Gilar M, Kaska J, Gebler JC. Rapid Commun. Mass Spectr. 2005; 19:2331-6.
3. Ahn J, Yu YQ, Gilar M. Rapid sample cleanup method development for 2-AB labeled N-linked glycans released from glycoproteins. Waters Application Note. 2008; 720002622en.
4. Gillece-Castro B, van Tran K, Turner JE, Wheat TE, Diehl DM. N-linked glycans of glycoproteins: a new column for completed resolution. Waters Application Note. 2009; 720003112en.
5. Oliviva P, Chen W, Chakraborty AB, Gebler JC. Rapid Commun. Mass Spectr. 2008; 22:29-40.
6. Chakraborty AB, Berger SJ, Gebler JC. Characterization of an IgG1 monoclonal antibody and related sub-structures by LC/ESI-TOF-MS. Waters Application Note. 2008; 720002107en.
7. Chakraborty AB, Chen W, Gebler JC. Characterization of reduced monoclonal antibody by online UPLC-UV/ESI-TOF MS. Waters Application Note. 2009; 720002919en.
8. Orlando R. Rapid Commun. Mass Spectr. 2007; 21:674-682. 9. Gillece-
9. Castro BL, Wheat TE, Mazzeo JR, Diehl D M. UPLC technology for the analysis of antibody glucopeptides. Waters Application Note. 2008; 720002382en.
10. Xie HW, Gilar M, Gebler JC. Analysis of deamidation and oxidation in monoclonal antibody using peptide mapping with UPLC/MSE. Waters Application Note. 2009; 720002897en.
11. Xie HW, Gilar M, Gebler JC. Anal. Chem. 2009; 81:5699-5708.
12. Ahn J, Gillece-Castro BL, Berger S. BiopharmLynx: A new bioinformatics tool for autumated LC/MS peptide mapping assignment. Waters Application Note. 2008; 720002754en.
13. Tomiya NT, Narang S, Lee YC, Betenhaugh MJ. Glycoconjugate J. 2004; 21:343-360.
应用方案 | 水源水和饮用水中107种典型农药及其代谢产物的检测
Waters AI Advisor:分析仪器行业的ChatGPT来了!
Arc GPC体验:借助SEC技术分析可降解材料PLGA
靶向DESI成像文献分享 | 谷胱甘肽治疗急性肝性脑病的可行性
相关产品
沃特世Xevo G3 QTof四极杆飞行时间质谱
沃特世Xevo TQ Absolute串联四极杆质谱仪
搭载ACQUITY Premier的BioAccord LC-MS系统
SELECT SERIES MRT
Arc Premier系统
ACQUITY Premier系统
沃特世Andrew+ Pipetting Robot自动移液机器人
DESI XS
ACQUITY APC超高效聚合物色谱系统
ACQUITY RDa质谱检测器
RADIAN ASAP直接质谱检测器
Arc HPLC系统
Prep SFC 150 AP系统
Waters Xevo TQ-S cronos三重四极杆质谱仪
SYNAPT XS高分辨率质谱仪

关注

拨打电话

留言咨询