受限于衍射极限光学显微镜分辨率有限,无法识别细胞内的细胞器和蛋白质。超分辨率显微镜可以超越衍射极限识别亚细胞结构,分辨率高达十几纳米。而原子力显微镜作为一种扫描探针技术更是可以实现亚纳米级别成像。但是无论是超分辨率显微镜还是原子力显微镜都需要样品固定。而固定后的细胞是否还能保持原来的性质就成了一个问题。来自澳大利亚La Trobe大学的Donna R. Whelan和Monash大学的Toby D. M. Bell利用活细胞超分辨光学波动成像(Super-Resolution Optical Fluctuation Imaging,SOFI)和单分子定位超分辨率成像-原子力显微镜Single Molecule Localization Microscopy,SMLM and Atomic Force Microscopy,AFM)系统实现对活细胞及固定细胞进行成像,实现对细胞结构的最小干扰。(ACS Bio Med Chem Au. 2023 Jun 21; 3(3): 261–269. doi: 10.1021/acsbiomedchemau.2c00086)SMLM和SOFI技术同样需要可逆转换荧光蛋白(Reversibly switching fluorescent proteins,RSFPs),二者可以在同一套光学显微镜上进行,再结合原子力显微镜就可以在同一样品上得到多维度的结构信息。对不同种类的物质进行不同的荧光蛋白染色可以实现多色SMLM,这样就可以从荧光颜色区别不同的物质种类。而由于适合SOFI的荧光蛋白发射波长都非常接近,无法使用简单的方法实现多色SOFI。但是利用荧光蛋白闪烁动力学的不同,同样可以实现多色SOFI,区别不同物质种类。在这篇文章中,作者就结合活细胞光学波动成像(SOFI),单分子定位超分辨成像(SMLM)和原子力显微镜(AFM)三种成像方法研究细胞微管网络在去除细胞膜后的变化。
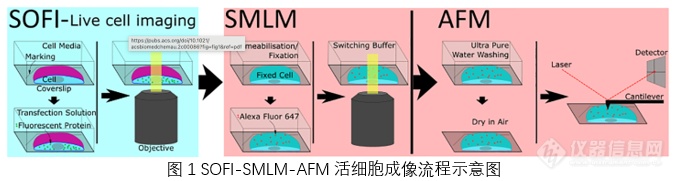
活细胞成像需要三种显微成像技术依次进行。首先将种子细胞用DNA质粒进行转染,在活细胞内表达荧光蛋白。一旦表达出足够多的荧光蛋白,就可以对盖玻片进行SOFI成像。之后再将细胞固定,去除细胞膜确保细胞结构不会发生重大重排。可以用抗体对细胞进行标记并再次进行SMLM成像,确定渗透和固定对细胞内部结构的影响。最后用超纯水进行大面积清洗,烘干后进行AFM成像。
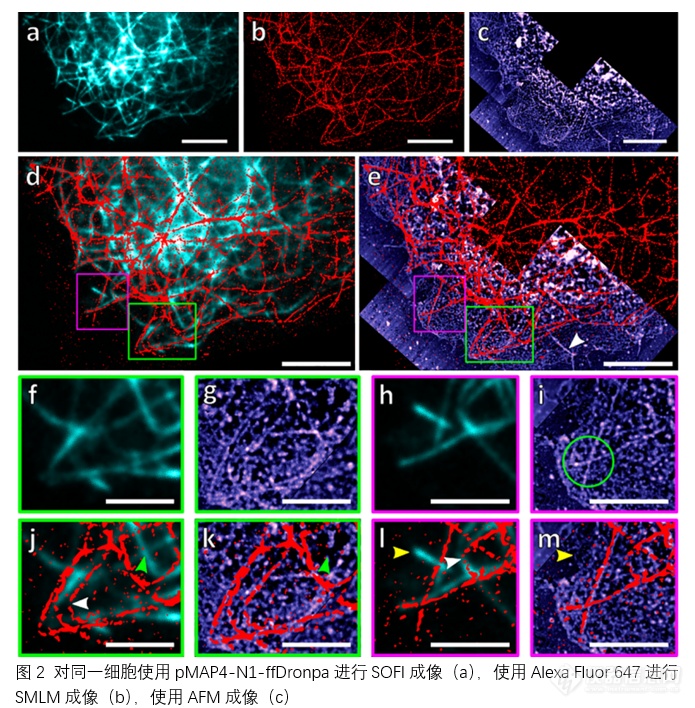
图 2b中的SMLM图像略显不连续,从j和l中的白色箭头可以更清楚地看出这一点。这可能是由于用于SOFI的RSFPs仍存在于微管上,导致抗体染色无法完全覆盖微管,并可能影响原子力显微镜测量得到的高度数据。从图 2b和d中可以看出,SMLM成像几乎完全覆盖了微管网络,这表明两种染色方法都可以在同一目标上进行。j和l的放大图像可以看到微管网络在活细胞和固定细胞中的总体形状基本一致。在j中可以看到微管大范围弯曲,在l中可以看到两条微管交叉,这表明在移除细胞膜后,微管网络结构得以保存。从完成活细胞成像到完成细胞固定大约需要20分钟,足以让微管网络发生一定移动和聚合解体,但是还不足以发生完全的重排。在活细胞成像中和固定后都能观察到这些纤维,但也有一些微小的差异,可能是细胞的微管动力学造成的。例如j中用绿色箭头突出显示的微管出现在SOFI中,但在SMLM中却没有。这可能是由于微管在固定前的短时间内发生了轻微移动,在自然生物过程或固定过程的影响下重新排列成SMLM中显示的构象。同样l和m中的黄色箭头显示了另一条微管,它在SOFI图像中存在,但在SMLM和AFM中都不存在。这可能是在活细胞成像和固定之间的时间内发生了解聚,也可能是SMLM成像深度窗口(0.5-1 微米)外的微管,但仍可在SOFI成像的 2-3 微米深度窗口中观察到。在原子力显微镜图像中还能看到一些丝状结构,但SMLM或SOFI都无法观察到,如e中白色箭头所示。这种结构和其他类似结构可能是细胞内存在但未被荧光标记的肌动蛋白或其他中间丝。
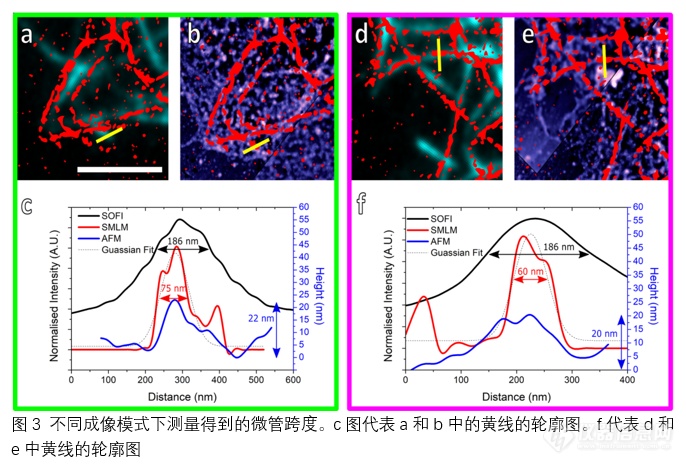
通过这些图像还可以确定微管宽度,从而对成像技术和已知25 nm直径的微管进行比较。图 3 显示了两个此类微管的分析结果,以确定它们在三种成像模式下的宽度。由于SOFI的活细胞成像与SMLM和AFM的固定成像在微管位置上偶尔会有细微差别,因此a和d上显示的黄色轮廓线仅用于SOFI分析,SMLM和AFM宽度则使用b和e上的黄色轮廓线进行分析。对于SOFI和SMLM,宽度是通过Line Profiler35 计算得出的,方法是对荧光强度横截面进行高斯拟合,然后求出2倍的标准偏差。对于原子力显微镜,则通过截面轮廓线相对于周围环境的高度来确定直径。
在a-c中测量的第一条微管显示,SOFI测量值为186纳米,而SMLM测量值为75纳米,AFM 测量值为22纳米。这一测量结果与d-f中显示的第二个微管测量结果一致,SOFI测量宽度为186纳米,SMLM测量宽度为60纳米,AFM测量宽度为20纳米。原子力显微镜测量发现的平均高度为26纳米,标准偏差为13纳米(N = 39,来自3个细胞),比预期的要小。由于这些数值是通过比较微管与周围环境的最大高度得出的,因此嵌入细胞残骸中的微管测量值可能小于其真实直径。从SOFI图像中获得的平均宽度为249 ± 68 nm(N = 89,来自5个细胞),远大于SMLM和真实值。这可能是由于二阶SOFI分辨率较低,再加上微管中添加了MAP4蛋白和RSFP,从而增加了观察到的微管直径。高分辨率SMLM 测得的微管宽度更接近预期值 71 ± 33 nm(3 个细胞中的118个),但仍然略大于预期值。这可能是由于每个PSF高斯拟合的定位精度以及一抗、二抗和染色剂分子的加入。
使用布鲁克BioAFM系列原子力显微镜可以非常容易的搭载在现成的超分辨率显微镜上。结合STED,SOFI,SMLM,SIM等超分辨率显微镜和AFM不仅可以得到样品的超高分辨率结构信息,还可以利用AFM的特性测量样品力学性质、进行纳米操纵等等。

应用X 射线衍射成像 (XRDI) 对深槽隔离结构中的材料应变进行表征
自动化、无需模拟的微焦斑X射线荧光技术(μHXRF) 测量GAA晶体管的横向空腔
ACS Nano:Aβ42寡聚体与海马体神经元细胞作用机制
Science: 利用水诱导强各向同性MXene桥接电化学储能用石墨烯片

相关产品
双焦面实时超高分辨系统Bruker3DVutura
多功能双光子成像平台Bruker2pplus
高品质双光子成像系统BrukerInvestigator
场扫描共聚焦成像系统BrukerOpterra II
布鲁克透射电镜专用原位纳米力学系统PI 95
布鲁克电镜专用原位纳米力学测试系统PI 88
布鲁克电镜专用原位纳米力学系统 PI 85L
布鲁克高精度纳米力学测试系统TI Premier
布鲁克高精度纳米力学测试系统TI 980
布鲁克三维光学显微镜Contour Elite
摩擦磨损试验机UMT-TriboLab
布鲁克原子力显微镜Dimension FastScan
探针式表面轮廓仪DektakXT
光学轮廓仪NPFLEX 3D
扫描探针显微镜系统Dimension Edge

关注

拨打电话

留言咨询