疟疾是一种威胁生命的疾病,通过被原生动物寄生虫感染的蚊子叮咬传播。最常见和最危险的疟疾类型是恶性疟原虫(plasmodium falciparum)引起的疟疾。疟疾引起了严重关切,因为世界上有一半的人口处于这种危险之中,而且迄今为止还没有有效疫苗。2016年,世界卫生组织报告了2.16亿例[1],其中50万人死亡,由疟疾造成的经济负担超过了数十亿美元。

图1. 疟原虫对红细胞的侵袭示意图
在细胞水平,恶性疟原虫对红细胞的感染引发了该疾病的临床症状。该阶段涉及高度动态的蛋白质间的相互作用,由于它们的复杂性,目前仍然知之甚少。澳大利亚墨尔本大学cowman等利用sp8 sted纳米显微镜和特定蛋白的条件表达,确定了在入侵阶段的关键蛋白复合物。形成复合物的蛋白质能够使宿主-病原体相连接,并且复合物的存在是宿主-病原体紧密连接和红细胞ca2+释放所必需的(图1)。这一突破发表在cell host&microbe杂志上[2]。
疟疾感染的主要参与者
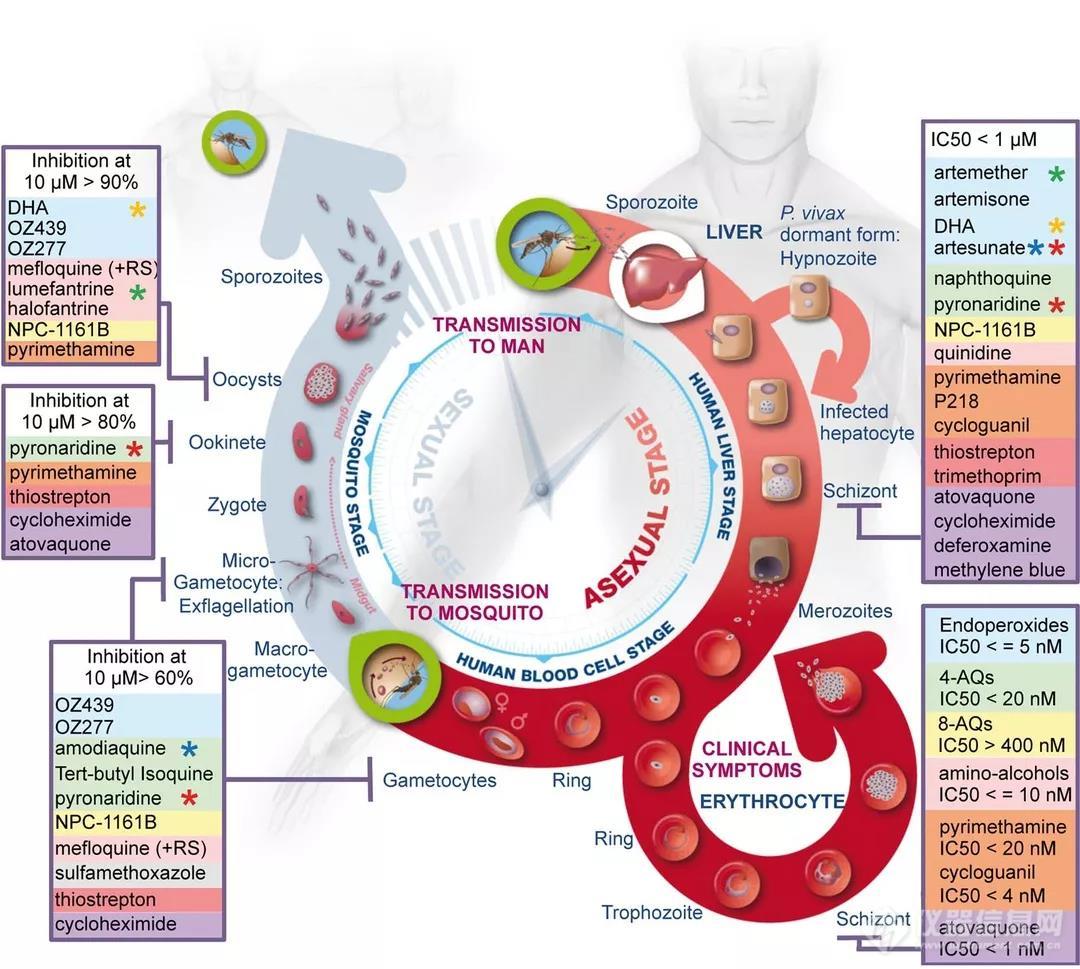
图2:疟原虫生命周期的三个主要阶段:肝脏阶段,血液阶段和载体阶段。绿色圆圈显示寄生虫从载体到宿主、从宿主到载体的关键入口点。图片来源[3]。
进入人类宿主后,随着疟疾的发展,疟原寄生虫在其生命周期中以不同的形式存在(图2)。在所谓的血液阶段[4],以裂殖子形式存在于红细胞,通过不同阶段进化,感染的宿主细胞中会产生约30个子代裂殖子,并准备入侵其他细胞。裂殖子入侵是寄生虫在血流中传播和疾病发作的关键。尽管如此,该疾病的分子机制尚不清楚。
为了侵入红细胞,裂殖子必须首先与宿主细胞接触,即所谓的“入侵前”阶段[5],使红细胞膜变形,裂殖子配体与膜中的特定受体结合,形成紧密连接,并触发ca2+流。ca2+的流动似乎对细胞侵袭很重要。寄生虫与细胞的附着变得不可逆转,并在不到2分钟内进入红细胞。
恶性疟原虫红细胞结合蛋白同源物(pfrh)和红细胞结合类蛋白是参与入侵的重要信号[6]。pfrh家族的关键成员是pfrh5,其与宿主蛋白受体basigin结合可以诱导ca2+释放到红细胞中,并标志着裂殖子和血细胞膜的桥连通道的形成。pfrh5对于裂殖子侵入至关重要,正如抗体或可溶性basigin抑制红细胞感染的研究所示[7]。pfrh5与pfrh5相互作用蛋白(pfripr)和富含半胱氨酸的保护性抗原(cyrpa)一起发挥作用,但这种相互作用的功能尚不清楚。了解pfrh5/pfripr/cyrpa的作用非常重要,因为这些蛋白质是开发抑制血液中疟疾发展的疫苗的重要候选者[8]。
用正确的工具寻找疟疾感染的答案
cowman等开展了转基因恶性疟原虫系的研究工作,分别敲除pfripr和cyrpa的基因,riprloxcre和cyrpaloxcre[2]。在含有riprloxcre和cyrpaloxcre基因的寄生虫加入重组酶(雷帕霉素诱导的dicre)以快速且非常有效地调节基因缺失,从而相应地控制两种蛋白质水平。作者还进行了活细胞成像,并确认pfripr和cyrpa在与宿主细胞初次接触后对红细胞侵袭至关重要。在没有pfripr或cyrpa的情况下,宿主细胞膜仍然变形,但缺乏ca2+流动,因此寄生虫不能进入血细胞(视频1)。
sp8 sted纳米显微镜发现未知
接下来,cowman等研究了入侵期间的pfrh5、pfripr和cyrpa的定位[2]。共聚焦成像显示三种蛋白质在寄生虫顶端优先定位,该区域优先与宿主细胞接触。然而,对于生物分子的空间分布的精确评估只可能发生于低于显微成像3/4衍射极限的分辨率水平上,2d通常低于30nm、3d sted(受激发射损耗)通常低于100nm。为此,将红细胞与裂殖子一起孵育以诱导入侵并用抗体探针对靶蛋白进行标记。样品被放置于leica tcs sp8 sted纳米显微镜上进行2d和3d超高分辨成像(775nm,视频2)。为了进一步确定入侵的初始阶段,研究人员还对ron4进行了免疫荧光标记,ron4是定位于寄生虫顶端的蛋白质(图3)。
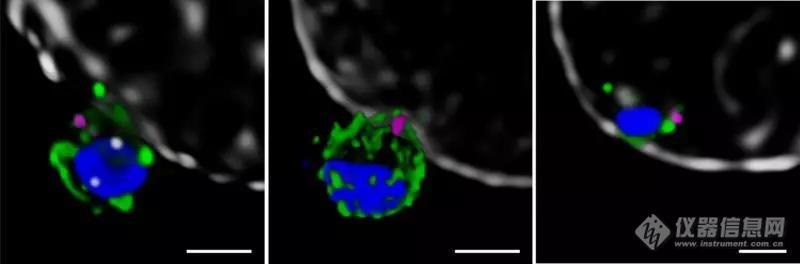
图3:侵入红细胞的裂殖子的sted纳米检测。3d sted图像显示ron4(品红色)与蛋白质pfrh5(上图左,绿色)、pfripr(中,绿色)、pfcyrpa(右,绿色)的叠加。dapi核染色显示为蓝色,红细胞膜显示为灰色。比例尺为1μm。图片由walter和eliza hall医学研究alan cowman教授。
用sp8 sted获得的空间信息显示pfrh5、pfripr和cyrpa在寄生虫顶端进行共定位,其中也发现了ron4的存在(视频2)。单个蛋白质和pfrh5/pfripr和cyrpa/pfripr二聚体复合物在裂殖子膜上表现出拼接分布,与顶端末端的释放一致。使用2d sted进行更近、更高分辨率的成像证实pfripr和cyrpa在裂殖子上扩散,但特别局限于顶端。对pfrh5/pfripr和cyrpa/pfripr的共定位程度的评估显示,pfrh5/pfripr的比例更大。该发现表明cyrpa/pfripr扩散到裂殖子表面上,随后pfrh5/cyrpa/pfripr复合物直接在表面顶端聚集以结合basigin,然后触发紧密连接的形成,并进入入侵感染的下一步。单个pfrh5、pfripr和cyrpa的出现也表明,每种蛋白质仍可用于合成复合物。
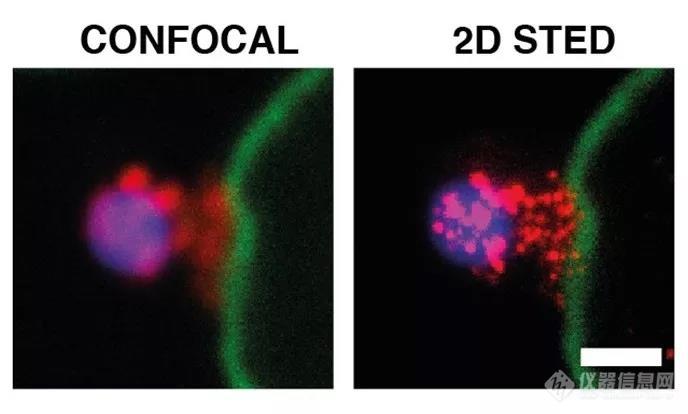
图3:pfripr在侵入红细胞的裂殖子上的定位。用wga(绿色)染色的红细胞膜。左为共聚焦图像,使用2d sted(mip)可视化pfripr。dapi(蓝色)。白条表示1μm。
展望

对红细胞的侵入是人类宿主中疟疾感染的关键阶段。直到最近,对所涉及的蛋白质的相互作用和功能的研究是有限的,因为关键配体pfrh5的抑制完全抑制感染的的入侵。使用pfripr和cyrpa的条件表达和sted纳米显微成像,cowman等揭示了pfripr、cyrpa和pfrh5/pfripr/cyrpa复合物在裂殖子入侵中的重要作用[2]。通过复合物与宿主受体basigin的结合,蛋白质参与ca2+释放到红细胞中。sp8 sted纳米显微镜提供了必要的分辨率,以显示pfrh5/pfripr/cyrpa复合物在寄生虫和宿主细胞之间界面处的形成。以前的研究表明,cyrpa将复合物与寄生虫膜相连[8],但cowman组进行了额外的生化分析,结果显示情况并非如此。相反,结果表明其他蛋白质必须将复合物锚定到宿主细胞并指导它在顶端的形成。
未来的工作将有助于找到参与裂殖子/宿主细胞相互作用的新蛋白质,并了解ca2+释放在感染途径中的功能作用。最终,解剖宿主和病原体之间的相互作用将有助于找到更有效的方法来对抗疟疾。
参考文献
doi: 10.1016/j.chom.2014.11.017
关于徕卡显微系统leica microsystems
徕卡显微系统是全球显微科技与分析科学仪器之领导厂商,总部位于德国维兹拉(wetzlar, germany)。主要提供显微结构与纳米结构分析领域的研究级显微镜等专业科学仪器。自公司十九世纪成立以来,徕卡以其对光学成像的追求和不断进取的创新精神始终得到业界广泛认可。徕卡在复合显微镜、体视显微镜、数码显微系统、激光共聚焦扫描显微系统、电子显微镜样品制备和医疗手术显微技术等多个显微光学领域处于全球先导地位。
徕卡显微系统在全球有七大产品研发与生产基地,在二十多个国家拥有服务支持中心。徕卡在全球一百多个国家设有区域分公司或销售分支机构,并建有遍及全球的完善经销商服务网络体系。
显微课程 | 激光显微切割的耗材
阿尔茨海默症(AD)机制研究中的组织及细胞光学成像(上篇)
显微课堂 | 工业显微镜在面板检测行业的应用案例分享
国庆节 | 礼赞盛世中华,谱写锦绣未“徕”

相关产品
德国徕卡 体视显微镜-数码显微镜 DVM6
德国徕卡 倒置荧光金相显微镜 Leica DMi8 M
MICA 全场景显微成像分析平台
ARveo 8数字化手术显微镜
德国徕卡 MICA宽焦全场景显微成像分析平台
德国徕卡 MICA宽场活细胞全场景显微成像分析平台
德国徕卡手术显微镜系统 Leica M525 F20
德国徕卡眼科手术显微镜徕卡M620 F20
德国徕卡桌面眼科手术显微镜 Leica M620 TTS
德国徕卡红光反射手术显微镜 M822
德国徕卡眼科手术显微镜M844 F40 / F20
德国徕卡眼科手术显微镜 Proveo 8
德国徕卡眼科手术显微镜 Leica ToricEyePiece
德国徕卡视网膜正像观察镜 Leica RUV800
德国徕卡摆臂式旋转分光器Leica Rotatable Beamsplitt

关注

拨打电话

留言咨询