
通过利用个体多巴胺能(DA)神经元空间转录组学解决帕金森病之谜
在阿尔茨海默病之后,帕金森病是第二常见的进行性神经退行性疾病。在首发症状出现之前,中脑中高达70%的多巴胺释放神经元已经死亡。本文描述了如何使用现代激光显微切割(LMD)方法帮助解决帕金森病之谜。研究涉及在空间背景下分离和分析神经元。这些细胞来自帕金森病患者的死后黑质组织样本,以便深入了解该病的分子机制。
帕金森病是什么?
帕金森症(PD)是一种神经退行性疾病,会降低受影响个体的生活质量。著名运动员穆罕默德·阿里和演员迈克尔·J·福克斯就是患有或曾经患有帕金森症的著名例子。该病的成因多种多样,例如遗传(迈克尔·J·福克斯的情况)或物理影响(穆罕默德·阿里的情况)。到目前为止,治疗该病主要侧重于症状的缓解,主要通过服用 L-DOPA(多巴胺前体)药物来实现。
该病的根本原因是中脑或黑质(SN,黑色物质)中一群多巴胺能(DA)神经元的选择性死亡[1,2]。在超过60%的多巴胺能神经元损失后,才可见到第一个表型。因此,基于年龄和性别匹配的对照,对死后帕金森病患者的中脑组织进行比较,就像是拿苹果和香蕉进行比较。因此,必须逐一分析黑质致密部中幸存的多巴胺能神经元,以发现这些特定多巴胺产生细胞之间的差异。
关于该病的起源有多种理论。因此,帕金森病可以比作一个拼图。已经找到了许多碎片,并且已经组合了一些碎片,但仍然没有人知道整个画面是什么样子。一些碎片的重要性尚未确定,也没有人知道在能够清楚地了解帕金森病之前,还需要找到多少碎片才能呈现完整的画面。
空间背景下的
多巴胺能神经元分离与帕金森病研究

使用的典型工作流程和实验程序
由于帕金森病通常在较晚的年龄出现,因此用于研究帕金森病的动物模型相当罕见,因此,啮齿类(小鼠和大鼠)模型没有与人类相似的明确表型。在猴子中进行的研究,其中帕金森病可以通过药物引入,即使在较年轻的动物中,也是昂贵的,并且需要许多研究人员无法获得的特殊条件。除了这些挑战之外,单个神经元的活性通常通过电生理学来研究。这种方法需要活脑组织切片,而这是无法从人身上获取的。因此,需要一种不同的方法来选择性分析多巴胺能(DA)神经元。出于这个原因,激光显微切割(LMD)方法发挥了作用[3]。

图1:用于帕金森病研究的实验流程图:从人类死后帕金森病大脑和对照组个体的黑质(SN)DA神经元中,通过紫外线激光显微切割(UV-LMD)和定量RT-PCR(实时聚合酶链式反应)基因表达分析进行单个神经元分析的协议。

数据和结果的分析与理解
通过将使用针进行修补以提取内容进行下游分析的单个神经元的分子生物学结果,与激光显微切割(LMD)解剖的神经元的结果进行比较,可以证明这两种收集方法的结果是可比的。此外,LMD允许研究人员从死后人类中脑收集单个神经元,更具体地说,是从黑质(SN)中收集,因为DA神经元由于含有神经黑色素而呈黑色,因此很容易识别。使用LMD,可以分析来自死后帕金森病患者的单个存活DA神经元和匹配对照组的表达模式,目的是找到两组在分子水平上的差异。这种调查有助于理解帕金森病的病因或后果。

研究黑质中多巴胺能神经元时面临的挑战
分析不同的死后标本就像是在帕金森病特定阶段的“快照”。这些“快照”可以相互比较,但这些标本不能用于检测改变的基因表达是疾病的结果还是原因。需要进一步研究这个问题。此外,考虑到帕金森病患者的基因表达仅在释放多巴胺的神经元中发生改变,那么对于帕金森病谜题的研究,只应分析这些相关的细胞类型。如果不小心将其他细胞类型添加到分析物中,它们会降低结果的质量。

激光显微切割
激光显微切割(LMD),也称为激光捕获显微切割(LCM),是一种用于从各种组织标本中在空间背景下隔离特定单个细胞或整个组织区域的无接触、无污染的方法。原始组织的厚度、质地和制备相对不重要。
然后,可以使用进一步的分子生物学方法对切割下来的组织进行分析,如下一代测序(NGS),包括RNA测序、定量聚合酶链式反应(qPCR)、实时qPCR、蛋白质组学、代谢组学、脂质组学和多组学技术。LMD现在被广泛应用于许多研究领域,例如病理学、神经学、癌症、植物分析、法医学和气候学。此外,LMD还用于细胞培养的操作或盖玻片的微雕刻。
LMD对于基因组学(DNA)、转录组学(RNA)和蛋白质组学(蛋白质)工作流程的优化非常有用,因为它允许在视觉控制下从组织中精确提取和收集纯净的起始材料以供分析。
使用LMD的结果
与完整的组织检查结果相比,对单个细胞的分析经常显示出不同的结果[3-6]。研究表明,帕金森病患者的组织中某些microRNA的表达发生了变化。
当同时检查微切割的细胞时,发现microRNA的表达在细胞水平上并没有变化。这种组织伪影是借助激光显微切割检测到的。
使用LMD系统可以实现单个细胞的无接触切割,或者在必要时,实现更大面积组织的切割。切割下来的材料被捕获在试管帽中,可以立即进行处理。请参考下面的图2、图3和图4。
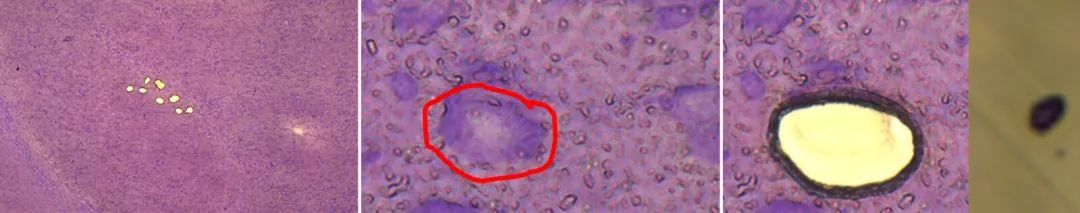
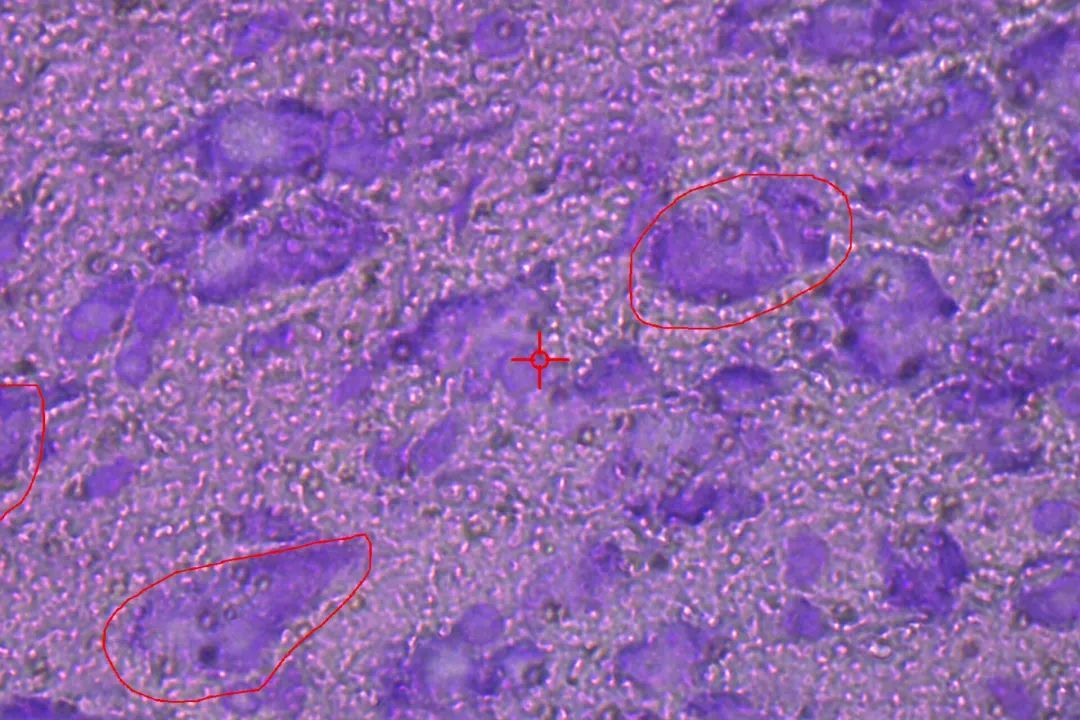
图2:左图:经过对10个单个DA神经元进行紫外线激光显微切割(UV-LMD)后的鼠脑中脑冠状切面,用甲酚紫染色。中图:从上图中选择一个神经元进行LMD。右图:在单个神经元切片(左)和盖帽对照(右)上进行UV-LMD后,显示了成功的隔离。
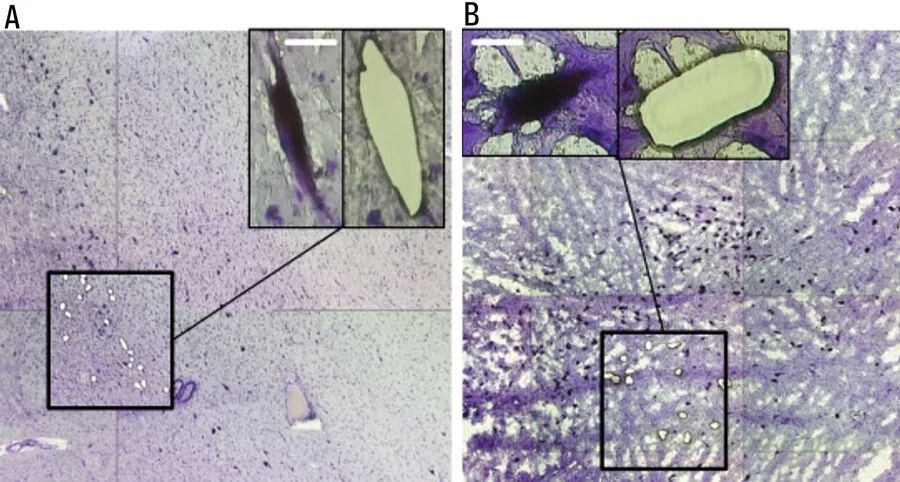
图3:通过LMD和mRNA表达分析从人类PD(帕金森病)和对照死后大脑中分离出的单个黑质DA神经元。通过LMD从PD(A)和对照组大脑(B)的甲酚紫染色水平中脑冷冻切片中分离出神经黑色素阳性[NM(+)]神经元群。
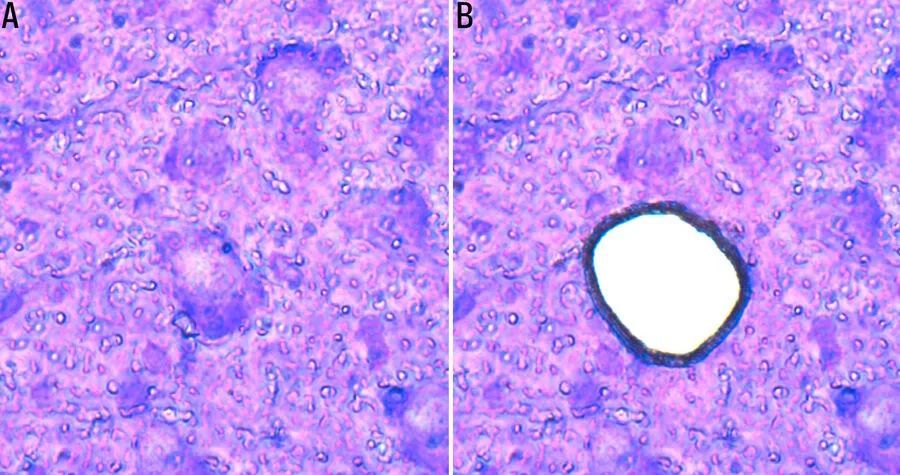
图4:LMD前后的甲酚紫染色小鼠大脑冷冻切片(A)和(B)[7]。
帕金森病研究的未来挑战
目前,没有用于早期诊断帕金森病的测试,而且该疾病存在许多变异。此外,还有一些具有类似症状的疾病。因此,一定比例的帕金森病病例被误诊或根本没有被诊断出来。
成功治疗帕金森病的前提是有效的早期诊断。如果能够在神经元刚刚开始退化的初期阶段诊断出疾病,就有可能防止神经元进行性退化并完全阻止疾病的发展。
在血液或脑脊液中识别生物标志物是目前研究的主要焦点。有些基因不仅在大脑中表达,而且在所有细胞中普遍表达。如果帕金森病病例中多巴胺能神经元的这些基因表达发生变化,就可以更容易地检查可接近的组织以用于诊断目的。
也许在不久的将来,激光显微切割(LMD)与人工智能(AI)甚至质谱技术的结合,可以为更好地理解帕金森病带来进一步的突破。
参考文献:(上下滑动查看更多)
相关产品

Leica LMD6 & LMD7激光显微切割系统






关于徕卡显微系统

显微课堂 | 半导体芯片应用案例
显微图库 | 徕卡拍摄的多色图像
案例分享 | 液晶屏玻璃基板上线路结构的观察
【白皮书下载】使用手术显微镜进行显微外科手术指南
相关产品
德国徕卡 体视显微镜-数码显微镜 DVM6
德国徕卡 倒置荧光金相显微镜 Leica DMi8 M
MICA 全场景显微成像分析平台
ARveo 8数字化手术显微镜
德国徕卡 MICA宽焦全场景显微成像分析平台
德国徕卡 MICA宽场活细胞全场景显微成像分析平台
德国徕卡手术显微镜系统 Leica M525 F20
德国徕卡眼科手术显微镜徕卡M620 F20
德国徕卡桌面眼科手术显微镜 Leica M620 TTS
德国徕卡红光反射手术显微镜 M822
德国徕卡眼科手术显微镜M844 F40 / F20
德国徕卡眼科手术显微镜 Proveo 8
德国徕卡眼科手术显微镜 Leica ToricEyePiece
德国徕卡视网膜正像观察镜 Leica RUV800
德国徕卡摆臂式旋转分光器Leica Rotatable Beamsplitt

关注
拨打电话

留言咨询