研究背景:利用FIDA确定ReS19-T与阿尔兹海默症治疗新靶点作用机制
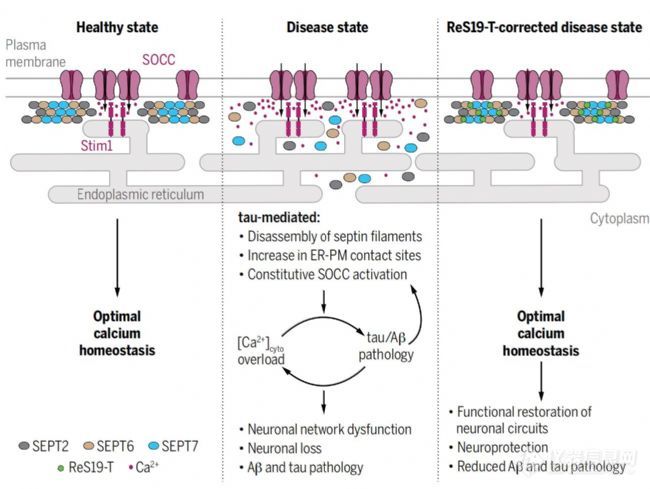
异常钙信号是阿尔茨海默病(AD)的核心病理组成部分。本研究筛选出了ReS19-T的化合物,它能够在基于细胞的tau病理模型中恢复钙稳态。异常的tau积累导致通过重塑细胞皮质的septin丝体不受控制地激活储存操作钙通道(SOCCs)。ReS19-T与septin结合,可以在疾病状态下恢复丝体的组装,并抑制SOCCs的钙离子进入。在由淀粉样β和tau驱动的小鼠疾病模型中,ReS19-T药物恢复突触可塑性,使脑网络活动正常化,并减轻淀粉样蛋白β和tau病理的发展。研究结果确定了septin细胞骨架是开发疾病修饰性AD治疗的潜在治疗靶点。
FIDA技术的关键作用
这项研究中,层流诱导分散分析(FIDA)技术发挥了至关重要的作用。文章中,由于septin蛋白容易聚集,导致常规互作技术无法得到有效数据,FIDA技术采用无需标记和无需固定的方式,完全的In-solution Labelfree,解决了蛋白因为固定或标记导致的分子结构与功能的异常的问题,而且FIDA通过同步的粒径(Rh)与构象(BRIC)分析对亲和力进行了两维表征。利用FIDA,研究人员精确测量了ReS19-T化合物与无标记的septin 6丝状蛋白的高亲和力结合,揭示了通过ReS19-T与septin 6的结合来恢复septin丝状结构的完整性,进而防止了病理状态下SOCCs的异常激活,这对于理解ReS19-T的药理作用机制至关重要。
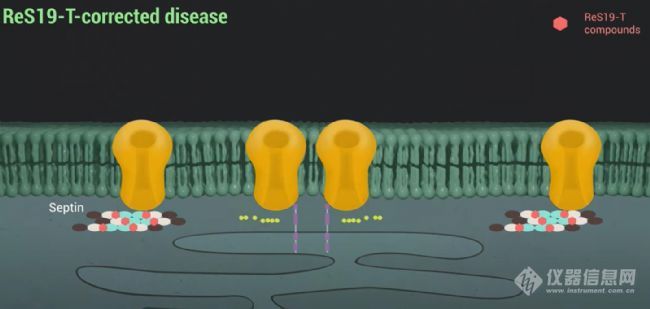
研究思路
通过筛选内部化合物库识别出具有保护作用的化合物ReS19-T,并进行三杂交确定SEPT6为待选高亲和力靶点
通过开发细胞基础筛选测定,模拟tau和钙引起的神经毒性,筛选内部化合物库,发现了具有保护作用的化合物ReS19-T及其衍生物。研究表明,REM127是最有效的化合物,能够降低细胞内钙浓度并对抗tau和淀粉样蛋白引起的神经毒性。此外,SEPT6被确定为ReS19-T的主要靶点,与ReS19-T有较强的结合能力,可能与tau及细胞骨架的关系密切。
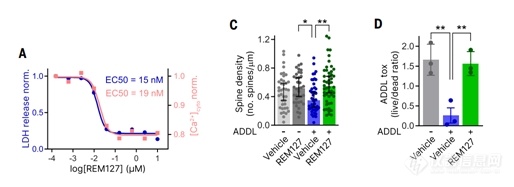
图1通过多轮筛选确定REM127(ReS19-T),是该系列中最有效的化合物,降低毒性和[Ca2+]细胞,中位有效浓度(ec50)分别为15和19 nM(图1A),但对tau表达或atra依赖的基因转录没有影响(C和D)
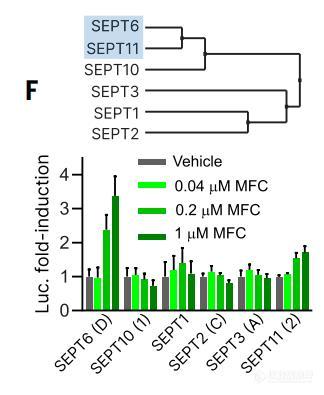
图2,胞内相互作用,不同septin亚型的MFC (REM929 - linked to甲氨蝶呤)(N = 3,误差条表示SD)。插图显示了在三杂交实验中探测到的septin同种异构体的系统发育分析
利用FIDA labelfree确定REM127(ReS19-T)与纯化的septin同种型的结合亲和力
文章中检测了小分子REM127(ReS19-T)与纯化的septin同种型的结合,使用层流诱导分散分析(FIDA),无标记和无固定化的通过测量水动力学半径大小(Rh)和构象(BRIC)的变化来量化生物分子相互作用。在这些实验中,septin同种型在高盐条件下维持,以防止聚集。REM127诱导了SEPT6的水动力半径(Rh)的浓度依赖性增加,当将其拟合到结合曲线时,计算出表观解离常数(Kd_app)为1.5 nM。基于构象的结合相关荧光强度变化(BRIC)测量Kd_app也得到了相近的值1.6 nM(图3A,D)。
对于SEPT7和SEPT2未检测到化合物诱导的水动力半径变化。这些体外结合研究表明REM127直接与SEPT6高亲和力结合,并可能影响靶点构象。研究还提供了REM127与SEPT7和SEPT2之间较弱结合的证据。
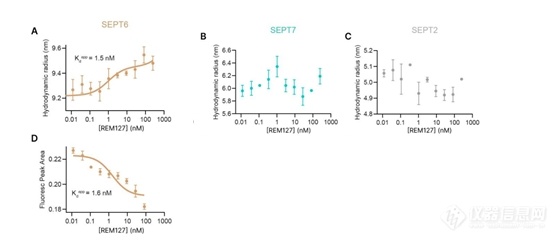
图3 REM127与SEPT6的亲和力曲线,(A)水动力学半径(Rh)拟合的亲和力曲线(D)BRIC拟合的亲和力曲线(B)(C)分别为REM127与SEPT7和SEPT2之间亲和力曲线
在验证REM127与SEPT6具有高亲和力后进一步探讨其在调节SOCE和钙稳态中的作用
SEPT6的沉默会降低REM127对毒性和细胞内钙浓度的抑制作用,表明SEPT6在药效中的重要性。tauP301L显著增加细胞内钙浓度和SOCE的振幅,而REM127能够恢复这些指标至正常水平。SOCE在tauP301L状态下被激活,导致细胞内钙过载,并可通过靶向SEPT6或抑制SOC通道来缓解毒性。所以REM127通过抑制tau诱导的SOCE及其对SEPT6的高亲和力结合,恢复钙稳态,从而有望作为治疗阿尔茨海默病的候选药物。
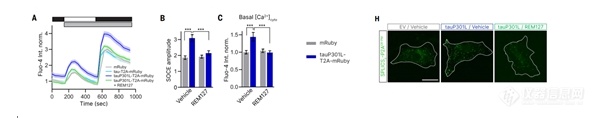
图4,tauP301L显著增加细胞内钙浓度和SOCE的振幅REM127能够恢复这些指标
ReS19-T调节septin可恢复患者源性iPSC神经元和AD小鼠模型的网络功能并减轻AD病理发展
在表达人tauP301S(一种引起FTD的突变)或携带AD家族突变V717I (APP- ln)的APP London突变的转基因小鼠中,研究了REM127对突触可塑性的影响。两种神经退行性变模型均显示海马CA1区长期增强(LTP)的严重缺陷(图C和D),这是一种与学习和记忆相关的突触效能的活性和钙依赖性增加形式。口服REM127可恢复tauP301S和APP-Ln小鼠的LTP(图C和D)。用该化合物治疗7天足以恢复APP-Ln小鼠的LTP(图D)
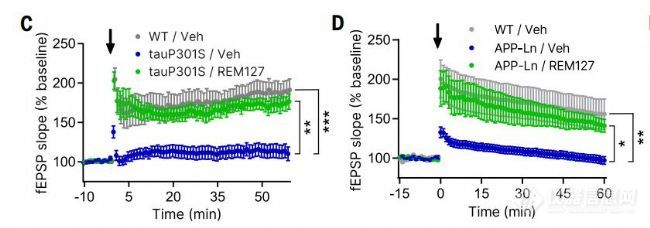
图5(C)WT和tauP301S小鼠(3.5月龄,每组N = 8)给予载药或REM127 (20 mg/kg/天)2个月CA1 LTP。箭头表示LTP诱导刺激。(D) WT/Veh (N = 5)、APP-Ln/Veh (N = 8)和APP-Ln/REM127 (N = 6)小鼠(7月龄)灌胃或REM127 (20 mg/kg/天)7 D后CA1 LTP的变化
除了介导神经元变性外,异常钙信号被认为促进了AD病理的发展。因此,我们假设通过ReS19-T抑制病变神经元中的钙内流可以减轻AD小鼠模型的病理。双源性APP-Ln的治疗:PS1(A246E)用REM127治疗3个月后,新皮质(图7)和托下(连接内鼻皮层和海马体的结构)中的Ab斑块堆积减少了55%至60%。这两个大脑区域都很突出。
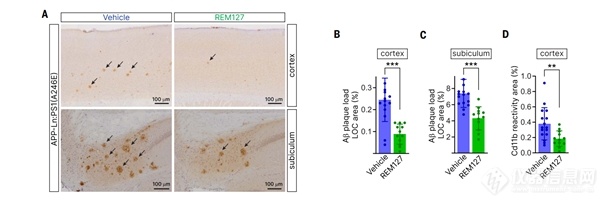
图6(A至D) APP-Ln:PS1(A246E)小鼠3个月后给药(N = 16)或口服REM127 (N = 12),剂量为20mg /kg/天。(A至C)抗淀粉样蛋白原纤维染色的Ab斑块皮质[(A)和(B)]和托骨下[(A)和(C)]的LOC抗体。(D)皮层CD11b免疫反应性
FIDA的技术优势
无需标记和固定:对于大多数小分子与蛋白互作实验可以通过FIDA的280nm光学模块无标记的Labelfree方式检测,FIDA技术无需固定、无需加热,无需标记。
数据QC与正交验证:FIDA技术提供的是第一性原理的水动力学绝对值检测,因此数据准确可靠。可同步构象改变(BRIC)进行正交亲和力验证。并可在实验的全流程进行样品的8个关键质量参数的质控。
灵敏度高:FIDA技术的灵敏度极高,并能够检测到小于1%的Rh变化,这对于评估小分子药物的结合亲和力等参数非常有用。
样品消耗少:本实验中 SEPT7 浓度为6 uM,单次检测只需要40nL,只需要极少量的蛋白样品,分析物(REM127)从0-250nM完成滴定。
CERO 3D生物反应器:细胞治疗领域的创新突破
CASY细胞计数:精准测量,助力糖尿病研究
SPR Microscopy技术及细胞原位分子互作动态分析系统SPRm200介绍
CERO创新—微流控3D肠道肿瘤模型为纳米药物递送开辟新路径


关注

拨打电话

留言咨询