
方案摘要
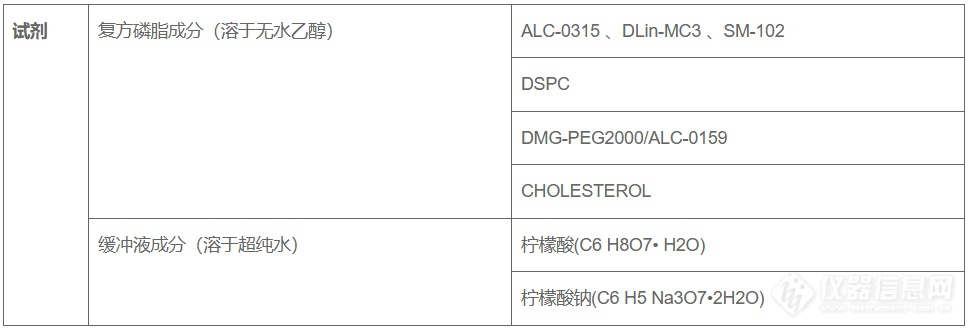
方案下载| 应用领域 | 制药/生物制药 |
| 检测样本 | 其他 |
| 检测项目 | 其他>其他 |
| 参考标准 | / |
参照 Moderna、BioNtech 和 Alnylam 的新冠疫苗配方,以SM102、ALC-0315、MC3为主要阳离子脂质制备包载 mRNA 的脂质纳米颗粒(lipid nanoparticles, LNPs)。
实验方案:微流控混合方式制备包裹mRNA的脂质纳米颗粒
配制复方脂质-乙醇溶液
配制柠檬酸缓冲液
计算RNA浓度,配制 mRNA-柠檬酸缓冲液
微流控混合操作(智能LNP合成仪S1的操作说明)
粒径与PDI的检测
产物的处理和保存
实验方案:使用Qubit测定LNP包封率
实验方案:使用酶标仪测定LNP包封率
实验方案:LNP转染293T细胞
附录
参照 Moderna、BioNtech 和 Alnylam 的新冠疫苗配方,以SM102、ALC-0315、MC3为主要阳离子脂质制备包载 mRNA 的脂质纳米颗粒(lipid nanoparticles, LNPs)。
ALC-0315、 MC3、和 SM102 是三种可用于人体的脂质。在酸性条件下,质子化形成阳离子脂质,能够通过静电作用和带负电的 mRNA 结合。脂质与溶有mRNA的水性溶液混合后析出,自组装形成载有 mRNA 的脂质纳米颗粒。本实验中采用微流控混合法,让脂质溶液与mRNA溶液在微混合器中充分、迅速、高度可重复地形成粒径均一可控的LNP。在制备过程中,脂质溶解于乙醇,核酸溶解于酸性缓冲液中,故制备得到的LNP初产物含有高浓度乙醇。因此后续还需要透析或者超滤去除残余的乙醇并将溶液体系置换至中性缓冲液中,以备后续生物学实验及长期保存。
[1]. 经测试,该三款注射器推杆较硬,推送液体较为准确
[2]. 此处不推荐NanoDrop检测核酸浓度,其对降解核酸以及低浓度核酸检测时会有较大波动
1. 配制复方脂质-乙醇溶液:LNP的成分与分子量见下表:
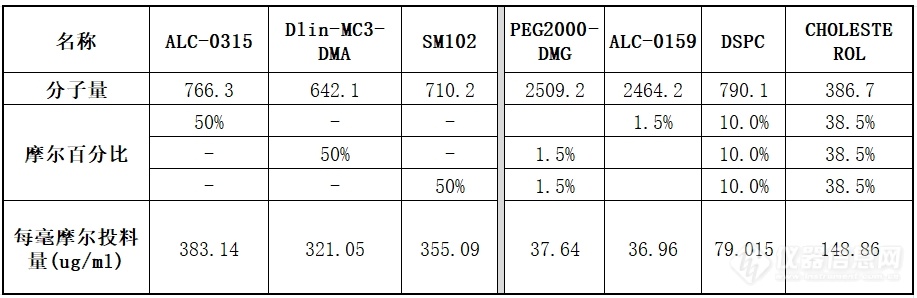
所有成分总浓度配置成 12 mM(约7.5 mg/ml)。如果需要摸索磷脂浓度对 LNP *终粒径的影响条件,可以配制以下浓度:8 mM(约 5 mg/ml)、12 mM(约 7.5 mg/ml)和 16 mM(约 10 mg/ml)等进行测试。需注意,低于4mM会难以形成均一的LNP,而过高浓度的磷脂反而会导致LNP粒径的增大。不同磷脂浓度对LNP粒径的影响见 附录-附件1。我们推荐使用12mM浓度的磷脂作为实验的起始条件。
备注 :配置好的磷脂溶液可于4℃密封保存半年。再次使用前请平衡至室温,直至溶液澄清。阳离子磷脂保存条件比较苛刻 ,常温下接触空气后会发生氧化变质,受潮则易析出。直接结果为合成 LNP时粒径出现异常增大(如粒径增大一倍以上),请确保妥善密封保存。
您也可以选择购买FluidicLab的LNP(脂质纳米颗粒)包封试剂盒。出厂前我们进行了严格的LNP合成检测,以确保LNP合成的质量和稳定。
2. 配制柠檬酸缓冲液
使用超纯水分别配制 100 mM 的一水合柠檬酸(分子量:210.14 ,称取 1.05 g)和二水合柠檬酸钠(分子量:294.10 ,称取 1.47 g)溶液各 50 ml 。取 33.0 ml 柠檬酸溶液和 17.0 ml 柠檬酸钠溶液混合,用NaOH调至pH =4 。随后用超纯水定容至 100 ml,加入终浓度0.1% 的DEPC静置30分钟。 高压灭菌去除 DEPC,即得 50 mM柠檬酸缓冲液。柠檬酸缓冲液与乙醇配置的磷脂,需要分别用0.22 μm的MCE滤膜(柠檬酸缓冲液)与PTFE滤膜(乙醇配置的磷脂)分别过滤,确保其终产物不含微小的固态颗粒(包封试剂盒内含100mM柠檬酸缓冲液,稀释后可直接使用)。
3. 计算RNA浓度,配制 mRNA-柠檬酸缓冲液:
氮磷比(N/P)是mRNA-LNP包封中常用的计算核苷酸用量与磷脂用量的参数。每个碱基含有一个磷酸根,1 mol的RNA或DNA即含有1mol的磷酸根(P)。磷脂中仅以可电离脂质比例计算氮原子数,每摩尔复方脂质中含有 0.5 mol氮原子(N)。
备注:虽然大多数的配方推荐的N/P比为6,但是实验表明,在后续的混合和超滤过程中,会损失一定的磷脂。所以在实践中,我们推荐您(可根据实验需要)将N/P比提高为8。更高的N/P比可以降低超滤和透析引起的粒径变大,并提高 mRNA 的利用率。缺点是可能会增大对细胞的毒性 ,降低细胞的存活率。对于包封率,高N/P比也并无优势。
核糖核苷酸的平均分子量为339.5,形成RNA脱水聚合后NEB推荐计算均值为320.5 g/mol。脱氧核糖核苷酸的平均分子量为327.0,形成双链DNA脱水聚合后,NEB推荐计算均值为308.0 g/mol。以可电离脂质比例计算氮原子数,每摩尔复方脂质中含有 0.5 mol氮原子。

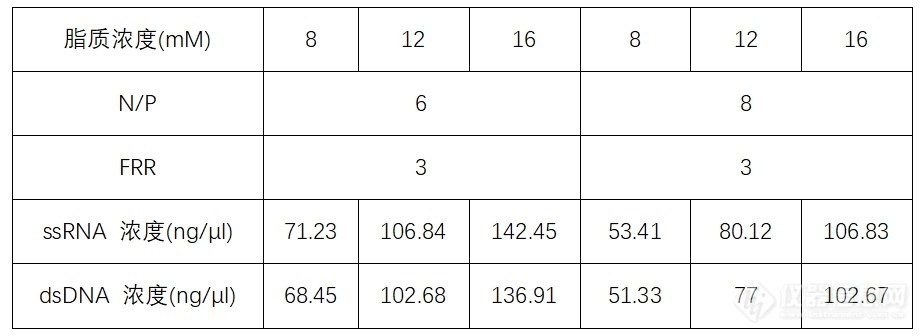
以柠檬酸缓冲液/复方磷脂流速比(FRR)= 3、N/P = 6、磷脂浓度 = 12 mM为例,进行核酸使用量的计算:
柠檬酸钠缓冲液中RNA浓度:(26.71 × 12) / 3 = 106.84 ng/μL;
柠檬酸钠缓冲液中DNA浓度:(25.67 × 12) / 3 = 102.68 ng/μL。
常用复方磷脂浓度与缓冲液中核酸浓度对应表
4. 微流控混合(智能LNP合成仪S1的操作说明):
4.1. 装配芯片。
将微流控芯片(B1-含鲁尔口)的鲁尔口朝上,装入适配器中(图1. A~C)。

图1. A.芯片适配器和微流控芯片;B. 微流控芯片鲁尔口朝上装入适配器中;C. 装配完成;
4.2. 装配反应仓
将B1芯片鲁尔口朝内朝下,适配器把手朝外,装入微流控反应仓(图2. A~B)

图2. A~B: B1芯片与适配器装入反应仓的操作。
4.3. 预冲洗芯片
实验前的预冲洗步骤是十分关键且必要的,请务必将芯片中预先填充乙醇和缓冲液,以帮助LNP高质量地合成。
4.3.1.注射器套筒的装配(此处以5ml注射器套筒为例)。
握住芯片适配器把手,向上转动反应仓(图3.A); 转动后可方便注射器适配器(套筒)的装入(图3. B)。随后装入符合需求的注射器套筒(使用20 ml注射器无需额外套筒)(图3. C~D)。

图3. A. 反应仓握持及转动方向示意图; B. 转动完成示意图;C. 装入符合需求的注射器套筒(使用20 ml注射器无需额外套筒);D. 装配完成示意图。
4.3.2. 注射器及收集管的装配(此处以5ml注射器为例)。
用两支注射器吸取乙醇与缓冲液,并排空气泡(图片未展示)。注意注射器吸取液体必需略大于实际实验用量。以拇指与食指握住注射器,挂耳对准自己(图4. A),向上插入反应仓套筒。向上插入稍稍遇到阻力后,在向上用力的同时旋转注射器(图4. B)。注意此处旋转并非是为了螺纹旋紧,而是释放对接中的应力,使得注射器与芯片连接更加牢固。装配完注射器后,将反应仓向下转动归位(图4. C),此时注射器与水平面垂直。*后安装两个15 ml离心管作为产物、废液收集管(图4. D)。安装部分操作完毕。
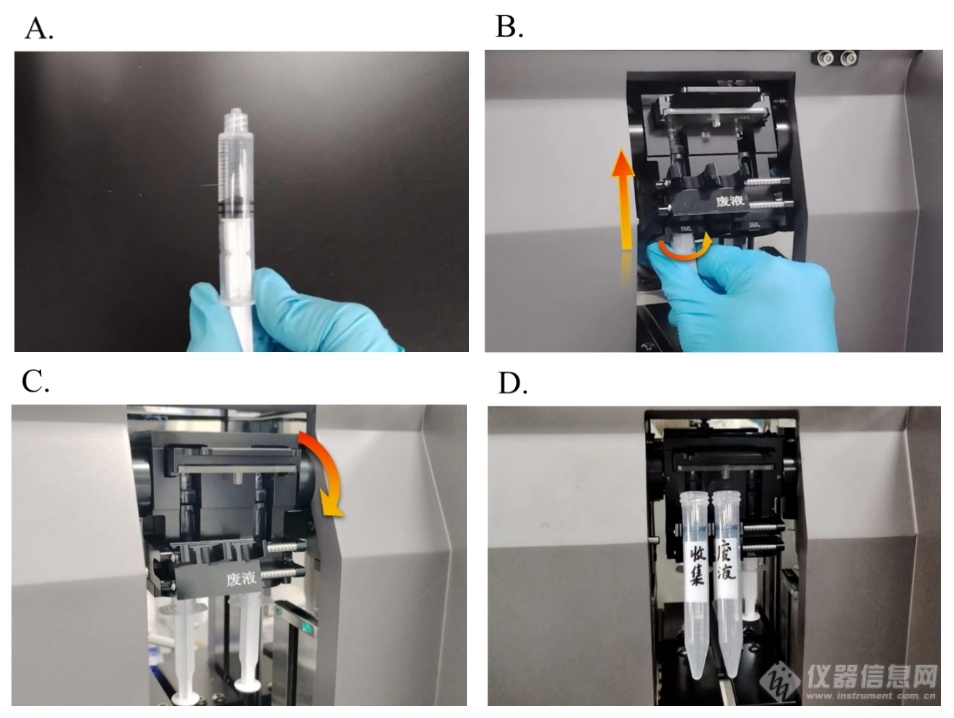
图4. A. 注射器装配时有利于推入的握持方式; B. 注射器装配时的用力方向示意图;C. 归位后反应仓与注射器形态示意图; D. 安装完成的收集管与废液管。
4.3.3. 软件的设置
首先连接设备电源。注意设备背后电源线处有一总开关。打开总电源开关后,打开前方控制面板电源。随后进行注射器参数及运行程序的设置。点击屏幕右上角注射器设置。依次选择脂相和水相注射器参数(图5.A)。正确的注射器参数才能保证准确的液体推送。请务必每一次实验前检查注射器参数是否与本次实验所用注射器一致。随后返回主页面。
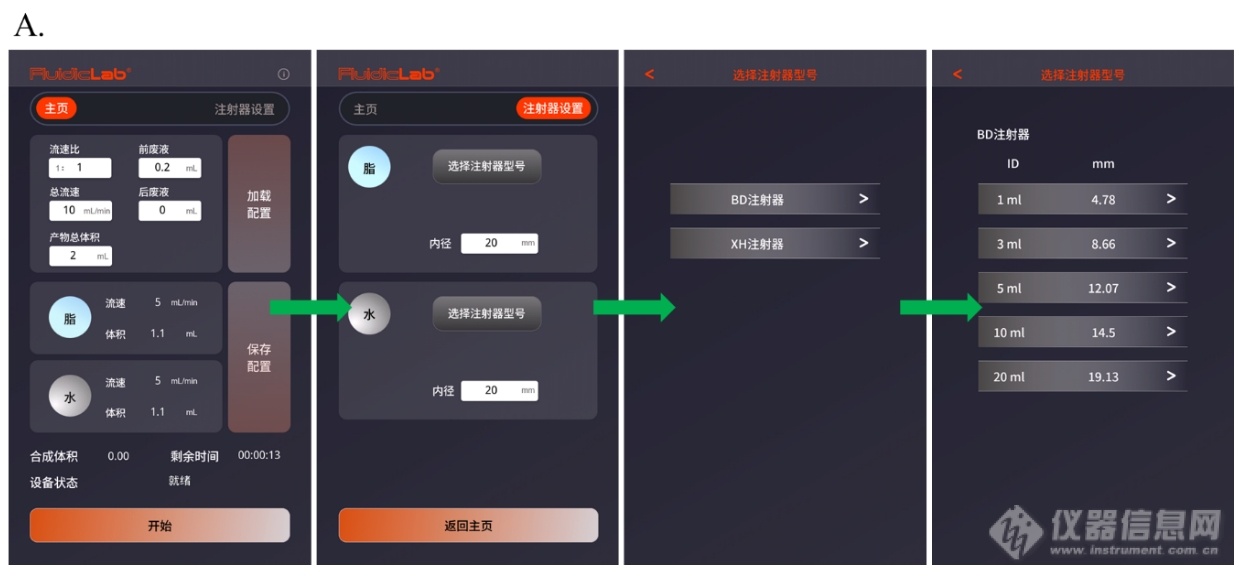
图5. A. 注射器参数的设置。
在主界面依次设置流速比,总流速,产物总体积,前后废液等参数。预充洗推荐参数:流速比1:3;总流速12 ml/min;产物总体积3 ml。预充洗无需前后废液,皆设为0 ml即可。设置完成点击界面*下端“开始”图标,即可开始预充洗。
4.3.4. 微流控混合制备LNP
1) 装配或更换适合的注射器套筒;
2) 使用注射器吸取配制好的复方磷脂及mRNA-柠檬酸缓冲液,排空气泡并与芯片连接。推荐*低吸取0.5ml;且吸取液体体积比实验计算用量略大0.1~0.2ml。如以1:3的流速比计划合成1ml终产物,0.2ml前废液( 即总产物1.2 ml )。则至少吸取0.5 ml( >0.3 ml,至少0.5ml )的复方磷脂和1 ml( > 0.9 ml )的mRNA-柠檬酸缓冲液。
3) 装配注射器,并于软件中修改或确认注射器品牌及参数。
4) 设置合成参数。我们推荐初始合成参数为:流速比1:3; 总流速12 ml/min,前废液0.2 ml,后废液0 ml。对于B1芯片:一定区间内流速越大,粒径越小,PDI也会越稳定。具体流速-粒径/PDI对应关系,参数详见附录-附件2实验数据。
5) 点击“开始”图标进行实验,S1智能合成仪即可全自动切换前(后)废液并收集产物。
5. 粒径和PDI的检测
mRNA-LNP产物可以使用动态光散射仪测定 LNP 粒径和均一度。正常结果如下图所示:
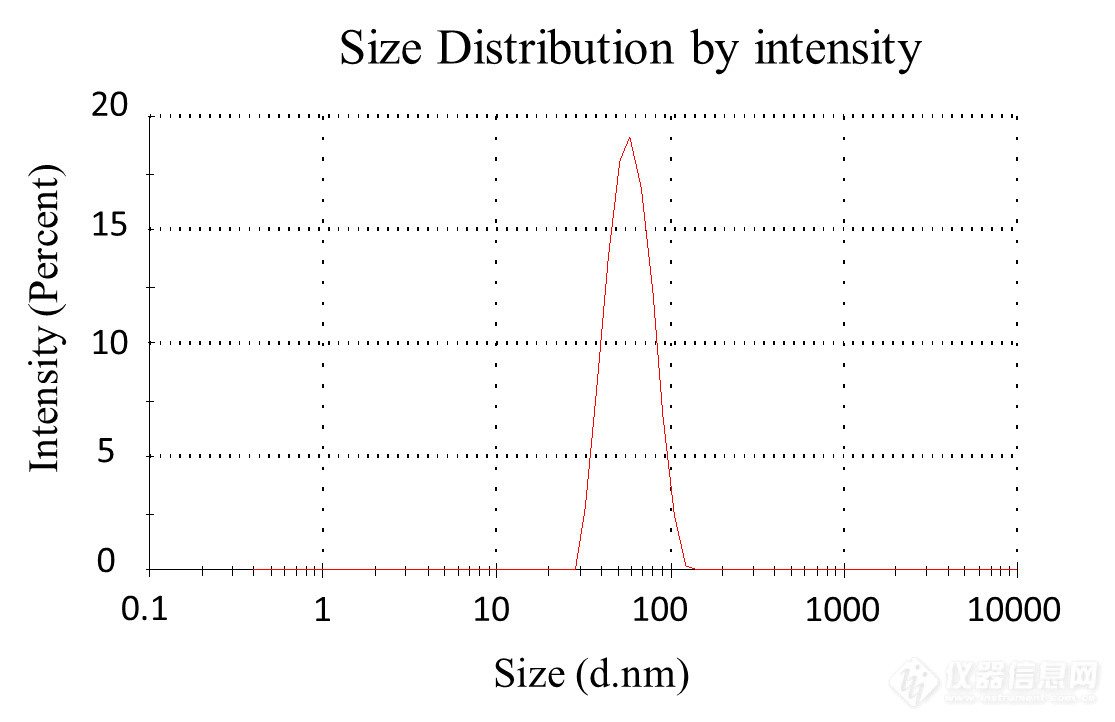
值得注意的是,由于LNP初产物中含25%乙醇,高浓度乙醇会导致直接检测初产物粒径有80%以上的偏差。因此需要及时地使用柠檬酸缓冲液将初产物稀释5倍进行检测。我们的实验数据显示,将乙醇的浓度稀释至5%以下,所测量的粒径才相对较为准确(误差<10%)。具体的稀释数据参考 附录-附件3 《乙醇浓度对LNP粒径及PDI检测的影响》。
备注:LNP初产物中高浓度乙醇会造成LNP融合,故推荐合成后立即用缓冲液稀释。若进行透析则无需稀释,尽快(10min内)将产物置于透析袋和透析液中进行透析。
6. 产物的处理和保存
可以根据实际情况选择超滤或者透析来去除产物中的乙醇并置换缓冲液。如果希望获得LNP粒径更小的终产物,则推荐进行透析。具体对比见 附录-附件4。
6.1.透析
1. 产物在制备后用注射器直接将产物移入透析卡(推荐使用Thermo的Slide-A-Lyzer™ 透析盒,20 K MWCO)或20 KD预处理过的透析袋。
2. 将装有LNP初产物的透析卡或透析袋置于至少50倍体积1 x PBS(pH=7.4),或50倍体积20 mM Tris-HCl(pH=7.4)于4℃透析2h。
3. 将透析液更换为50倍体积,含有10% 蔗糖 的PBS(pH=7.4),或50倍体积,含有8% 蔗糖的20 mM Tris-HCl(pH=7.4)于4℃透析过夜。
4. 透析后LNP终产物可于4℃或-20℃进行保存。
6.2. 超滤
1. 样品收集后 ,加入3倍体积的柠檬酸缓冲液稀释。
备注 :不建议直接使用 PBS 或者 Tris 缓冲液稀释 ,过快改变 LNP 外环境 pH 会造成不可控的粒径/PDI的增大。
2. 使用 Milipore 30 kD 超滤管,3000 g离心10 min,超滤至原体积的 1/4。(使用过小孔径的超滤管会使得超滤困难,超滤时间延长。不建议使用10kD或更小的超滤管。)
3. 补加1 x PBS(或20 mM Tris-HCl)至原体积 ,再次超滤10 min,至原体积 1/4。
4. 重复步骤 3 两次 ,将乙醇含量降低至 0.5%以下。
5. *后一次使用含有蔗糖保护液的缓冲液超滤浓缩,使得PBS缓冲液的终产物中含有10%的蔗糖(Tris-HCl缓冲液终产物含有8%蔗糖)。
6. 将超滤后的液体收集,于4℃ 或 -20℃冻存。
Tips :
LNP保存缓冲液与粒径的关联:
虽然根据 Moderna 公开数据显示 ,SM-102 适合使用含有8%蔗糖 的 20 mM Tris buffer(pH=7.4) 进行保存,但是我们测试发现DLin-MC3-DMA,SM102两种配方使用含有10% 蔗糖的PBS(pH=7.4)透析后粒径更小,且差异显著。ALC-0315配方生成的LNP保存于两种缓冲液中,粒径/PDI接近。故,对粒径有要求的实验者建议使用含有蔗糖的PBS进行透析和保存。
LNP保存时效与保存环境的关联:
LNP-RNA产物于含有10 % 蔗糖的PBS中,-20℃ 条件下保存一个月,与新制备LNP-RNA产物比较,稳定性和体内效力两者接近[1]。我们的实验结果则显示,4℃保存一个月,LNP产物粒径/PDI基本稳定,且仍具有转染细胞的能力。故,请4℃或-20℃保存。切勿进行-80℃冻存[1]。
LNP转染效率与保存缓冲液的关联:
有文献报道显示DLin-MC3-DMA于TBS(Tris-buffered saline)缓冲液条件下转染效率会高于PBS缓冲液[2]。所以若对后续转染细胞或小鼠有需求的实验者,可以参考该文献对缓冲液体系进行优化。
[1]. Kim B, Hosn RR, Remba T, Yun D, Li N, Abraham W, Melo MB, Cortes M, Li B, Zhang Y, Dong Y, Irvine DJ. Optimization of storage conditions for lipid nanoparticle-formulated self-replicating RNA vaccines. J Control Release. 2023 Jan;353:241-253.
[2]. Henderson MI, Eygeris Y, Jozic A, Herrera M, Sahay G. Leveraging Biological Buffers for Efficient Messenger RNA Delivery via Lipid Nanoparticles. Mol Pharm. 2022 Nov 7;19(11):4275-4285.
此篇实验方案未完,请点击链接继续观看(由于平台编辑器总字数限制,分2篇内容完成)
https://www.instrument.com.cn/netshow/SH111222/s955615.htm


实验方案:微流控混合方式制备盐酸多柔比星脂质体(Doxorubicin-Liposome)
实验方案:微滴/微球制备仪制备透明质酸(HAMA)微球
文献导读 之 mRNA-LNP 在体(in vivo)改造CAR-T细胞 在体(in vivo)改造的CAR-T细胞治疗心脏损伤
FluidicLab自动微球/微液滴制备仪-液滴微流控系统
FluidicLab 微流控智能LNP脂质纳米颗粒合成仪
FluidicLab微流控多通道精密压力泵
FluidicLab脂质纳米颗粒(LNP)科研级制备系统-微流控
FluidicLab玻璃/PDMS标准微流控芯片夹具
FluidicLab微流控精密压力控制器Light版
FluidicLab多通道高精密微流控压力泵/压力控制器
FluidicLab单细胞包裹/Janus微球生成微流控芯片PDMS材质
FluidicLab微流体流量传感器-热差式流量计-微流控
FluidicLab血脑屏障器官芯片
FluidicLab微流控电动旋转选通阀/切换阀
FluidicLab层流流动腔流通池flow cell
Fluidiclab数字型压力传感器/模拟型压力传感器
FluidicLab 微流控芯片|定制加工|微球液滴制备生成
FluidicLab压力传感器数据采集卡

关注

拨打电话

留言咨询