
方案摘要
方案下载| 应用领域 | 制药/生物制药 |
| 检测样本 | 生物药品药物研发 |
| 检测项目 | 临床前研究>其他 |
| 参考标准 | / |
使用微流控混合方式制备包裹盐酸多柔比星(DOX)的脂质体并对其质量进行检测。
脂质体(Liposome)是最先被广泛研究的纳米颗粒之一,是一种磷脂双分子层囊泡。由于其结构类似于生物膜的主要结构磷脂双分子层,故脂质体也被称为“人工生物膜”。脂质体的主要成分一般由磷脂与胆固醇构成,都是生物体内的内源性物质,几乎没有免疫原性。具有低毒性/高生物相容性等特点,被广泛用于药物的递送。
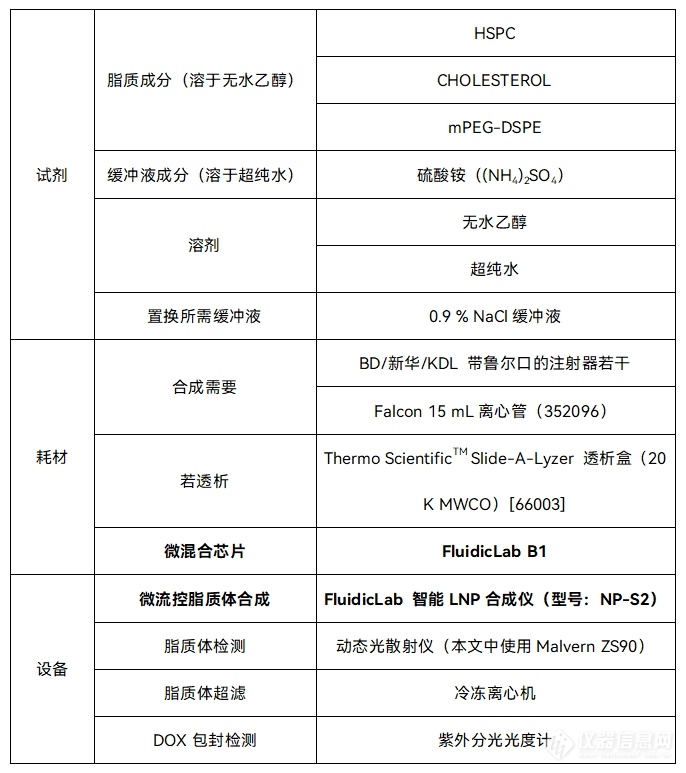
实验步骤:
为方便称量,可先行配置总浓度200 mM的脂质溶液母液,可使用60℃的水浴加热帮助溶解。根据后续实验的需求,再对母液进行稀释。室温下200mM的母液会逐渐析出,请溶解后尽快稀释配置工作液,或发现析出后再次加热助溶。
2.配置硫酸铵缓冲液
称取1.9812 g硫酸铵(分子量:132.14),使用超纯水定容至50 mL,得到300 mM的硫酸铵缓冲液50 mL。硫酸铵缓冲液与无水乙醇配置的脂质溶液需要分别使用0.22 μm的MCE滤膜与0.22μm的PTFE滤膜过滤,确保终产物中不含微小固态颗粒或杂质。
3.微流控合成

智能纳米颗粒合成仪操作界面如下:

对于仪器的使用方法,请参照我司智能纳米颗粒合成仪的操作指导视频(https://www.bilibili.com/video/BV1Kg4y127tc?share_source=copy_web),或我司官网发布的LNP合成的实验方案https://www.fluidiclab.com/mrna-lnp-s1/)。经测试,我们发现不同总脂质浓度、总流速、流速比等条件都会对脂质体的合成粒径、PDI产生影响。
具体来说,该配方下,随着总脂质浓度升高,合成的脂质体粒径先下降后上升。在80mM浓度及以上合成的脂质体中,PDI显著升高。其影响的具体参数见【附录-附件1】。对于微流控参数条件进行测试,我们也发现其受到流速与流速比的影响。配方和实验参数经优化,结果为:使用15 mM浓度的脂质溶液(附录-附件1),总流速为16 mL/min(附录-附件2);流速比为1:4(附录-附件3),可获得该配方下,粒径最小且均匀的脂质体。
4.粒径和PDI的检测
合成的脂质体可以使用动态光散射仪测定粒径与均一度。正常结果如下图所示:
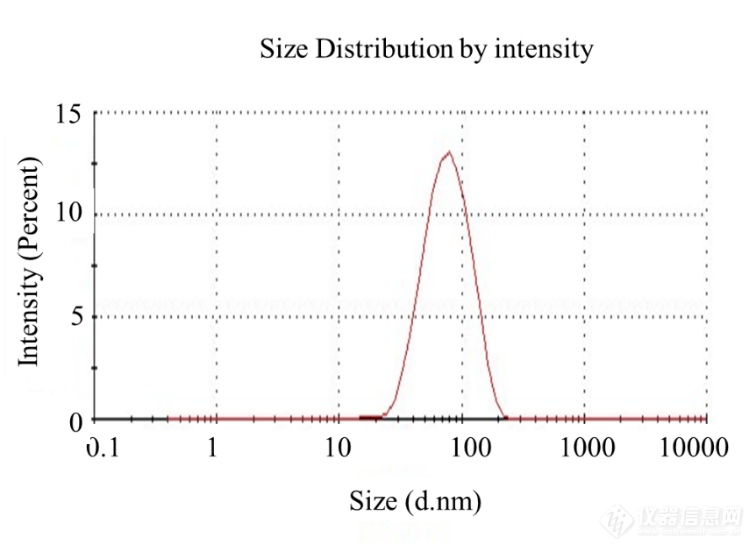
由于脂质体初产物中含20%的乙醇,高浓度乙醇会使检测初产物的粒径有80%以上的偏差。因此需要及时将初产物稀释进行检测。
经测试,我们推荐的稀释方式是使用硫酸铵缓冲液将乙醇浓度稀释至2.5%(8倍稀释)。稀释浓度的确定过程参考附录-附件4。也可参考我司LNP合成方案中,附录3的稀释实验结论,其原理一致。
备注:Liposome初产物中高浓度乙醇会造成脂质体融合,需尽快(10 min内)将产物置于透析袋和透析液中透析。
5.DOX的包封
称取4.5g NaCl,使用超纯水定容至500 mL,配成质量浓度为0.9 %的NaCl。使用该缓冲液将DOX配置为10 mg/mL母液。
1.合成后的脂质体初产物用注射器直接移入透析卡(推荐使用Thermo的Slide-A-LyzerTM透析盒,20 K MWCO)或20 kDa预处理过的透析袋。
2.将装有脂质体初产物的透析卡或透析袋置于至少50倍体积的0.9% NaCl缓冲液中,室温透析至少6h。中途进行一次换液。
3.透析后的脂质体产物可以4 ℃保存。
1.选择适量DOX,加入透析完成的脂质体产物,并混合均匀。将溶液置于60 ℃水浴中共孵育30 min。
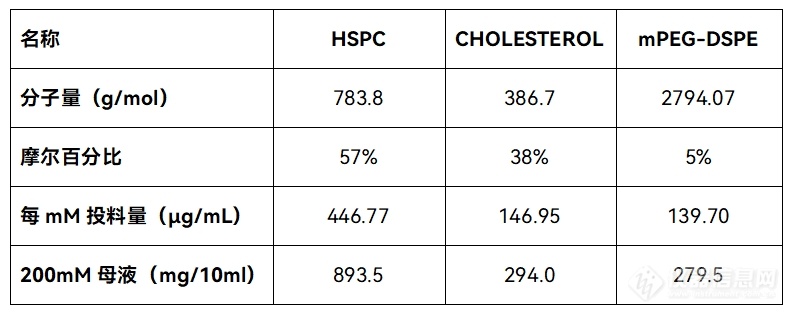
推荐的Drug:Lipid比例为1:5-10(mol:mol),已知DOX分子量为543.525 g/mol。以20 mM浓度的脂质溶液合成1 mL脂质体为例,
选择1:5的药脂比,药物的量为1 mL× 1/5 (1:4的流速比) × 20 mM × 1/5(1:5的药脂比)× 543.525 g/mol = 0.435 mg,即加入10 mg/mL DOX溶液435 μL。因此【推荐的DOX的量为435 μL-217 μL】
2.孵育完毕,将产物用注射器移入透析卡或透析袋中,置于至少50倍体积的0.9% NaCl缓冲液中,室温透析至少6h,中途换液2次。
3.透析后的DOX-Liposome可以在4 ℃保存
4.随后,可对该脂质体进行包封率的测量
实验方案:使用紫外分光光度计测定脂质体(Liposome)的包封率
实验目的:
离心管与枪头若干,
比色皿
Millipore 30 kDa 超滤离心管
实验仪器:
紫外分光光度计
实验步骤:
1.配置测试溶液
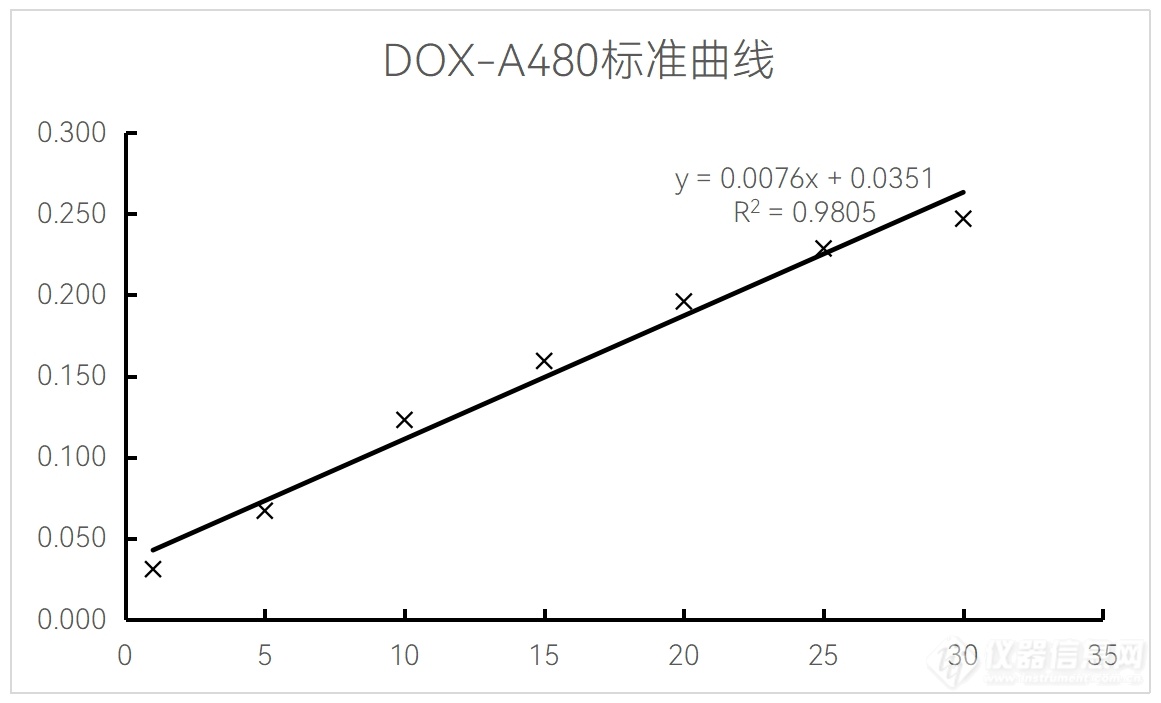
取45 mL异丙醇与5 mL浓度为75 mM的盐酸混合均匀备用标准曲线的测定
使用0.9% NaCl分别将DOX稀释至10 μg/mL、50 μg/mL、100 μg/mL、150 μg/mL、200 μg/mL。取100 μL不同浓度的DOX溶液与900 μL异丙醇-盐酸溶液混合,在波长480 nm下测定吸光度,将吸光度与DOX浓度绘制成标准曲线备用,我们测定的DOX-A480标准曲线见附录-附件5。
2.产物超滤
记录制备完成的DOX-Liposome的体积V0。使用30 kDa超滤管进行超滤并收集超滤后,超滤管中的液体(体积记为V2)与超滤下的液体(体积记为V1)。
该步骤有2个作用。一为对脂质体进行浓缩;
二为分离不含脂质体的外部缓冲液,方便后续确认未包封DOX的量。
3.包封率的测定
分别取100 μL上述液体与900 μL 异丙醇-盐酸溶液混合,在波长480 nm下测定吸光度,并代入标准曲线中,超滤下的液体的吸光度记为A1,超滤后超滤管内获得的液体的吸光度记为A2,通过标曲将其分别换算为浓度B1与B2。

附录
附件清单
附件1:脂质溶液浓度与粒径/PDI的关系图
附件2:Liposome合成总流速与粒径/PDI的关系图
附件3:Liposome合成流速比与粒径/PDI的关系图
附件4:乙醇浓度与稀释溶液对Liposome粒径/PDI的影响
附件5:DOX-A480标准曲线
附件1:
脂质体(Liposome)合成中,脂质浓度与粒径/PDI的关系图
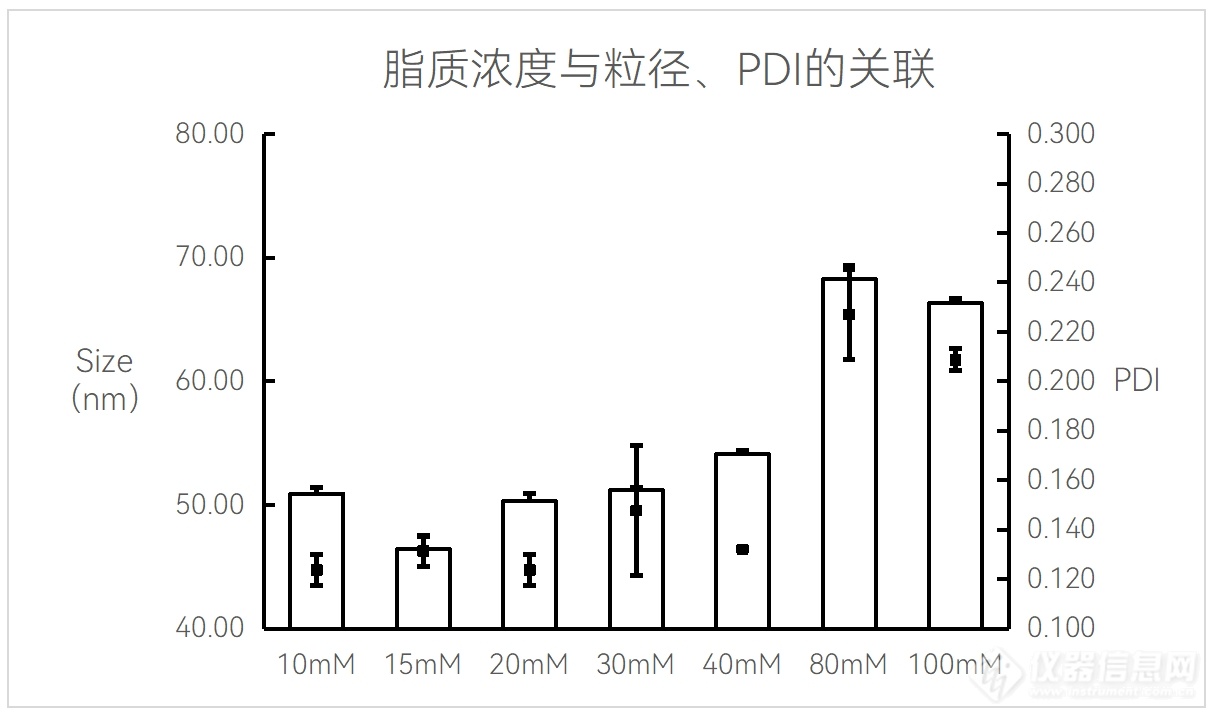
实验条件:仪器:FluidicLab NP-S2;芯片:FluidicLab-COC-LNP-B1
总流速:16 mL/min;流速比(脂相:水相=1:4);前废液:0.3 mL;
Liposome空包无DOX;
产物经硫酸铵缓冲液稀释至乙醇浓度为2.5%后进行DLS检测。
可见该配方下,15 mM脂质溶液合成的脂质体粒径最小,且均一度佳。
附件2
脂质体(Liposome)合成中,合成总流速与粒径/PDI的关系图
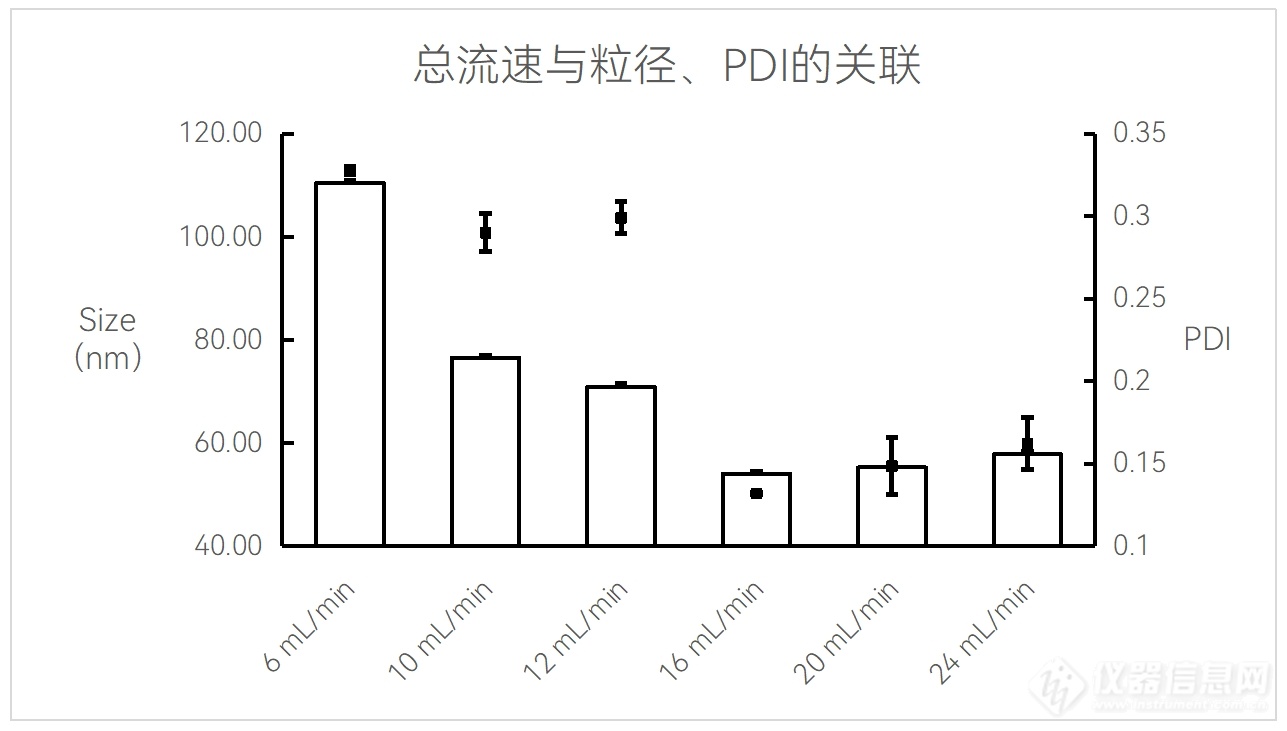
实验条件:仪器:FluidicLab NP-S2;芯片:FluidicLab-B1
40 mM脂质溶液;流速比:1:3(脂相:水相);前废液:0.3 mL;
Liposome空包无DOX;产物经硫酸铵稀释至乙醇浓度为2.5%。
可见该配方下,16 mL/min的总流速合成的脂质体粒径更小,均一度佳。
附件3
脂质体(Liposome)合成中,合成流速比与粒径/PDI的关系图
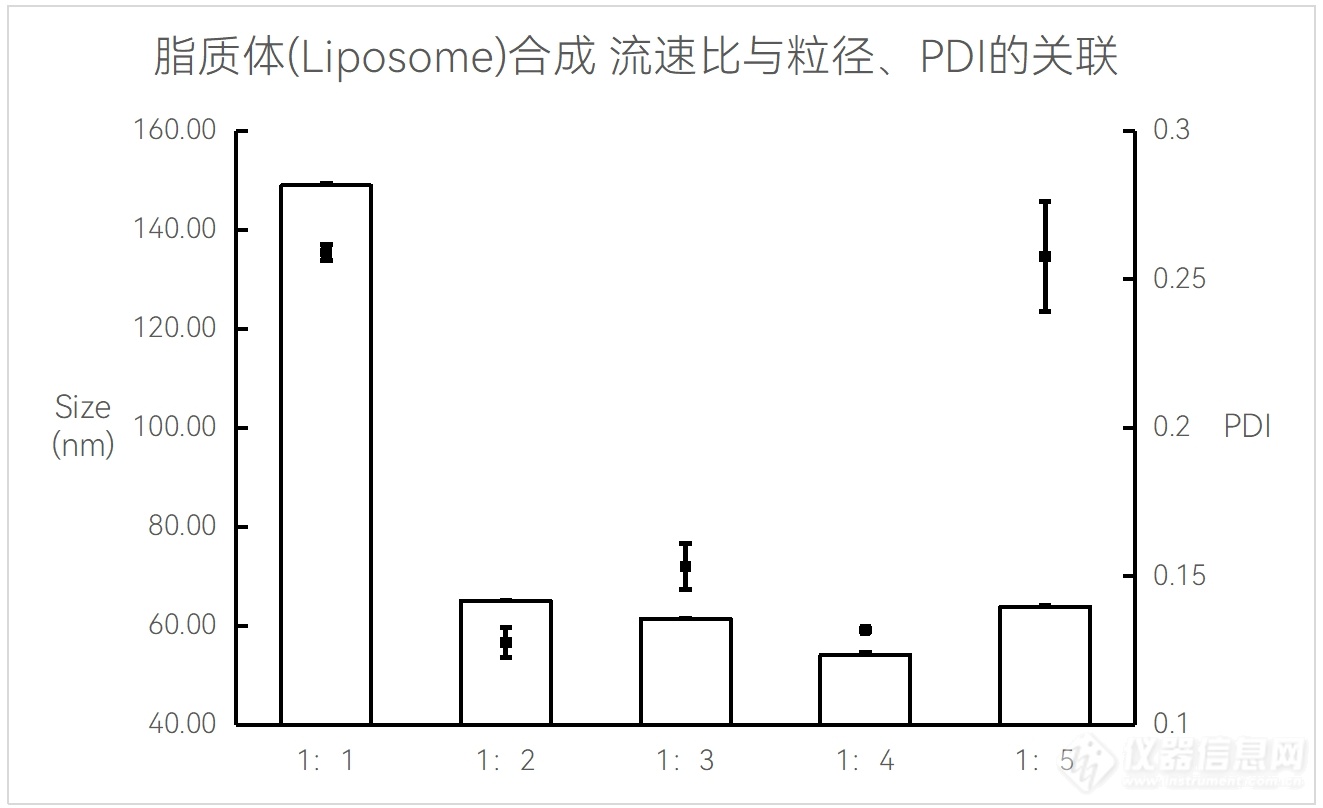
实验条件:仪器:FluidicLab NP-S2;芯片:FluidicLab-B1
40 mM脂质溶液;总流速16 mL/min;前废液:0.3 mL;
Liposome空包无DOX;各产物经硫酸铵稀释,确保乙醇浓度统一为2.5%。
可见该配方下,1:4的流速比合成的脂质体粒径最小。
附件4
乙醇浓度与稀释溶液对脂质体(Liposome)粒径/PDI的影响
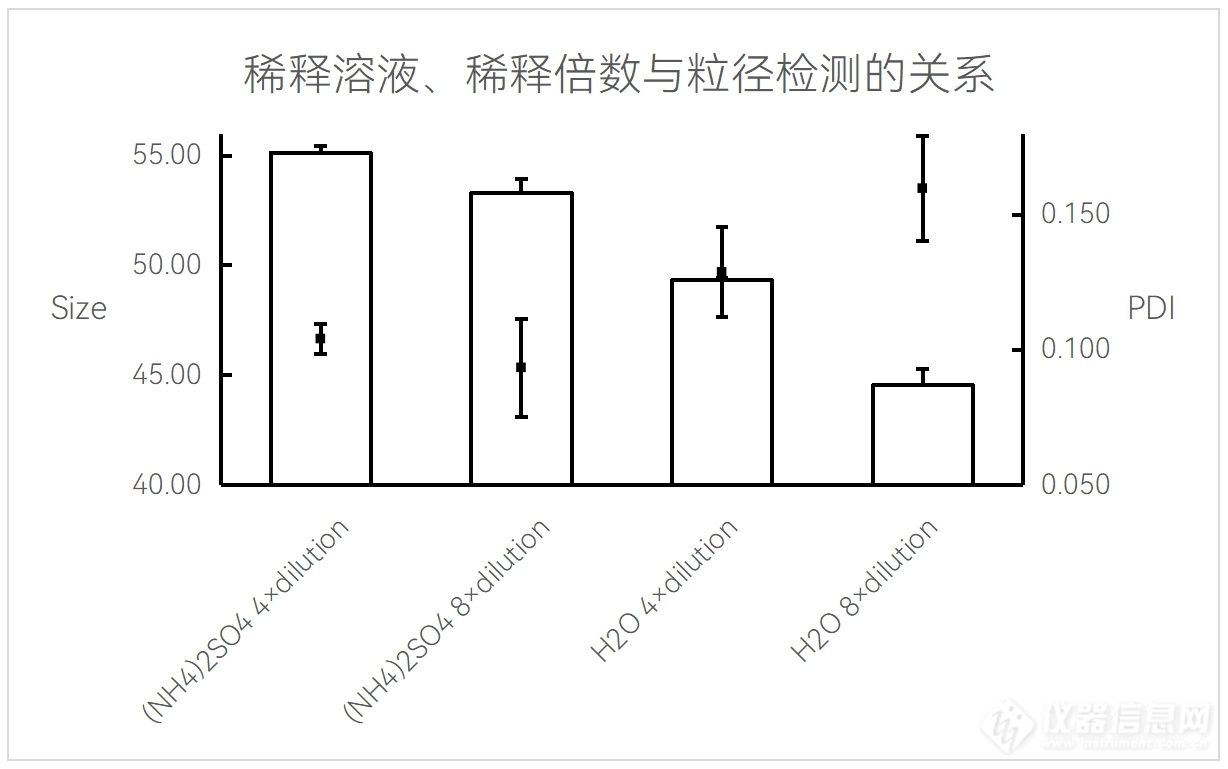
实验条件:仪器:FluidicLab NP-S2;芯片:FluidicLab-B1
20 mM脂质溶液;总流速16 mL/min;流速比1:4(脂相:水相);前废液:0.3 mL;Liposome空包无DOX;产物经不同溶液与稀释倍数稀释。
可见虽然水稀释测得的粒径更小,但PDI却较高,且在1000 nm以上的位置产生了小峰(见下图)。这有可能是离子浓度发生了较剧烈改变导致的。因此为了获得更稳定的结果,我们推荐使用300 mM硫酸铵缓冲液将乙醇稀释至2.5%及以下。
附件5
DOX-A480标准曲线


实验方案:微滴/微球制备仪制备透明质酸(HAMA)微球
文献导读 之 mRNA-LNP 在体(in vivo)改造CAR-T细胞 在体(in vivo)改造的CAR-T细胞治疗心脏损伤
文献精读 之 mRNA-LNP递送肿瘤疫苗 淋巴结靶向的LNP-mRNA肿瘤疫苗引发强烈 CD8+ T细胞应答
FluidicLab自动微球/微液滴制备仪-液滴微流控系统
FluidicLab 微流控智能LNP脂质纳米颗粒合成仪
FluidicLab微流控多通道精密压力泵
FluidicLab脂质纳米颗粒(LNP)科研级制备系统-微流控
FluidicLab玻璃/PDMS标准微流控芯片夹具
FluidicLab微流控精密压力控制器Light版
FluidicLab多通道高精密微流控压力泵/压力控制器
FluidicLab单细胞包裹/Janus微球生成微流控芯片PDMS材质
FluidicLab微流体流量传感器-热差式流量计-微流控
FluidicLab血脑屏障器官芯片
FluidicLab微流控电动旋转选通阀/切换阀
FluidicLab层流流动腔流通池flow cell
Fluidiclab数字型压力传感器/模拟型压力传感器
FluidicLab 微流控芯片|定制加工|微球液滴制备生成
FluidicLab压力传感器数据采集卡

关注

拨打电话

留言咨询