
方案摘要
方案下载| 应用领域 | 制药/生物制药 |
| 检测样本 | 预防类生物药品 |
| 检测项目 | |
| 参考标准 | / |
众所周知,LNP作为一种递送系统,其递送核酸等生物大分子的能力、递送的安全性已经在新冠疫苗中得到了广泛的验证。然而由于LNP常规配方其独特的肝脏靶向性,导致其应用收到了一定的限制。 来自Tufts大学的Qiaobing Xu教授于2022年在PNAS发表了题为《Lipid nanoparticle-mediated lymph node–targeting delivery of mRNA cancer vaccine elicits robust CD8+ T cell response.》的文章。他们在不使用靶头的前提下,通过筛选阳离子脂质,筛选到了一种拥有淋巴结(LN)靶向性的阳离子脂质及其配方,将其应用于肿瘤治疗性mRNA-LNP疫苗的开发,并验证了其有效性。
众所周知,LNP作为一种递送系统,其递送核酸等生物大分子的能力、递送的安全性已经在新冠疫苗中得到了广泛的验证。然而由于LNP常规配方其独特的肝脏靶向性,导致其应用收到了一定的限制。
来自Tufts大学的Qiaobing Xu教授于2022年在PNAS发表了题为《Lipid nanoparticle-mediated lymph node–targeting delivery of mRNA cancer vaccine elicits robust CD8+ T cell response.》的文章。他们在不使用靶头的前提下,通过筛选阳离子脂质,筛选到了一种拥有淋巴结(LN)靶向性的阳离子脂质及其配方,将其应用于肿瘤治疗性mRNA-LNP疫苗的开发,并验证了其有效性。
关键词:肿瘤疫苗;核酸疫苗;淋巴结靶向LNP;LNP配方筛选
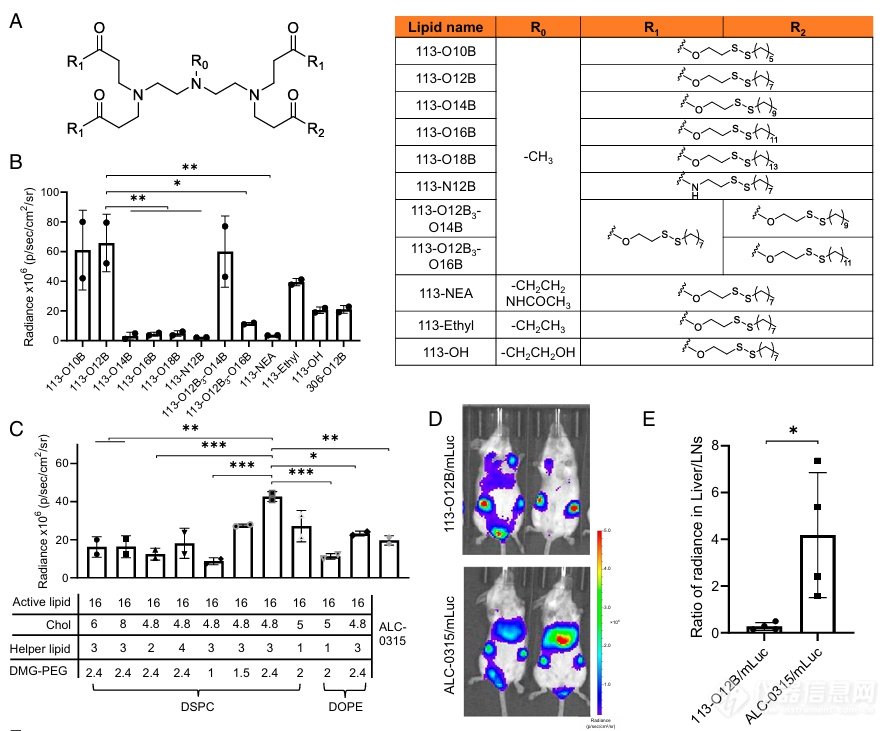
1) 筛选并优化能够靶向递送淋巴结的LNP配方
【结论:筛选到的113-O12B的可以靶向淋巴结的DC及Macrophage】
首先,作者通过实验筛选和对比,发现了短链磷脂113-O12B拥有相较于长链磷脂更佳的淋巴结递送及表达效率(Fig. 1B)。对于优化比例后的复方磷脂配方(Fig. 1C),113-O12B相较于常规的ALC-0315表现出了更低的肝脏靶向性及更好的LN靶向性(Fig. 1D、E)。
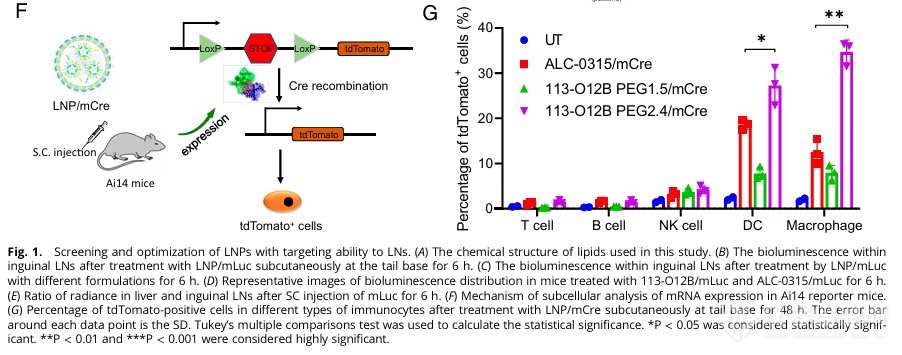
Ail4转基因小鼠在接受含有Cre蛋白的mRNA转染后,其细胞会表达红色荧光(tdTomato),从而能够通过流式检测出LNP转染成功的细胞。使用该小鼠进行转染实验,发现113-O12B配合2.4%的PEG配方会使得多至约27%的树突状细胞(DC)及约34%的巨噬细胞(Macrophage)两种抗原递呈细胞(APC)被转染mRNA。APC细胞的靶向性及较高的转染效率意味着该配方可以应用于激活下游的免疫反应。
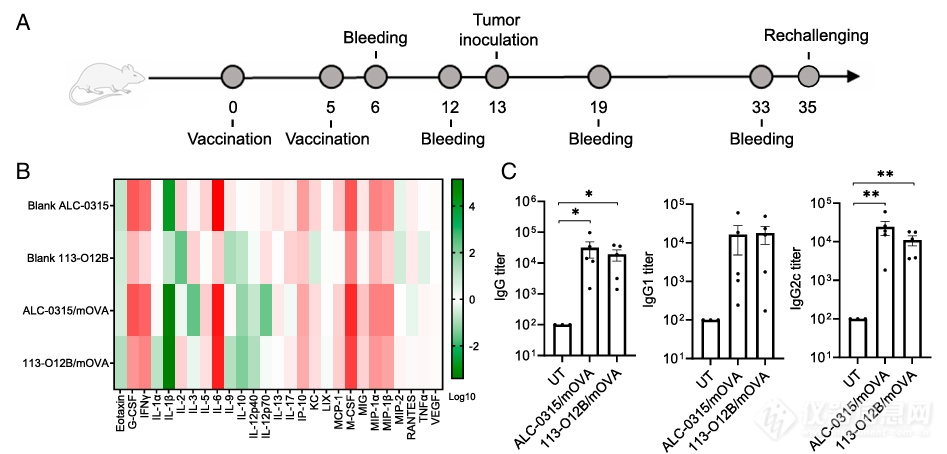
2) 113-O12B/mOVA疫苗的预防功能验证
【结论:113-O12B/mOVA 可以引起T细胞的免疫应答,并对B16F10-OVA肿瘤模型小鼠起到预防保护作用。】
B16F10-OVA肿瘤细胞包含了已知的OVA序列作为抗原。利用该模型可研究小鼠的肿瘤免疫反应。小鼠先接种疫苗,后注射肿瘤细胞,从而研究其免疫反应和免疫效果。
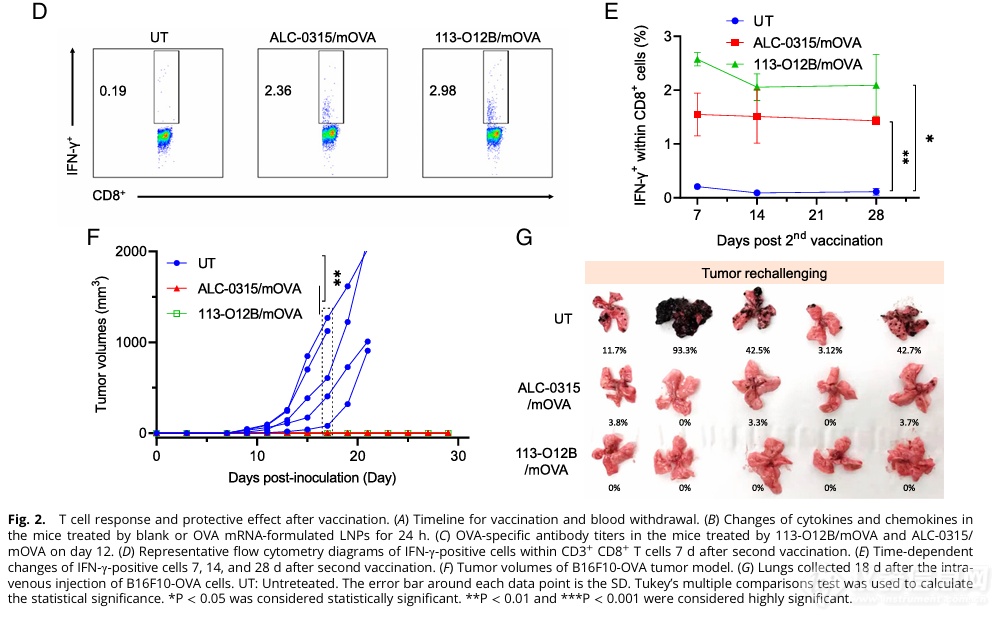
ELISA检测发现,经113-O12B递送的mOVA疫苗免疫小鼠血液中产生OVA抗体,OVA特异的CD8+T细胞比例相较于对照组皆有显著上升(Fig. 2D、E),与此同时,在疫苗接种4周后仍有CD8+T能够在OVA抗原刺激下表现为IFN-γ+,证明了疫苗免疫产生了持久的T细胞反应。
更重要的是,113-O12B/mOVA免疫小鼠进行B16F10-OVA肿瘤细胞的接种,相较于对照组的肿瘤快速生长,其注射部位未发现明显肿瘤生长(Fig. 2F),且其肺部完全未发现肺部转移灶(Fig. 2G);这些结果说明了LNP/mOVA疫苗可以保护B16F10-OVA肿瘤模型接种的小鼠。
3) 113-O12B/mOVA疫苗的功能验证
【结论:113-O12B/mOVA疫苗可以改变B16F10-OVA肿瘤模型中免疫细胞组成】
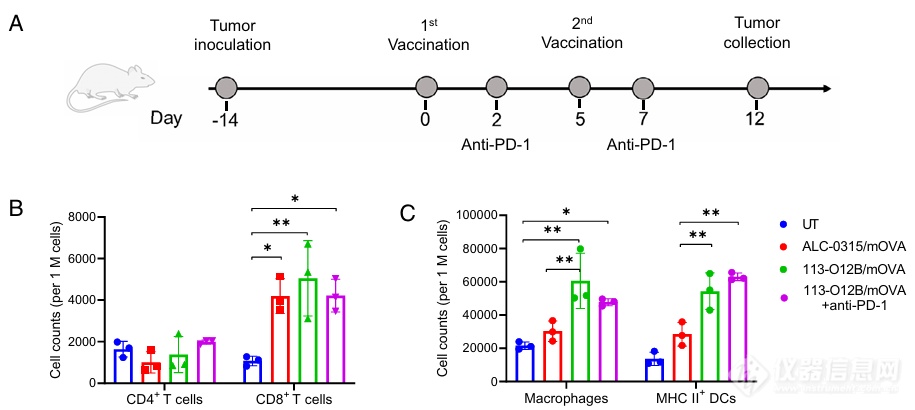
作者随后进行了疫苗治疗效果测测试,对小鼠先接种肿瘤细胞,后使用疫苗进行治疗。对肿瘤内部细胞类型的检测发现,接受113-O12B/mOVA疫苗治疗的肿瘤模型小鼠CD8+ T细胞比例(Fig. 3B、C),巨噬细胞及MHC II+的DC细胞比例显著上升,而CD4+的T细胞则无显著变化。
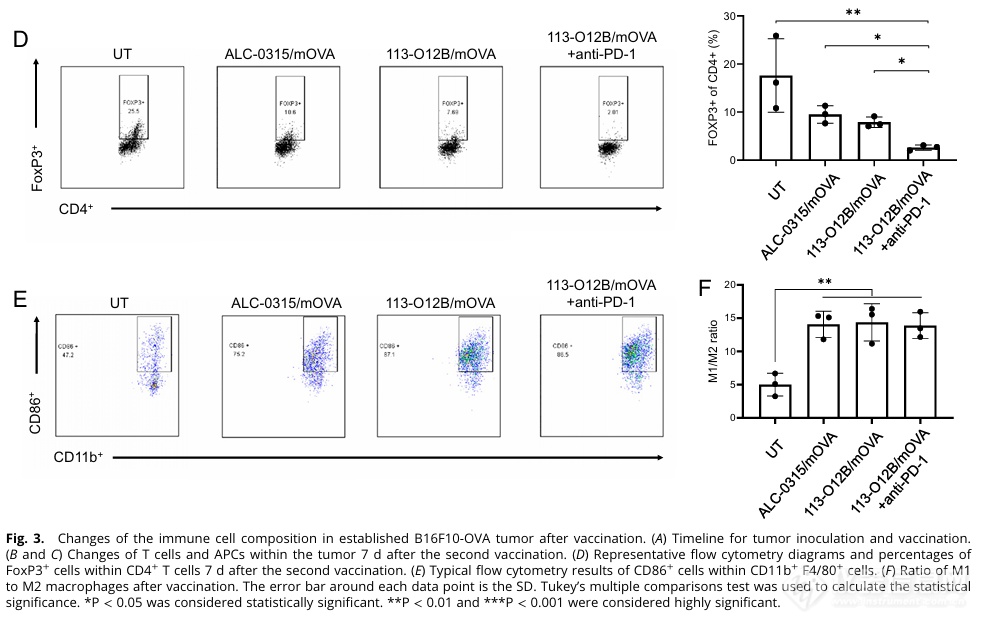
对CD4+ T细胞和巨噬细胞的亚型分析发现,两组疫苗接种的实验组中,Treg细胞的数量降低,巨噬细胞M1的比例上升。前者被认为有肿瘤免疫抑制的效果,后者具有促炎和抗肿瘤效果。该结果意味着肿瘤的免疫抑制效果降低,抗肿瘤效果上升。
4) 113-O12B/mOVA疫苗对B16F10-OVA肿瘤模型的治疗效果验证
【结论:在B16F10-OVA肿瘤模型中,113-O12B/mOVA疫苗有治疗效果】
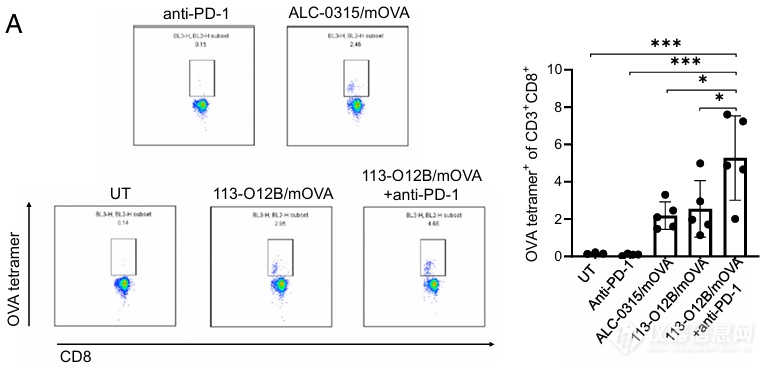
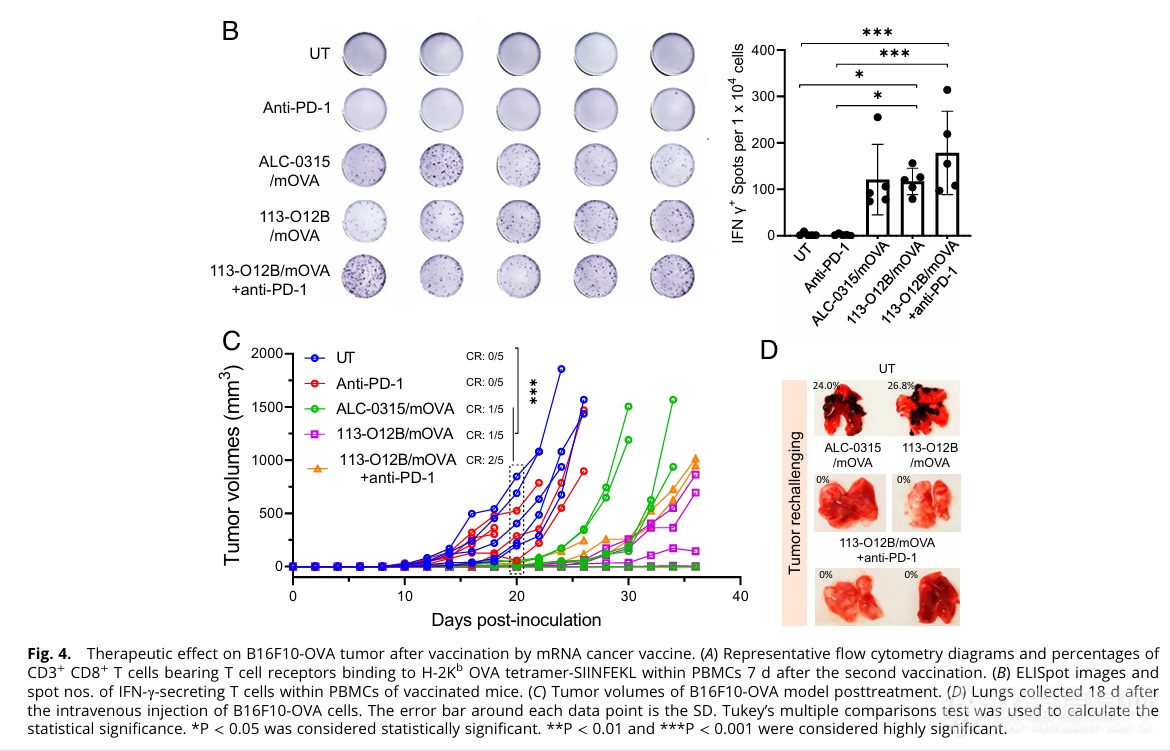
作者接下来对疫苗的治疗效果进行了研究。113-O12B/mOVA治疗组中能够产生特异性杀伤OVA肿瘤的CD8+ T细胞(Fig. 4A)。此外,在额外使用了anti-PD-1抗体治疗的113-O12B/mOVA实验组中,OVA抗原特异性的CD8+ T细胞比例进一步上升,能够分泌IFN γ的T细胞数量显著上升(Fig. 4B)。这可以说明疫苗治疗可以引发强烈的T细胞反应。
对于肿瘤体积的实验检测结果如(Fig. 4C)所示,113-O12B/mOVA治疗效果优于ALC-0315/mOVA的治疗,而113-O12B/mOVA联合anti-PD-1用药有着更优于单独质量的效果。
mRNA疫苗的长期免疫效果结果显示,所有经历了疫苗治疗且在初次注射肿瘤存活下来的小鼠,再次注射肿瘤细胞均未发生肺部转移灶(Fig. 4D),证明了疫苗注射治疗的长效保护性。
5) 113-O12B//TRP2180–188疫苗对B16F10肿瘤模型的治疗效果验证
【结论:在B16F10肿瘤模型中,113-O12B/TRP2180–188疫苗有治疗效果】
Tyrosinase-related protein-2 (TRP2)是一种弱免疫原性的肿瘤相关抗原,为B16F10肿瘤模型的天然抗原。作者以TRP2180–188 (SVYDFFVWL)序列作为mRNA肿瘤疫苗的抗原设计靶点。
结果发现PBMC中,疫苗治疗显著增加了可被TRP2180–188 激活产生IFN-γ的 CD8+ T细胞比例(Fig. 5B)。接受了疫苗治疗的小鼠至少存活超过36天。以上2只同时接受了anti-PD-1治疗并且表现出强T细胞反应的小鼠则展现出了肿瘤完全缓解的结果,意味着核酸疫苗+免疫检查点抑制剂治疗组合有着绝佳的治疗效果和应用潜力。

以上是这篇文章重要结果的总结。在后新冠时代,如何有效利用mRNA-LNP这种快速开发疫苗的技术成为了大家思考的一个重点。这篇文章的工作给予了我们很好的启发,即筛选出能够靶向APC细胞的相关磷脂,递送Tumor specific antigen或neoantigen的mRNA至APC中引发免疫反应并治疗肿瘤是可行的。更令人欣喜的是,该治疗方法与肿瘤免疫检查点治疗肿瘤的方法联用在小鼠中有着更佳的治疗效果。mRNA-LNP递送核酸疫苗治疗肿瘤的潜力令人期待。


实验方案:微流控混合方式制备盐酸多柔比星脂质体(Doxorubicin-Liposome)
实验方案:微滴/微球制备仪制备透明质酸(HAMA)微球
文献导读 之 mRNA-LNP 在体(in vivo)改造CAR-T细胞 在体(in vivo)改造的CAR-T细胞治疗心脏损伤
FluidicLab自动微球/微液滴制备仪-液滴微流控系统
FluidicLab 微流控智能LNP脂质纳米颗粒合成仪
FluidicLab微流控多通道精密压力泵
FluidicLab脂质纳米颗粒(LNP)科研级制备系统-微流控
FluidicLab玻璃/PDMS标准微流控芯片夹具
FluidicLab微流控精密压力控制器Light版
FluidicLab多通道高精密微流控压力泵/压力控制器
FluidicLab单细胞包裹/Janus微球生成微流控芯片PDMS材质
FluidicLab微流体流量传感器-热差式流量计-微流控
FluidicLab血脑屏障器官芯片
FluidicLab微流控电动旋转选通阀/切换阀
FluidicLab层流流动腔流通池flow cell
Fluidiclab数字型压力传感器/模拟型压力传感器
FluidicLab 微流控芯片|定制加工|微球液滴制备生成
FluidicLab压力传感器数据采集卡

关注
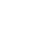
拨打电话

留言咨询