牛人施一公:刚发1篇Nature 又背靠背连发2篇Science!
导读:2016年7月22日,生命科学联合中心施一公研究组于《科学》(Science)杂志就剪接体的结构与机理研究发表两篇长文(Research Article),题目分别为《酵母剪接体激活状态3.5埃的结构》和《第一步催化反应后的酵母剪接体3.4埃的结构》。

2016年7月22日,生命科学联合中心施一公研究组于《科学》(Science)杂志就剪接体的结构与机理研究发表两篇长文(Research
Article),题目分别为《酵母剪接体激活状态3.5埃的结构》(Structure of a Yeast Activated Spliceosome at
3.5 Angstrom Resolution)和《第一步催化反应后的酵母剪接体3.4埃的结构》(Structure of a Yeast Catalytic Step I
Spliceosome at 3.4 Angstrom Resolution),报道了酿酒酵母(Saccharomyces
cerevisiae)剪接体激活和剪接反应催化过程中两个重要状态的剪接体复合物近原子分辨率的三维结构,阐明了剪接体的激活和催化机制,从而进一步揭示了前体信使RNA剪接反应(pre-mRNA
splicing,以下简称RNA剪接)的分子机理。
RNA剪接是真核生物从DNA到蛋白质信息传递中心法则的关键一环。其主要执行者是一个极其复杂的分子机器——剪接体。通过剪接反应,前体信使RNA中数量、长度不等的内含子被剔除,剩下的外显子按照特异顺序连接起来从而形成成熟的信使RNA(mRNA),进一步在核糖体的催化下被翻译成蛋白质。RNA剪接的化学本质就是前体信使RNA经历两步转酯反应完成剪和接在两个关键步骤,而每一步都需要由剪接体催化完成。
剪接体是一个由大量蛋白因子介导、核酸(RNA)催化的金属核酶(protein-directed metalloribozyme)。在剪接反应过程中,组成剪接体的蛋白质-核酸复合物及剪接因子按照高度精确的顺序进行结合和解聚,并伴随大规模的结构重组,组装成一系列具有不同组分和构象的统称为剪接体的分子机器,根据它们在RNA剪接过程中的生化性质,这些剪接体又被人为区分为B、Bact、B*、 C、P、ILS等若干状态。获取剪接体在激活及催化反应过程中不同状态的结构是最基础也是最富挑战性的结构生物学难题之一。2015年8月,施一公研究组率先突破,在世界上首次报道了裂殖酵母剪接体处于ILS状态的3.6埃高分辨率结构。
在最新发表的两篇《科学》论文中,施一公研究组进一步探索并优化了蛋白提纯方案,捕获了性质良好的酿酒酵母剪接体分别处于激活状态(activated spliceosome,又称为Bact complex)和第一步催化反应后(catalytic step I spliceosome,又称为C complex)的优质样品,并利用单颗粒冷冻电镜技术和高效的数据分类方法,重构出了总体分辨率分别为3.5和3.4埃的两个高分辨率冷冻电镜结构,并搭建了原子模型(图1,2)。这两个复合物近原子分辨率三维结构的解析,首次完整地展示了第一步转酯反应前后pre-mRNA和起催化作用的snRNA的反应状态,以及剪接体内部蛋白组分的组装情况。尤为值得一提的是,催化核心区域的分辨率达到了2.8至3.0埃,清晰的展示出剪接反应中心的结构信息,为解释剪接体对pre-mRNA splicing的催化机制提供了迄今最为清晰的关键证据。
如上两个结构与该研究组之前报道的ILS剪接体及2016年1月报道的3.8埃的酿酒酵母tri-snRNP结构的对比更为深刻的揭示了剪接体在pre-mRNA剪接反应过程中作为核酶催化完成两步转酯反应的本质,是RNA剪接研究领域的又一突破性进展。
清华大学医学院三年级博士生万蕊雪、生命学院博士后闫创业、生命学院一年级博士生白蕊为两篇文章的共同第一作者;生命学院一年级博士黄高兴宇为第二篇文章的共同第一作者;施一公为通讯作者。电镜数据采集于清华大学冷冻电镜平台,计算工作得到清华大学高性能计算平台、国家蛋白质设施实验技术中心(北京)、联想高性能计算、以及荣之联董事长王东辉先生的支持。本工作获得了北京结构生物学高精尖创新中心及国家自然科学基金委的经费支持。
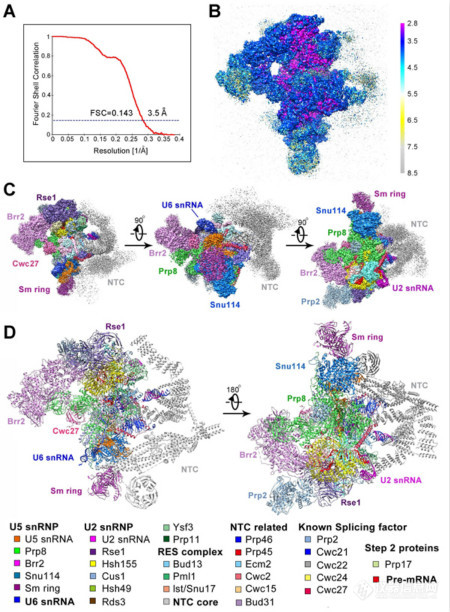
图1 Bact complex电镜密度及三维结构示意图
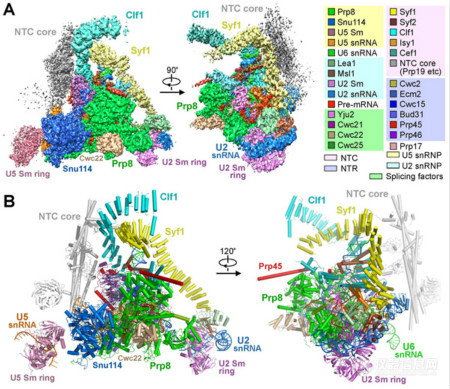
图2 C complex电镜密度及三维结构示意图
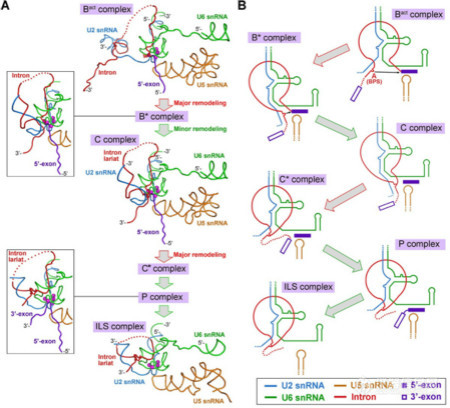
图3 剪接反应机理图解
去年研究成果被誉为“诺奖级别”
2015年8月21日,《科学》(Science)杂志同时发表了施一公教授研究组的两篇具有里程碑意义的论文,宣布得到了高分辨率的剪接体三维结构和剪接体对前体信使RNA执行剪接的基本工作机理,从而将分子生物学的“中心法则”在分子机理的研究上大幅度向前推进。
当时,施一公先生接受采访时也表示:“我此前以通讯作者身份在《科学》、《自然》和《细胞》上发表的文章总共接近50篇,但我觉得这次的意义特别重大!这项研究成果的意义很可能超过了我过去25年科研生涯中所有研究成果的总和!”
当时很多领域内顶尖科学家也认为这是过去二三十年中,中国科学家在基础生物学领域做出的最杰出成就,这项成就将得到诺贝尔奖委员会的认真考虑。因此,很多媒体都以“中国取得诺奖级研究成果”为题进行了报道。
近年学术成果丰硕,屡获大奖
近年来,施一公先生学术成果丰硕。根据Scopus数据库的统计,施一公院士这些年来总共发表了超过165篇重量级论文,其中发表在Nature、Science、Cell、PNAS和Nature子刊等全球最顶尖期刊上的顶尖论文就高达80篇。另外施一公先生2008年全职回国后,以清华大学为第一单位发表的论文就高达60篇,相比于他在国外时的成就毫不逊色甚至还完全超越。
此外,在施一公先生身上的头衔和荣誉令人难忘,除了当选为清华大学副校长,施一公先生还是美国艺术与科学院院士、美国国家科学院外籍院士和中国科学院院士,另外还是欧洲分子生物学组织外籍成员,奖项方面施一公还获得了鄂文西格青年研究家奖、国际赛克勒生物物理学奖、香港求是科技基金会杰出科学家奖、谈家桢生命科学终身成就奖、瑞典皇家科学院颁发的2014年度爱明诺夫奖等奖项,无一不是超重量级的荣誉。
相关论文链接:
http://science.sciencemag.org/content/early/2016/01/06/science.aad6466
http://science.sciencemag.org/content/early/2015/08/19/science.aac8159
http://science.sciencemag.org/content/early/2015/08/19/science.aac7629
来源于:科学网
热门评论
最新资讯
新闻专题
更多推荐