对于FDA刚批准的广谱抗癌药,必须知道这四点!
导读:2018年11月26日,FDA加速批准了TRK抑制剂Larotrectinib(商品名Vitrakvi)上市。该药物由Loxo Oncology和拜耳合作研发,用于治疗携带NTRK基因融合的晚期或转移性实体瘤的成人和儿童患者,适用癌种覆盖17种。
2018年11月26日,FDA加速批准了TRK抑制剂Larotrectinib(商品名Vitrakvi)上市。该药物由Loxo Oncology和拜耳合作研发,用于治疗携带NTRK基因融合的晚期或转移性实体瘤的成人和儿童患者,适用癌种覆盖17种。
消息一出,大伙炸开了锅:这不就是传说中包治百病的神药吗!某些自媒体更是力捧,“这是获批的第一个与肿瘤发生位置无关的广谱抗癌靶向药,具有划时代的意义!”

很遗憾,我要先泼四盆冷水。
一、不是第一个
首先,这款药并不是所谓的“第一款于肿瘤类型无关的广谱抗癌药”,人家FDA在原文里明明白白写了,是第二个。
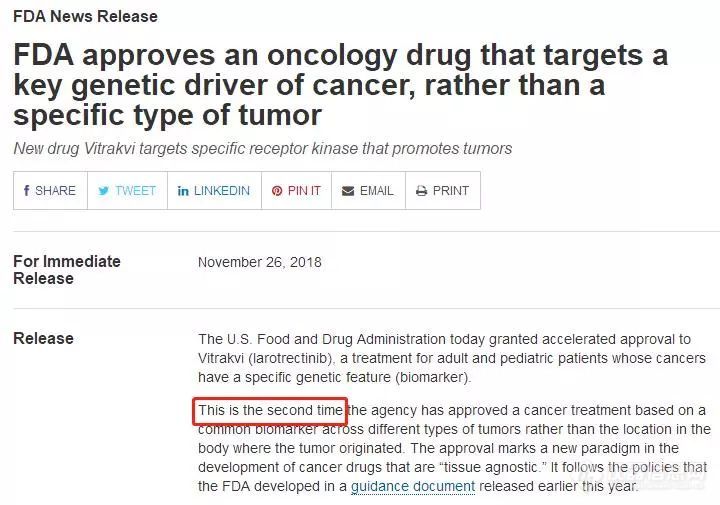
第一个是谁呢?就是《药神》里的格列卫,而目前最受关注的是PD-1/PD-L1这类广谱的免疫抗癌药。
二、使用范围比你想象得苛刻
FDA在新闻中言明,被治疗的必须是实体瘤。
什么叫实体瘤呢?就是有形状的肿瘤或癌症,像血液、淋巴系统的癌症,就不能用了。
除此之外,你还得携带一种罕见的NTRK基因融合变异。介绍它之前,我们要先了解下为什么这个药叫TRK抑制剂。
TRK,原肌球蛋白受体激酶 (tropomyosin receptor kinase) ,是调节细胞通讯和肿瘤生长的重要信号通路,而NTRK是编码TRK蛋白的基因。
在罕见情况下,NTRK基因会与其它基因融合,表达出融合蛋白成为致癌驱动因子,影响TRK信号通路正常功能,促进肿瘤的生长。而Larotrectinib正是一种被设计用来抑制这些融合蛋白的活性抑制剂。
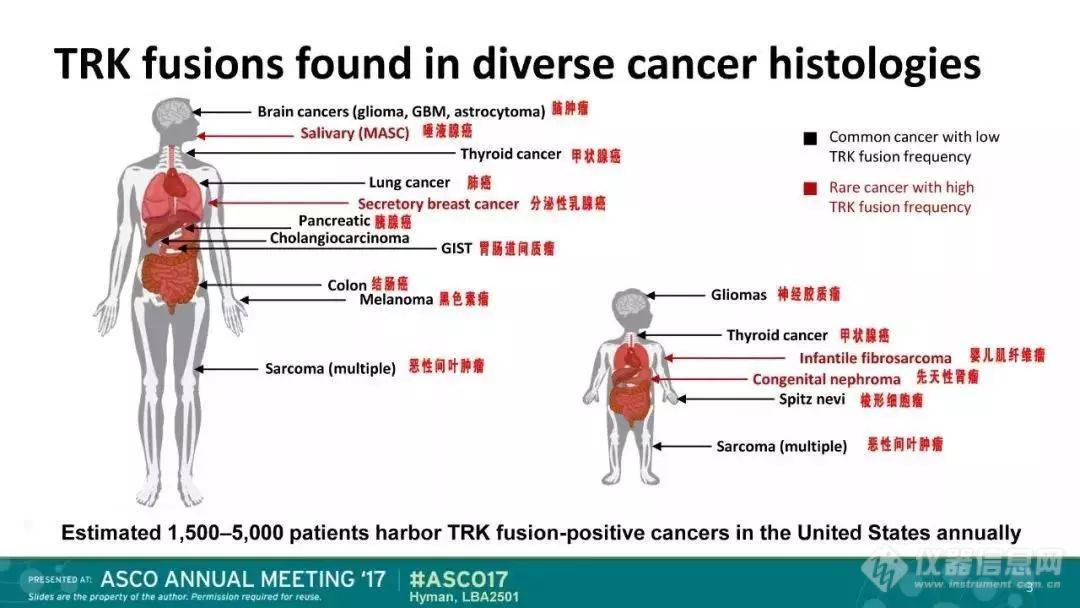
尽管Larotrectinib作用有效的这些癌种生长位置不同,但它们都有一个共同特点:携带NTRK基因融合,而且依赖这个突变基因提供生长信号。因此,它们才会都对该NTRK靶向药物产生积极响应。即只要患者携带NTRK基因融合,就可考虑使用Larotrectinib。
但是这个基因变异很罕见,受众比较窄。
根据文献表明,NTRK融合在纤维肉瘤、分泌型乳腺癌以及乳头状甲状腺癌等癌种中比例较高,而对于国内常见的肺癌和肠癌等,NTRK融合的比例比较低,不到5%。
简单来说,如果你没有这个靶子,很抱歉,这颗导弹炸不死你身上的癌细胞。
如果想要知道自身是否携带NTRK融合变异,前提是需要进行基因检测。但就算满足了这条,也不是所有的患者上来就能用。
按照适应症的规定,是有癌转移或者不能手术的,并且是没有其他治疗办法,或者是治疗后又复发的。才可以用上这个药。
另外,由于这款“抗癌神药”还未在国内上市,对于走投无路的癌症患者来说,只能借助一些国外的临床试验。
三、有效性不等于治愈率
原文说的是有效性,不是治愈率。
有效性,就是说起效了,但是效果有大有小啊。所以,在癌症治疗上,我们最关心的不是有没有效,而是能不能治好,即治愈率,也就是肿瘤完全消失的概率。
Larotrectinib的疗效在三个临床试验中进行了研究,包括了55名患有实体肿瘤的儿童和成人患者。这些患者具有已鉴定的NTRK基因融合,没有耐药突变,并且已经出现转移,或者手术无法切除。这些患者没有令人满意的其他治疗方法,或治疗后肿瘤仍然进展。
结果显示,这款药在不同类型的实体瘤中表现出75%的总缓解率。其中73%的缓解至少持续6个月,在结果分析时有39%已经持续一年或更长时间。
这里我们需要解释下,什么叫总缓解率。
部分缓解(PR):靶病灶最大径之和减少≥30%,至少维持4周。
完全缓解(CR):所有靶病灶消失,无心病灶出现,且肿瘤标志物正常,至少维持4周。
总缓解率=从第一次出现CR或PR,到第一次诊断出癌症进展(靶病灶最大径之和至少增加≥20%或出现新病灶)或复发的时间。
简单来说,75%的总缓解率是指:在Larotrectinib的治疗下,一些患者所有靶病灶消失,无新病灶出现,且肿瘤标志物正常,至少维持4周。
但是这并不等于治愈。我们说的临床治愈,需要5年之内都不复发。
所以总的来看,这个药确实是针对新靶点的创新药,但是意义并没有那么大。
FDA之所以加速批准它上市,是因为在Larotrectinib能够治疗的肿瘤中,有一些至今没有很好的治疗办法,但FDA也要求,还需要进一步的临床试验来确认Larotrectinib的临床获益。
另外,这个药还有存在一些已知的副作用。
四、几个副作用
在临床试验中,接受Larotrectinib的患者报告的常见副作用包括:疲倦、恶心、咳嗽、便秘、腹泻、头晕、呕吐以及转氨酶水平升高。
FDA建议:
在治疗的第一个月内每两周监测患者的ALT和AST肝功能检测指标,以后每月一次,或按临床指征进行监测。
孕妇或哺乳期女性不应服用Larotrectinib,因为它可能对正在发育的胎儿或新生儿造成损伤。
Larotrectinib的批准反映了使用生物标志物指导药物研发和靶向递送药物领域的重大进展。越来越多的医生将有能力让合适的患者在正确的时间获得匹配药物的治疗。
但是在宣传上,我们也希望广大媒体和自媒体,在报道医学进展时,不夸大、不歪曲,不要对患者造成误导。
参考:
https://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm626710.htm
来源于:基因谷
热门评论
最新资讯
新闻专题
更多推荐













