FDA官网发布资金缺乏、被解雇人员补偿等相关申明
导读:华尔街日报援引FDA声明称,在2019年2月8日左右,费用将用完。 FDA告诉华尔街日报,如果没有新的政府资金,那么使用这部分费用支付工资的员工将不得不被解雇。
美国部分政府关门已满一个月,在政府关门期间,由于制药公司支付了费用,FDA能够批准新药或先前批准的药物的新适应症。在缺乏联邦资金期间,也为FDA的审查过程提供了资金。然而,华尔街日报援引FDA声明称,在2019年2月8日左右,这些费用将用完。 FDA告诉华尔街日报,如果没有新的政府资金,那么使用这部分费用支付工资的员工将不得不被解雇。
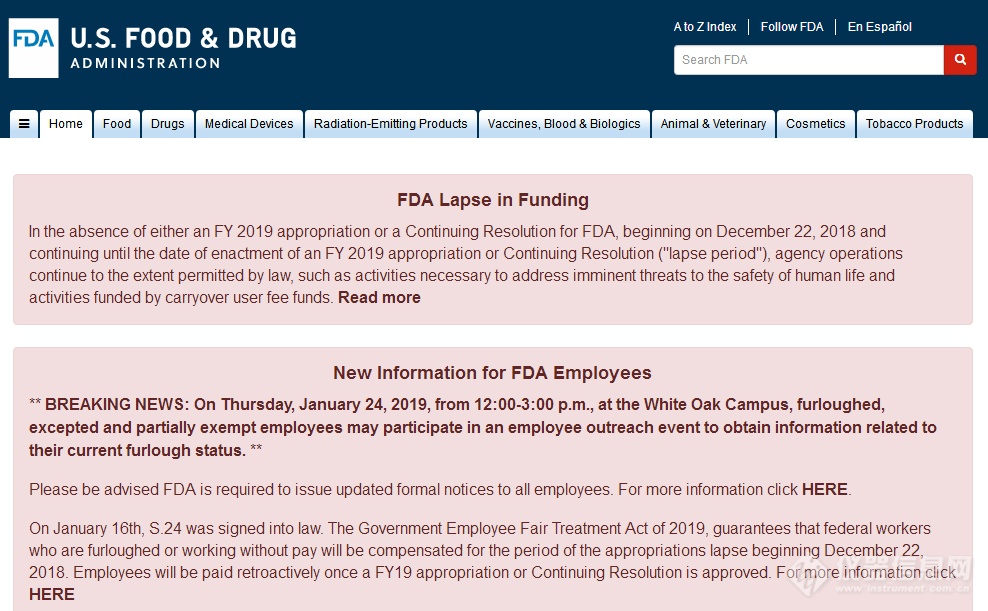
FDA官网发布资金缺乏、被解雇人员补偿等相关申明
由于多家公司有《处方药申报者付费法案(PDUFA)》规定的日期 ,如果没有解决关门问题,那么2月8日之后会有大量的药物将延迟上市。例如,Merck的重磅抑制剂Keytruda,其PDUFA日期为2月16日,该药物可作为切除的高风险III期黑色素瘤的潜在治疗方案将获得批准。 Bausch Health公司正在争取在2月15日批准Duobrii,这是一种治疗斑块状银屑病的局部治疗药物。
在政府关门期间,监管机构未能接受新药申请,也没有相关费用,其平均费用在150美元至270万美元之间。此外,FDA已暂停对用户费用来对现有研究性新药(IND)和生物制剂许可证申请(BLA)申请的审查。关门已经导致一些公司推迟预期推出他们希望FDA在2019年上半年批准或开始审查的新药物。上周,总部位于加利福尼亚州的Aimmune公布其的花生过敏药物AR101便是其中之一。Aimmune在向美国证券交易委员会提交的一份文件中表示,关门是罪魁祸首。
华尔街日报报道,在没有恢复资金供应的情况下,FDA不仅不能在2月8日之后批准新药,而且FDA用于审查药物的有效性和安全性信息的外部医生咨询委员会也将不得不取消。
资料来源:FDA User Fees Will Run out by Feb. 8, Causing Delay in Drug Approvals Unless Shutdown Ends
来源于:新药合成plus
热门评论
最新资讯
新闻专题
更多推荐












