注射剂一致性评价正式启动,你准备好了吗?
2020年5月14日,国家药监局发文“关于开展化学药品注射剂仿制药质量和疗效一致性评价工作的公告(2020年第62号)”,该公告的发布,标志着注射剂一致性评价正式拉开序幕。

图片来源:国家药品监督管理局官网
一致性评价是提升一个国家医药产业水平的一项重要举措,这将大大提高我国仿制药的整体质量,提升临床用药的有效性、安全性,也是考验企业技术实力、经济实力的主要方式,必定是我国医药产业转型、升级的重要推手。
注射剂一致性评价大事记
2017年10月
国务院发布《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,提出要在5-10年内完成注射剂的一致性评价。
2017年12月
国家食药监局药审中心发布 《已上市化学仿制药(注射剂)一致性评价技术要求(征求意见稿)》。
2019年9月
国家药监局综合司公开征求《化学药品注射剂仿制药质量和疗效一致性评价技术要求(征求意见稿)》《已上市化学药品注射剂仿制药质量和疗效一致性评价申报资料要求(征求意见稿)》意见。
2020年5月14日
国家药监局发文“关于开展化学药品注射剂仿制药质量和疗效一致性评价工作的公告(2020年第62号)”。
2020年5月14日
国家药监局药审中心发布关于《化学药品注射剂仿制药质量和疗效一致性评价技术要求》等3个文件的通告(2020年第2号)。
注射剂一致性评价研究包括参比制剂的选择、原辅包的质量研究与评估、处方及制备工艺的研究、生产工艺验证、稳定性研究、安全性评价研究等诸多方面。在这个过程中,需要建立稳定、专属性强、高灵敏度的分析方法,发现产品的关键质量属性(CQAs),以控制关键生产工艺和关键原辅料参数。
岛津作为全球知名的分析仪器供应商,以丰富的产品线和严谨的售后服务体系,致力于为客户提供技术领先的分析仪器及全面可靠的综合技术方案。每时每刻,全世界数以万计的药学科研人员从中获益。在注射剂一致性评价工作中,岛津将一如既往地提供技术支援。

一、原料药粒度和形貌
复溶时间、粒径分布等物化指标的研究是注射用粉末剂型仿制药一致性进行评价关键因素。

激光粒度仪
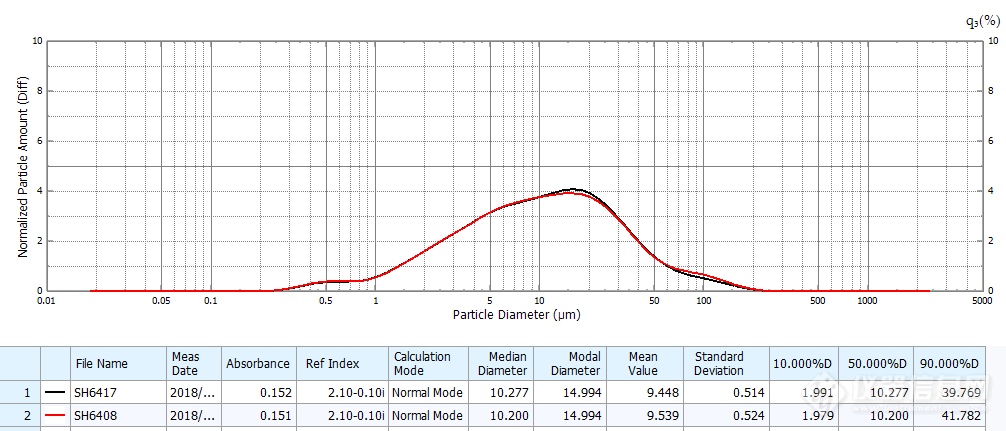
原研药粒度与分布及批间一致性
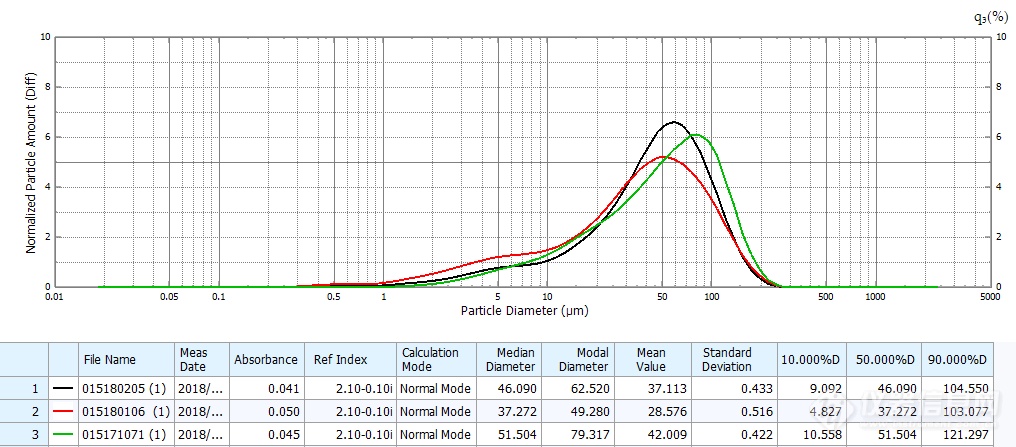
仿制药粒度与分布及批间一致性
以上结果可见两者存在明显差异:原研药分布范围宽,但呈较好的均匀正态分布,不同生产批次间粒度分布均一稳定、精密度良好;仿制药粒径明显大于原研药,以45μm左右大粒径为主,且不同批次间差异较大。

EPMA(电子探针显微分析仪)

原研药颗粒形貌观察结果 某仿制药颗粒形貌观察结果
二、未知杂质分析
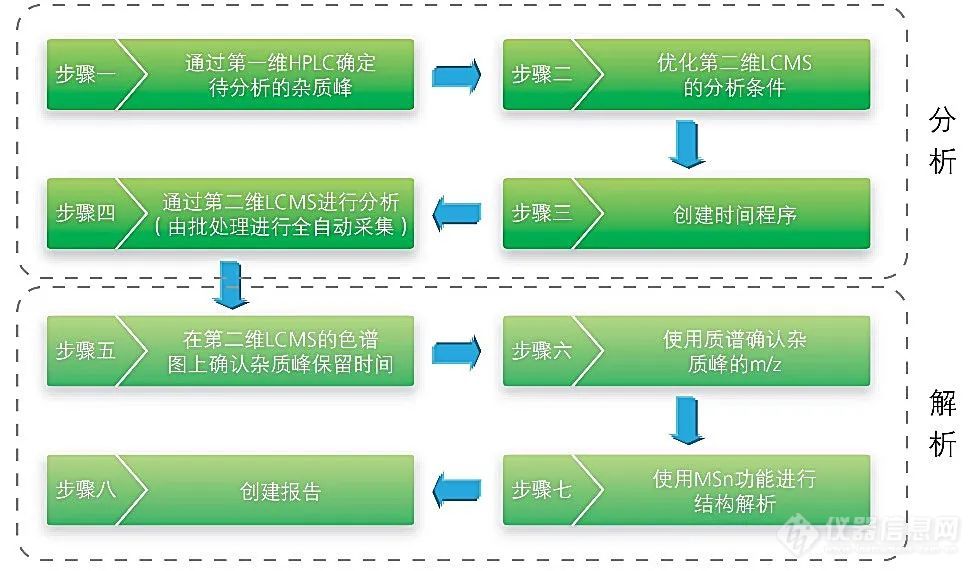
利用高分辨率、高灵敏度的LCMS-Q-TOF四极杆飞行时间串联质谱技术,可对杂质进行结构分析和确认。借助岛津公司的二维LC/LCMS-QTOF系统,即使原分析方法中使用了非挥发性缓冲盐流动相,也无需改变原有分析条件,即可开展杂质分析研究工作。
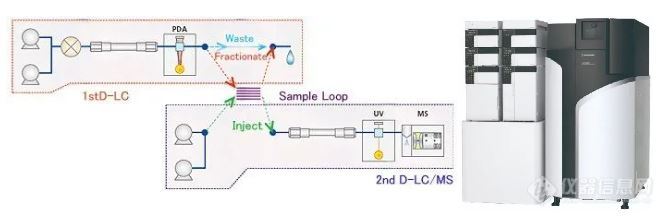
2D-LC+QTOF杂质鉴定系统
三、遗传(基因)毒性杂质
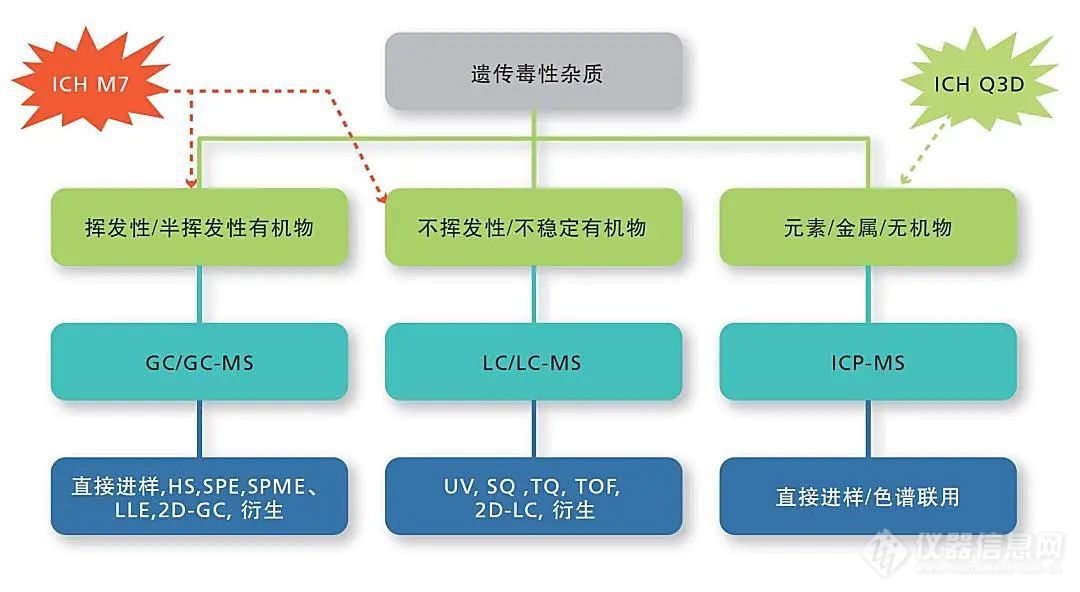
根据ICH M7通则对遗传毒性杂质的分类,NDMA和NDEA属于第一类:已知的、具有基因毒性(突变性)和致癌性的物质。岛津GC-MS和LC-MS/MS平台可以提供遗传毒性杂质NDMA、NDEA等的检测解决方案。
四、元素杂质
岛津ICPMS-2030系列完美应对ChP、USP 232/233、ICH Q3D等对元素杂质规范要求。

五、其他技术要求
1.药包材相容性研究
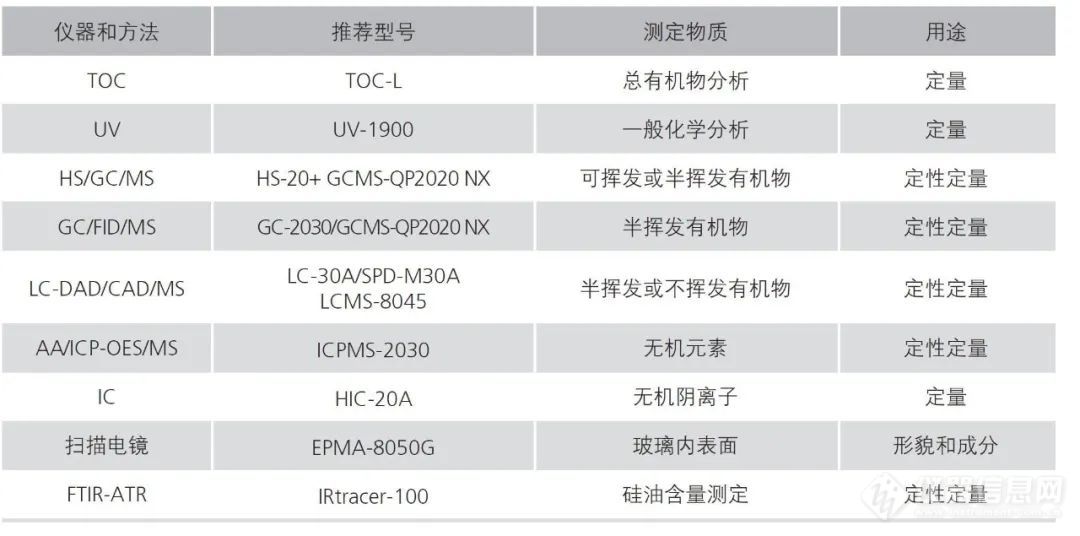
2、药用辅料:吐温检测
近年来,吐温在注射剂中的安全性愈来愈得到大家的重视,药品审评部门对其使用严格限制,岛津作为产品线齐全的分析仪器供应商,可应对以上各种药典标准检测并给出解决方案。
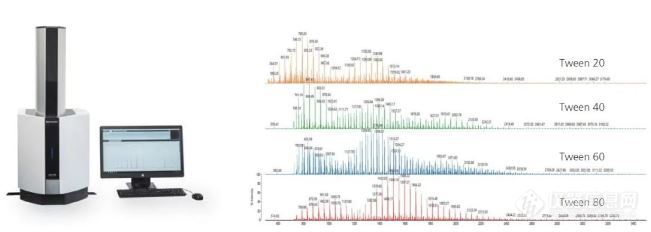
基于台式MALDI-TOF获得的聚山梨酯类化合物质谱图
来源于:岛津企业管理(中国)有限公司/岛津(香港)有限公司
热门评论
最新资讯
厂商动态
新闻专题
更多推荐













