干货科普|浅析基于质谱分析的药物靶点发现方法
导读:盘点基于质谱分析的药物靶点发现方法
药品与我们的生活密不可分。新药研发一方面关系着全人类的健康需求,另一方面也关系着国家经济与社会的发展需求。 据权威统计,单一药物上市的成本超过十亿美元,整个过程花费约十年的时间,药物筛选的失败率高达97%。但药物筛选是新药研发中至关重要的一步,确定靶标分子及筛选模型是现代新药开发的基础。它主要有两种方式,表型筛选(Phenotypic drug discovery, PDD)和靶点筛选(Target-based drug discovery,TDD)。

PDD的起点是一个化合物库或抗体库,用一个和疾病高度相关的临床前模型或者实验来筛选库中的药效,找到达到期望药效的分子再进一步优化和开发。经典的药物表型筛选更多的是基于动物疾病模型的筛选,实验选择遗传背景明确或者来源清楚的动物,例如鸡、猪、狗、猫、鼠、蛙、蛇、猴子、鱼、果蝇、线虫等。
TDD则是基于对疾病和靶点机理的理解,针对某一个和疾病机理高度相关的特定的靶点,从而有针对性的设计大分子或小分子药物的研发方式。

由于表型筛选无法提供活性化合物作用靶标信息, 因此需要利用化学蛋白组学回溯鉴定那些因与小分子药物直接发生作用而引起功能改变的蛋白质,在分子水平上系统揭示特定蛋白质的功能以及蛋白质与化学小分子的相互作用, 从而准确找到药物的作用靶点。旨在建立药物活性与细胞表型之间的联系,阐明药物的作用机理,一方面探究药物的脱靶效应和耐药性机制,提高药物发现的效率;另一方面在药物研发的早期阶段预测潜在的副作用和毒性, 从而降低药物研发失败的风险。
化学蛋白质组学研究方法的一般流程是, 先将化学探针或小分子化合物与蛋白质提取液进行共孵育,然后利用亲和层析等方法将这些蛋白质分离,再通过高灵敏度的质谱鉴定, 最后对它们做进一步的生物信息学分析。
1. 基于活性的蛋白质谱分析 (activity-based protein profiling, ABPP)
ABPP利用基于靶酶活性的特异化学小分子探针 (activity-based probes, ABPs) 来探测功能蛋白质组, 利用活性小分子探针来识别蛋白质靶点。分子探针是指能与特定的靶分子发生特异性相互作用并能被特殊方法所检测的分子。ABP 的设计通常包括两个基本组成部分:“反应基团”和“报告基团” , 一般通过碳链或者聚乙二醇链将二者连接在一起. 反应基团通常是具有独特化学结构的亲电性化学小分子, 能够选择性地与蛋白质组中某一类蛋白酶的活性中心结合, 并与其中执行重要催化功能的亲核性氨基酸发生反应, 从而将探针分子共价地标记在靶标蛋白上。
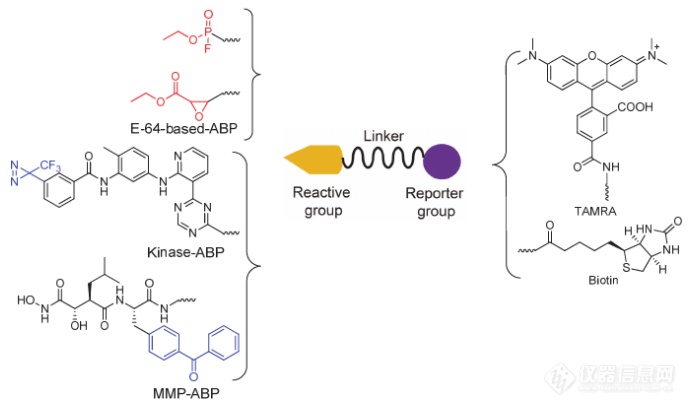
活性分子探针结构示意图
2.药物亲和致靶点稳定性(drug affinity responsive target stability,DARTS)
DARTS通过对比药物处理组与DMSO对照组蛋白质酶解片段的差异,找出酶解情况不同的蛋白质,再进行结合特异性分析,找出特异结合的靶标。
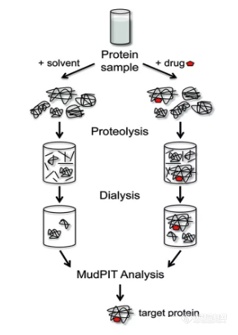
DARTS实验步骤
这种方法的优点是, 仅依靠药物和蛋白直接结合而并不需要对小分子化合物进行修饰, 从而确定出小分子的任意靶点。因此, 可采用小分子稳定其靶蛋白的结构从而导致蛋白酶抵抗, 结合质谱分析法发现未知靶点。DARTS 可将具有生物活性的天然产物提取物在分离之前就用于靶点发现,多用来研究多靶点药理学以及复方中成药物。
3.细胞热转变分析(Cellular Thermal Shift Assay,CETSA)
CETSA是一种检测细胞内药物与靶蛋白结合效率的实验,其原理是靶蛋白与药物分子结合时通常会变得稳定。即随着温度的升高,蛋白会发生降解;当蛋白结合药物后,相同温度下,未降解蛋白的量会提高,该复合蛋白的热熔曲线会右移。用溶解蛋白质的量作温度的函数可以得到蛋白质的变性曲线,由此可以确定蛋白质的变性温度点或蛋白质的熔点。CETSA实验的样品来源,可以是细胞,也可以是组织样本,检测方法主要有Western blot和MS。该技术能在天然的细胞环境中进行,也无需对目标分子和蛋白进行任何修饰以及标记。
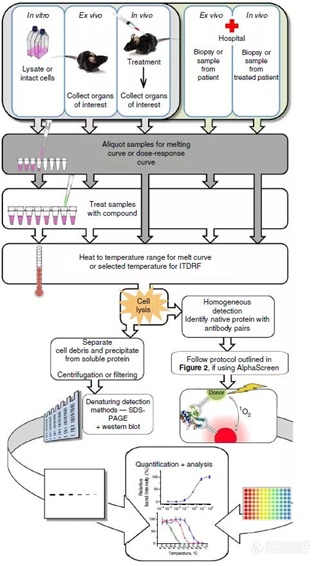
CETSA实验步骤
目前已证实该技术能识别许多已知的抗癌试剂的靶点,如在细胞裂解液、完整细胞或组织样本中均鉴定出多个药物的作用靶标。然而,CETSA方法不适用于高度不均匀的蛋白质或蛋白质配体结合域的结构展开,并不会诱导蛋白的聚集和变性的情况,如DNA和伴侣蛋白质的结合。
有研究将cellular thermal shift assay与质谱联用(MS-CETSA),可以同时监测整个蛋白质组在药物作用下蛋白质稳定性的变化,因此可以鉴定出与药物相互作用的蛋白质,而不需要预先知道药物的作用通路或机制。
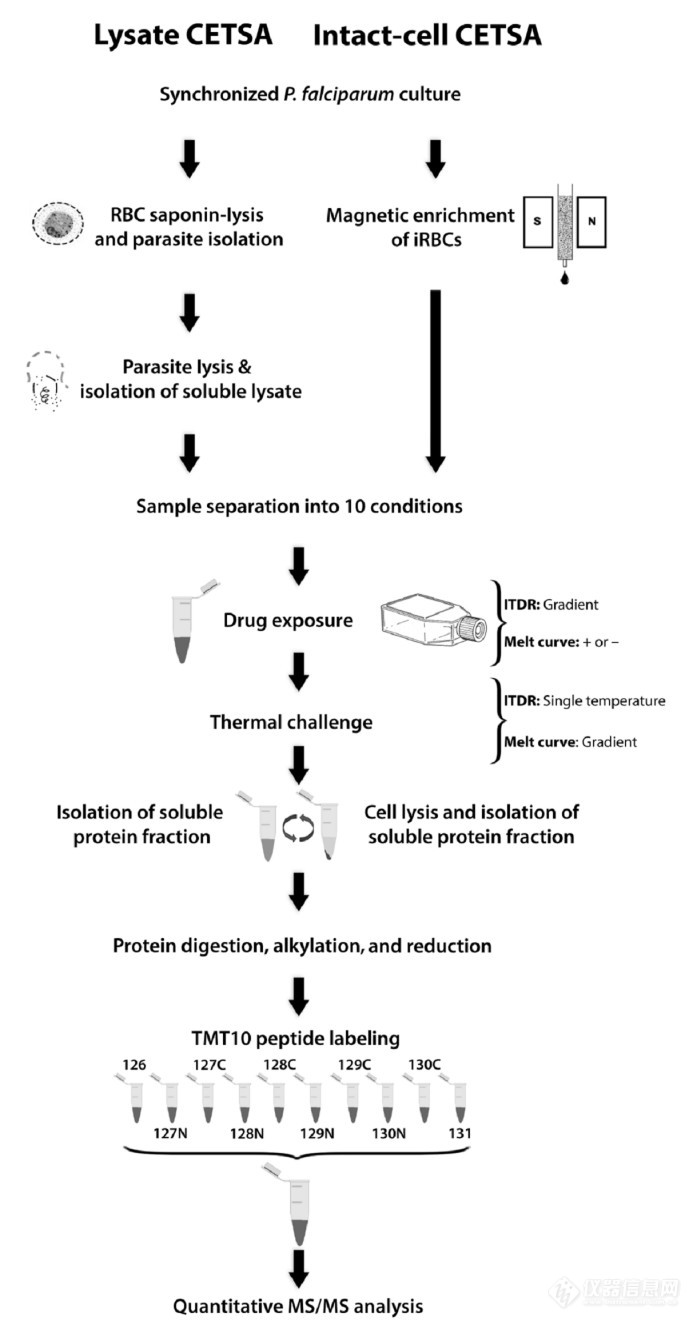
MS-CETSA流程图
4. 有限蛋白水解质谱(Limited Proteolysis-Mass Spectrometry,LiP-MS)
LiP-MS不需要对配体进行化学修饰,就可以实现在复杂的生物环境中鉴定药物靶标。实验步骤是用低浓度的非选择性蛋白酶K进行有限的蛋白水解,优先切割蛋白质暴露在外的柔性部分(环或者未折叠部分),经过变性和胰蛋白酶消化后,通过LC-MS分析肽混合物。
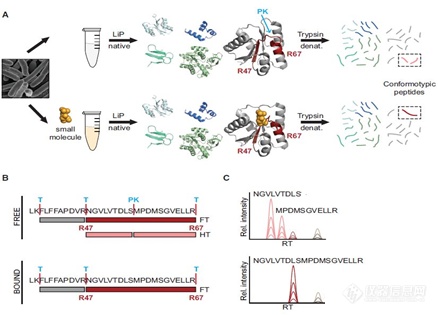
基于LiP-MS的小分子图谱
靶点的发现在整个药物研发过程中起着至关重要的作用。随着现代分子生物学技术的发展和人类基因组计划的完成,出现了大量可供治疗干预的新型分子靶点,但并不是所有的靶点都能够成为与疾病有关的有效靶点,因此对新型靶点进行发现和验证便成为非常重要的工作。
来源于:仪器信息网
热门评论
最新资讯
新闻专题
更多推荐
















