Cancer Cell | 通过单细胞基因组测序绘制肿瘤抗原图谱
导读:作者给出了有别于组织学水平和单一突变水平研究肿瘤以及肿瘤治疗的方法,也就是基于高通量单细胞全基因组测序和图谱数据分析方法。并预测,这一方法可以在预测免疫治疗靶标和临床精准抗癌方面发挥重要作用。
一个世纪之前,诺贝尔奖得主、德国化学家Paul Ehrlich 曾经说过:如果我们可以设计出特异性靶向某个病原体的化合物,那么,我们就可以在不伤害宿主的基础上杀死这一病原体【1】。多年过去了,尽管Ehrlich尝试了多种方法来寻找特异性肿瘤靶点,但精准抗癌,也就是在不伤害机体的情况下靶向杀伤肿瘤细胞这一概念,似乎仍停留在概念阶段【2】。
时隔多年,以免疫细胞修饰为基础的免疫治疗,包括抗体-药物偶联物(antibody-drug conjugates,简称ADCs)、双特异性T细胞衔接器(bispecific T cell engagers,简称BiTEs)和嵌合抗原受体T细胞(chimeric antigen receptor T cells,简称CAR-T)似乎是现今的新方向。有报道指出,靶向CD19的CAR-T疗法,可以将一些B细胞淋巴瘤的治愈率提高至43%~71%【3】,但是,有40%患者出现一定程度的神经损伤。这一“脱靶效应”很可能是由其他表达CD19的细胞类型引起的【4】。事实上,作者通过提取数目稀少的血脑屏障壁细胞,并进行全基因组单细胞测序确定,上述CAR-T疗法靶向B细胞淋巴肿瘤的同时,也会靶向这些壁细胞。这也说明,单细胞全基因组测序这一方法,不但可以预测免疫治疗的脱靶效应,还可以以数据为基础分析出特异的靶标。
2021年12月13日,来自美国斯坦福大学Caleb A. Lareau,Ansuman T. Satpathy和来自Cartography 公司的Kevin R. Parker 在Cancer cell上发表题为Charting the tumor antigen maps drawn by single-cell genomics的评论性文章,全面展示了这一研究方法。
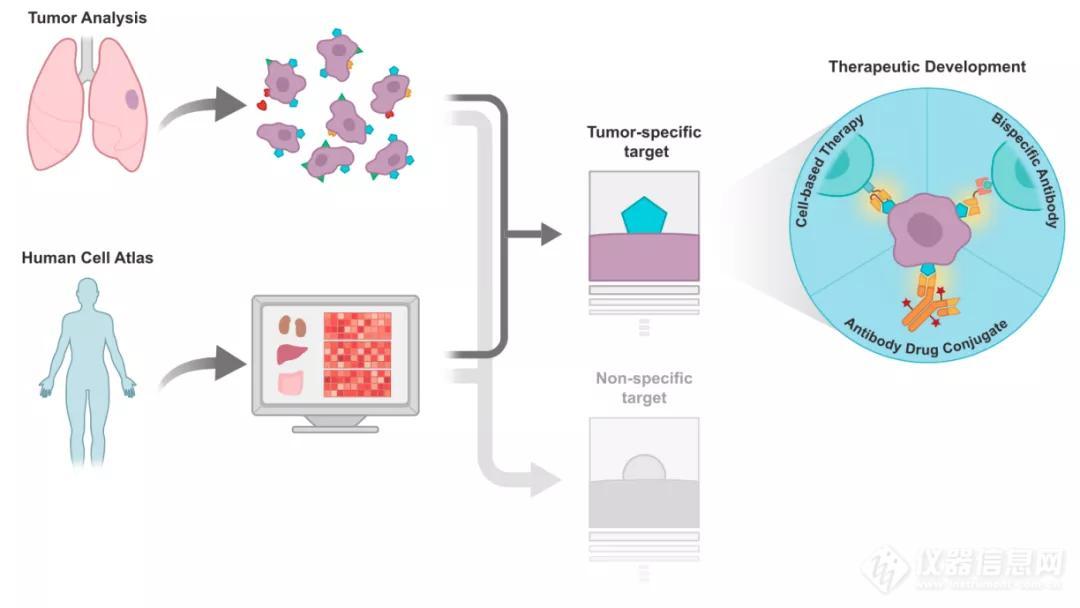
在概念上,作者认为,寻找和确定免疫治疗的靶点应该基于数据。下图展示了通过结合大尺度但细胞图谱和特定肿瘤分析来确定抗原靶点。高通量的单细胞全基因组测序数据库可以提供肿瘤细胞抗原的潜在靶点以及这些靶点是否存在于其他细胞上。
接下来,作者阐述了目前精准抗癌的现状和存在的问题。
首先,目前在临床上精准抗癌的靶点主要有三类:一是在肿瘤细胞和正常体细胞上同时表达的细胞特异性标签,比如上述针对B细胞的CD19。这一类目前应用最为广泛,并且,如果其对应的体细胞不算十分重要的话,这一诊疗方案可以说是行之有效;二是与正常体细胞相比,在肿瘤细胞上过表达的分子,比如HER2。靶向这类分子可以使得杀伤作用更为精准和强大,并且,其过表达程度,还可以表征肿瘤发展水平;三是特异性表达在肿瘤细胞上的分子,比如1997年发现的NY-ESO-1【5】。当然,高通量基因组学数据库显示这一分子还表达在免疫豁免器官和组织,比如睾丸和胎盘。这也就是说,仅通过传统手段来确定表达靶标分子的细胞类型不够精确,还需要高通量单细胞基因组数据库来进行有力补充。
其次,上述数据库可以用来预测和减低免疫治疗的脱靶效应所带来的细胞毒性。如上述靶向CD19治疗B细胞淋巴瘤案例所示,免疫治疗常常会出现脱靶效应。虽然研究脱靶效应对病人的副作用这方面至关重要,但是从单细胞基因组学分析来确定特定免疫疗法对正常体细胞的影响也十分必要。
接下来,作者表明,单细胞全基因组测序这一方法也适用于表达量十分稀少的细胞类型,比如CD4+T细胞,CD4的RNA水平很低,但是蛋白质水平却很高,这一类分子需要高通量数据库进行修正。
最后,作者提出了单细胞全基因组测序所面临的挑战:一是如何界定某一类型细胞重要与否,并且,随年龄、性别等影响,其重要性是否有所区别。二是如何确定一标准,使得某分子在肿瘤细胞与体细胞的表达量超过这一标准,才可以认定为是潜在靶标。三是影响抗原表达水平的因素都有什么。最后,理论上可行的靶标在临床上也可能出现各类未知问题。
综上所述,作者给出了有别于组织学水平和单一突变水平研究肿瘤以及肿瘤治疗的方法,也就是基于高通量单细胞全基因组测序和图谱数据分析方法。并预测,这一方法可以在预测免疫治疗靶标和临床精准抗癌方面发挥重要作用。
原文链接:
https://doi.org/10.1016/j.ccell.2021.11.005
来源于:BioArt
热门评论
最新资讯
新闻专题
更多推荐