Nature子刊:尹鹏团队发明质谱流式信号放大技术,大幅提高单细胞及空间蛋白表位分析灵敏度
进入 #2024流式细胞朋友圈阅读更多话题内容
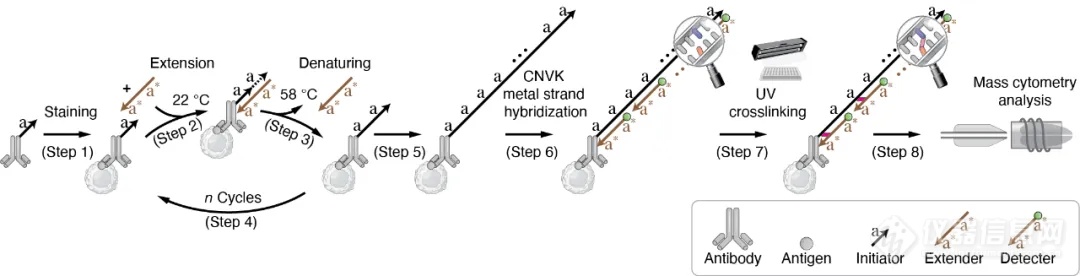
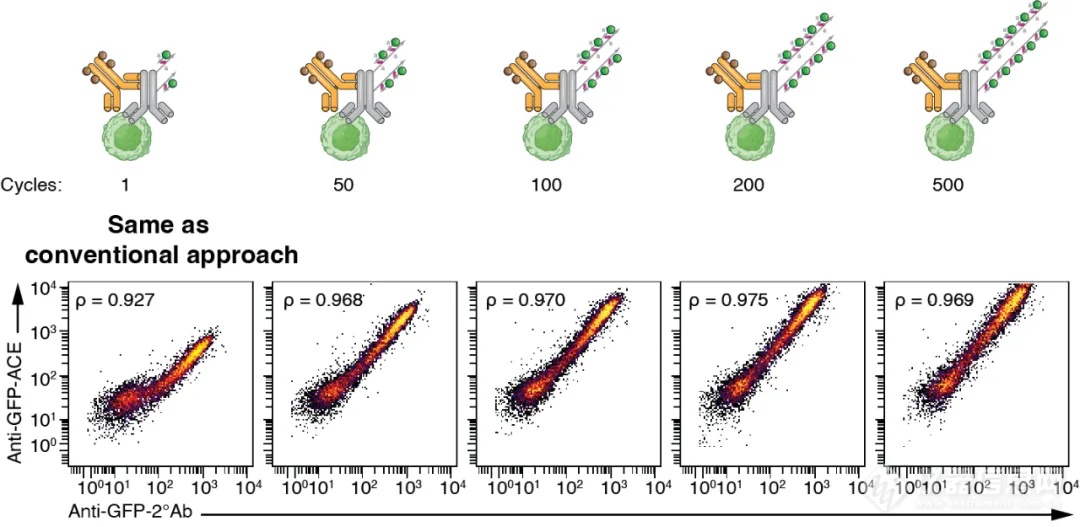
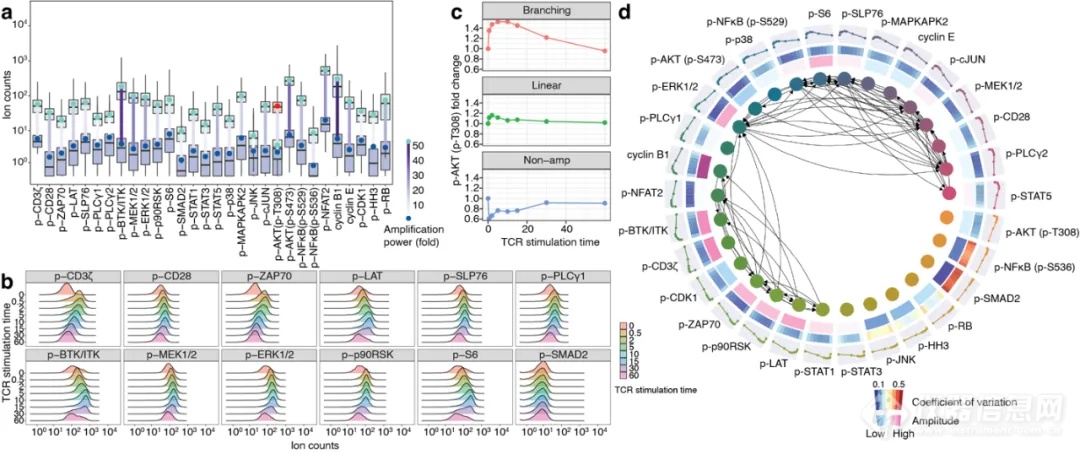
导读:哈佛尹鹏教授团队开发ACE技术,通过循环延伸扩增高效放大质谱流式信号,解决灵敏度瓶颈,大幅提升低丰度蛋白检测灵敏度与准确性,适用于悬浮与成像质谱流式,应用于单细胞蛋白组分析,促进生物医学研究。

来源于:生物世界
热门评论
最新资讯
新闻专题
更多推荐
写评论…
0
进入 #2024流式细胞朋友圈阅读更多话题内容
导读:哈佛尹鹏教授团队开发ACE技术,通过循环延伸扩增高效放大质谱流式信号,解决灵敏度瓶颈,大幅提升低丰度蛋白检测灵敏度与准确性,适用于悬浮与成像质谱流式,应用于单细胞蛋白组分析,促进生物医学研究。




来源于:生物世界
热门评论
最新资讯
新闻专题
更多推荐