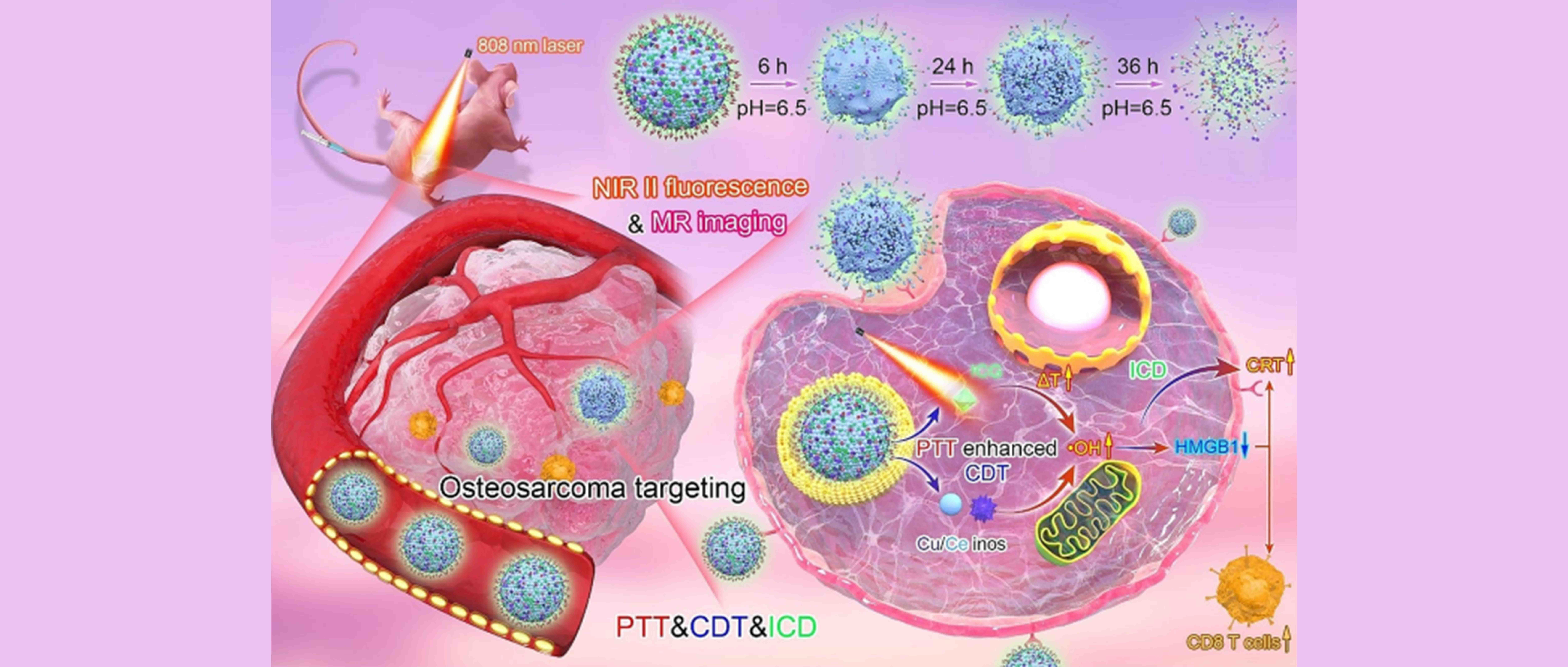
通过具有稳定开启和轻推锁定策略的通用化学平台开发可激活的双模态 NIR-II 探针
本文要点:NIR-II区域的可激活近红外(NIR)成像对于深层组织生物分析物追踪至关重要。然而,由于通用化学策略的可用性有限,设计此类探针仍然具有挑战性。本文介绍了一个可激活探针的基础平台,使用分析物触发的智能调制NIR-II发射的罗丹明杂交体的π偶联系统。通过调整邻羧基部分的亲核性,实现了一种称为“坚定推动打开和光推动锁定”的电子效应,这使得探针在感应之前能够完全螺旋环化,并且当轻推动苯胺氨基甲酸酯触发器转化为坚定推动的苯胺时,可以有效地形成两性离子。该平台在活小鼠中产生具有~50倍荧光和可激活光声信号的双模态NIR-II成像探针,超过了已报道的可激活信号通常低于10倍的探针。为了证明通用性,成功地设计了用于过氧化氢(H2O2)和硫化氢(H2S)的探针。本文设想广泛采用化学平台,在各种应用中设计可激活的NIR-II探针。
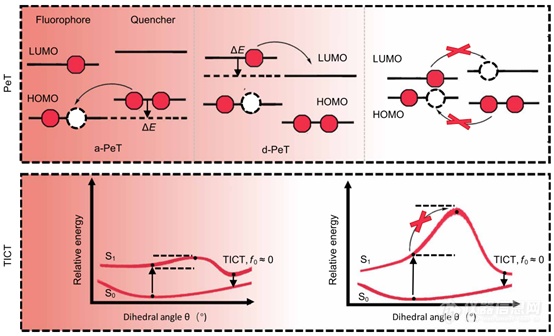
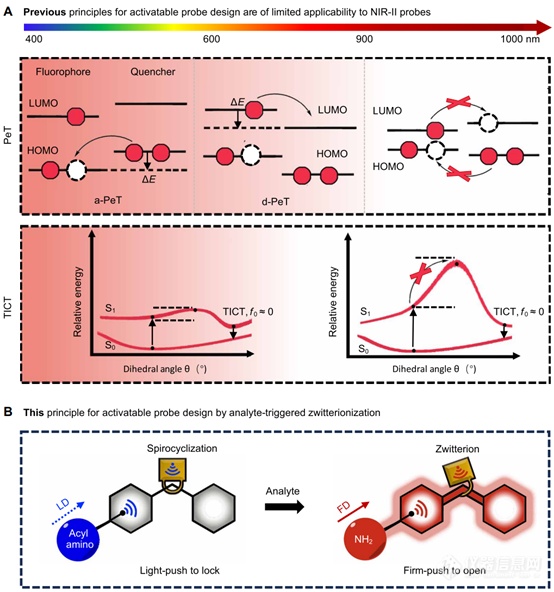
图1. 荧光调谐策略
本文探讨了各种邻羧基团如何影响一对CS NIR衍生物的平衡:一个具有NHBoc,另一个具有NH2取代基位于荧光团的 C5 位置,模拟基于反应的探针在感应其生物靶标之前和之后的行为(图 1B)。我们的研究揭示了C5取代基的供电子能力与邻羧基部分的亲核性之间的协同作用。这导致了理想匹配的电子效应的鉴定,本文称之为“稳定的开启和光推锁定”(FOLL),表示 NHBoc 取代基诱导的螺旋环化在感应和 NH2 之前感应后的取代基诱导两性离子,假设理想匹配的邻羧基部分已经到位。通过FOLL,在基于溶液和细胞的成像实验中观察到~50倍的荧光响应。
将FOLL效应转化为优化的罗丹明杂交体,其最大发射波长(920 nm)落入NIR-II窗口,本文建立了一个通用化学平台,用于在活小鼠(SBR~50)中设计具有最小背景和超荧光信号的NIR-II探针。此外,该化学平台中的这种螺旋环化-两性离子平衡机制促进了其在可激活光声成像中的应用。作为验证,作者成功开发了使用此平台进行探测H2O2的探针。这使得内源性H2O2的荧光和可激活光声成像成为可能。活细胞和活小鼠的背景信号几乎为零,证明了该平台的可靠性。该平台的潜在通用性也体现在成功构建 H2S 探针。
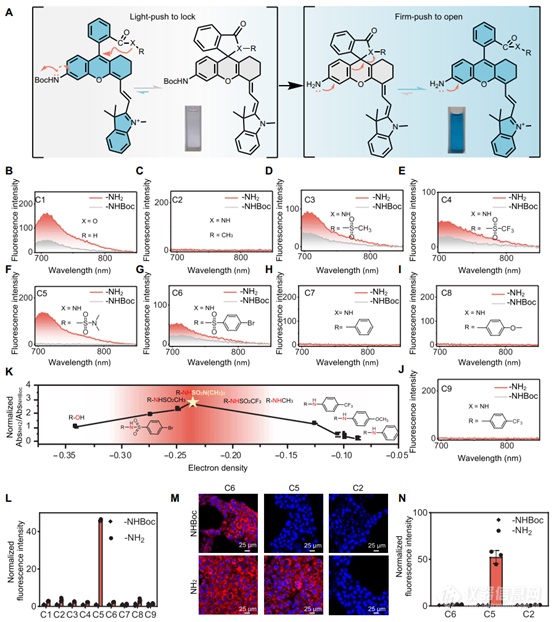
图2. 调整邻羧基部分以获得有效的 FOLL 效果
本文使用 CS NIR 荧光团作为模型开始研究,因为它易于合成。鉴于分析物触发的从苯基氨基甲酸酯到苯胺的转化在检测酶活性、反应性代谢物或金属离子方面的广泛适用性,作者战略性地将两种取代基引入荧光团的 C5 位置:无电子供体 NHBoc 基团和提供 NH2 的电子组(图 2A)。该做法的目标有两个:(i)模拟探针在感测目标之前和之后的结构变化,以及(ii)模拟荧光团核心在感应前后的不同亲电性。目标是确定一种邻位羧基部分,该部分有利于 NHBoc 取代结构的最大螺旋环化(“轻推锁定”效应)和 NH2- 的最大两性离子形成替代对应物(“坚定推动打开”效应)。
作者最初合成了以羧酸为邻羧基部分的 C1 化合物(图 2B)。荧光光谱测量显示,NHBoc-C1在近红外范围内有中等背景信号,表明螺旋环化效率低下,其在该范围内的显着吸收进一步支持了这一点。这与羧酸有限的亲核性一致。为了增强螺环化倾向,将羧酸基团转化为亲核性更强的N-甲基酰胺。虽然这种转变完全消除了 NHBoc-C2 近红外范围内的背景荧光,但它阻碍了 NH2- 中两性离子的形成由于N-甲基酰胺的高亲核性而取代的对应物(图2C)。
然后,通过降低氮原子的电子密度或增加其周围的空间效应来微调酰胺基团的亲核性。这导致了另外七对化合物(C3至C9)的合成,并记录了它们的荧光光谱(图2,D至J)。由于传统罗丹明的螺环化-两性离子平衡对pH变化敏感,我们使用pH 7.4下NH2/NHBoc对的近红外吸收强度比作为两性和螺环形式之间探针平衡变化的粗略估计(图2K和图S15),并通过高斯计算将这些数据与酰胺氮原子的计算电子密度相关联(图S16和表S2)(48),间接测量了亲核性。如图2K所示,具有最低和最高亲核性的羧基团都具有较低的信噪比。由于螺旋环化有限,较差的亲核试剂无法有效抑制NHBoc取代结构中的背景信号,而强亲核试剂无法在NH2-中实现灵敏的荧光信号由于两性离子形成有限而取代的结构。在测试的化合物中,C5对具有邻羧基部分作为酰基磺酰胺的C5对表现出最明显的可激活荧光(图2L),NH2与NHBoc-C5相比,-C5的量子产率增加了7倍。
为了进一步验证 FOLL 效应诱导的高 SBR 的功效,作者用三对化合物(C2、C5 和 C6)对活细胞进行染色,其中 NHBoc 取代的化合物代表感应前的探针,而 NH2-取代化合物代表感应后的探针。用 C6 对结构染色的细胞表现出均匀的强荧光,与 NHBoc-C6 相比,仅观察到 NH 2-C6的 1.5 倍信号适度增加。相反,用C2对化合物染色的细胞保持非荧光,与光谱测量一致。正如预期的那样,用 C5 对化合物染色的细胞表现出异常的荧光反应,NHBoc-C5 显示几乎为零的背景信号和 NH2-C5 表现出明显的荧光(~50 倍)(图 2、M 和 N )。这些发现进一步验证了作者的FOLL策略在设计高荧光探针方面的成功。
在确定了合适的邻羧基团后,我们的下一个目标是优化罗丹明杂化聚甲基染料的荧光特性。我们的策略包括探索硫取代和共轭延伸,以设计具有NIR-II发射的荧光团。我们设计了四种结构,并通过Knoevenagel反应合成了它们(图3A)。在检查它们的吸收、荧光和光声光谱(图3,B至I)后,很明显,D4表现出最多的红移吸收、发射和光声信号。D4 表现出超出 900 nm 范围的尾状吸收和巨大的光声强度。鉴于 D4 在 C5 位置具有羟基取代基,选择D4作为候选荧光团,用于构建用于设计荧光探针的通用化学平台。
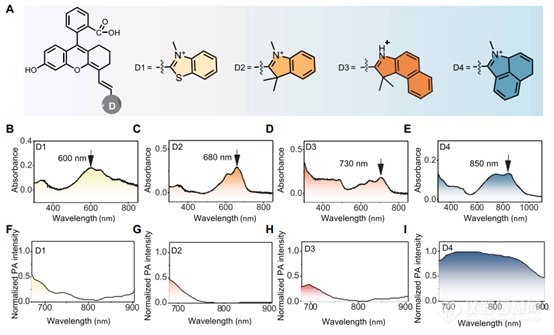
图3. 调整罗丹明杂化聚亚甲基染料的NIR-II发射
作者的下一步是评估 C5 中酰基磺酰胺的亲核性与苯胺衍生的 D4 荧光团的相容性。合成了化合物 NHBoc-D4 和 NH2-D4,掺入邻酰基磺酰胺部分(图4A)。通过比较这对化合物的吸收和荧光光谱,我们发现FOLL效应在该荧光基团中表现出比CS NIR荧光团更大的功效。如图4(B和C)所示,NHBoc-D4在近红外范围内的吸收和发射几乎为零,而NH2-D4 在此范围内表现出强烈的吸收和荧光。
作者进一步验证了这对结构在活细胞和活小鼠中的显着成像对比度。用 NHBoc-D4 染色的细胞没有可见荧光,而用 NH2-D4 染色的细胞显示明显的荧光;并观察到~28倍的荧光信号(图4,D和E)。同样,在将探针注射到活小鼠肿瘤中后,在 NHBoc-D4 组中没有观察到信号,而 NH2-D4组表现出明显的信号(~50倍)(图4,F和G)。作者观察到,在静脉给药时,NH2-D4 显示全身分布曲线。在处死小鼠并使用NIR-II成像系统检查各种器官后,在NHBoc-D4组的器官中未检测到可辨别的荧光信号。相比之下,来自 NH 2-D4的所有器官组表现出明显的信号,其中肝脏的信号最为突出。两组之间的对比在不同器官中有所不同,这归因于探针的局部浓度不同。
鉴于 NHBoc-D4 和 NH 之间的近红外吸收形成鲜明对比2-D4,在肿瘤内施用探针时对小鼠进行了光声扫描。横截面图像显示NHBoc-D4组没有信号,而NH2-D4组表现出明显的信号(~50倍)(图4,H和I),与荧光成像观察到的结果一致。
总之,这些数据表明,NH2-D4应通过转化为相应的氨基甲酸酯,成为构建高荧光NIR-II探针的理想化学平台。此外,可以同时实现可激活的光声成像。值得注意的是,在磷酸盐缓冲盐水(PBS)中100μM的NH2-D4对20当量的高氧化物种如ONOO-和NaClO的处理是稳定的。这些发现强调了这种化学平台在广泛的生物应用中的多功能性和潜力。
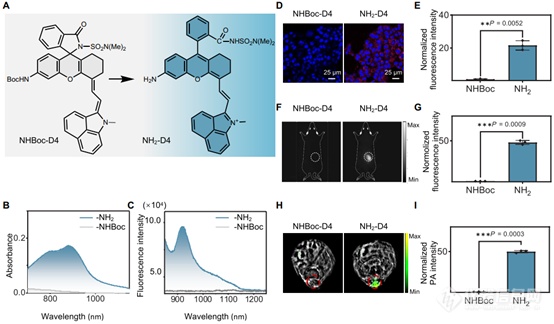
图4. 开发用于荧光NIR-II成像的化学平台
苯硼酸酯部分作为感测H2O2的化学触发器有着悠久的历史。因此,我们将NH2-D4荧光团转化为硼苯氧基氨基甲酸酯。该探针被标记为H2O2-D4(图5A),测试了其对H2O2的反应。H2O2-D4显示出以500nm为中心的最大吸收带,表明其以螺环形式存在。与H2O2相互作用后,以500nm为主的吸光度降低,同时出现了以790和900nm为中心的两个相邻峰(图5B)。这一转变表明H2O2触发了两性离子的形成。值得注意的是,吸光度的减少和增加都与施加的H2O2剂量成正比(图5C)。动态记录表明,H2O2与H2O2-D4的传感在1小时内完成(图5C)。液相色谱-质谱(LC-MS)分析进一步证实了这一观察结果(图5E),显示H2O2-D4在与H2O2相互作用1小时内完全转化为NH2-D4。在不同的生物相关pH水平下进行了传感反应(图5F)。观察到探针在测试的pH值水平下保持黑暗。然而,H2O2相互作用后的传感信号随着pH值的增加而增强。由于我们已经证实NH2-D4的螺环化两性离子平衡对pH不敏感,这一观察结果归因于在更碱性的条件下,探针更有效地转化为NH2-D4,这是由H2O2的反应性增强和自焚连接体的加速切割共同驱动的。此外,证实了探针对H2O2的高选择性,因为其他反应性物质对其吸收几乎没有变化(图5D)。同样,在与H2O2相互作用时,观察到探针的高度荧光反应(图5,G和H)。值得注意的是,由于螺环化在NIR-II区域诱导了有效的荧光淬灭,通过补充材料中详述的3SB/K方法,H2O2-D4可以实现7.0 nM的H2O2检测限。
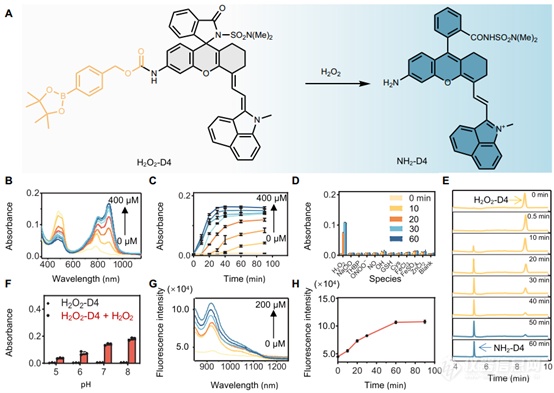
图5. H2O2型可激活探针验证研究
在成功评估了探针在基于水溶液的测定中对 H2O2 的性能,并确认了其在培养细胞(图S28)和小鼠(图 S29)中的安全性之后,我们的下一步是使用该探针对生物样品中的H2O2 进行成像。我们首先用不同浓度的H2O2 刺激培养细胞 3 小时,以诱导急性氧化应激。随后,清洗细胞,用 H2O2-D4 染色,然后进行成像。观察到细胞荧光随着 H2O2浓度的变化而呈剂量依赖性增加(图 6、A 和 B)。值得注意的是,与阴性对照组相比,在存在 H2O2(1.0 mM)的情况下,细胞探针荧光增加了约 15 倍。将研究扩展到另一种涉及百草枯诱导的急性氧化应激的模型。在这种设置中,细胞最初用不同浓度的百草枯处理 3 小时,然后清洗、用探针染色,然后成像。与 H2O2处理组类似,我们观察到细胞探针荧光随着百草枯浓度的变化而呈剂量依赖性增加(图 6、C 和 D)。总的来说,这些结果表明 H2O2-D4能够通过其荧光信号评估细胞氧化应激水平的程度,从而为监测活细胞中的氧化应激动态提供了有价值的工具。
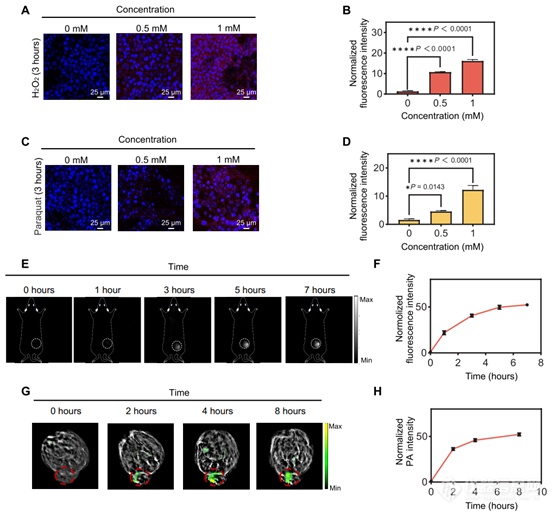
图6. 活细胞和小鼠中的 H2O2 可激活成像
基于细胞研究中获得的有希望的结果,我们继续评估H2O2-D4在异种移植4T1肿瘤小鼠模型中成像H2O2的可行性。然后,进行实时NIR-II荧光成像,以监测和量化活体小鼠肿瘤内注射探针后H2O2激活探针荧光信号的增强(图6E)。记录7小时后,肿瘤部位的NIR-II荧光大约比背景高50倍(图6F),这代表了有史以来最高的SBR。此外,作者还探讨了该探针在H2O2可激活光声成像中的适用性。与NIR-II荧光成像结果类似,观察到小鼠肿瘤部位光声信号随时间增加,几乎没有背景信号干扰,8小时后SBR达到50(图6,G和H)。
受H2O2-D4成功应用的鼓舞,我们开始探索设计可激活NIR-II探针的化学平台的普遍适用性。其中一个重要的目标分子是H2S,它是生命系统中的内源性气体信号分子,在多种生理过程中起着关键作用。通过将H2S响应触发器引入NH2-D4荧光团,开发了H2S传感探针,表示为H2S-D4(图7A)。
作者的初步研究旨在评估探针对水溶液中H2S的传感性能。吸收光谱显示,H2S-D4在近红外范围内没有表现出明显的吸收(图7B),表明更倾向于螺环形式。然而,在暴露于H2S后,作者观察到近红外吸收的剂量依赖性增强,表明向两性离子形式的转变。这种转变也被发现与孵育时间有关(图7C)。此外,作者证实了探针对H2S的高选择性(图7D),与报道的苯基叠氮化物部分对H2S的选择性一致。与吸收分析平行,荧光光谱测量表明探针对H2S有显著的荧光反应(图7E),检测限确定为23 nM。使用了高效液相色谱(HPLC)分析,为H2S触发的氨基甲酸酯探针转化为NH2-D4荧光团(图7F和)。
细胞首先用NaHS(1 mM)作为H2S供体处理3小时,进行H2S-D4染色(5μM)不同时间,然后成像。结果显示,染色时间依赖性细胞探针荧光增强(图7、G和H),表明细胞H2S-D4持续转化为NH2-D4。在另一个实验中,细胞用不同剂量的NaHS(0、0.5和1 mM)处理3小时,然后用H2S-D4孵育90分钟,然后成像。细胞探针荧光信号以NaHS剂量依赖的方式增强,表明其能够对活细胞中不同的H2S浓度做出反应(图7、I和J)。这一结果表明,探针H2S-D4对内源性H2S生成的成像足够敏感。
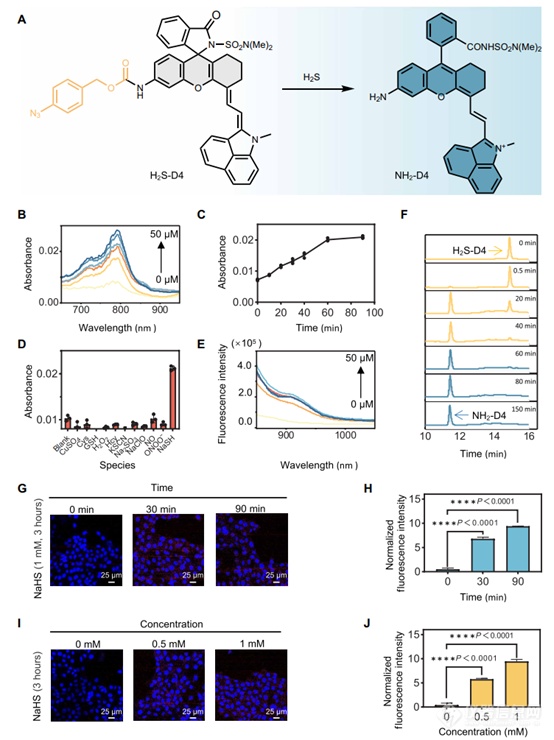
图7. 用于成像H2S的可激活探针
本文通过结合分析物触发的电子效应与邻羧基部分的亲核性进行了系统研究。使用罗丹明杂交物作为模型化合物,使用 5-NHBoc 取代的衍生物在感应生物靶标之前模拟探针,使用 5-NH2–感应后代表产品的替代对应物。通过仔细调整正羧基部分,确定了一种理想匹配的电子效应——用力推动打开,轻推锁定。这种效应确保了探针在感应前的最佳螺旋环化和感应后的最大两性离子特性。
此外,通过结构改性来改进混合物的发射特性,我们确定了NH2-D4 作为具有 NIR-II 区域发射能力的荧光团。选定的邻羧基团完美地补充了该荧光团。虽然 NHBoc-D4 表现出可忽略不计的 NIR 吸收,这意味着完全螺旋环化,但 NH2-D4显示出大量的近红外吸收率。小鼠活体成像证实了NH2-D4与 NHBoc-D4 相比的高荧光和可激活光声信号。
最后,验证了 NH2-D4 荧光团作为 NIR-II 范围内可激活光学探针的直接设计的化学平台的适用性和通用性。我们通过将 NH2-D4 中的胺基简单地衍生为相应的 H2O2或 H2S 响应氨基甲酸酯,成功开发了超灵敏的荧光 NIR-II 探针。还发现这些探针与可激活光声成像兼容。此外,还实现了小鼠肿瘤组织或受损肝脏的活体成像。因此,该平台代表了一种设计可激活 NIR-II 探针的直接方法,可在 NIR-II 光谱中实现双模态成像。
参考文献
Lili Shen et al., A firm-push-to-open and light-push-to-lock strategy for a general chemical platform to develop activatable dual-modality NIR-II probes. Sci. Adv.10,eado2037 (2024).
⭐️ ⭐️ ⭐️
动物活体荧光成像系统 - MARS
In Vivo Imaging System
有不同型号的样机可以测试,
请联系:021-61620699
⭐️ ⭐️ ⭐️
恒光智影
上海恒光智影医疗科技有限公司,被评为“国家高新技术企业”,荣获“科技部重大仪器专项立项项目”,上海市“科技创新行动计划”科学仪器领域立项单位。
恒光智影,致力于为生物医学、临床前和临床应用等相关领域的研究提供先进的、一体化的成像解决方案。
专注动物活体成像技术,成像范围覆盖 400-1700 nm,同时可整合CT, X-ray,超声,光声,光热成像等技术。
可为肿瘤药理、神经药理、心血管药理、大分子药代动力学等一系列学科的科研人员提供清晰的成像效果,为用户提供前沿的生物医药与科学仪器服务。
地址:上海市浦东新区张江高科碧波路456号 B403-3室
网址:www.atmsii.com
邮箱:liupq@atmsii.com
电话:137 6102 1531 (同微信)
来源于:上海恒光智影医疗科技有限公司
热门评论
最新资讯
厂商动态
新闻专题