斯坦福大学揭示弓形虫运动新视角!
导读:新研究揭示弓形虫滑行运动机制,通过自我组织理论模型,解释其多样滑行行为,发现F-肌动蛋白流动受肌球蛋白与自我组织影响,为寄生虫运动理解与疾病治疗提供基础。
【研究背景】
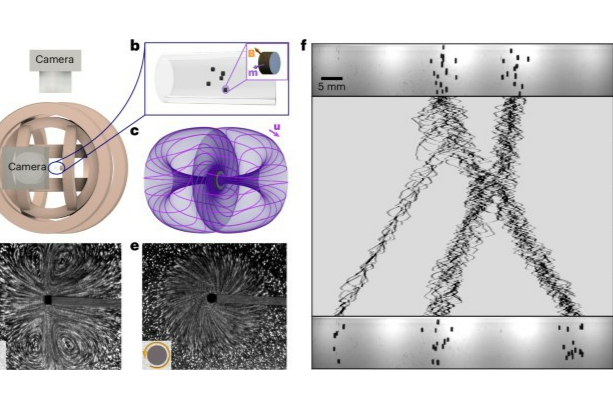
弓形虫(Toxoplasma gondii)是一种广泛传播的单细胞寄生虫,因其在医学和生物学等领域的重要性而受到广泛关注。弓形虫的运动机制与传统的细胞运动方式有着显著的区别,特别是其独特的滑行运动。滑行是通过一种称为丝状(F)-肌动蛋白的细胞骨架结构实现的,该结构在寄生虫的质膜与内膜复合体(IMC)之间形成一层薄薄的流动层。这一机制使得弓形虫能够在宿主细胞和细胞外基质中高效移动,具有灵活的运动能力,如螺旋滑行、圆形滑行和旋转运动等。
与传统的依赖纤毛游动或细胞形状变化的运动方式相比,弓形虫的滑行运动具有更高的速度和适应性。然而,这种滑行机制仍面临一些挑战,例如如何有效地控制和调节肌动蛋白的流动,以适应不同的运动模式。此外,现有的研究未能全面解释弓形虫的多样化滑行行为背后的分子机制,这给研究者带来了新的挑战。
近日,来自美国斯坦福大学Alexander R. Dunn课题组的Christina L. Hueschen等研究人员在弓形虫的滑行运动机制研究中取得了新进展。该团队通过自我组织的理论框架,设计并构建了一种新的F-肌动蛋白流动模型,成功实现了对弓形虫不同滑行模式的解释。利用这种新模型,该团队显著提高了对F-肌动蛋白流动特性的理解,成功获取了能够解释弓形虫多样化滑行运动的实验结果。
通过研究,团队发现F-肌动蛋白的流动不仅依赖于肌球蛋白MyoA的作用,还受到肌动蛋白自我组织能力的影响。这一发现揭示了弓形虫滑行运动的内在机制,为理解寄生虫的运动能力提供了新的视角,并可能为开发针对相关疾病的治疗策略奠定基础。该研究成果为未来深入探讨寄生虫运动机制提供了有价值的理论依据和实验基础。

【表征解读】
本文通过免疫荧光和共聚焦显微镜等先进的表征手段,发现了Toxoplasma gondii的肌动蛋白自组织行为,从而揭示了其在细胞表面运动中的重要机制。研究表明,Toxoplasma gondii的肌动蛋白通过与肌球蛋白的相互作用而被极化推进,形成一种“极性自推动”状态,促使寄生虫能够有效地在宿主细胞内迁移。这一发现为理解寄生虫如何利用宿主细胞的细胞骨架提供了新的视角。
针对Toxoplasma gondii在宿主细胞内的运动现象,本文通过软X射线断层成像技术详细表征了寄生虫内部结构的微观机理,得到了其复杂的细胞形态与肌动蛋白网络的详细信息。结合这些微观表征,本文进一步挖掘了寄生虫在细胞内的运动模式与环境适应性的关系,揭示了寄生虫在不同生理条件下的行为变化和生存策略。
在此基础上,本文采用了多种表征手段,包括经典的流体动力学模型和成像技术,结合数学建模,分析了Toxoplasma gondii肌动蛋白的自组织行为。通过对肌动蛋白聚合与去聚合过程的深入探讨,研究结果显示,寄生虫肌动蛋白的动态变化与细胞运动具有密切的关联。此研究着重研究了肌动蛋白在寄生虫运动中的角色,揭示了其自组织能力对寄生虫生存与致病性的影响。
总之,经过免疫荧光、共聚焦显微镜及软X射线断层成像等多种表征手段,本文深入分析了Toxoplasma gondii的细胞运动机制与微观结构特征,进而为制备新型抗寄生虫材料提供了理论基础。这些研究不仅推动了寄生虫学的进展,也为理解细胞骨架在细胞运动中的作用提供了新的思路,最终促进了相关生物医药领域的发展。
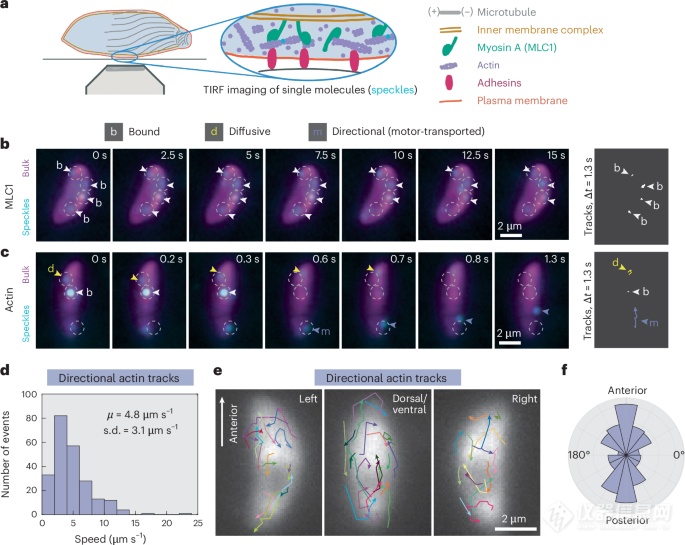
弓形虫的肌动蛋白运输方向是异质的,而不是均匀向后
参考文献:Hueschen, C.L., Segev-Zarko, La., Chen, JH. et al. Emergent actin flows explain distinct modes of gliding motility. Nat. Phys. (2024). https://doi.org/10.1038/s41567-024-02652-4
来源于:仪器信息网
热门评论
最新资讯
新闻专题