进口
10-15秒钟内实现光谱成像和定量分析
3百万像素/波长,提供,2100万像素/帧分辨率
全套分析时间10-15秒/样品
软件备选:图像处理工具包 (IPT)
Videometer Lite采用了LED频闪光源系统,有效组合了7个波长测量,并生成图谱合一的融合光谱图像,每个像素对应一个不同反射光谱。该设备包括可见光以及NIR近红外波段,用于作物表型、植物病害等等进行精确、全面检测。该便携式Videometer Lite可搭载到推车支架上,在田间使用,也可手持使用,是一款多功能成像平台。
主要功能
结合可见光成像和光谱成像优点
对种子、病害表型成像
便携设计,方便带到温室或野外使用
标准校准功能,数据可重复
经验丰富的专家根据应用经验设计的软件,操作简单,解决农业应用中遇到的问题
内置颜色校正
标配7个光谱波段,并不断升级中
Videometer植物/种子检验检测表型分析平台产品说明
该系统也可以对细菌、真菌、虫卵等进行高通量成像测量,进行毒理学或其它研究,用于食品谷物、作物、肉品等等进行精确、全面品质检测。Videometer系统生成图片可用其它分析系统进行分析,如Matlab等。考虑到Videometer Lite可能需要经常带到温室、野外或其它地方进行测量,因此它被设计成可便携携带的样式。
VideometerLab Lite的工作软件由Videometer公司强大的生物信息学和软件团队开发,充分考虑在实际应用的需求,操作简单,功能强大。Videometer还在不断研究、升级新算法,适合各种需求。
VideometerLab LiteVideometer植物/种子检验检测表型分析平台通过测量种子在7种不同波长(波长范围405-850nm)的LED频闪光下的成像来获取有用的信息。这些图像可以独立分析使用,也可以叠加起来合成高分辨率的颜色图像。基础整合模块,含7个波段多光谱成像系统。软件可进行颜色校准,标签识别,灰度图转换等。

田间多光谱表型成像系统应用
表型性状分析/挖掘,基因型-表型关联
农业育种
园艺学、农业信息学
果实品质分析
植物病理研究
生物量分析
种子萌发研究
抗逆研究
直接测量的参数
尺寸
形状
颜色
形态纹理
光谱质构
与表面化学相关的光谱成分
计数
间接测量或计算
种子纯度
发芽百分比
发芽率
种子活力
种子健康度
种子成熟度
种子寿命等
主要特点
集成球体提供均匀和弥散光线照明
10-15秒钟内实现光谱成像和定量分析
7不同波长/光源
3百万像素/波长,提供,2100万像素/帧分辨率
标准设备包括易于使用设备校准
与传统RGB技术相比具有先进的彩色测量功能
根据应用需求可自动切换动态范围
光源寿命长、可达10万小时
LED光源技术稳定性增强
研究用强大探索软件
易用常规应用配方构建工具(建模)
成像特点
快速、无损检测
包括处理在内每样品处理仅需10-20秒
与其它破坏性技术组合
高灵活性测量
主要专注:可重复洗、可追溯性、耐用性、可传递性
技术参数
全套分析时间10-15秒/样品
电源:5 V DC 3 A
电源功耗300 VA
环境温度操作: 5-40℃,储存-5-50℃
环境湿度20-90 % RH相对湿度,非冷凝
软件备选:图像处理工具包 (IPT)
光谱成像工具盒 (MSI)
斑点工具盒
设备尺寸: 270 mm(h) * 240 mm(w) * 200 mm(d)
重量:1.1kg
案例应用

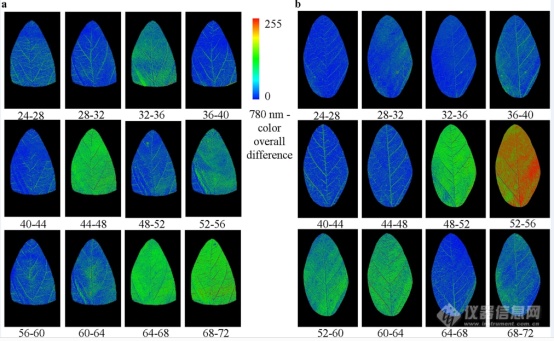
由叶绿素/成熟度区分种子
来自英国的科学家研究重点是对高级成像技术进行评估,以对根定植进行真菌检测和精确定量,通过测量光合参数评估对地上部健康的影响。研究中使用了VideometerLab 多光谱成像系统。
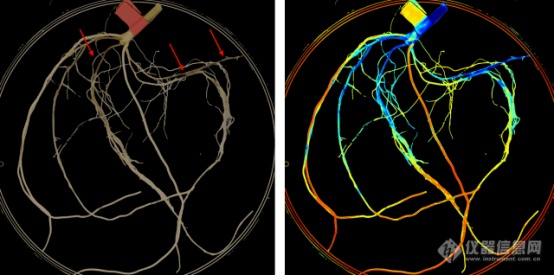
图中显示“Take-all”感染小麦幼苗。左侧是原始图像,有红色箭头标示“take-all ”损失,用手工评分;右图是相同图像经‘VideometerLab’分析,将根组织分类为感病(蓝色)和健康(桔色/黄色)。
利用Videometer多光谱成像系统对藜麦霜霉病成像
藜麦(Chenopodium quinoa)是一种作物,营养丰富,在多个国家广有种植。真菌病如霜霉病限制了谷物产量,培育抗性品系,如抗霜霉病品系是藜麦育种的中心目标。
利用常规RGB成像来测量藜麦对霜霉病的表型反应(Peronospora variabilis ) 测量比较困难,原因在于来自不同藜麦基因型在叶片上有不同绿色和红色斑点进行干扰,参见图1和图2。
开发图像分析规程来区分健康藜麦叶片组织以及感染霜霉病的藜麦叶片组织。研究利用Videometer多光谱成像系统对严重度程度表型和孢子形成进行研究。
严重程度是叶片正面损伤的面积占整个叶片面积的百分比。依基因型不同,颜色可为桔色、黄色或红色。
孢子形成是损伤部上方孢子量,以百分比测量,通过测量叶片正面进行评估。
多光谱图像分析
研究人员利用VideometerLab 4多光谱成像系统进行多光谱成像,积分球确保对样品的均一照明(图3)。每个获取的图像层由19个不同图像波段组成,波长涵盖365nm(UVA)到970nm(NIR)。图像的每个像素分辨率为~41 µm。每个图像层的分辨率为2192X2192像素。
图像分析严重度模型
从G9基因型叶片正面(图4)清楚看到了黄化现象(A),拍摄了RGB图像(常规相机,人眼可见光波段。(B)和(C)显示了多光谱图层中的2个波段,蓝光490nm(B)和黄光570nm(C)。对健康植物组织和黄化界定进行了初始标记,转换建立了模型(D),通过nCDA(归一化典型判别分析将19个波段信息(图像中多个图层),转换为了整个图层的代表像素范围值。之后切割(E和F),可用于所有图像-所有品系和基因型,获取有黄化组织(E黄色)百分比定量分析,该特定叶片比例为68.0%,或者包括红色覆盖孢子区(F),比例为18,9%,黄化(黄色)比例68%,孢子和黄化区综合面积占比75.8%。
图像分析孢子形成
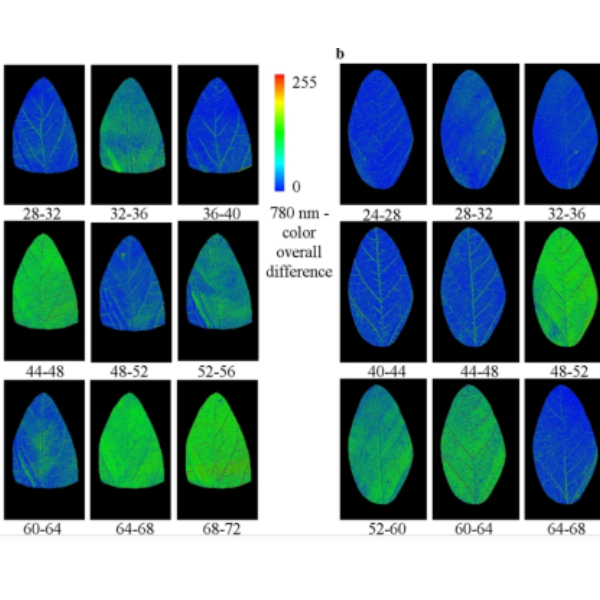
在叶片正面(底部),RGB图像中的G9基因型清晰可见到孢子形成图像(下底部A和B放大)。尽管在可见光波段很难检测到单个波段,这里特别标出了蓝光波段(490nm)(C)。进入NIR(780nm)波段(下左部的D和E放大),清晰看见了孢子。使用该信息(仅标识黑灰色孢子)可帮助我们区分切割孢子像素(F),并将该面积定量,该叶片孢子比例为12.5% (黄色显示),不包括黄化部分面积。
另外,此处的孢子标识与正面图像分析而言更加保守。 覆盖的非黑灰区的像素部分 (像素比单个孢子要大)估计,孢子比例为~23%(此处未予以显示)。
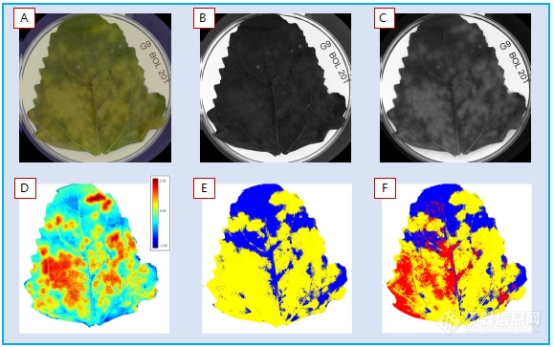
图4(A) sRGB图像。(B),490nm(蓝光),(C),570nm(黄色),(D) 转换,(E)和(F),2种类型定量分割。
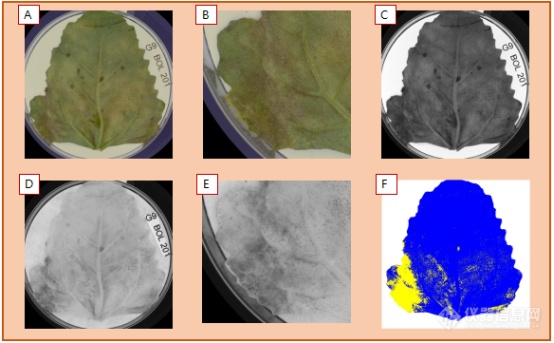
图5(A) sRGB 图像,(B)490nm(蓝光),(C) 570nm(黄色),(D)转换,(E)定量分割。
结果
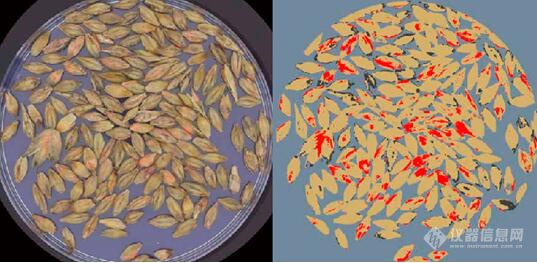
图6:133个基因型的平均严重程度(%)分布
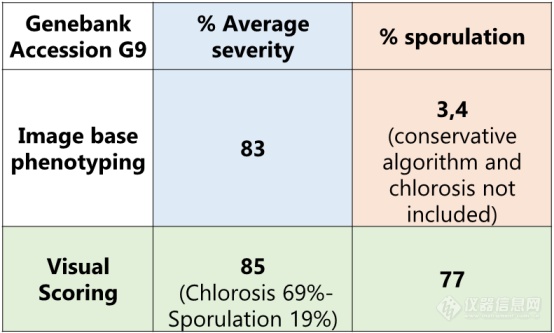
表1手工以及基于多光谱表型成像的藜麦霜霉病互作
1年
是
有
安装调试时进行培训
无
因外力因素损坏的不予零部件更换
仪器故障需安排工程师上门维护
- 相关仪器
相关产品





 仪器对比
仪器对比



 关注
关注