推荐厂家
暂无
暂无
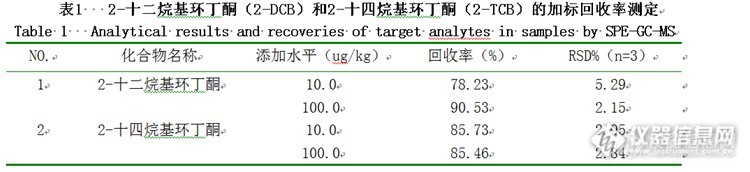
摘 要:建立固相萃取-气相色谱- 质谱联用(solid phase extraction with gas chromatography-mass spectrometry,SPE-GC-MS)法测定植物油中2-十二烷基环丁酮和2-十四烷基环丁酮。对影响分析物萃取效率的诸因素如洗脱溶剂等进行详细考察和优化。最佳萃取条件为0.5 g样品与5 mL乙腈混匀,经ProElut Silica (500 mg/3mL)固相萃取柱净化后,以GC-MS 进行测定,该方法对2-十二烷基环丁酮和2-十四烷基环丁酮的检出限为10μg/kg,线性范围为0.01~0.5μg/mL,线性相关系数分别为0.99938和0.99977,相对标准偏差(relative standard deviation,RSD)(n=3)小于6%。该方法成功应用于植物油中2-十二烷基环丁酮和2-十四烷基环丁酮的分析,加标回收的回收率为78%~91%。关键词:固相萃取;气相色谱-质谱;2-十二烷基环丁酮;2-十四烷基环丁酮;植物油 食品辐照作为对物质或食品进行加工处理的新型保藏技术,在国际上已逐渐被认可,但是在商业化应用、国际贸易以及辐照食品的市场监管方面,迫切需要有辐照食品鉴定检测方法。 经辐照后,在含脂食品中会产生特异性辐解产物2-烷基环丁酮(2-Alkylcyclobutanones ,2-ACBs),它是含脂辐照食品的特异性辐解产物,在未辐照的含脂食品中,至今还从未检测到此类化合物。在1990年, 2-ACBs 类化合物可作为检测含脂辐照食品的标志性化合物, 首次被报道,随后依据该结论制定了欧盟标准EN1785和GB\T 21926-2008 。2-ACBs由食品中的游离脂肪酸或甘油三酸酯的羰基氧失去一个电子,再经由重排过程生成,其过程如图1所示。http://ng1.17img.cn/bbsfiles/images/2015/07/201507091523_554630_2452211_3.png图1 经辐照后游离的脂肪酸转化为2-ACBs的示意图 在大多数食品中,棕榈酸、硬脂酸、油酸、亚油酸是主要的脂肪酸,而棕榈酸和硬脂酸是其中含量最高的饱和脂肪酸,其辐解物2-十二烷基环丁酮(2-dodecylcyclobutanone,2-DCB)和2-十四烷基环丁酮(2-tetradecylcyclobutanone,2-TCB)相对于其它2-ACBs较为稳定,因此一般作为检测含脂辐照食品的主要标志性化合物。目前对含脂辐照食品大多采用佛罗里硅土柱进行净化,但是该法的应用范围有限。本实验拟通过优化固相萃取(solidphase extraction,SPE)条件,采用气相色谱-质谱联用(gas chromatography-massspectrometry,GC-MS)技术测定植物油中2-十二烷基环丁酮和2-十四烷基环丁酮,为进一步缩短2-ACBs 萃取和分离时间、减少溶剂使用量、提高检测灵敏度以及扩大方法应用范围提供基础数据和理论依据。1 材料与方法1.1 材料、试剂与仪器GCMS-QP2010 气相色谱-质谱联用仪 日本岛津公司;DM-5MS 毛细管柱(30 m×0.25 mm,0.25 μm)迪马公司;XH-C 涡旋混合器 江苏金坛市盛威实验仪器;80-1 高速离心机 河南省予华仪器;OSB-2100 旋转蒸发仪 上海爱朗仪器有限公司;12孔固相萃取装置 迪马公司; ProElut Silica(500 mg/3mL)固相萃取柱 迪马公司。HSC-12B 氮吹仪天津市威仪科技发展有限公司;丙酮、二氯甲烷、乙酸乙酯乙腈、甲基叔丁基醚、正己烷(均为色谱纯)迪马公司。实验所用的植物油均购自当地市场。1.2 方法1.2.1 标准贮备液的制备称取一定量标准品,溶于正己烷溶剂中,配制成浓度为0.5 mg/mL的标准贮备液。再配制成质量浓度系列为0.01μg/mL、0.02μg/mL、0.05μg/mL、0.1μg/mL、0.2μg/mL、0.5μg/mL的标准工作溶液,备用。1.2.2 仪器分析条件气相色谱条件:色谱柱为DM-5MS (30.0m×250μm,0.25μm);载气He(99.995%);恒流,柱流速1.0mL/min;不分流,进样量1μL,进样口温度为260℃;起始温度80℃(保持1min),以15℃/min的速度升至150℃,再以8℃/min升温至200℃,再以20℃/min升温至260℃(保持5min)。质谱条件:EI源,离子源200℃,溶剂延迟为3min,选择离子监测模式(SIM),选择监测离子(m/z):69、84、98、112、125。1.2.3 样品的提取称取0.5 g样品于10 mL带塞试管中,加入5 mL乙腈,涡旋混合2 min,超声提取2 min,4000 rpm下离心2min,取上清液;下层油脂再用5 mL乙腈重复上述步骤,合并两次上清液。将得到的上清液在50℃下,氮吹近干,再慢慢挥干,再向氮吹瓶中加入2.5 mL正己烷复溶,待净化。1.2.4 样品的净化依次用5 mL甲基叔丁基醚,5mL正己烷缓慢通过ProElut Silica固相萃取柱,以达到润湿小柱,活化填料,除去干扰杂质的目的;再将1.2.3节方法制得的待净化液转移到ProElut Silica固相萃取柱中,流出液弃去;然后用5 mL正己烷淋洗,弃去流出液;再用10 mL甲基叔丁基醚:正己烷(1:99V:V)洗脱,用旋转蒸发瓶接收,直至洗脱液完全自然滴出。在50 ℃下,将收集到的洗脱液氮吹浓缩,然后用正己烷定容至1 mL后供GC-MS分析。2 结果与分析在固相萃取操作中,影响分析物峰面积的主要固相萃取因素有洗脱剂、洗脱体积、洗脱速率和上样速率。为了获得最佳分析结果,需要对其进行优化。2.1固相萃取条件的确定2.1.1 提取溶剂的选择2-十二烷基环丁酮(2-DCB)和2-十四烷基环丁酮(2-TCB)与脂肪酸的结构及其类似,故能溶于极性和中等极性的试剂中。分别用丙酮、二氯甲烷、甲基叔丁基醚、乙酸乙酯作为2-DCB 和2-TCB的提取溶剂。实验结果表明乙腈提取效果较好,再加以涡旋振荡后结合超声提高回收率。2.1.2 固相萃取柱的选择对于油脂类样品,采用固相萃取柱进行样品净化是必不可少的步骤。结合相应参考文献,本实验采用了硅胶、PSA、Florisil、Alumina等填料的固相萃取柱,结果表明对于植物油,硅胶柱相对于其他填料的固相萃取柱来说,2-DCB 和2-TCB回收率较高,添加回收率达到了80%-120%,满足分析检测的要求,且达到很好的净化效果。如图2所示http://ng1.17img.cn/bbsfiles/images/2015/07/201507091524_554631_2452211_3.pngA:标准品;B:空白样品;C:添加标品的样品图2 植物油空白样品及其添加样品的总离子流图2.1.3 淋洗曲线的建立固相萃取技术最重要的目的在于通过固相萃取柱将目标化合物与主要干扰物分开,从而实现净化的目的。在此过程中应非常注意选择合适的洗脱溶剂。样品处理过程是先用正己烷将其中的中性化合物除去,参照Horvarovich 等报道,用硅胶柱分离样品中的2-DCB和2-TCB,选用弱极性的甲基叔丁基醚(methyl-t-butyl ether,TBME)/正己烷(V/V)混合溶剂将稍强极性的2-DCB 和2-TCB洗脱下来。由于样品基质与文献不一样,淋洗液与洗脱液的选择也会不一样。因次需要考察正己烷以及其与甲基叔丁基醚不同比列的混合液作为洗脱液时2-DCB和2-TCB的回收率。选用5根ProElut Silica固相萃取柱,取0%、0.5%、1%、2%、5%不同浓度的甲基叔丁基醚:正己烷(V/
在某网上看到一段话:关于丁酮与丙酮的区别描述:丙酮是三个碳原子,丁酮是四个碳原子,都有羰基,丙酮易挥发而丁酮挥发性没有丙酮好丁酮比丙酮毒性低.丙酮作为溶剂最大的缺点就是挥发性太强,这也是它无法替代丁酮的最主要的原因.丁酮沸点 73.4 ℃丙酮沸点56.05℃大家觉得这些描述正确吗?还有什么补充的吗?最根本的区别是这个吗?
用甲醇钠制得丁酮烯醇钠,计算收率的时候用什么方法来确定干燥品中丁酮烯醇钠的占比是多少呢?




 400-860-5168转4637
400-860-5168转4637
 留言咨询
留言咨询

 400-860-5168转0803
400-860-5168转0803
 留言咨询
留言咨询

 400-860-5168转2141
400-860-5168转2141
 留言咨询
留言咨询