推荐厂家
暂无
暂无
大家都用那些容积配置过黄芩苷对照品啊?怎么我们用稀乙醇溶液溶解的时候不易溶解啊,超声半小时还会有很多不容物?
配制两个黄芩苷对照品溶液第一个是用50%的甲醇溶解,我感觉这个好难溶,超声了也不见得全部溶解,如果全部溶解配制出来的应该是澄清的吧?该如何处理好呢??第二个要用减压干燥器60度干燥4小时再配制,我觉得涂了凡士林在60度会溶了吧,就不能减压了,我可以直接打开对照品瓶盖直接在烘箱里烘4小时不?这样做会有很大的影响吗?
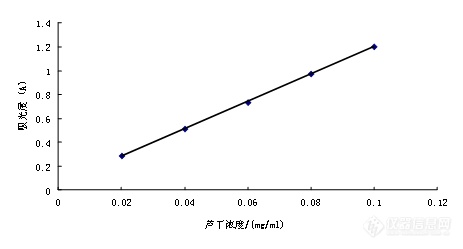
[align=center]从黄芩中提取黄酮类化合物的工艺研究[/align][align=center]西安国联质量检测技术股份有限公司[/align][align=center]食品事业部:李灿[/align][b]摘要:[/b]探讨超声波辅助法提取黄芩中总黄酮的最佳提取条件及对提取物的抗氧化性活性研究,这为黄芩作为天然抗氧化剂和功能性食品的开发利用提供理论基础和实验依据。[b][/b] 通过设计正交试验,采用超声波辅助法提取黄芩中总黄酮的最佳工艺条件条件,并通过对羟自由基、超氧自由基和DPPH自由基的清除效果研究其抗氧化活性。[b][/b]超声波辅助提取黄芩中总黄酮的最佳条件为:乙醇浓度为50%,时间为25min,料液比为1∶10,温度为30℃,黄芩总黄酮的提取率为3.25%。并且研究了黄芩提取物中的黄酮类物质对O[sub]2[/sub]-• 、• OH和DPPH自由基的抗氧化性能。研究结果表明洋葱提取物中黄酮类物质的抗氧化性较VC强。在浓度为0.0125mg/ml下,对羟基自由基的清除率为88.30%,对超氧基自由基的清除率为90.01%,对DPPH自由基的清除率为93.87%。[b]关键词[/b]:黄芩;超声波提取;总黄酮;抗氧化活性 [align=center][b] Study on extraction technology of flavonoids from Scutellaria[/b][/align][align=center]Li Can[/align][align=center] (Department of Chemistry and Chemical Engineering, Xi′an University of [/align][align=center]Arts and Science, Xi′an 710065)[/align][b]Abstract: [/b]To investigate the ultrasonic assisted extraction optimum extraction conditions of total flavonoids from Scutellaria and to extract antioxidant activity, which is a skullcap as a natural antioxidant and functional food development and utilization of theoretical and experimental evidence provided . [b][/b] Through orthogonal experiment, the optimum conditions using ultrasonic assisted extraction conditions of total flavonoids from Scutellaria, and to study its antioxidant activity by hydroxyl radicals, superoxide radicals and DPPH radical scavenging effect. Optimal conditions . [b] [/b]Ultrasonic assisted extraction of total flavonoids from Scutellaria: ethanol concentration of 50%, the time is 25min, solid-liquid ratio of 1:10, the temperature is 30 ℃, extraction of total flavonoids was 3.25%. And studied the extract of Scutellaria flavonoids on O2-• , • OH and DPPH radical antioxidant properties. The results show that the onion extract antioxidant flavonoids than VC strong. At a concentration of under 0.0125mg/ml, hydroxyl radical scavenging rate of 88.30% for super-group was 90.01% scavenging of DPPH radical scavenging rate was 93.87%.[b][color=#2b2b2b]Key Words[/color][/b][color=#2b2b2b]:[/color][color=#2b2b2b] [/color][color=#2b2b2b]Skullcap [/color][color=#2b2b2b]U[/color][color=#2b2b2b]ltrasonic extraction [/color][color=#2b2b2b]T[/color][color=#2b2b2b]otal flavonoids [/color][color=#2b2b2b]A[/color][color=#2b2b2b]ntioxidant activity[/color][b]1 前言[/b]黄岑主要生长在陕西秦岭,为常用中草药之一,性寒,味苦。具有清热燥湿,泻火解毒,止血安胎[sup][/sup]等功效,它的主要成分为黄酮类化合物[sup][/sup],黄酮类化合物主要存在于双子叶及裸子植物的叶、果、实、根、皮中,在植物中主要与糖结合成苷的形式存在[sup][/sup]。目前从黄酮类物质有很多种,黄酮类化合物的结构特点是具有 C[sub]6[/sub]- C[sub]3[/sub]- C[sub]6[/sub]的基本骨架,根据中间三碳链的氧化程度、B 环( 苯基) 连接位置( 2-或3-位) 以及三碳链是否呈环状等特点,主要有黄酮醇,二氢黄酮,二氢黄酮醇,黄烷,黄烷醇,异黄酮等,被广泛应用在医药、功能食品添加剂、兽药和农药等领域。在医药方面,根据其在心血管系统、内分泌系统、抗肿瘤方面的药理作用,很多以黄酮类成分为主的制剂已作为成药上市[sup][/sup]。在食品中它们应用于功能性食品添加剂,如天然甜味剂、天然抗氧化剂、天然色素等;应用于功能食品,如生物类黄酮口香糖、银杏叶袋泡茶等防衰、抗癌、提高免疫力食品;在兽药、农药等领域,现已开发出些具有特效功能的含有黄酮类化合物药品和驱虫、杀虫剂等[sup][/sup]。目前国内侧重于对黄酮类化合物的研究,但他们常被当作残渣而扔掉,因而就造成了黄芩的浪费,没有使黄芩得到充分利用,本文主要针对黄芩总黄酮的提取方法及其抗氧化能力测定方法进行研究,以期为黄芩黄酮类成分的进一步开发利用从黄岑中提取黄酮类化合物的方法有很多种,传统提取方法有煎煮法[sup][/sup]、有机溶剂提取法[sup][/sup]、浸渍法、渗漉法、回流提取法[sup][/sup]、水提法等,新的提取方法有超声波提取法、微波提取法、索氏提取法、超临界萃取法、大孔树脂吸附法、酶解法提取[sup][/sup]。黄芩黄酮的提取主要为溶剂萃取法,包括无机溶剂萃取法和有机溶剂萃取法。其主要原理是利用黄芩黄酮能溶于碱水或甲醇等有机溶剂的特性来提取黄芩中的黄酮[sup][/sup],考虑到该法提取时间长,提取率较低的缺点,我们采用超声波辅助提取法。因为超声波提取法是一种新型方法,它具有能耗低、效率高、不破坏有效成分的特点,在低温下可以强化水浸提效率,达到省时高效节能的目的,而且是目前广泛使用的方法。超声提取的主要理论依据是超声的空化效应、热效应和机械作用。当大能量的超声波作用于介质时,介质被撕裂成许多小空穴,这些小空穴瞬时闭合,并产生高达几千个大气压的瞬间压力,即空化现象。超声空化中微小气泡的爆裂会产生极大的压力,使植物细胞壁及整个生物体的破裂在瞬间完成,缩短了破碎时间,同时超声波产生的振动作用加强了胞内物质的释放、扩散和溶解,从而显著提高提取效率。因此本实验拟决定用超声波提取法来提取黄酮类化合物。黄酮类化合物的测定方法也多种多样,目前有薄层扫描法、紫外分光光度法、液相色谱法等[sup][/sup]。但是以上方法测定黄芩提取液中总黄酮的含量都比较繁琐,非黄酮类物质干扰比较大。由于Al[sup]3+[/sup]仅与黄酮类物质有特征反应,使用这种显色方法可以使黄酮类化合物溶液在510nm左右出现吸收峰,采用紫外分光光度法测定黄芩提取液中总黄酮含量,方法简单快速[sup][/sup]。对于黄酮类化合物的抗氧化性研究,国内外所做研究也比较多。方法可分为体外抗氧化与体内抗氧化,其中体外抗氧化运用较为广泛,体外抗氧化还可分为直接清除活性氧自由基、抑制油脂过氧化反应[sup][/sup]等;体内抗氧化是用受试物连续喂饲大鼠或小鼠1个月~3个月,然后处死动物,测定其血或组织(如肝、脑)中各物质的含量,同对照组进行比较,间接地说明受试物的抗氧化活性。采用体外抗氧化性研究,常用到的自由基有OH[sup] [/sup],O[sub]2[/sub][sup]-[/sup], DPPH等,由于直接清除活性自由基的方法易行且效果直观,本次实验采用该种方法。本实验将从两个方面研究黄芩黄酮类化合物。第一部分为黄芩总黄酮最佳提取方法的研究。本环节采取超声辅助提取法,采用料液比(A),乙醇浓度(B), 超声时间(C),超声温度(D)作为研究因素,采用四因素三水平,选择L[sub]9[/sub](3[sup]4[/sup])设计正交试验。用芦丁做标准曲线测定黄芩提取液中总黄酮的含量。第二部分为总黄酮类化合物抗氧化性的研究,采用对OH,O[sub]2[/sub][sup]-[/sup]自由基和DPPH自由基的清除作用研究其抗氧化性。[b]2 实验部分2.1 材料与仪器2.1.1 材料和试剂[/b] 黄芩(购于西安同仁堂大药房),芦丁(分析纯,上海试剂药品厂),亚硝酸钠(分析纯,成都市科龙化工试剂厂),硝酸铝(分析纯,成都市科龙化工试剂厂),氢氧化钠(分析纯,成都市科龙化工试剂厂),邻苯三酚(分析纯,成都市科龙化工试剂厂),盐酸(分析纯,天津市天力化学试剂有限公司),双氧水(天津市天力化学试剂有限公司),硫酸亚铁(分析纯,成都市科龙化工试剂厂),水杨酸(分析纯,天津市天力化学试剂有限公司),无水乙醇(分析纯,天津市天力化学试剂有限公司),三羟基甲基氨基甲烷(分析纯,天津市福晨化学试剂厂),邻二氮菲(分析纯,天津市福晨化学试剂厂),DPPH(购于阿拉丁试剂)。[b]2.1.2 仪器[/b] 高速粉碎机(FW80型,北京中兴伟业仪器有限公司);紫外可见分光光度计(722N,上海精密科学仪器有限公司) 电子天平(YP202W,上海精密科学仪器有限公司);循环水式多用真空泵(SHB-Ⅲ,郑州长城科工贸有限公司);超声波清洗机(11—1404,宁波新芝生物科技股份有限公司);智能型恒温鼓风干燥箱(CMD-20X型,上海琅轩试验设备有限公司);玻璃仪器气流烘干器(TH48SYBQ-1型,北京中兴伟业仪器有限公司)。[b]2.2实验方法2.2.1黄芩样品的制备[/b] 将黄芩在烘箱中60℃干燥8h,干燥后的黄芩用粉碎机粉碎成粉末,用分样筛(40目)筛分黄芩粉末,保证粉末均匀一致,密封保存,待用。[b]2.2.2 总黄酮的测定方法2.2.2.1 芦丁标准曲线的绘制[/b] 准确称取干燥至恒重的芦丁4.0mg 于小烧杯中,用50%乙醇溶解,并定容于25ml的容量瓶,摇匀,得浓度0.16mg/ml的标准液。准确吸取标准应用液0、1.0、2.0、3.0、4.0、5.0ml 于6 个10ml容量瓶中,与上述容量瓶中分别加入5% NaNO[sub]2[/sub]0.3ml,摇匀,放置6min后,分别加入10% Al(NO[sub]3[/sub])[sub]3[/sub] 溶液0.3ml,摇匀,放置6min后,再分别加入4% NaOH 溶液4ml,加50%乙醇定容至10ml,摇匀,以试剂空白为参比,放置10~15min,用紫外可见分光光度计进行全波长扫描,在最大吸收波长510nm处测定吸光度,得到吸光度Y与芦丁浓度X(mg/ml)间标准曲线回归方程。[b]2.2.2.2 提取液总黄酮含量的测定 [/b]准确称取1.00g黄芩粉末,在不同的提取条件下提取黄芩总黄酮,提取液用乙醇稀释定容至50ml。准确吸取提取液1.0ml于25ml容量瓶,按上述方法显色后测定吸光度,代入标准曲线回归方程中可以得到黄芩中黄酮类物质的含量(mg/ml),从而计算出黄芩中黄酮类物质的提取率,即:黄芩中黄酮类物质的提取率= ×100%[b]2.2.3 单因素试验[/b] 主要研究料液比、乙醇浓度、超声波时间、超声波温度4个因素,在保持其他因素相同的条件下分别进行单因素试验,研究各因素对黄芩总黄酮提取效果的影响,筛选最佳的提取条件。 准确称取黄芩粉末,在不同的条件下进行超声提取,提取液冷却后用乙醇定容,按照2.2.2的测定方法,计算黄芩中总黄酮的含量。[b]2.2.4 正交试验[/b]在单因素试验基础上,选择料液比、乙醇浓度、超声时间、超声温度4因素,设计L[sub]9[/sub](3[sup]4[/sup])正交试验,以总黄酮的含量为评价指标,确定黄芩总黄酮超声辅助法的最佳提取工艺。[b]2.2.5 总黄酮体外抗氧化性的研究2.2.5.1 对羟自由基清除作用的研究[sup][/sup][/b]原理:通过反应所产生的羟基自由基可将Fe[sup]2+[/sup]氧化为Fe[sup]3+[/sup], Fe[sup]2+[/sup]和邻二氮菲反应可产生有色络合物,向有色沉淀加入抗氧化剂后,其反应效果会相对减弱。羟基自由基对二价铁离子的氧化作用,会导致吸光值不断变化,从而评价样液消除羟基自由基的能力。步骤:取0.75 mmoL/L邻二氮菲溶液1 mL,加入不同浓度的样液,再加0.75 mmoL/L硫酸亚铁1 mL混匀,加0.75mmol/l的过氧化氢1 mL,于37 ℃ 水浴下,水浴60 min后,在536 nm处测其吸光度,所得吸光度A[sub]b[/sub]。 反应方程式:H[sub]2[/sub]O[sub]2[/sub] + Fe[sup]2+[/sup]=OH[sup]-[/sup] +OH + Fe[sup]3+ [/sup]清除率S(%)=「Ax- A[sub]b[/sub]]/[As- A[sub]b[/sub]] ×100% 其中 A[sub]b[/sub]:标准体系的吸光度 Ax:不含黄芩提取液的吸光度As:不含过氧化氢的标准体系吸光度本底吸光度[b]2.2.5.2 对超氧自由基清除作用的研究 [sup][/sup][/b] 原理:在碱性条件下,邻苯三酚能迅速发生自氧化反应,生成超氧阴离子自由和有色中间产物,且邻苯三酚自氧化速率与生成超氧阴离子自由基的浓度呈正相关,该有色中间产物在300nm处有一特征吸收峰。当加入抗氧化剂能催化超氧阴离子自由基与H[sup]+[/sup]结合生成O[sub]2[/sub]和H[sub]2[/sub]O[sub]2[/sub] ,从而阻止了中间有色产物积累,溶液在320nm 处的吸收减弱。因此可通过测定添加试样前后吸光度[i]A[/i]的变化来表示抗氧化剂对超氧阴离子自由基的清除效果。步骤:取0.05mol/L三羟甲基氨基甲烷盐酸缓冲液(pH =8.2)4.5mL,置于25℃水浴中预热20min,分别加入0.1mL试样和0.4mL2.5mmol/L邻苯三酚溶液,混匀后于25℃水浴中反应4min,加入8mol/L HCl溶液两滴终止反应,于波长299nm处测定吸光度As,空白对照组以相同体积的蒸馏水代替样品,并计算清除率。 清除率计算公式: S(%)=[(1-(As-A[sub]0[/sub] )/A[sub]b[/sub]]×100%其中 A[sub]b[/sub]:不含黄芩提取物的标准体系吸光度 As:标准体系的吸光度值 Ao:不含邻苯三酚的标准体系吸光度[b]2.2.5.3 对DPPH自由基清除作用的研究[sup][/sup] [/b]原理:DPPH 在有机溶液中是一种稳定的自由基,其乙醇溶液呈深紫色,当 DPPH 溶液中加入自由基清除剂时,其孤对电子被配对,溶液颜色变浅,可由此来检测自由基的清楚状况,从而评价物质的抗氧化能力。步骤:将样品储备液适当稀释得到不同浓度的黄芩黄酮溶液。 向一系列 10 mL比色管中加入 3.5 mL 1.0×10[sup]-4[/sup]mol/L 的 DPPH 溶液和 0.5 mL 样品液,摇匀避光反应30 min,与波长517 nm下测定吸光度 A s。空白对照组以无水乙醇代替样品,并计算清除率。清除率计算公式: 清除率S(%)=[(1-(As-A[sub]0[/sub] )/A[sub]b[/sub]]×100% 其中 A[sub]b[/sub]:不含黄芩提取物的标准体系吸光度 A[sub]s[/sub]:标准体系的吸光度值 A[sub]0[/sub]:不含DPPH的标准体系吸光度[b]3. 结果与分析 3.1 芦丁标准曲线[/b]由图可得,芦丁在0.02—0.10mg/ml浓度范围内与吸光度呈良好的线性关系,R[sup]2[/sup]= 0.9998。回归方程为Y= 11.47X+ 0.0554 [align=center]表1 芦丁浓度与吸光度的关系[/align][table][tr][td][align=center]序号[/align][/td][td][align=center]1[/align][/td][td][align=center]2[/align][/td][td][align=center]3[/align][/td][td][align=center]4[/align][/td][td][align=center]5[/align][/td][/tr][tr][td][align=center]芦丁浓度/(mg/ml)[/align][/td][td][align=center]0.02[/align][/td][td][align=center]0.04[/align][/td][td][align=center]0.06[/align][/td][td][align=center]0.08[/align][/td][td][align=center]0.10[/align][/td][/tr][tr][td][align=center]吸光度(A)[/align][/td][td][align=center]0.288[/align][/td][td][align=center]0.514[/align][/td][td][align=center]0.736[/align][/td][td][align=center]0.976[/align][/td][td][align=center]1.204[/align][/td][/tr][/table][align=center] [/align][align=center] [/align][align=center] [/align][align=center][img=,463,249]http://ng1.17img.cn/bbsfiles/images/2018/07/201807091813421003_7187_2904018_3.png!w463x249.jpg[/img] [/align][align=center]图1 芦丁标准曲[/align]Fig.1 Standard curve of rutin[b]3.2 总黄酮提取条件的优化3.2.1 料液比对黄酮类化合物提取效果的影响[/b]在料液比为1:6,1:8,1:10,1:12,1:14时,50%乙醇作为提取剂,超声波时间为20min,超声波温度为60℃,冷却后采用超声波提取法提取黄芩中黄酮类化合物含量,研究料液比对提取效果的影响。[align=center]表2 料液比与提取率的关系[/align][align=center][img=,394,250]http://ng1.17img.cn/bbsfiles/images/2018/07/201807091815178933_5515_2904018_3.png!w394x250.jpg[/img][/align][align=center] 图2 料液比对黄芩黄酮提取的影响[/align][align=center]Fig.2 Solid-liquid ratio on the extraction of flavonoids from Scutellaria impact[/align]由图2可见,随着料液比的增加,黄酮类化合物的提取率也逐渐升高,当料液比为1:10时,黄酮类化合物的提取率达到最高值,继续增加料液比,提取率会有一定的降低。在一定范围内料液比的增加有利于物料中黄酮类物质的溶出,但料液比过大的时候,会导致溶液浓度太小,从而影响到黄酮类物质对超声波能的吸收,导致黄酮得率下降。因此选定料液比在1:10的条件下进行实验。[b]3.2.2 乙醇浓度对黄酮类化合物提取效果的影响[/b]当乙醇浓度为30%,40%,50%,60%,70%时作为提取剂,超声波时间为20min,超声波温度为60℃,料液比为1:10的条件下,冷却后采用超声波提取法提取液中总黄酮含量,研究料液比对提取效果的影响。结果如图2所示[align=center]表3 乙醇浓度与提取率的关系[/align][table][tr][td][align=center]序号[/align][/td][td][align=center]1[/align][/td][td][align=center]2[/align][/td][td][align=center]3[/align][/td][td][align=center]4[/align][/td][td][align=center]5[/align][/td][/tr][tr][td][align=center]乙醇浓度(%)[/align][/td][td][align=center]30[/align][/td][td][align=center]40[/align][/td][td][align=center]50[/align][/td][td][align=center]60[/align][/td][td][align=center]70[/align][/td][/tr][tr][td][align=center]提取率(%)[/align][/td][td][align=center]2.08[/align][/td][td][align=center]2.44[/align][/td][td][align=center]3.18[/align][/td][td][align=center]2.15[/align][/td][td][align=center]1.28[/align][/td][/tr][/table][align=center][img=,457,289]http://ng1.17img.cn/bbsfiles/images/2018/07/201807091815413326_3128_2904018_3.png!w457x289.jpg[/img][/align]图3 乙醇浓度对黄芩总黄酮提取的影响[align=center] Fig.3 The effect of ethanol concentration on the extraction of flavonoids from Scutellaria[/align]由图3可见,随着乙醇浓度的增加,黄酮类化合物的提取率逐渐升高,在乙醇浓度为50%时提取率最高,再增加乙醇浓度,提取率逐渐降低。这主要是随着乙醇浓度的增加导致溶液极性的改变,使提取液中杂质含量增加,因此选择50%的乙醇溶液作为提取剂。[b]3.2.3 超声波时间对黄酮类化合物提取效果的影响[/b]当超声波时间为5min,10min,15min,20min,25min,料液比为1:10,乙醇浓度为50%,超声波温度为60℃的条件下,冷却后采用超声波提取法提取液中总黄酮含量,研究料液比对提取效果的影响。[align=center]表4 超声波时间与提取率的关系[/align][table][tr][td][align=center]序号[/align][/td][td][align=center]1[/align][/td][td][align=center]2[/align][/td][td][align=center]3[/align][/td][td][align=center]4[/align][/td][td][align=center]5[/align][/td][/tr][tr][td][align=center]超声波时间(min)[/align][/td][td][align=center]5[/align][/td][td][align=center]10[/align][/td][td][align=center]15[/align][/td][td][align=center]20[/align][/td][td][align=center]25[/align][/td][/tr][tr][td][align=center]提取率(%)[/align][/td][td][align=center]1.67[/align][/td][td][align=center]1.82[/align][/td][td][align=center]1.93[/align][/td][td][align=center]2.19[/align][/td][td][align=center]2.08[/align][/td][/tr][/table][align=center][img=,420,258]http://ng1.17img.cn/bbsfiles/images/2018/07/201807091815572952_9256_2904018_3.png!w420x258.jpg[/img][/align]图4 超声时间对黄芩总黄酮提取的影响[align=center]Fig.4 Ultrasonic time of total flavonoids extracted[/align]由图4可见,随着超声波时间的延长,黄酮类化合物提取率逐渐升高,在20min时提取率最高,继续延长超声波提取时间提取率几乎不变,主要是因为在初期,黄芩中黄酮类化合物没有完全浸提到溶剂中,而随着时间的增加,黄酮类化合物逐渐完全溶于提取剂中,因此提取率几乎不变。所以选择超声波时间为20min时进行实验。[b]3.2.4 超声波温度对黄酮类化合物提取效果的影响[/b]当超声波温度为20℃,30℃,40℃,50℃,60℃,料液比为1:10,乙醇浓度为50%,超声波时间为20min的条件下,冷却后采用超声波提取法提取液中总黄酮含,研究料液比对提取效果的影响。[align=center]表5 超声波温度与提取率的关系[/align][table][tr][td][align=center]序号[/align][/td][td][align=center]1[/align][/td][td][align=center]2[/align][/td][td][align=center]3[/align][/td][td][align=center]4[/align][/td][td][align=center]5[/align][/td][/tr][tr][td][align=center]超声波温度(℃)[/align][/td][td][align=center]20[/align][/td][td][align=center]30[/align][/td][td][align=center]40[/align][/td][td][align=center]50[/align][/td][td][align=center]60[/align][/td][/tr][tr][td][align=center]提取率(%)[/align][/td][td][align=center]1.87[/align][/td][td][align=center]2.34[/align][/td][td][align=center]2.44[/align][/td][td][align=center]2.25[/align][/td][td][align=center]2.31[color=#ff0000] [/color][/align][/td][/tr][/table][align=center][img=,360,256]http://ng1.17img.cn/bbsfiles/images/2018/07/201807091816171242_5784_2904018_3.png!w360x256.jpg[/img][/align][align=center] [/align][align=center] [/align]图5 超声温度对黄芩黄酮提取的影响[align=center]Fig.5 Skullcap ultrasonic extraction temperature on impact[/align] 由图5可见,随着超声波温度的升高,黄酮类化合物提取率逐渐升高,在40℃时提取率最高,继续升高超声波提取温度,提取率反而略有下降。高温提取的过程是先使物料升温,保持一定时间后,利用温度使细胞壁破碎,乙醇溶剂溶入细胞内部,黄酮充分溶解,再继续升高温度,反而使更多的杂质释放出来,导致黄酮提取率不再上升。所以选择超声波温度为40℃进行实验。[b]3.3 正交试验确定最佳工艺3.3.1 正交试验结果[/b]通过上述单因素试验,得出各个单因素的最佳条件,其中料液比为1:10,乙醇浓度为50%,超声时间为20min,超声温度为40℃。选择料液比、乙醇浓度、超声波时间、超声波温度4因素3水平,设计L[sub]9[/sub](3[sup]4[/sup])正交试验,因素与水平见表1,试验结果见表2为了进一步判断上述4类因素对试验结果的影响是否存在,将以正交试验数据进行方差分析,找出这些因素中起主导作用的来源。表1 正交试验因素及水平表Tab 1 Factors and levels of the orthogonal tests[table][tr][td=1,2]水平[/td][td] 因素[/td][/tr][tr][td]A B C D料液比(g/ml) 乙醇浓度(%) 超声时间(s) 超声温度(℃)[/td][/tr][tr][td=2,1]1 1:8 40 15 302 1:10 50 20 403 1:12 60 25 50[/td][/tr][/table]表2 正交试验结果及分析 Tab 2 The results and analysis of orthogonal tests [table][tr][td=1,2]试验号[/td][td] 因素[/td][td=1,2]提取量(%)[/td][/tr][tr][td]A B C D料液比(g/ml) 乙醇浓度(%) 超声时间(s) 超声温度(℃)[/td][/tr][tr][td=3,1]1 1:8 40 15 30 2.622 1:8 50 20 40 2.903 1:8 60 25 50 2.764 1:10 50 25 30 3.255 1:10 60 15 40 2.626 1:10 40 20 50 2.507 1:12 60 20 30 2.408 1:12 40 25 40 2.589 1:12 50 15 50 2.85K[sub]1[/sub]/3 2.76 2.57 2.70 2.76K[sub]2[/sub]/3 2.79 3.00 2.60 2.70K[sub]3[/sub]/3 2.61 2.59 2.86 2.70R 0.18 0.43 0.26 0.06[/td][/tr][/table]由表1、2可知,主次因素由极差大小确定:B>C>A>D,即影响黄芩总黄酮提取效率的因素贡献率为乙醇浓度>超声时间>料液比>超声温度。以总黄酮含量为评价指标,得最佳提取工艺条件为A[sub]2[/sub]B[sub]2[/sub]C[sub]3[/sub] D[sub]1[/sub],即乙醇浓度为50%、超声时间为25min、料液比为1∶10、超声温度为30℃。最佳条件为正交表中的第四组,因此测抗氧化性实验选择此组数据。[b]3.4 总黄酮的抗氧化性3.4.1 对羟自由基的清除作用[/b][align=center]表6 提取液浓度对羟基自由基清除率[/align][table][tr][td][align=center]序号[/align][/td][td][align=center]1[/align][/td][td][align=center]2[/align][/td][td][align=center]3[/align][/td][td][align=center]4[/align][/td][td][align=center]5[/align][/td][/tr][tr][td][align=center]提取液浓度/(mg/ml)[/align][/td][td][align=center]0.0025[/align][/td][td][align=center]0.0050[/align][/td][td][align=center]0.0075[/align][/td][td][align=center]0.0100[/align][/td][td][align=center]0.0125[/align][/td][/tr][tr][td][align=center]VC清除率(%)[/align][/td][td][align=center]20.54[/align][/td][td][align=center]42.88[/align][/td][td][align=center]59.39[/align][/td][td][align=center]74.44[/align][/td][td][align=center]79.09[/align][/td][/tr][tr][td][align=center]黄酮清除率(%)[/align][/td][td][align=center]40.39[/align][/td][td][align=center]67.21[/align][/td][td][align=center]78.42[/align][/td][td][align=center]85.29[/align][/td][td][align=center]88.30[/align][/td][/tr][/table][align=center][img=,360,256]http://ng1.17img.cn/bbsfiles/images/2018/07/201807091816376703_5430_2904018_3.png!w360x256.jpg[/img][/align]图6 黄芩总黄酮对羟自由基的清除Fig.6 Scutellaria Flavonoids on Scavenging of Hydroxyl Radicals黄芩总黄酮对羟自由基的清除作用,结果见图6。由图6可知,黄芩总黄酮对羟基自由基具有一定的清除作用。在相同的浓度范围下,清除能力大小为:提取物VC溶液。在0.0025—0.0125mg/ml浓度下,各溶液的清除能力都随浓度的增大而增大。当提取液浓度为0.0125mg/ml下,黄芩提取液的清除率达到了88.30%。3.4.2 [b]对超氧自由基的清除作用[/b][align=center]表7 提取液浓度对超氧基自由基清除率[/align][table][tr][td][align=center]序号[/align][/td][td][align=center]1[/align][/td][td][align=center]2[/align][/td][td][align=center]3[/align][/td][td][align=center]4[/align][/td][td][align=center]5[/align][/td][/tr][tr][td][align=center]提取液浓度/(mg/ml)[/align][/td][td][align=center]0.0025[/align][/td][td][align=center]0.0050[/align][/td][td][align=center]0.0075[/align][/td][td][align=center]0.0100[/align][/td][td][align=center]0.0125[/align][/td][/tr][tr][td][align=center]VC清除率(%)[/align][/td][td][align=center]26.77[/align][/td][td][align=center]43.09[/align][/td][td][align=center]61.73[/align][/td][td][align=center]78.69[/align][/td][td][align=center]80.20[/align][/td][/tr][tr][td][align=center]黄酮清除率(%)[/align][/td][td][align=center]49.81[/align][/td][td][align=center]75.29[/align][/td][td][align=center]84.38[/align][/td][td][align=center]89.21[/align][/td][td][align=center]90.01[/align][/td][/tr][/table]黄芩总黄酮对超氧自由基的清除作用,结果见图7。由图7可知,黄芩总黄酮对邻苯三酚自氧化产生的超氧自由基有一定的清除作用,其清除率随浓度的增大而增大。在相同的浓度范围下,清除能力大小为:提取物VC溶液。各溶液的清除能力都随浓度的增大而增大。当提取液浓度为0.0125mg/ml下,黄芩提取液的清除率达到了90.01%。3.4.3 [b]对DPPH自由基的清除作用[/b][align=center]表8 提取液浓度对DPPH自由基清除率[/align][table][tr][td][align=center]序号[/align][/td][td][align=center]1[/align][/td][td][align=center]2[/align][/td][td][align=center]3[/align][/td][td][align=center]4[/align][/td][td][align=center]5[/align][/td][/tr][tr][td][align=center]提取液浓度/(mg/ml)[/align][/td][td][align=center]0.0025[/align][/td][td][align=center]0.0050[/align][/td][td][align=center]0.0075[/align][/td][td][align=center]0.0100[/align][/td][td][align=center]0.0125[/align][/td][/tr][tr][td][align=center]Vc清除率(%)[/align][/td][td][align=center]27.36[/align][/td][td][align=center]52.41[/align][/td][td][align=center]79.98[/align][/td][td][align=center]80.49[/align][/td][td][align=center]81.31[/align][/td][/tr][tr][td][align=center]黄酮清除率(%)[/align][/td][td][align=center]55.7[/align][/td][td][align=center]82.3[/align][/td][td][align=center]89.78[/align][/td][td][align=center]93.74[/align][/td][td][align=center]93.81[/align][/td][/tr][/table][b] [/b]黄芩总黄酮对DPPH的清除作用,结果见图8。由图8可知,黄芩总黄酮对DPPH有一定的清除作用,其清除率随浓度的增大而增大。相同的浓度范围下,清除能力大小为:提取物VC溶液。各溶液的清除能力都随浓度的增大而增大。当提取液浓度为0.0125mg/ml下,黄芩提取液的清除率达到了93.81%。[b]4.总结[/b]1.通过单因素实验,得出各个单因素的最佳条件,其中料液比为1:10,乙醇浓度为50%,超声时间为20min,超声温度为40℃,为正交试验奠定了基础。然后用设计正交试验,确定了超声辅助法提取黄芩总黄酮的最佳工艺条件:乙醇浓度为50%、超声时间为25min、料液比为1∶10、超声温度为30℃。黄芩总黄酮的提取率为3.25%。2.本实验分别就黄芩提取物对羟基自由基,超氧阴离子自由基和DPPH自由基的抗氧化性进行了测定,并与VC进行了对比实验,得到如下结论:在0.0025—0.0125mg/ml浓度下,提取物对各自由基清除能力为:DPPH O[sub]2[/sub][sup]-[/sup]• • OH ,同浓度黄芩提取物清除能力普遍高于VC溶液,黄芩黄酮提取液和VC溶液对自由基清除率随其浓度的增大而增大。在浓度为0.0125mg/ml下,对羟基自由基的清除率为88.30%,对超氧基自由基的清除率为90.01%,对DPPH自由基的清除率为93.87%,由此可知黄芩总黄酮是一种天然有效的自由基清除剂。黄芩中黄酮类化合物的利用已经有一定的规模,但黄芩中黄酮化合物的提取方法和工艺尚未成熟,所以充分利用黄芩资源是我国药用研究的科学发展方向。基于提取率、成本等因素的影响,通过对各种因素的比较分析,从而探索开发出适合工业化生产应用的方案,提高黄芩利用率,仍是研究工作的重点之一。随着人们对健康的日渐重视,因黄芩中的黄酮化合物有着极高的药用营养及良好的保健作用,具有极为广阔的市场前景[b]。[/b]本文旨在研究黄芩中黄酮类物质的提取工艺及其体外抗氧化活性,为黄芩中黄酮类化合物作为天然抗氧化剂和功能性药品得到开发利用提供理论基础和实验依据。[align=center][b] [/b][/align] 刘雄,高建德.黄芩研究进展.甘肃中医学院,2007,24(2):46-50. 罗小文.黄芩中黄酮类成分提取工艺研究进展.中国现代中药.2010,12(7):5-8. 张睿,徐雅琴,时阳.黄酮类化合物提取工艺研究.食品与机械.2003,15(1):21-22. 梁丹,张保东.黄酮类化合物提取和分离方法研究进展.周口师范学院学报,2007,24(5):87-89. 龙春,高志强,陈凤鸣,等.黄酮类化合物的结构-抗氧化活性研究进展.重庆文理学院学报.2006,5(2):13-15. 刘雄,高建德.黄岑研究进展.甘肃中医学院学报,2007,24(2):46-50. 郭雪峰, 岳永德. 黄酮类化合物的提取-分离纯化和含量测定方法的研究进展. 安徽农业科学. 2007, 35(26): 8083- 8086.. 唐德智.黄酮类化合物的提取、分离、纯化研究进展.中药与天然产物,2009,21(12):101-104.. 张岩, 曹国杰, 张燕,等. 黄酮类化合物的提取以及检测方法的研究进展.天食品研究与开发,2008,29(1):154-157. 韩雅慧,陶宁萍.甘草黄酮提取及其抗氧化能力测定方法研究进展.山西农业科学,2010, 38(11):89- 93. 崔永明,余龙江,等. 甘草总黄酮的提取技术及其抑菌活性研究.中药材,2006, 29(8): 838-840. 孙墨珑, 宋湛谦, 方桂珍. 核桃楸总黄酮的提取工艺.东北林业大学学报, 2006, 34 (1) : 38 - 39. 徐清萍,钟桂,芳孟君. 抗氧化剂抗氧化方法研究进展.食品工程,2007,6(7):23-25. 安卓,贾昌喜.苦苣菜总黄酮提取、纯化工艺优化抗氧化活性研究.食品科学. 赵新淮.大黄醇提取物对三种自由基的清除能力的研究.东北农业大学学报.1998,29(3):284-288 杨立琛,李荣.花椒叶黄酮的微波提取及其成分分析.食品科学. CHI Ru-an,ZHOU Fang,HUANG Kun,ZHANG Yue-fei.Separation of baicalin form Scutellaria Baicalensis Georgi with polyamide.Key Laboratory for Green Chemical Process of Ministry of Education.2008,15(1):606-611.






 留言咨询
留言咨询

 留言咨询
留言咨询

 留言咨询
留言咨询


