推荐厂家
暂无
暂无
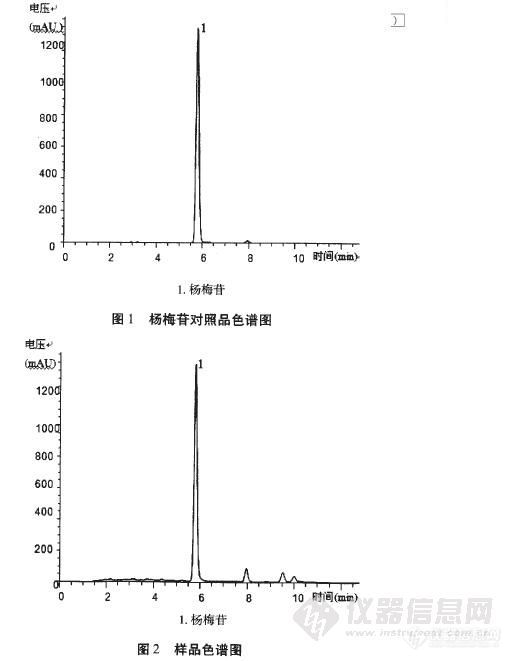
作者:齐洁;万竹青;李默影;吴秋月;刘丽芳(中国药科大学天然药物活性物质与功能国家重点实验室 江苏南京210009)摘要:目的:建立HPLC法测定杨梅叶中杨梅苷含量的方法。方法:采用DiamonsilC18(150mm×4.6mm,5耻m)柱,流动相乙腈-0.1%磷酸水溶液梯度洗脱,流速1.0mL/min,检测波长358nm,柱温30cC。结果:杨梅苷在0.088-0.880mg/mL内与峰面积呈良好线性关系,A=36113C-401.56,r=0.9994;平均回收率为102.4%,RSD:1.9%(n:9)。测得杨梅叶中杨梅苷含量为1.43%。结论:该测定方法准确,可靠,对于杨梅的进一步开发利用具有重要的参考意义。谱图:http://ng1.17img.cn/bbsfiles/images/2012/08/201208211741_385107_1609970_3.jpg

[align=center][color=#444444][img=,380,275]https://ng1.17img.cn/bbsfiles/images/2019/08/201908200938344012_6965_676_3.png!w380x275.jpg[/img][/color][/align][color=#444444]1、杨梅对大肠杆菌、痢疾杆菌等细菌有抑制作用,能治痢疾腹痛,对下痢不止者亦有良效。杨梅性味酸涩,具有收敛消炎作用,加之其能够抑菌,故还可治各种泄泻。而杨梅树皮含鞣质、杨梅树皮甙等,也是主治痢疾、目翳、牙痛、恶疮疥癞等病症的良品。[/color][color=#444444]2、生津止渴是夏季祛暑之良品可以预防中暑去痧解除烦渴。且助消化增食欲,因其含有多种有机酸,维生素C的含量也十分丰富,鲜果味酸,食之可增加胃中酸度,消化食物,促进食欲。[/color][color=#444444]3、降血压防中风。杨梅鲜果中钾的含量极为丰富,每100克鲜果含钾量达100毫克左右。钾元素在维持心脏功能、参与新陈代谢以及降低血压等方面的功效突出,还有助于调节情感,稳定情绪,减少中风的发病率。因此具有理气活血,调节血脂,降低胆固醇和血压,预防中风等作用。[/color][color=#444444]4、防癌抗癌杨梅中含有维生素C、B对防癌抗癌有积极作用。杨梅核仁中含有维生素B17,这是一种抗癌物质,所含的氰苷类、脂肪油等也有抑制癌细胞的作用。[/color][color=#444444]5、注意事项。一般人群均能食用,但溃疡病患者慎食牙疼、胃酸过多、上火的人不要多吃糖尿病患者忌食。[/color]
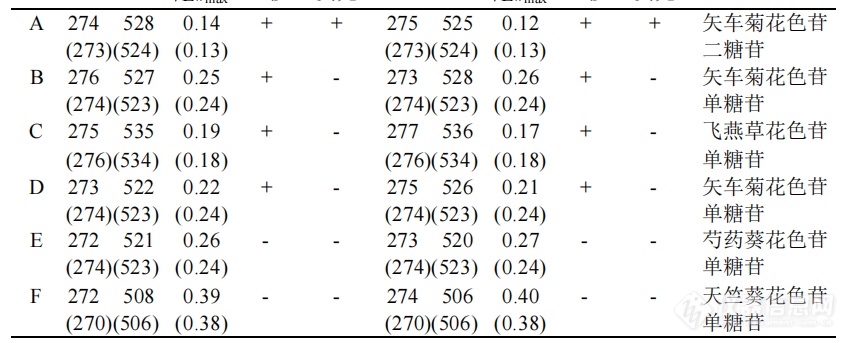
[align=center][/align][align=center][font='仿宋'][size=16px][color=#000000]丁磊[/color][/size][/font][/align][align=center][font='黑体'][size=21px][color=#000000]目录[/color][/size][/font][/align][url=#_Toc6221][font='calibri'][size=14px]第1章:食品着色剂的开发和利用[/size][/font][/url][font='calibri'][size=14px]3[/size][/font][url=#_Toc25066][font='calibri'][size=14px]1.1食品着色剂[/size][/font][/url][font='calibri'][size=14px]3[/size][/font][url=#_Toc22488][font='calibri'][size=14px]1.2食品天然着色剂[/size][/font][/url][font='calibri'][size=14px]3[/size][/font][url=#_Toc27630][font='calibri'][size=14px]1.3食品天然着色剂与应用[/size][/font][/url][font='calibri'][size=14px]4[/size][/font][url=#_Toc17278][font='calibri'][size=14px]第2章:杨梅红色素的提取与分析[/size][/font][/url][font='calibri'][size=14px]5[/size][/font][url=#_Toc24833][font='calibri'][size=14px]2.1杨梅[/size][/font][/url][font='calibri'][size=14px]5[/size][/font][url=#_Toc15566][font='calibri'][size=14px]2.2提取实验仪器与方法[/size][/font][/url][font='calibri'][size=14px]5[/size][/font][url=#_Toc27032][font='calibri'][size=14px]2.21实验仪器[/size][/font][/url][font='calibri'][size=14px]5[/size][/font][url=#_Toc19226][font='calibri'][size=14px]2.22实验方法[/size][/font][/url][font='calibri'][size=14px]5[/size][/font][url=#_Toc13728][font='calibri'][size=14px]2.23杨梅红色素组成鉴定[/size][/font][/url][font='calibri'][size=14px]6[/size][/font][url=#_Toc13535][font='calibri'][size=14px]2.3杨梅红色素的组成[/size][/font][/url][font='calibri'][size=14px]6[/size][/font][url=#_Toc30430][font='calibri'][size=14px]第三章:杨梅红色素的理化性质[/size][/font][/url][font='calibri'][size=14px]7[/size][/font][url=#_Toc15645][font='calibri'][size=14px]3.1研究方法[/size][/font][/url][font='calibri'][size=14px]7[/size][/font][url=#_Toc9051][font='calibri'][size=14px]3.1.1[/size][/font][/url][url=#_Toc9051][font='calibri'][size=14px]杨梅红色素的光谱试验取测试液[/size][/font][/url][font='calibri'][size=14px]7[/size][/font][url=#_Toc27803][font='calibri'][size=14px]3.1.2 p[/size][/font][/url][url=#_Toc27803][font='calibri'][size=14px]H值对杨梅红色素稳定性的影响[/size][/font][/url][font='calibri'][size=14px]8[/size][/font][url=#_Toc26656][font='calibri'][size=14px]3.1.3[/size][/font][/url][url=#_Toc26656][font='calibri'][size=14px]温度对杨梅红色素稳定性的影响[/size][/font][/url][font='calibri'][size=14px]8[/size][/font][url=#_Toc20019][font='calibri'][size=14px]3.1.4[/size][/font][/url][url=#_Toc20019][font='calibri'][size=14px]氧化剂对杨梅红色素的影响[/size][/font][/url][font='calibri'][size=14px]8[/size][/font][url=#_Toc14023][font='calibri'][size=14px]3.1.5[/size][/font][/url][url=#_Toc14023][font='calibri'][size=14px]还原剂对杨梅红色素的影响 [/size][/font][/url][font='calibri'][size=14px]8[/size][/font][url=#_Toc32406][font='calibri'][size=14px]3.1.8[/size][/font][/url][url=#_Toc32406][font='calibri'][size=14px]金属离子对杨梅红色素稳定性的影响[/size][/font][/url][font='calibri'][size=14px]8[/size][/font][url=#_Toc27826][font='calibri'][size=14px]3.2结果分析[/size][/font][/url][font='calibri'][size=14px]9[/size][/font][url=#_Toc13106][font='calibri'][size=14px]3.3结论分析[/size][/font][/url][font='calibri'][size=14px]12[/size][/font][url=#_Toc18666][font='calibri'][size=14px]参考文献[/size][/font][/url][font='calibri'][size=14px]13[/size][/font][align=center][/align][align=center][font='calibri'][size=14px]第1章:食品着色剂的开发和利用[/size][/font][/align][align=left][font='calibri'][size=14px]1.1食品着色剂[/size][/font][/align][align=left][font='宋体'][size=16px]食品着色剂(Food Colorant)又称食品色素,是以食品着色为主要目的的一类食品添加剂。食品的色泽是人们对于食品食用前的第一个感性接触,是人们辨别食品优劣,对其做出初步判别的基础,也是食品质量的一个重要指标。食品天然的颜色,可以预见其营养价值、变质与否以及商品价值的高低。食品若具有鲜艳的色泽不仅可以提高食品的感官性质,给人以美的享受,还可以引起人们的食欲。反之,若食品在加工过程中,由于受到光、热、氧气或化学药剂作用等各种原因,使天然色素褪色或造成食品色变而失去光泽,引起色泽失真,会使人产生一种不协调的食品变质的错觉,从而严重影响食品的感官质量。因此,在食品加工中为了更好地保持或改善食品的色泽,需要向食品中添加一些食品着色剂。[/size][/font][font='宋体'][size=16px] [/size][/font][font='宋体'][size=16px]食用着色剂是食品添加剂的重要组成部分,不仅广泛应用于饮料、酒类、糕点、糖果等饮料食品,以改善其感官质量,而且也大量用于医药和化妆品生产中。[/size][/font][font='宋体'][size=16px] [/size][/font][/align][align=left][font='calibri'][size=14px]1.2食品天然着色剂[/size][/font][/align][align=left][font='宋体'][size=16px]食品天然着色剂,也称食品天然色素,主要是指从动、植物和微生物中提取的着色剂,一些品种还具有维生素活性(如β胡萝卜素),有的还具有一定的生物活性功能(如栀子黄、红花黄等)。其品种繁多,色泽自然,无毒性,而且使用范围和日允许用量(ADI)都比合成着色剂宽,但也存在成本高、着色力弱、稳定性差、容易变质,-些品种还有异味、异臭、难以调出任意色等缺点。近年来天然着色剂的开发应用发展很快,一-些国家天然着色剂的用量已超过合成着色剂。天然食用色素按其来源不同,主要有以下三类:①植物色素,如甜菜红、姜黄、β胡萝卜素、叶绿素等 ②动物色素,如紫胶红、胭脂虫红等 ③微生物类,如红曲红等。按其化学结构可以分成六类:①四吡略衍生物(卟啉类衍生物),如叶绿素等 ②异戊二烯衍生物,如辣椒红、β胡萝卜素、栀子黄等 ③多酚类衍生物,如越橘红、葡萄皮红、玫瑰茄红、萝卜红、红米红等 ④酮类衔生物,如红曲红、姜黄素等 ⑤醌类衍生物,如紫胶红、胭脂虫红等 ⑥其他,如甜菜红等。按照溶解性质的不同,天然食用着色剂可分为水溶性和油溶性两类。但是其溶解性是可以改变的,如β胡萝卜素不溶于水,在脂肪为主的食品中溶解较慢,且易被氧化,但经工艺处理后,则可以转变为可溶于水、油,又可延缓氧化。[/size][/font][font='宋体'][size=16px] [/size][/font][font='宋体'][size=16px]在19世纪中叶以前,主要是应用一些比较粗制的天然色素作为食用着色剂 随着化学工业的发展,合成色素相继问世,并以其具有色泽鲜艳、稳定性好、着色力强、适于调色、易于溶解、品质均一、 无臭无味以及价格 便宜的优点,很快就取代了食用天然着色剂在食品中的应用。但随着毒理学研究的进展,合成者色剂作为食品添加剂的安全性问题受到广泛关注,很多国家部分甚至全部禁止了食用合成者色剂,所以,食品着色剂,特别是食品天然着色利的研究与开发有着广蟈的发展前景和很大的市场潜力。[/size][/font][/align][align=left][font='calibri'][size=14px]1.3食品天然着色剂与应用[/size][/font][/align][align=left][font='宋体'][size=16px]食品天然着色剂以植物性着色剂占多数。天然食品着色剂不仅安全,而且许多具有一童说.定的营养价值和生理活性:如β胡萝卜素不仅是食品天然着色剂,同时还是一种重要的营养强化剂,在防癌抗癌和预防心血管疾病方面具有明显作用。目前,许多国家和地区都致力于天然着色剂的发掘和研制。由于食品天然着色剂的安全性较高,因而发展较快,世界各国许可使用的品种和用量都在不断增加,国际上开发出的天然着色剂已有100种以上。[/size][/font][font='宋体'][size=16px] [/size][/font][font='宋体'][size=16px]大力发展天然着色剂已成为食品着色剂的发展方向。缺点:成本高、着色力弱.稳定性差容胃天然着色剂作为食品添加剂的一种已经被人们所接受,而且随着人们对食品添加剂安有些身全性意识的提高,大力开发“天然、营养、多功能”的食用天然色素,如胡萝卜、黄酮类异口.色素等,将越来越得到人们的重视。但天然着色剂来自于天然产物,其成分复杂,而且有难叭的未经完全分离、精制和鉴定,所以研究天然色素中成分的结构、性质以及它们的功能性任常和安全性也是食用天然色素面临的重要课题。[/size][/font][/align][align=center][/align][align=center][font='calibri'][size=14px]第2章:杨梅红色素的提取与分析[/size][/font][/align][align=center][/align][align=left][font='calibri'][size=14px]2.1杨梅[/size][/font][/align][align=left][font='宋体'][size=16px][color=#000000]杨梅:属于[/color][/size][/font][url=https://baike.baidu.com/item/%E6%9C%A8%E5%85%B0%E7%BA%B2][font='宋体'][size=16px][color=#000000]木兰纲[/color][/size][/font][/url][font='宋体'][size=16px][color=#000000]、杨梅科、杨梅属小乔木或灌木植物,又称圣生梅、白蒂梅、[/color][/size][/font][url=https://baike.baidu.com/item/%E6%A0%91%E6%A2%85][font='宋体'][size=16px][color=#000000]树梅[/color][/size][/font][/url][font='宋体'][size=16px][color=#000000]具有很高的药用和食用价值,在中国[/color][/size][/font][url=https://baike.baidu.com/item/%E5%8D%8E%E4%B8%9C][font='宋体'][size=16px][color=#000000]华东[/color][/size][/font][/url][font='宋体'][size=16px][color=#000000]和湖南、广东、广西、贵州等地区均有分布。杨梅原产中国浙江余姚,1973年余姚境内发掘新石器时代的河姆渡遗址时发现杨梅属花粉,说明在7000多年以前该地区就有杨梅生长。该属有50多个种,中国已知的有杨梅、[/color][/size][/font][url=https://baike.baidu.com/item/%E7%99%BD%E6%9D%A8%E6%A2%85][font='宋体'][size=16px][color=#000000]白杨梅[/color][/size][/font][/url][font='宋体'][size=16px][color=#000000]、[/color][/size][/font][url=https://baike.baidu.com/item/%E6%AF%9B%E6%9D%A8%E6%A2%85][font='宋体'][size=16px][color=#000000]毛杨梅[/color][/size][/font][/url][font='宋体'][size=16px][color=#000000]、[/color][/size][/font][url=https://baike.baidu.com/item/%E9%9D%92%E6%9D%A8%E6%A2%85][font='宋体'][size=16px][color=#000000]青杨梅[/color][/size][/font][/url][font='宋体'][size=16px][color=#000000]和[/color][/size][/font][url=https://baike.baidu.com/item/%E7%9F%AE%E6%9D%A8%E6%A2%85][font='宋体'][size=16px][color=#000000]矮杨梅[/color][/size][/font][/url][font='宋体'][size=16px][color=#000000],经济栽培主要是杨梅。杨梅枝繁叶茂,树冠圆整,初夏又有红果累累,十分可爱,是园林绿化结合生产的优良树种。孤植、丛植于[/color][/size][/font][url=https://baike.baidu.com/item/%E8%8D%89%E5%9D%AA/8938060][font='宋体'][size=16px][color=#000000]草坪[/color][/size][/font][/url][font='宋体'][size=16px][color=#000000]、[/color][/size][/font][url=https://baike.baidu.com/item/%E5%BA%AD%E9%99%A2/181202][font='宋体'][size=16px][color=#000000]庭院[/color][/size][/font][/url][font='宋体'][size=16px][color=#000000],或列植于[/color][/size][/font][url=https://baike.baidu.com/item/%E8%B7%AF%E8%BE%B9/8962003][font='宋体'][size=16px][color=#000000]路边[/color][/size][/font][/url][font='宋体'][size=16px][color=#000000]都很合适;若采用密植方式来分隔空间或起遮蔽作用也很理想。经济用途果味酸甜适中,既可直接食用,又可加工成杨梅干、酱、蜜饯等,还可酿酒,有止渴、生津、助消化等功能。[/color][/size][/font][/align][font='calibri'][size=14px]2.2提取实验仪器与方法[/size][/font][font='calibri'][size=14px]2.21实验仪器[/size][/font][align=left][font='宋体'][size=16px][color=#000000]HPLC 仪(waters 600,GBC),UV-1200 仪(USA,PE 公司),723 型分光光度计(上海第三 分析仪器厂),超级恒温水浴锅(±0.2℃,重庆试验设备厂),pHS-3B 精密 pH 计(上海雷磁仪 器厂)。无水乙醇、甲醇、乙醚、石油醚、氯仿、丙酮,Al(NO3)3、Fe(NO3)3 等试剂,均为 AR级。“早红杨梅”、“海红杨梅”(市售)[/color][/size][/font][/align][font='calibri'][size=14px]2.22实验方法[/size][/font][align=left][font='宋体'][size=16px][color=#000000]提取 分别取“早红杨梅”、“海红杨梅”鲜果,洗净、滤干、压榨,各称取干渣 100g, 加 5000mL 1%(V/V)HCl-甲醇溶液,在高速匀浆机中控制 3000r/min 捣碎 5min,移入烧杯, 4℃下存放 12h,以 8000r/min,离心 6min,取上清液,分装入真空旋转蒸发器中于 25℃下浓缩 至 50mL,依次编为Ⅰ、Ⅱ。 [/color][/size][/font][/align][align=left][font='宋体'][size=16px][color=#000000] 取浓缩液于定性新华滤纸(50cm×40cm)上点样数次,吹干后在 1%(V/V)HCl 水溶液中层析 5h,取出风干,裁下红色部分,继用 0.01%(V/V)HCl-甲醇溶液解析,然后真空 浓缩至 5mL。浓缩液再点样、层析[展开剂(BAW)为正丁醇:冰醋酸:水=4:1:5]12h,取出 风干,剪取红色部分,用 0.01%HCl 解析,浓缩后点样,再层析[展开剂:15%(V/V)HAc]5h, 取出风干,红色部分用 0.01%HCl-甲醇溶液解析,真空浓缩、干燥,得“早红”杨梅红色素(Ⅰ)、 “海红”杨梅红色素( Ⅱ)。[/color][/size][/font][/align][font='calibri'][size=14px]2.23杨梅红色素组成鉴定[/size][/font][align=left][font='宋体'][size=16px][color=#000000]杨梅红色素组成鉴定 分别取 0.1mgI、Ⅱ杨梅红色素,用 5mL 1mol/L HCl 溶解,100 ±0.2℃保持 40min,冷却后加 2.5mL 戊醇,振荡,静置 15min。取有机相点样、层析[展开剂 为 BAW,1%HCl、Formic(HCOOH:浓 HCl:H2O=5:2:3)],测定 Rf 值;取水相用 HPLC 法鉴定, 标准糖为葡萄糖、半乳糖、阿拉伯糖、鼠李糖和木糖。 光谱分析 分别扫描Ⅰ、Ⅱ溶液及加 1.50mL 0.5%(W/V)AlCl3-CH3OH 溶液后的 UV-VIS 光谱,同时观测 254nm 紫外分析灯下斑点的荧光。[/color][/size][/font][/align][align=left][/align][font='calibri'][size=14px]2.3杨梅红色素的组成[/size][/font][align=left][font='宋体'][size=16px][color=#000000]有机相经纸色谱分析,结果表明:Ⅰ、 Ⅱ均有 6 条谱带,其中 D 谱带分别占 95%、96%, 其余含量甚微;与文献[7]的 Rf 值比较,可推出 D 带为矢车菊花色苷元,其余可能为天竺葵花 色苷、飞燕草花色苷元和芍药花色苷等,详见表 1。 表 1 “早红”、“海红”杨梅红色素的 Rf 值。[/color][/size][/font][/align][align=left][img]https://ng1.17img.cn/bbsfiles/images/2021/06/202106191602003652_6234_1608728_3.jpeg[/img][/align][align=left][font='宋体'][size=13px][color=#000000]([/color][/size][/font][font='宋体'][size=16px][color=#000000])内数据为文献[7]数值,下同。 [/color][/size][/font][/align][align=left][font='宋体'][size=16px][color=#000000]水相用 HPLC 法检测,“早红”和“海红”杨梅水解的糖的保留值为 6.18 与 6.19min,而标 准葡萄糖为 6.21min,半乳糖 6.52min,阿拉伯糖 5.24min。由此可推测,“早红”及“海红”杨梅 花色苷中的糖为葡萄糖。 [/color][/size][/font][/align][align=left][font='宋体'][size=16px][color=#000000]I 和Ⅱ的 6 条纸色谱带洗脱液的 UV—VIS 光谱数据表明:两种色素于 UV 和 VIS 区均有 最大吸收峰,当有 Al3+存在时,A、B、C、D 谱带在 VIS 区的最大吸收峰发生红移,说明β 环有邻位羟即含有矢车菊、牵牛花和飞燕草花色苷。在紫外灯下除 A 谱带外,无荧光现象, 说明花色苷的α位上无羟基。[/color][/size][/font][/align][align=left][/align][align=left][/align][align=left][img]https://ng1.17img.cn/bbsfiles/images/2021/06/202106191602003393_3153_1608728_3.png[/img][/align][align=left][/align][align=left][font='宋体'][size=16px][color=#000000]据文献[7],在单苷中 E440/Eλmax=0.24,E1λmax/E2λmax=0.60 者只有矢车菊花色苷元-3-葡萄糖苷和芍药花色苷元-3-葡萄糖苷,从而推测 I、Ⅱ的花色苷组成主要为矢车菊花色苷,少量芍药 花色苷和天竺葵花色苷。[/color][/size][/font][/align][align=center][font='calibri'][size=14px]第三章:杨梅红色素的理化性质[/size][/font][/align][align=left][/align][font='calibri'][size=14px]3.1研究方法[/size][/font][align=left][/align][font='calibri'][size=14px]3.1.1[/size][/font][font='calibri'][size=14px]杨梅红色素的光谱试验取测试液[/size][/font][align=left][font='宋体'][size=16px]在440~560[/size][/font][font='宋体'][size=16px]n[/size][/font][font='宋体'][size=16px]m的波长范围扫描,得到红色素液的光谱图。[/size][/font][/align][align=left][/align][align=left][/align][align=left][/align][align=left]3.1.2 pH值对杨梅红色素稳定性的影响[/align][align=left][font='宋体'][size=16px]取等量的测试液11份于小烧杯中,用稀HC[/size][/font][font='宋体'][size=16px]L[/size][/font][font='宋体'][size=16px]和稀NaOH溶液调节PH值,放置5mi[/size][/font][font='宋体'][size=16px]n[/size][/font][font='宋体'][size=16px]于510[/size][/font][font='宋体'][size=16px]n[/size][/font][font='宋体'][size=16px]m处测吸光值。[/size][/font][/align][align=left]3.1.3温度对杨梅红色素稳定性的影响[/align][align=left][font='宋体'][size=16px]配置p[/size][/font][font='宋体'][size=16px]H值为[/size][/font][font='宋体'][size=16px]3和pH为5[/size][/font][font='宋体'][size=16px]的一定浓度的红色素溶液20mI,分别在25(室温)40.60.80°C[/size][/font][font='宋体'][size=16px].[/size][/font][font='宋体'][size=16px]沸水的恒温水浴中保存2[/size][/font][font='宋体'][size=16px]h[/size][/font][font='宋体'][size=16px]测吸光度。[/size][/font][/align][align=left][/align][font='calibri'][size=14px]3.1.4[/size][/font][font='calibri'][size=14px]氧化剂对杨梅红色素的影响[/size][/font][align=left][font='宋体'][size=16px]以[/size][/font][font='宋体'][size=16px]和[/size][/font][font='宋体'][size=16px]为氧化剂,在测试液中分别加入10mL[/size][/font][font='宋体'][size=16px]0.[/size][/font][font='宋体'][size=16px]01%、[/size][/font][font='宋体'][size=16px]0.[/size][/font][font='宋体'][size=16px]02%、1.0%(不超过一般食品中的最大安全使用量2[/size][/font][font='宋体'][size=16px].[/size][/font][font='宋体'][size=16px]0% )”的溶[/size][/font][font='宋体'][size=16px]溶液,[/size][/font][font='宋体'][size=16px]或5mL0[/size][/font][font='宋体'][size=16px].[/size][/font][font='宋体'][size=16px]10、0[/size][/font][font='宋体'][size=16px].[/size][/font][font='宋体'][size=16px]50、1.00m[/size][/font][font='宋体'][size=16px]g[/size][/font][font='宋体'][size=16px]/mL的[/size][/font][font='宋体'][size=16px]溶液,测定吸光度值。[/size][/font][/align][align=left]3.1.5还原剂对杨梅红色素的影响 [/align][align=left][font='宋体'][size=16px]以[/size][/font][font='宋体'][size=16px]为还原剂,在测试液中分别加入10mL0.01、[/size][/font][font='宋体'][size=16px]0.[/size][/font][font='宋体'][size=16px]06、[/size][/font][font='宋体'][size=16px]0.[/size][/font][font='宋体'][size=16px]20m[/size][/font][font='宋体'][size=16px]g[/size][/font][font='宋体'][size=16px]/mL的[/size][/font][font='宋体'][size=16px]溶液,测定吸光度值。以维生素C为还原剂,在测试液中加入0.2.4[/size][/font][font='宋体'][size=16px].[/size][/font][font='宋体'][size=16px]6[/size][/font][font='宋体'][size=16px].[/size][/font][font='宋体'][size=16px]8.10mL1[/size][/font][font='宋体'][size=16px]0.[/size][/font][font='宋体'][size=16px]0mg/mI的维生素C溶液,测定吸光度值。[/size][/font]3.1.6食品基质对杨梅红色素稳定性的影响[/align][align=left][font='宋体'][size=16px] [/size][/font][font='宋体'][size=16px] [/size][/font][font='宋体'][size=16px]取一定浓度PH值为3的红色素溶液各20m[/size][/font][font='宋体'][size=16px]L[/size][/font][font='宋体'][size=16px],加入葡萄糖、蔗糖、淀粉、食盐各0、2、4、6、8、10mL10.0mg/[/size][/font][font='宋体'][size=16px]mL[/size][/font][font='宋体'][size=16px]浓度的基质,放置120min测吸光度值。[/size][/font]3.1.7自然光对杨梅红色素稳定性的影响[/align][align=left][font='宋体'][size=16px]取等量的测试液2份,在25°C[/size][/font][font='宋体'][size=16px].[/size][/font][font='宋体'][size=16px](室温)下,1份避光保存,另1份不避光。每隔1d测1次吸光度。[/size][/font][/align][align=left][/align][font='calibri'][size=14px]3.1.8[/size][/font][font='calibri'][size=14px]金属离子对杨梅红色素稳定性的影响[/size][/font][align=left][font='宋体'][size=16px]取等量的测试液8份,1份不添加金属离子,其余分别加入2[/size][/font][font='宋体'][size=16px].[/size][/font][font='宋体'][size=16px]0m[/size][/font][font='宋体'][size=16px]g[/size][/font][font='宋体'][size=16px]/mI.[/size][/font][font='宋体'][size=16px]、[/size][/font][font='宋体'][size=16px]、[/size][/font][font='宋体'][size=16px]、[/size][/font][font='宋体'][size=16px]、[/size][/font][font='宋体'][size=16px]、[/size][/font][font='宋体'][size=16px]、[/size][/font][font='宋体'][size=16px]、[/size][/font][font='宋体'][size=16px]、[/size][/font][size=16px]2mL[/size][font='宋体'][size=16px]放置30m[/size][/font][font='宋体'][size=16px]in[/size][/font][font='宋体'][size=16px]和测定吸光度。[/size][/font][/align][align=left][/align][font='calibri'][size=14px]3.2结果分析[/size][/font][align=left][/align][align=left][font='黑体'][size=16px]3.2.1杨梅红色素的光谱试验。[/size][/font][/align][align=left][font='宋体'][size=16px]杨梅红色素在可见光范围440~560[/size][/font][font='宋体'][size=16px]n[/size][/font][font='宋体'][size=16px]m处有最大吸收波长为510[/size][/font][font='宋体'][size=16px]n[/size][/font][font='宋体'][size=16px]m[/size][/font][font='宋体'][size=16px]。[/size][/font][/align][align=left][/align][align=left][font='黑体'][size=16px]3.2.2 pH值对杨梅红色素稳定性的影响。[/size][/font][/align][align=left][font='宋体'][size=16px]p[/size][/font][font='宋体'][size=16px]H值对杨梅红色素稳定性的影响结果如表1所示。由表1可知,杨梅红色素在PH值2~6时吸光度变化不大,PH值越小颜色越鲜艳,PH值大于7时,吸光度变化较大且颜色发生变化,所以不宜在碱性条件提取、保存和使用杨梅红色素。[/size][/font][/align][align=left][img]https://ng1.17img.cn/bbsfiles/images/2021/06/202106191602004818_7713_1608728_3.png[/img][/align][align=left][/align][align=left][/align][align=left][font='黑体'][size=16px]3.2.3 温度对杨梅红色素稳定性的影响。 [/size][/font][/align][align=left][font='宋体'][size=16px]温度对杨梅红色素稳定性的影响试验结果见表2从表2可以看出,杨梅红色素随温度的升高吸光值不断减小。红色素随保存时间的推移,吸光度不断减小,但在60°C以下,变化率较小。所以,红色素在酸性条件下,60°C以下保存2h稳定性较好。[/size][/font][/align][align=left][img]https://ng1.17img.cn/bbsfiles/images/2021/06/202106191602005590_837_1608728_3.png[/img][/align][align=left][/align][align=left][/align][align=left][/align][align=left][font='黑体'][size=16px]3.2.4 氧化剂对杨梅红色素的影响.[/size][/font][/align][align=left][font='宋体'][size=16px]由表3可以看出,随溶液中氧化剂[/size][/font][font='宋体'][size=16px]浓度的增加和时间的延长,吸光度值递减,表明杨梅红色素耐氧化剂较差,应用中应避免与氧化剂接触。由图1可知,氧化剂[/size][/font][font='宋体'][size=16px]的加入降低了红色素的吸光度值,但影响不大。[/size][/font][/align][align=left][img]https://ng1.17img.cn/bbsfiles/images/2021/06/202106191602007577_1428_1608728_3.png[/img][/align][align=left][font='黑体'][size=16px]3.2.5 还原剂对杨梅红色素的影响。[/size][/font][/align][align=left][font='宋体'][size=16px]由图2可知,[/size][/font][font='宋体'][size=16px]液对红色素的吸光度值有较大影响。[/size][/font][font='宋体'][size=16px]溶液浓度越大,影响越大。[/size][/font][/align][align=left][/align][align=left][img]https://ng1.17img.cn/bbsfiles/images/2021/06/202106191602008407_7557_1608728_3.png[/img][img]https://ng1.17img.cn/bbsfiles/images/2021/06/202106191602009501_2891_1608728_3.png[/img][/align][align=left][/align][align=left][font='黑体'][size=16px]3.1.6 食品基质对杨梅红色素稳定性的影响。[/size][/font][/align][align=left][font='宋体'][size=16px]由表4可知,随着食品基质加入量的增大,红色素的吸光度稍有减小,但减小的趋势非常缓慢,说明加入以上基质对红色素的稳定性影响不大。[/size][/font][/align][align=left][/align][align=left][img]https://ng1.17img.cn/bbsfiles/images/2021/06/202106191602009203_6063_1608728_3.png[/img][/align][align=left][/align][align=left][font='黑体'][size=16px]3.2.7自然光对杨梅红色素稳定性的影响。[/size][/font][/align][align=left][font='宋体'][size=16px]由表5可知,红色素在避光和不避光的条件下保存,吸光.度值都随着时间的延长而减小,在不避光条件下,吸光度降低得更快,说明自然光对红色素有很大的影响。在试验过程中应该注意避光。[/size][/font][/align][align=left][/align][align=left][img]https://ng1.17img.cn/bbsfiles/images/2021/06/202106191602010004_8158_1608728_3.png[/img][/align][align=left][/align][align=left][font='黑体'][size=16px]3.2.8 金属离子对杨梅红色素稳定性的影响。[/size][/font][/align][align=left][font='宋体'][size=16px]从表6可以看出,[/size][/font][font='宋体'][size=16px]、[/size][/font][font='宋体'][size=16px]、[/size][/font][font='宋体'][size=16px]、[/size][/font][font='宋体'][size=16px]对杨梅红色素吸光度基本无影响,[/size][/font][font='宋体'][size=16px]的影响较小,[/size][/font][font='宋体'][size=16px]、[/size][/font][font='宋体'][size=16px]响很大,不但吸光度值降低很多,而且溶液的颜色也发生显著变化。加入的溶液,颜色由红色变为浅橙色[/size][/font][font='宋体'][size=16px]。[/size][/font][/align][align=left][/align][align=left][img]https://ng1.17img.cn/bbsfiles/images/2021/06/202106191602010824_2046_1608728_3.png[/img][/align][align=left][/align][align=left][/align][align=left][/align][font='calibri'][size=14px]3.3结论分析[/size][/font][align=left][/align][align=left][font='宋体'][size=16px]本研究结果表明,PH值对杨梅红色素的稳定性影响较大。色素在pH值2~6时较稳定,pH值越小颜色越鲜艳,pH值大于7时吸光度变化较大且颜色发生变化,所以该色素不宜在碱性条件下提取、保存和使用。杨梅红色素热稳定性较差,在加工过程中不宜超过60°C,控制在40°C以内效果最佳。自然光对红色素有影响,所以在试验过程中或作为产品,都应该避光保存。氧化剂[/size][/font][font='宋体'][size=16px]、还原剂[/size][/font][font='宋体'][size=16px]对杨梅红色素的影响很大。氧化剂[/size][/font][font='宋体'][size=16px]对杨梅红色素基本无影响。还原剂维生素C对杨梅红色素有一定的增色作用,但增色作用不明显。本试验中加入的4种食品基质对杨梅红色素稳定性的影响甚微。在食品加工中可以不考虑这4种食品基质对杨梅红色素的影响。金属离子[/size][/font][font='宋体'][size=16px]、[/size][/font][font='宋体'][size=16px]和[/size][/font][font='宋体'][size=16px]对色素的影响很大,在加工中应避免接触,不使用铜制[/size][/font][/align][align=center][font='times new roman'][size=21px][color=#000000]参考文献[/color][/size][/font][/align][font='calibri'][size=14px][1] [/size][/font][font='calibri'][size=14px][color=#231f20]中华人民共和国国家卫生和计划生育委员会. [/color][/size][/font][font='calibri'][size=14px][color=#231f20]GB2760-2014[/color][/size][/font][font='calibri'][size=14px][color=#231f20]食品安全国家标准, 食品添加剂使用标准[/color][/size][/font][font='calibri'][size=14px][color=#231f20][s][/s][/color][/size][/font][font='calibri'][size=14px][color=#231f20]. 北京:中国标准出版社, [/color][/size][/font][font='calibri'][size=14px][color=#231f20]2014.[/color][/size][/font][font='calibri'][size=14px][2] [/size][/font][font='calibri'][size=14px][color=#231f20]杨梅果实品质分析和红色素稳定性研究.严和平,陈瑞,刘卫,路俊梅,龙云惠,姚立华[/color][/size][/font][font='calibri'][size=14px][3] [/size][/font][font='calibri'][size=14px][color=#231f20]杨梅红色素的提取,纯化,及其理化性质。林璇[/color][/size][/font][font='calibri'][size=14px][4] [/size][/font][font='calibri'][size=14px][color=#231f20]食品添加剂第二版。孙包国主编[/color][/size][/font][align=left][img]https://ng1.17img.cn/bbsfiles/images/2021/06/202106191602011928_9621_1608728_3.png[/img][/align][align=left][img]https://ng1.17img.cn/bbsfiles/images/2021/06/202106191602013827_479_1608728_3.jpeg[/img][/align]






 留言咨询
留言咨询

 400-860-5168转4930
400-860-5168转4930
 留言咨询
留言咨询

 留言咨询
留言咨询


