推荐厂家
暂无
暂无
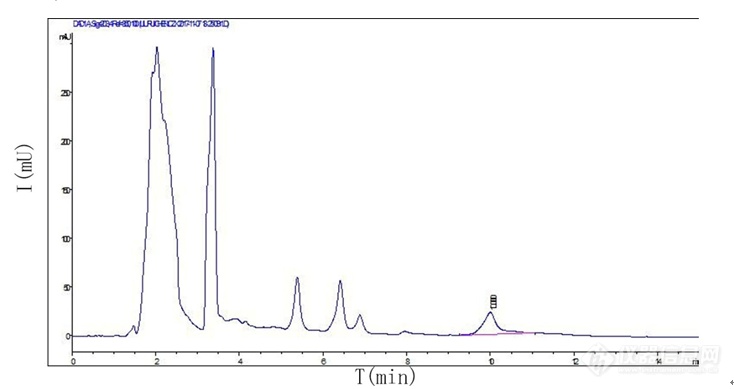
检测黄芪药材中的黄芪甲苷,用elsd检测器,c18柱,雾化管30 漂移管70 药典方法乙腈比水32比68 对照品塔板数11000,但是样品塔板数才2800,含量合格,要求塔板数是4000这是怎么回事,重做了好多次塔板数就是上不去
[align=center][b]HP[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]/MS法测定黄芪醇提物中的黄芪甲苷的含量[/b][/align][b]黄芪甲苷是黄芪皂苷提取物中的特征性成分,也是具有代表性的主要成分,黄芪甲苷可以促进患者心肌细胞的供氧能力,使冠状动脉供血区供血充足,避免因缺血导致的大范围心肌坏死,继而缓解患者心绞痛症状,平稳心跳速率[sup][/sup]。药典中有关于黄芪药材中黄芪甲苷含量的测定方法,但此方法并不完全适用于黄芪醇提物中的黄芪甲苷的含量测定,而且黄芪水提物与黄芪醇提物中化学成分有差异,预实验中发现测定黄芪水提物中黄芪甲苷含量建立的方法也不适应于黄芪醇提物中中黄芪甲苷含量的测定。本章实验利用[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]液质联用仪[/color][/url]建立黄芪醇提物中黄芪甲苷含量测定方法,并利用该方法测定其含量,计算出黄芪甲苷的转移率,用于黄芪醇提最佳提取工艺的优选。同时,本章实验系统地验证所建立的方法的可行性,为选择黄芪甲苷的含量测定方法提供参考。[b]1 材料和仪器1.1 样品 [/b] 收集9组黄芪醇提物样品,所有黄芪药材均由济宁华能制药厂提供。[b]1.2 试剂 [/b]黄芪甲苷对照品(成都瑞芬思生物科技有限公司批号H-013-170117);乙腈为色谱纯(赛默飞世尔科技有限公司);D101大孔吸附树脂(廊坊淼阳化工有限公司生产20160310);盐酸溶液(国药集团化学试剂有限公司生产);氢氧化钠溶液(国药集团化学试剂有限公司生产20160824);超纯水。[b]1.3 仪器 [/b]液相色谱仪系统(美国Agligent Technology 公司1260型液相色谱仪,包括G1312B二元泵,G1322A在线脱气机,G1316A柱温箱);NASCA F5100型自动进样器(日本SHISEIDO公司);资生堂CAPCELL PAC CN 色谱柱(2.0*150 mm,5 mm,日本SHISEIDO公司);API 4000型三重四级杆串联离子肼质谱仪(美国Applicated Biosystem Scuex公司)。[b]2 方法学考察2.1 色谱条件[/b]色谱柱为 Synergi C18 80A(250 mm×4.6 mm,4 μm),以十八烷基硅烷键合硅胶为填充剂,以乙腈-水(35 : 65)进行等度洗脱;进样量10 μL;检测波长为203 nm;柱温30 ℃,流速为1 mL/min。黄芪甲苷保留时间约为10 min。黄芪醇提物和黄芪甲苷标准品HPLC色谱图见表5-1,表5-2。[/b][align=center][img=,690,365]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131711071808_2711_3237657_3.png!w690x365.jpg[/img][/align][align=center]图5-1 黄芪醇提物HPLC色谱图[/align][align=center][img=,690,373]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131711240945_4181_3237657_3.png!w690x373.jpg[/img][/align][align=center]图5-2 黄芪甲苷标准品HPLC色谱图[/align][b]2.2 质谱条件 [/b]电喷雾电离,正离子模式(喷雾电压:4.5 kV);鞘气压力:30 arb;辅助气压力:10 arb;离子传输管温度:550 ℃;扫描模式:全扫描;扫描范围:m/z 100-1000。按“2.1.3”项下色谱条件进样,进样量10 μL。为进一步验证10 min出峰的物质是黄芪甲苷,利用LC/MS技术对黄芪皂苷提取物的化学成分进行研究,采用正离子源ESI检测。黄芪甲苷分子量784.97 Da,由于仪器差异,黄芪甲苷出峰时间后移至12.5 min,此峰的鉴定结果质谱图显示含大量黄芪甲苷。图5-3为黄芪皂苷提取物的正离子模式HP[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]总离子流图、分离子流图和质谱图。[align=center][img=,690,426]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131711415732_2681_3237657_3.png!w690x426.jpg[/img][/align][align=center]图5-3 黄芪甲苷正离子模式HP[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url] 总离子流图、分离子流图和质谱图[/align][b]2.3 供试品溶液的制备[/b]对D101大孔吸附树脂预处理:第一步用乙醇或甲醇清洗吸附柱内壁,向柱内加入称量好的树脂体积0.4-0.5倍的乙醇或甲醇,然后将新的D101大孔吸附树脂投入吸附柱中,使乙醇液面高于D101大孔吸附树脂层0.5 m,浸泡过夜。用2 个柱体积的乙醇或甲醇通过D101大孔吸附树脂层,用乙醇缓慢浸泡D101大孔吸附4-5 h,观察洗脱液加水后不呈白色浑浊为止。再用蒸馏水以2 BV洗柱,洗至洗脱液呈中性。用2 BV的5 %盐酸溶液以4-6 BV/h过柱,浸泡2-4 h。用蒸馏水以2 BV/h洗至洗脱液呈中性。用2 BV的2 %氢氧化钠溶液以4-6 BV/h过柱,浸泡2-4 h。最后用蒸馏水洗D101大孔吸附树脂,洗至洗脱液显中性即可。上样:取黄芪醇提物加水溶解至15 mL得黄芪提取液,以1 mL/min过树脂,先以4 BV蒸馏水洗脱,弃去水液,再用4 BV的70 %乙醇溶液洗脱,用烧杯收集吸附柱内的洗脱液,转入蒸发皿,水浴蒸干后,用甲醇溶解并转移至10 mL容量瓶定容。[b]2.4 对照品溶液的制备[/b]用万分之一天平精密称取10.1 mg黄芪甲苷对照品至10 mL容量瓶,加甲醇定容,得1.01mg/mL的对照品溶液,用0.22μm的微孔滤膜过滤,备用。[b]3 结果3.1 线性关系考察[/b]精密量取黄芪甲苷标准品10.1 mg黄芪甲苷,用甲醇10 mL制备成1.01 mg/mL黄芪甲苷储备液,然后吸取相应体积稀释成浓度梯度为150 μg/mL、250 μg/mL、300 μg/mL、400 μg/mL 、500 μg/mL的对照品溶液,上述对照品溶液按“2.3”项下色谱条件分别进样10 μL,利用自动积分功能测定峰面积积分值,以黄芪皂苷提取物中黄芪甲苷的峰面积积分值对标准品浓度进行线性回归,所得回归方程为y = 2821.6x + 12.438(回归系数[i]R[sup]2[/sup][/i]= 0.9989),证明蒙古黄芪中黄芪甲苷在150~500 μg/mL范围内线性关系良好,黄芪甲苷对照品标准曲线如图5-4所示。[align=center][img=,542,346]https://ng1.17img.cn/bbsfiles/images/2019/08/201908131711574358_4557_3237657_3.png!w542x346.jpg[/img][/align][align=center]图5-4 黄芪甲苷标准曲线[/align][b]3.2 精密度试验[/b]在拟定分析条件下,精密吸取供试品溶液10 μL,连续进样 6 次,记录提取离子流图峰面积,测定黄芪甲苷量,计算得相对标准偏差RSD为1.9% ,提示该方法具有较好的精密度。[b]3.3 重复性实验[/b]取同一黄芪样品 6份,按2. 2 项下方法制备供试品溶液,在拟定分析条件下,准确吸取10 μl 进样分析,测定黄芪甲苷量,计算得 RSD为2.0%,提示该方法重复性良好。[b]3.4 稳定性试验[/b]取黄芪药材供试品溶液,分别在0 h、3 h、6 h、9 h、24 h、48 h后,在拟定分析条件下,准确吸取10 μl 进样分析,测定黄芪甲苷量,计算得RSD为 4.4% ,提示黄芪供试品溶液稳定性较差。[b]3.5 加样回收率试验[/b]精密称取 6 份黄芪甲苷量已知的黄芪水提物样品,每份折合黄芪药材 0. 5 g,分别准确加入浓度为 0. 0 342 mg /ml 黄芪甲苷溶液1 ml,1 ml,2ml,2ml,3ml,3ml,按 2. 2 项下方法制备供试品溶液,准确吸取 1. 0 μl 进样分析,测定黄芪甲苷量,计算回收率,结果见表3-1。由表3-1可见,方法平均回收率为 97.92%,表明该方法具有较好的回收率。[align=center]表5-1 黄芪甲苷加样回收率测定结果[/align] [table][tr][td] [align=center]样号[/align] [/td][td] [align=center]样品中的量/mg[/align] [/td][td] [align=center]加入量/mg[/align] [/td][td] [align=center]测得量/mg[/align] [/td][td] [align=center]回收率/%[/align] [/td][td] [align=center]平均值/%[/align] [/td][td] [align=center]RSD/%[/align] [/td][/tr][tr][td] [align=center]1[/align] [/td][td] [align=center]1.94 [/align] [/td][td] [align=center]0.96 [/align] [/td][td] [align=center]2.88 [/align] [/td][td] [align=center]97.92 [/align] [/td][td=1,6] [align=center]97.92 [/align] [/td][td=1,6] [align=center]0.7 [/align] [/td][/tr][tr][td] [align=center]2[/align] [/td][td] [align=center]1.94 [/align] [/td][td] [align=center]0.96 [/align] [/td][td] [align=center]2.89 [/align] [/td][td] [align=center]98.96 [/align] [/td][/tr][tr][td] [align=center]3[/align] [/td][td] [align=center]1.94 [/align] [/td][td] [align=center]1.92 [/align] [/td][td] [align=center]3.83 [/align] [/td][td] [align=center]98.44 [/align] [/td][/tr][tr][td] [align=center]4[/align] [/td][td] [align=center]1.94 [/align] [/td][td] [align=center]1.92 [/align] [/td][td] [align=center]3.81 [/align] [/td][td] [align=center]97.40 [/align] [/td][/tr][tr][td] [align=center]5[/align] [/td][td] [align=center]1.94 [/align] [/td][td] [align=center]2.88 [/align] [/td][td] [align=center]4.76 [/align] [/td][td] [align=center]97.92 [/align] [/td][/tr][tr][td] [align=center]6[/align] [/td][td] [align=center]1.94 [/align] [/td][td] [align=center]2.88 [/align] [/td][td] [align=center]4.73 [/align] [/td][td] [align=center]96.88 [/align] [/td][/tr][/table][b]3.6 黄芪甲苷的含量测定结果[/b]取9组黄芪水提物按照“2.3”项下操作,制备供试品溶液,准确吸取 1 0 μL 进样分析,在拟定的分析条件下,测定黄芪甲苷峰面积积分值,计算相应的黄芪甲苷含量。9组蒙古黄芪中黄芪甲苷含量测定结果如表5-2所示。[align=center]表5-2 9组蒙古黄芪中黄芪甲苷含量测定结果[/align] [table][tr][td] [align=center]试验号[/align] [/td][td] [align=center]峰面积[/align] [/td][td] [align=center]含量(mg/g)[/align] [/td][/tr][tr][td] [align=center]1[/align] [/td][td] [align=center]560.07 [/align] [/td][td] [align=center]0.13 [/align] [/td][/tr][tr][td] [align=center]2[/align] [/td][td] [align=center]501.70 [/align] [/td][td] [align=center]0.12 [/align] [/td][/tr][tr][td] [align=center]3[/align] [/td][td] [align=center]564.61 [/align] [/td][td] [align=center]0.13 [/align] [/td][/tr][tr][td] [align=center]4[/align] [/td][td] [align=center]507.19 [/align] [/td][td] [align=center]0.12 [/align] [/td][/tr][tr][td] [align=center]5[/align] [/td][td] [align=center]524.05 [/align] [/td][td] [align=center]0.12 [/align] [/td][/tr][tr][td] [align=center]6[/align] [/td][td] [align=center]477.02 [/align] [/td][td] [align=center]0.11 [/align] [/td][/tr][tr][td] [align=center]7[/align] [/td][td] [align=center]921.07 [/align] [/td][td] [align=center]0.21 [/align] [/td][/tr][tr][td] [align=center]8[/align] [/td][td] [align=center]783.88 [/align] [/td][td] [align=center]0.18 [/align] [/td][/tr][tr][td] [align=center]9[/align] [/td][td] [align=center]924.71 [/align] [/td][td] [align=center]0.22 [/align] [/td][/tr][/table][b]3.7 黄芪甲苷转移率正交试验设计及结果[/b]醇提的黄芪甲苷转移率考察正交试验与醇提的出膏率考察正交试验设计相同,首先以乙醇作为提取溶剂,把影响药材提取效果的提取溶剂乙醇用量(A)、提取次数(B)、提取时间(C)确定为考察因素,以上三个考查因素各分3个水平考察,见表5-3。[align=center]表5-3 实验因素水平表[/align] [table][tr][td=1,2] [align=center]水平[/align] [/td][td=3,1] [align=center]因素[/align] [/td][/tr][tr][td] [align=center]A(乙醇用量/倍)[/align] [/td][td] [align=center]B(提取次数/次)[/align] [/td][td] [align=center]C(提取时间/h)[/align] [/td][/tr][tr][td] [align=center]1[/align] [/td][td] [align=center]4[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]1[/align] [/td][/tr][tr][td] [align=center]2[/align] [/td][td] [align=center]8[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]2[/align] [/td][/tr][tr][td] [align=center]3[/align] [/td][td] [align=center]10[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]3[/align] [/td][/tr][/table]黄芪甲苷转移率=各实验组黄芪提取物中黄芪甲苷含量/原黄芪药材中黄芪甲苷含量×100%。原药材中毛蕊异黄酮苷的含量按照药典的方法测得的结果为0.4042mg/g。跟据实验数据,得到水提实验中设定的不同工艺条件下的毛蕊异黄酮苷的转移率,其中因素D为误差项,作直观分析表和方差分析表,见表5-4,5-5。[align=center]表5-4 黄芪甲苷转移率考察 L[sub]9[/sub](3[sup]4[/sup])正交试验表[/align] [table][tr][td] [align=center]试验号[/align] [/td][td] [align=center]A[/align] [/td][td] [align=center]B[/align] [/td][td] [align=center]C[/align] [/td][td] [align=center]D[/align] [/td][td] [align=center]黄芪甲苷 转移率/%[/align] [/td][/tr][tr][td] [align=center]1[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]32.01 [/align] [/td][/tr][tr][td] [align=center]2[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]28.60 [/align] [/td][/tr][tr][td] [align=center]3[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]32.28 [/align] [/td][/tr][tr][td] [align=center]4[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]28.92 [/align] [/td][/tr][tr][td] [align=center]5[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]29.91 [/align] [/td][/tr][tr][td] [align=center]6[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]27.16 [/align] [/td][/tr][tr][td] [align=center]试验号[/align] [/td][td] [align=center]A[/align] [/td][td] [align=center]B[/align] [/td][td] [align=center]C[/align] [/td][td] [align=center]D[/align] [/td][td] [align=center]黄芪甲苷 转移率/%[/align] [/td][/tr][tr][td] [align=center]7[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]53.11 [/align] [/td][/tr][tr][td] [align=center]8[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]45.09 [/align] [/td][/tr][tr][td] [align=center]9[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]53.33 [/align] [/td][/tr][tr][td] [align=center]K1[/align] [/td][td] [align=center]92.89[/align] [/td][td] [align=center]114.04[/align] [/td][td] [align=center]104.26[/align] [/td][td] [align=center]115.25[/align] [/td][td] [align=center] [/align] [/td][/tr][tr][td] [align=center]K2[/align] [/td][td] [align=center]85.99[/align] [/td][td] [align=center]103.60[/align] [/td][td] [align=center]110.85[/align] [/td][td] [align=center]108.87[/align] [/td][td] [align=center] [/align] [/td][/tr][tr][td] [align=center]K3[/align] [/td][td] [align=center]151.53[/align] [/td][td] [align=center]112.77[/align] [/td][td] [align=center]115.30[/align] [/td][td] [align=center]106.29[/align] [/td][td] [align=center] [/align] [/td][/tr][tr][td] [align=center]优水平[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center]3[/align] [/td][td] [align=center]1[/align] [/td][td] [align=center] [/align] [/td][/tr][tr][td] [align=center]R[/align] [/td][td] [align=center]65.54[/align] [/td][td] [align=center]9.17[/align] [/td][td] [align=center]11.04[/align] [/td][td] [align=center]8.96[/align] [/td][td] [align=center] [/align] [/td][/tr][/table][align=center]表5-5 黄芪甲苷转移率考察方差分析结果[/align] [table][tr][td] [align=center]方差来源[/align] [/td][td] [align=center]离差平方和[/align] [/td][td] [align=center]自由度[/align] [/td][td] [align=center]F[/align] [/td][td] [align=center]显著性[/align] [/td][/tr][tr][td] [align=center]A[/align] [/td][td] [align=center]864.64[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]46.01[/align] [/td][td] [align=center]*[/align] [/td][/tr][tr][td] [align=center]B[/align] [/td][td] [align=center]21.63[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]0.07[/align] [/td][td] [align=center]-[/align] [/td][/tr][tr][td] [align=center]C[/align] [/td][td] [align=center]20.57[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]0.07[/align] [/td][td] [align=center]-[/align] [/td][/tr][tr][td] [align=center]D [/align] [/td][td] [align=center]14.18[/align] [/td][td] [align=center]2[/align] [/td][td] [align=center]-[/align] [/td][td] [align=center]-[/align] [/td][/tr][/table]注:F[sub]0.1[/sub](2,2)=9,F[sub]0.05[/sub](2,2)=19,*为有显著性,-为无显著性。从正交试验结果可知:醇提实验中,各因素对黄芪甲苷转移率的影响大小顺序为:A(乙醇用量)B(提取次数)C(提取时间);每个因素3水平之间的趋势为A[sub]3[/sub]A[sub]1[/sub]A[sub]2[/sub],B[sub]1[/sub]B[sub]3[/sub]B[sub]2[/sub],C[sub]3[/sub]C[sub]2[/sub]C[sub]1[/sub],直观分析得最佳提取工艺为A[sub]3[/sub]B[sub]1[/sub]C[sub]3[/sub],即加醇10倍量,提取1次,每次3h。表5-5的方差分析结果表明: A因素的影响具有统计学差异(PB(提取次数)C(提取时间);每个因素3水平之间的趋势为A[sub]3[/sub]A[sub]1[/sub]A[sub]2[/sub],B[sub]1[/sub]B[sub]3[/sub]B[sub]2[/sub],C[sub]3[/sub]C[sub]2[/sub]C[sub]1[/sub],直观分析得最佳提取工艺为A[sub]3[/sub]B[sub]1[/sub]C[sub]3[/sub],即加醇10倍量,提取1次,每次3h。表5-7的方差分析结果表明: A因素的影响具有统计学差异(P0.05),即乙醇用量对黄芪甲苷转移率具有显著影响。[b]4 讨论[/b]本章实验利用[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]液质联用[/color][/url]技术,测定了黄芪醇提物中黄芪甲苷的含量,并系统地验证所建立的方法的可行性,经过试验条件的摸索,黄芪甲苷的色谱条件为35 %乙腈洗脱,所建立的方法能够较好的将黄芪甲苷与其他成分分开,可用于黄芪皂苷中黄芪甲苷含量测定,黄芪甲苷稳定性试验结果RSD值高于2 %,可能是由于黄芪皂苷Ⅰ或黄芪皂苷Ⅱ在酸性水解的条件下易转化成黄芪皂苷Ⅳ,即黄芪甲苷,使黄芪水提物中黄芪甲苷在48h内的稳定性不好。根据三个因素水平趋势可知,随着乙醇的用量增加,黄芪甲苷的提取效率越来越高,实验设置中每次10倍量是最大乙醇用量,这是从大工业生产和节能降耗等方面考虑的结果。根据煎煮次数水平趋势,提取1次的黄芪甲苷转移率最大,这有可能是因为黄芪皂苷Ⅰ或黄芪皂苷Ⅱ在酸性水解的条件下易转化成黄芪皂苷Ⅳ,即黄芪甲苷,而黄芪皂苷Ⅰ或黄芪皂苷Ⅱ在第一次就较完全的被提取出来,随着时间增加,转换成黄芪皂苷Ⅳ,即黄芪甲苷,第二次时黄芪皂苷Ⅰ或黄芪皂苷Ⅱ的结构可能被破坏,影响其转化成黄芪甲苷。第三次时可能黄芪甲苷被提取的更彻底,转移率又开始小幅增大。在3h内,当提取时间增加,黄芪甲苷会逐渐增大,原因可能是黄芪甲苷的提取更加彻底,黄芪皂苷Ⅰ或黄芪皂苷Ⅱ转化成黄芪甲苷最多。实验设置中每次3h是最大提取时间,这也是从综合成本与效率的角度考虑的结果。因此,综合考虑,将加醇10倍量,提取1次,共3h作为最佳醇提实验工艺。由黄芪甲苷转移率结合出膏率的到的综合评分的结果可以看出,不同提取工艺对黄芪醇提物中黄芪甲苷的含量和出膏率的影响不同,其中7、8、9组评分较高,三个组的黄芪甲苷转移率相较于其他组也是最高,但第8组出膏率却相对较低,另外出膏率高低的顺序也不与黄芪醇提物中黄芪甲苷的转移率高低的顺序项一致,这说明出膏率与黄芪醇提物中黄芪甲苷的转移率并无明显的对应关系。[align=center]参考文献[/align] 朱燕辉, 严奉祥. 黄芪甲苷及其生物学活性.现代生物医学进展,2008, 8 ( 4 ) : 781-783.
黄芪静脉输液中黄芪甲苷和黄芪多糖的含量测定摘要:建立黄芪静脉输液中黄芪甲苷和黄芪多糖的含量测定方法。方法:用高效液相色谱法测定黄芪甲苷的含量,用碘量法测定黄芪多糖的含量。结果:黄芪甲苷和黄芪多糖的平均回收率分别为9751%、9918%,相对标准差分别为248%、191%。结论:本文建立的方法准确可靠、灵敏度高、重现性好,可作为黄芪静脉输[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]液质[/color][/url]量控制的有效方法。关键词:黄芪甲苷;黄芪多糖;高效液相色谱法;碘量法; 英文摘要:ToestablishthemethodfordeterminationofastragalosideIVandastragaluspolysaccharidesinRadixAstragaliinjectionMETHODS:AstragalosidewasdeterminedbyHPLCandastragaluspolysaccharidesbyiodometryRESULTS:Therecoveriesofastragalosideandastragaluspolysaccharideswere9751%RSD=248%and9918%(RSD=191%)respectivelyCONCLUSION:Thismethodisaccurate,sensitiveandrepeatable,andcanbeusedforqualitycontrolofthepreparation英文关键词:astragaloside;astragaluspolysaccharide;HPLC;iodometry;contentdetermination黄芪为补气药,性甘温,归肺、脾经,具有补气固表、利尿托毒、排脓、敛疮生肌之功效。医疗实践证明,黄芪注射液对心气虚损、血脉瘀阻、病毒性心肌炎、心功能不全、脾虚困湿之肝炎有较好的疗效,也是肿瘤、免疫功能低下等较理想的辅助治疗药物。目前临床所使用的黄芪注射液为小容量针剂,需稀释后滴注,且不含黄芪多糖,所以疗效不够理想。为此,武警四川总队乐山医院和四川省乐山市三民药物研究所共同研制了含黄芪多糖、黄酮、苷类等有效成分的黄芪静脉输液。黄芪注射液的含量检测尽管WS3-β-3335-98执行标准仅要求采用薄层色谱法,但因高效液相色谱法操作更简便,精密度更高,故笔者参照文献以蒸发光散色高效液相色谱法[1]测定黄芪静脉输液中的黄芪甲苷含量;至于黄芪多糖含量的检测则选择采用碘量法。1仪器与试药11仪器美国奥泰公司高效液相色谱仪,包括蒸发光散射(ELSD)500检测器、Alltech426主机泵;电动离心机(江苏金坛公司);TP-150超声波清洗机(北京天鹏公司)。12试药黄芪甲苷对照品(中国药品生物制品检定所,批号:0781-9908);甲醇、乙醇、正丁醇、氢氧化钠、硫酸、葡萄糖均为分析纯;乙腈为色谱纯;水为重蒸馏水。2方法和结果21黄芪甲苷含量的测定211色谱条件:色谱柱为ODS柱(250mm×40mm),柱温为40℃,流动相为乙腈-水(36∶64),流速为06ml/min,进样量为20μl。212漂移管温度选择:根据ELDS检测使用手册推荐,设置气体流速为300slpm,漂移管温度为75℃,观察流动相(不进样)进入检测器的基线噪音,不断改变漂移管温度(步长为5℃),根据基线随温度的变化情况,选择95℃为试验最优温度。213载气流速选择:设定漂移管温度为95℃,取黄芪甲苷对照液恒量,得相应峰面积,不断改变气体流速(步长为025slpm)观察峰面积和基线的变化情况,最终选择270slpm为试验最优载气流速。214最低检测限试验:精密称取黄芪甲苷对照品适量,加甲醇溶解并稀释成浓度为1mg/ml的溶液作为贮备液,精密量取适量,逐步稀释测定,直到黄芪甲苷主峰信号为检测器噪声水平的3倍为止。得黄芪甲苷最低检测限为153ng。215线性试验:取“214”项黄芪甲苷对照品贮备液适量,精密量取10、20、30、40、50、60分别置于10ml容量瓶中,加甲醇稀释至刻度(约相当于黄芪甲苷01、02、03、04、05、06mg)。以对照品峰面积的常用对数值为横坐标(X),以进样量的常用对数值(Y)为纵坐标进行线性回归,得回归方程为Y=06001X—34896(r=09991),黄芪甲苷进样量在20μg~120μg范围内线性关系良好。216精密度试验:精密称取黄芪甲苷对照品适量,加甲醇溶解并稀释至浓度为025mg/ml的溶液作为对照溶液,注入液相色谱仪,连续重复进样6次,测得黄芪甲苷的相对标准差为179%,精密度符合规定。217重现性试验:精密量取黄芪注射液适量(相当于黄芪甲苷约20mg)5份,按“2110”项下方法制备,测定黄芪甲苷含量。结果黄芪注射液中黄芪甲苷为2390mg,RSD=201%,表明方法重现性良好。218稳定性试验:取“217”项下样品溶液,分别于0、1、2、3、5、8h取样测定峰面积,结果RSD=107%,表明黄芪甲苷溶液在8h内基本稳定。219回收率试验:分别精密量取黄芪注射液适量(约相当于黄芪甲苷10、12、14mg)共3份,每份各精密加入对照溶液(0404mg/ml)25、30、35ml,按“2110”项下方法制备,测定黄芪甲苷含量,结果详见表1。由表1可见,平均回收率为9751%,RSD=248%,符合规定,说明方法具有可行性。2110样品中黄芪甲苷的含量测定:精密量取黄芪注射液100ml,置于烧杯中浓缩至10ml,加无水乙醇40ml沉淀,放置20min,离心,沉淀用80%的乙醇溶液洗涤2次,每次10ml,合并离心液与洗涤液,置水浴上蒸干。残渣加1%NaOH溶液10ml溶解,用饱和的正丁醇水溶液提取3次,每次20ml,合并正丁醇的水溶液,蒸干,残渣再加1%NaOH溶液5ml溶解,通过已处理的D101大孔吸附树脂柱(Φ15×20cm,内装树脂高约10cm)吸附,以1%NaOH溶液50ml洗脱,弃去,用蒸馏水洗至中性,再用30%乙醇溶液50ml洗脱,弃去洗脱液,继续用70%乙醇液50ml洗脱,收集洗脱液并蒸干,残渣加甲醇溶解并定容至10ml,得供试品溶液。精密称取黄芪甲苷对照品适量,加甲醇溶解并稀释成浓度为01、03mg/ml的溶液作为对照溶液。分别精密量取上述溶液各20μl注入液相色谱仪,记录色谱图,并以峰面积和进样量的对数值按二点法计算,详见图1;3批样品按上述方法制备测定,结果详见表2。22黄芪多糖含量的测定[2,3]221线性试验:精密称取105℃干燥至恒重的葡萄糖适量,加水溶解并稀释成浓度为10mg/ml的标准溶液,分别精密量取此标准溶液100、90、80、70、60ml,置于250ml碘量瓶中,分别加水0、10、20、30、40ml,然后精密加入01mol/L碘滴定液25ml,在不断振摇的情况下缓缓滴加01mol/LNaOH40ml,密塞,在暗处放置10min,然后加入05mol/LH2SO4液6ml,摇匀,立即用01mol/LNa2S2O3滴定液滴定,近终点时,加淀粉指示液2ml,继续滴定至蓝色消失,并同时作空白试验校正。以取样量(X)与Na2S2O3的消耗量(Y)进行线性回归,得回归方程为Y=009766X—000244,(r=09999),表明葡萄糖在60mg~100mg的范围内线性关系良好。222重现性试验:精密量取黄芪注射液100ml,按“224”项下方法制备5份,测定黄芪多糖含量,结果为10423mg,RSD=099%,表明方法重现性良好。223回收率试验:分别精密量取黄芪注射液(多糖含量为10423mg/100ml)120、150、180ml,每份各加入葡萄糖标准液(25002mg/ml)50、60、70ml制成80%、100%、120%浓度的溶液。分别浓缩至10ml,加无水乙醇40ml,放置20min,离心。沉淀用80%乙醇洗涤2次,每次10ml,弃去离心液与洗涤液,沉淀加热蒸馏水10ml溶解,并转移至25ml容量瓶中,定容,摇匀。分别精密量取3种不同浓度的溶液80、70、60ml置于250ml碘量瓶中,分别精密加水2、3、4ml,按“224”项方法测定,每个浓度测定3次,共9次,计算得到回收率为9918%,RSD=191%,详见表3。224样品中黄芪多糖的含量测定:精密量取黄芪注射液100ml,浓缩至10ml,加无水乙醇40ml,放置20min,离心。沉淀用80%乙醇洗涤2次,每次10ml,加热蒸馏水3ml使沉淀溶解并定容至10ml,摇匀。移置于250ml碘量瓶中,加入1mol/LH2SO420ml,置于水浴中水解2h,取出,放冷,加入2mol/LNaOH溶液调节pH值=7,冷却至室温。精密加入碘滴定液(01mol/L)25ml,在不断振摇的情况下缓缓滴加01mol/LNaOH40ml,密塞,置暗处放置10min。然后加入05mol/LH2SO46ml,摇匀,立即用Na2S2O3滴定液(01mol/L)滴定,至近终点时,加淀粉指示液2ml,继续滴定至蓝色消失,并同时作空白试验校正,计算即得(每1ml上述碘滴定液相当于9008mg的C6H12O6)。3批黄芪注射液样品,按上述方法测定多糖含量均符合规定,结果详见表4。3讨论测定黄芪甲苷含量时,如将精密量取的黄芪注射液浓缩后仅采用正丁醇的水饱合液提取制得供试品溶液,则所得的样品杂质峰多,基线略有漂移,因此不宜采用。黄芪多糖主要为葡萄糖,因此,可采用以葡萄糖或葡聚糖作对照品的苯酚-浓硫酸法[4]、蒽酮-浓硫酸法[5]或水解后用碘量法等测定其含量,但一般多采用后两种方法。采用蒽酮-浓硫酸法时,由于其线性试验回归方程为C=98481A+08314(r=09663),浓度线性范围为35~165μg/ml,线性关系不好,故不宜采用。






 400-892-9759
400-892-9759
 留言咨询
留言咨询

 留言咨询
留言咨询

 留言咨询
留言咨询


