推荐厂家
暂无
暂无




 400-622-8982
400-622-8982
 留言咨询
留言咨询

 400-622-8982
400-622-8982
 留言咨询
留言咨询
 400-860-5168转3078
400-860-5168转3078
 留言咨询
留言咨询



[color=#444444]求助s-腺苷甲硫氨酸合成酶的液相分析方法,各位大神求帮忙!最好说明使用的流动相、配比。所使用的色谱柱、柱温。进样量。检测波长等。越详细越好。谢谢啦。[/color]
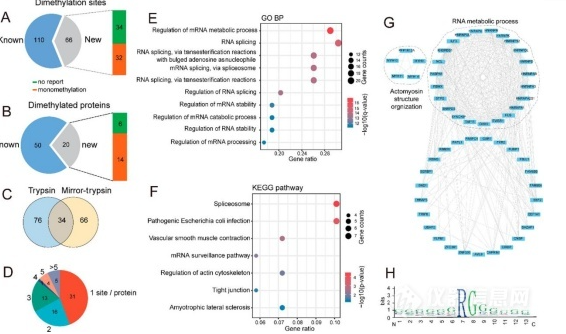
大家好,我们在进行蛋白质修饰鉴定过程中,发现有异亮氨酸甲基化的修饰(采用二级CID碎裂模式),分析软件(BioPharmaView)中给定的修饰中也含有异亮氨酸,为了确定甲基化修饰的机理,我们推测,甲基化修饰在了异亮氨酸形成的肽键N上,对此我们使用etHCD碎裂模式进行二级碎裂,结果显示,甲基化并非修饰在肽键N上,我们查询文献并没有相关的报道,想问下各位大神,有知道蛋白中异亮氨酸发生甲基化是发生在哪个位置么?如果有文献支持就更好了。
[font=system-ui, -apple-system, &][size=16px][color=#333333](1)磷酸化修饰。[/color][/size][/font] [font=system-ui, -apple-system, &][size=16px][color=#333333]蛋白质磷酸化是由蛋白激酶催化的磷酸基转移反应,是最常见、最重要的蛋白质修饰方式之一。[/color][/size][/font] [font=system-ui, -apple-system, &][size=16px][color=#333333]蛋白质磷酸化修饰的具体生物效应包括:改变被修饰蛋白质的活性、改变蛋白的亚细胞内定位、改变蛋白与其他蛋白或其他生物分子的相互作用。[/color][/size][/font] [font=system-ui, -apple-system, &][size=16px][color=#333333]①催化蛋白质磷酸化的蛋白激酶,根据底物的磷酸化位点可分为三大类,蛋白质丝氨酸/苏氨酸激酶、蛋白质酪氨酸激酶、双专一性蛋白激酶。[/color][/size][/font] [font=system-ui, -apple-system, &][size=16px][color=#333333]②催化蛋白质去磷酸化的蛋白磷酸酶,根据磷酸化的氨基酸残基不同可分为两类,蛋白质丝氨酸/苏氨酸磷酸酶和蛋白质酪氨酸磷酸酶。[/color][/size][/font] [font=system-ui, -apple-system, &][size=16px][color=#333333](2)甲基化修饰。[/color][/size][/font] [font=system-ui, -apple-system, &][size=16px][color=#333333]蛋白质甲基化是指在甲基转移酶催化下,甲基基团由S-腺苷甲硫氨酸转移至相应蛋白质的过程。[/color][/size][/font] [font=system-ui, -apple-system, &][size=16px][color=#333333]蛋白质甲基化修饰可产生多种不同的生物效应,包括影响蛋白质间的相互作用、蛋白质和RNA间的相互作用、蛋白质的定位、RNA加工、细胞信号转导等。[/color][/size][/font] [font=system-ui, -apple-system, &][size=16px][color=#333333]催化蛋白质甲基化的酶:甲基转移酶。[/color][/size][/font] [font=system-ui, -apple-system, &][size=16px][color=#333333](3)乙酰化修饰。[/color][/size][/font] [font=system-ui, -apple-system, &][size=16px][color=#333333]蛋白质乙酰化是指在乙酰基转移酶的催化下,在蛋白质特定的位置添加乙酰基的过程。蛋白质乙酰化修饰所产生的生物效应,主要包括促进基因转录、诱导细胞自噬、调节代谢酶的活性及代谢通路。[/color][/size][/font] [font=system-ui, -apple-system, &][size=16px][color=#333333]催化蛋白质乙酰化的酶:组蛋白乙酰基转移酶。[/color][/size][/font] [font=system-ui, -apple-system, &][size=16px][color=#333333](4)类泛素化修饰。[/color][/size][/font] [font=system-ui, -apple-system, &][size=16px][color=#333333]小泛素相关修饰物(SUMO)是类泛素蛋白家族的重要成员之一,可与多种蛋白结合发挥相应的功能。SUMO化修饰可参与转录调节、核转运、维持基因组完整性及信号转导等多种细胞内活动。[/color][/size][/font] [font=system-ui, -apple-system, &][size=16px][color=#333333]①SUMO的分类:SUMO蛋白分布广泛,人类基因组编码了4种不同SUMO蛋白,分别为:SUMO1、SUMO2、SUMO3和SUMO4。其中,SUMO1-3在各种组织中均有表达,而SUMO4则主要在肾脏、淋巴结和脾脏中表达。[/color][/size][/font] [font=system-ui, -apple-system, &][size=16px][color=#333333]②催化蛋白质SUMO化修饰的酶。SUMO化修饰需要一系列酶的参与,包括E1活化酶,E2结合酶以及E3连接酶。[/color][/size][/font] [font=system-ui, -apple-system, &][size=16px][color=#333333](5)巴豆酰化修饰。[/color][/size][/font] [font=system-ui, -apple-system, &][size=16px][color=#333333]作为一种新型组蛋白翻译后修饰方式,蛋白质巴豆酰化是一种进化上高度保守,且在细胞生物学功能上完全不同于组蛋白赖氨酸乙酰化的蛋白质修饰方式。[/color][/size][/font] [font=system-ui, -apple-system, &][size=16px][color=#333333]蛋白质巴豆酰化是指在巴豆酰基转移酶的催化下,在蛋白质特定的位置添加巴豆酰基的过程。组蛋白赖氨酸巴豆酰化修饰与基因的活化密切相关。此外,催化蛋白质巴豆酰化的酶是巴豆酰基转移酶。[/color][/size][/font]