推荐厂家
暂无
暂无
 金牌4年
金牌4年
 400-860-5168转4713
400-860-5168转4713
 留言咨询
留言咨询
 金牌15年
金牌15年
 400-860-5168转1895
400-860-5168转1895
 留言咨询
留言咨询
 留言咨询
留言咨询

 400-860-5168转1895
400-860-5168转1895
 留言咨询
留言咨询

 400-860-5168转1895
400-860-5168转1895
 留言咨询
留言咨询

 400-860-5168转1895
400-860-5168转1895
 留言咨询
留言咨询



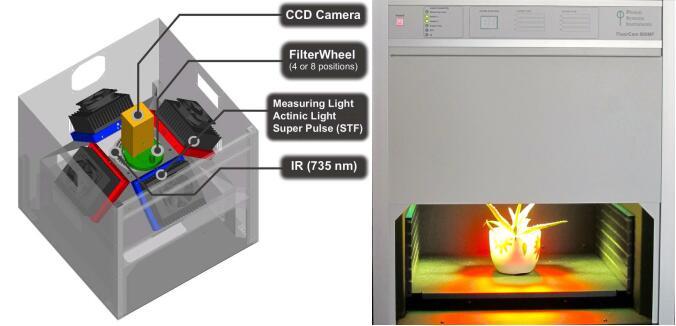

[align=center][size=16px][/size][/align][size=16px] 光合作用是地球上最重要的化学反应,植物、藻类及光合细菌等吸收光能、将[/size][size=16px]CO[/size][font='calibri'][sub][size=16px]2[/size][/sub][/font][size=16px]和水转化为有机物并释放[/size][size=16px]O[/size][font='calibri'][sub][size=16px]2[/size][/sub][/font][size=16px]。获得光能的叶绿素分子从基态跃迁到激发态,激发态的叶绿素分子可通过三种途径释放能量回到基态:推动光化学反应、以热的形式耗散、释放光子产生荧光。这三种途径的总和是一定的,因此叶绿素荧光的变化反映了光化学效率和热耗散能力的变化。叶绿素荧光成像是[/size][size=16px]广泛应用[/size][size=16px]的[/size][size=16px]光合生理研究的重要探针[/size][size=16px],[/size][size=16px]叶绿素荧光显微成像又将研究尺度进一步拓展到细胞、亚细胞水平。叶绿素荧光技术发展出了很多不同的测量程序,以慢诱导荧光动力学曲线为例,通过测量光([/size][size=16px]ML[/size][size=16px])、作用光([/size][size=16px]AL[/size][size=16px])、饱和脉冲光([/size][size=16px]SP[/size][size=16px])激发样品,记录动力学曲线并计算叶绿素荧光参数[/size][size=16px],[/size][size=16px]可以用于反映植物光合作用机理和光合生理状况([/size][size=16px]朱新广[/size][size=16px],[/size][size=16px]2021[/size][size=16px])。[/size][size=16px][/size][size=16px] 叶绿素荧光成像技术能记录整个叶片、植株等样品不同区域的荧光动力学分布变化,实现从宏观到微观的光合机理研究。叶绿素荧光成像由于其无损、高通量的技术特征,在光合作用相关突变体筛选领域成为了广泛应用的重要技术,为光合作用机理及抗[/size][size=16px]逆研究[/size][size=16px]提供了强大的技术支持。叶绿素荧光显微成像技术最早出现于[/size][size=16px]2000[/size][size=16px]年,[/size][size=16px]K[/size][size=16px]ü[/size][size=16px]pper[/size][size=16px]等人将叶绿素荧光脉冲调制式激发光源与显微镜结合,首次获得了显微尺度的叶绿素荧光图像([/size][size=16px]K[/size][size=16px]ü[/size][size=16px]pper[/size][size=16px] [/size][size=16px]et al.[/size][size=16px], 2000[/size][size=16px])。叶绿素荧光显微成像技术在国外已经展开多方面研究应用,[/size][size=16px]目前国内的叶绿素荧光成像显微研究尚处于起步阶段,多个课题组都[/size][size=16px]正[/size][size=16px]在[/size][size=16px]探索[/size][size=16px]这项技术[/size][size=16px]在[/size][size=16px]不同研究领域中[/size][size=16px]的[/size][size=16px]应用。[/size][size=16px][/size][size=16px] 叶绿素荧光技术[/size][size=16px]适用研究样品微观结构上光[/size][size=16px]合功能[/size][size=16px]的空间差异,例如叶片横截面栅栏组织与海绵组织的差异,[/size][size=16px]C[/size][size=16px]4[/size][size=16px]植物花环结构[/size][size=16px]中维管束鞘细胞与叶肉细胞的差异[/size][size=16px],藻类中有差异的单个细胞、异形胞[/size][size=16px]等。我们多年来与[/size][size=16px]吉林师范大学、四川省农业科学研究院[/size][size=16px]等[/size][size=16px]单位[/size][size=16px]合作[/size][size=16px],[/size][size=16px]目前已合作发表的[/size][size=16px]3[/size][size=16px]篇相关论文是国内该领域[/size][size=16px]开创性[/size][size=16px]的应用成果,[/size][size=16px]以叶绿素荧光显微成像的特色优势技术[/size][size=16px]为光合作用的微观[/size][size=16px]探究提供有力支撑[/size][size=16px]。[/size][size=16px][/size][size=16px] Yu[/size][size=16px]等[/size][size=16px]发现[/size][size=16px]狗枣猕猴桃[/size][size=16px]([/size][size=16px]A[/size][size=16px]ctinidia [/size][size=16px]kolomikta[/size][size=16px])[/size][size=16px]的白化[/size][size=16px]叶片[/size][size=16px]通过调整叶片结构及基因表达调控,仍然保持了相对较高的光合能力[/size][size=16px]。[/size][size=16px]应用[/size][size=16px]叶绿素荧光显微成像技术[/size][size=16px]比较了[/size][size=16px]白化和绿色叶片栅栏组织、海绵组织的叶绿素荧光参数,[/size][size=16px]揭示了白化叶片海绵组织光[/size][size=16px]合能力[/size][size=16px]增强的机理[/size][size=16px]。[/size][size=16px]绿叶中栅栏组织[/size][size=16px]F[/size][font='calibri'][size=14px][sub][size=16px]v[/size][/sub][/size][/font][size=16px]/[/size][size=16px]F[/size][font='calibri'][size=14px][sub][size=16px]m[/size][/sub][/size][/font][size=16px](最大光化学效率)[/size][size=16px]更高,而白叶中海绵组织[/size][size=16px]显著增厚,[/size][size=16px]F[/size][font='calibri'][size=14px][sub][size=16px]v[/size][/sub][/size][/font][size=16px]/[/size][size=16px]F[/size][font='calibri'][size=14px][sub][size=16px]m[/size][/sub][/size][/font][size=16px]更高[/size][size=16px],[/size][size=16px]光[/size][size=16px]合能力[/size][size=16px]增强,补偿[/size][size=16px]了[/size][size=16px]白化的影响,成为叶片光合作用主力组织[/size][size=16px]([/size][size=16px]Yu [/size][size=16px]et al.[/size][size=16px], 2022[/size][size=16px])[/size][size=16px]。[/size][size=16px]接下来[/size][size=16px]Chen[/size][size=16px]等又比较了两种猕猴桃白化叶片的光保护策略差异[/size][size=16px],狗枣猕猴桃的白叶[/size][size=16px]主要通过反射实现光保护,强光下花青素[/size][size=16px]积累,叶片[/size][size=16px]转变为粉色[/size][size=16px],更有效地保护叶片[/size][size=16px];[/size][size=16px]而[/size][size=16px]葛[/size][size=16px]枣猕猴桃([/size][size=16px]A[/size][size=16px]ctinidia[/size][size=16px] [/size][size=16px]polygama[/size][size=16px])[/size][size=16px]强光下[/size][size=16px]仍为白色[/size][size=16px],[/size][size=16px]具[/size][size=16px]有更[/size][size=16px]强[/size][size=16px]的叶绿[/size][size=16px]素荧光参数,说明[/size][size=16px]它[/size][size=16px]具有更高的强光适应能力[/size][size=16px]([/size][size=16px]Chen[/size][size=16px] [/size][size=16px]et al.[/size][size=16px], 202[/size][size=16px]3[/size][size=16px])。[/size][size=16px]Liu[/size][size=16px]等比较了干旱处理下的玉米叶肉细胞和维管束鞘细胞,发现这两种细胞具有不同的不同光保护策略[/size][size=16px]。对玉米[/size][size=16px]完整叶片的分析显示,[/size][size=16px]随着干旱处理程度增强,[/size][size=16px] [/size][size=16px]F[/size][font='calibri'][size=14px][sub][size=16px]v[/size][/sub][/size][/font][size=16px]/[/size][size=16px]F[/size][font='calibri'][size=14px][sub][size=16px]m[/size][/sub][/size][/font][size=16px]、[/size][size=16px]Φ[/size][font='calibri'][size=14px][sub][size=16px]PSII[/size][/sub][/size][/font][size=16px](实际光化学效率)[/size][size=16px]降低,[/size][size=16px]NPQ[/size][size=16px](非光化学猝灭[/size][size=16px]系数[/size][size=16px])[/size][size=16px]显著升高[/size][size=16px]。进一步应用[/size][size=16px]叶绿素荧光显微成像[/size][size=16px]的分析结果[/size][size=16px]与完整叶片[/size][size=16px]相符合,并且发现[/size][size=16px]与叶肉细胞相比,维管束鞘细胞[/size][size=16px] [/size][size=16px]F[/size][font='calibri'][size=14px][sub][size=16px]v[/size][/sub][/size][/font][size=16px]/[/size][size=16px]F[/size][font='calibri'][size=14px][sub][size=16px]m[/size][/sub][/size][/font][size=16px]、[/size][size=16px]Φ[/size][font='calibri'][size=14px][sub][size=16px]PSII[/size][/sub][/size][/font][size=16px]更低,干旱胁迫后[/size][size=16px]NPQ[/size][size=16px]升高更显著[/size][size=16px],[/size][size=16px]不同细胞的变化趋势[/size][size=16px]差异[/size][size=16px]表明它们[/size][size=16px]具有不同的光保护策略[/size][size=16px],[/size][size=16px]维管束鞘细胞中可能具有更强的热耗散能力[/size][size=16px]([/size][size=16px]Liu [/size][size=16px]et al.[/size][size=16px], 2022[/size][size=16px])。[/size][size=16px][/size][size=16px] 叶绿[/size][size=16px]素[/size][size=16px]荧光显微成像技术在光合作用的微观研究领域具有独特的技术优势,在[/size][size=16px]光合作用机理研究、环境及毒理胁迫与抗性筛选、优良品系选育等领域[/size][size=16px]具[/size][size=16px]有广阔的应用前景。目前多家单位的科研人员[/size][size=16px]都[/size][size=16px]在[/size][size=16px]探索该技术[/size][size=14px][size=16px]的新应用,我们也正在[/size][size=16px]将该技术拓展到[/size][size=16px]多个新的领域,例如对[/size][size=16px]原生质体[/size][size=16px]以及[/size][size=16px]种子、茎秆等非叶片器官的[/size][size=16px]研究[/size][size=16px]。[/size][/size][font='黑体']参考文献:[/font][font='calibri'][size=13px][1] [/size][/font][font='calibri'][size=13px]朱新广[/size][/font][font='calibri'][size=13px], [/size][/font][font='calibri'][size=13px]许大全主编[/size][/font][font='calibri'][size=13px]. [/size][/font][font='calibri'][size=13px]光合作用研究技术[/size][/font][font='calibri'][size=13px], [/size][/font][font='calibri'][size=13px]上海科学技术出版社[/size][/font][font='calibri'][size=13px], 2021[/size][/font][font='calibri'][size=13px][2] [/size][/font][font='calibri'][size=13px]H[/size][/font][font='calibri'][size=13px]. [/size][/font][font='calibri'][size=13px]Küpper[/size][/font][font='calibri'][size=13px],[/size][/font][font='calibri'][size=13px] [/size][/font][font='calibri'][size=13px]I[/size][/font][font='calibri'][size=13px].[/size][/font][font='calibri'][size=13px] [/size][/font][font='calibri'][size=13px]?etlík[/size][/font][font='calibri'][size=13px], [/size][/font][font='calibri'][size=13px]M[/size][/font][font='calibri'][size=13px].[/size][/font][font='calibri'][size=13px] [/size][/font][font='calibri'][size=13px]Trtílek[/size][/font][font='calibri'][size=13px],[/size][/font][font='calibri'][size=13px] et al. [/size][/font][font='calibri'][size=13px]Photosynthetica[/size][/font][font='calibri'][size=13px], 2000, 38, s553-570 [/size][/font][font='calibri'][size=13px][3] [/size][/font][font='calibri'][size=13px]M[/size][/font][font='calibri'][size=13px].[/size][/font][font='calibri'][size=13px] [/size][/font][font='calibri'][size=13px]Yu, [/size][/font][font='calibri'][size=13px]L[/size][/font][font='calibri'][size=13px]. [/size][/font][font='calibri'][size=13px]Chen, [/size][/font][font='calibri'][size=13px]D[/size][/font][font='calibri'][size=13px].[/size][/font][font='calibri'][size=13px] H[/size][/font][font='calibri'][size=13px]. [/size][/font][font='calibri'][size=13px]Liu[/size][/font][font='calibri'][size=13px],[/size][/font][font='calibri'][size=13px] et al. [/size][/font][font='calibri'][size=13px]Front. Plant Sci.[/size][/font][font='calibri'][size=13px], 2022, 13: 856732 [/size][/font][font='calibri'][size=13px][4] [/size][/font][font='calibri'][size=13px]L[/size][/font][font='calibri'][size=13px].[/size][/font][font='calibri'][size=13px] Chen[/size][/font][font='calibri'][size=13px],[/size][/font][font='calibri'][size=13px] D[/size][/font][font='calibri'][size=13px]. [/size][/font][font='calibri'][size=13px]Q[/size][/font][font='calibri'][size=13px].[/size][/font][font='calibri'][size=13px] Wen[/size][/font][font='calibri'][size=13px],[/size][/font][font='calibri'][size=13px] G[/size][/font][font='calibri'][size=13px]. [/size][/font][font='calibri'][size=13px]L[/size][/font][font='calibri'][size=13px].[/size][/font][font='calibri'][size=13px] Shi[/size][/font][font='calibri'][size=13px],[/size][/font][font='calibri'][size=13px] [/size][/font][font='calibri'][size=13px]et al.[/size][/font][font='calibri'][size=13px] [/size][/font][font='calibri'][size=13px]Physiol. Plant.[/size][/font][font='calibri'][size=13px], 2023, [/size][/font][font='calibri'][size=13px]175:[/size][/font][font='calibri'][size=13px] [/size][/font][font='calibri'][size=13px]e13880[/size][/font][font='calibri'][size=13px][5] [/size][/font][font='calibri'][size=13px]W[/size][/font][font='calibri'][size=13px].[/size][/font][font='calibri'][size=13px] J[/size][/font][font='calibri'][size=13px].[/size][/font][font='calibri'][size=13px] [/size][/font][font='calibri'][size=13px]Liu, [/size][/font][font='calibri'][size=13px]H[/size][/font][font='calibri'][size=13px].[/size][/font][font='calibri'][size=13px] [/size][/font][font='calibri'][size=13px]Liu, [/size][/font][font='calibri'][size=13px]Y[/size][/font][font='calibri'][size=13px].[/size][/font][font='calibri'][size=13px] E[/size][/font][font='calibri'][size=13px].[/size][/font][font='calibri'][size=13px] [/size][/font][font='calibri'][size=13px]Chen[/size][/font][font='calibri'][size=13px],[/size][/font][font='calibri'][size=13px] et al. [/size][/font][font='calibri'][size=13px]Front. Plant Sci.[/size][/font][font='calibri'][size=13px], 2022, 13: 885781[/size][/font]
分析叶绿素a的高速离心机有什么具体参数要求?叶绿素荧光仪能否直接测叶绿素a ?国家环保局认可吗?
叶绿素a存在于一切独立营养植物中,是一种能将光合作用的光能传递给化学反应系统的惟一色素。因此,叶绿素a就成为水中有机物的源泉。通过测定叶绿素a,可以了解海洋、湖泊和河流中植物性浮游生物的现存量和基础生产量,可掌握水体中藻类现存量。因此,叶绿素a指标是评价水体富营养化程度最直接有效的方法,也是目前科学地预测其发展趋势的有效方法。根据实测资料分析,当叶绿素a含量从常量上升至10 mg/m3以上,并有迅速增加的趋势,就可预测水体即将发生富营养化。(一)叶绿素a的分光光度法测定在一定量的水样中添加1%碳酸镁悬浮液1 mL,充分搅匀,用玻璃纤维滤纸或微孔滤膜过滤。若不能立即提取,将带样品的滤膜放人冰箱保存(1~2 d)。将载有藻类的滤膜放人研钵中,加入90%丙酮6~7 mL,研磨至呈糊状,再用90%丙酮溶液洗入具塞刻度离心管中,密封,放置暗处静置萃取6~20 h。以3500~4000r/min转速离心lO~15 min,取上清液转入1 cm比色皿中,以90%丙酮溶液为参此,于波长665 nm和750 nm处测吸光度,然后加入几滴l mol/L盐酸酸化,于波长665 nm和750 nm处再测吸光值。叶绿素a浓度计算公式为:Chla=27.3×665一E750)一(A665一A750)]×V丙酮/V水样式中:Chla——叶绿素a含量(μg/L);E665,E750——丙酮萃取液分别于波长665 nm和750 nm的吸光度;A665,A750——丙酮萃取液酸化后分别于波K 665 nm和750 nm的吸光度;V丙酮——丙酮萃取液的体积,mL;V水样——水样过滤的体积,L。(二)叶绿素a的荧光法测定适合于藻类较少的贫营养湖泊或外海洋中的叶绿素a的测定。基本原理是,当丙酮提取液经紫外线照射时,叶绿素a显现其固有的红色荧光特征,其浓度与荧光强度存在一定的规律性,因此可定量测定叶绿素a的含量。由于所用的光源强度高,故荧光法的灵敏度比分光光度法约高两个数量级。[/td][/tr][/table]


